922740707
ASYMETRYCZNA SYNTEZA a-AMINOKWASÓW 5
— nadmiar diastereoizomeru (ang. diastereomeric excess, de), zwany też diastereoselektywnością, definiowany jako:
gdzie [/4] i [£] oznaczają ilości indywidualnych diastereoizomerów powstających w reakcji.
1. SYNTEZA STRECKERA
Synteza Streckera jest jedną z najstarszych metod otrzymywania a-amino-kwasów na skalę preparatywną [3]. Początkowo ograniczała się ona do syntezy związków racemicznych. Pierwsza stereoselektywna reakcja tego typu została przeprowadzona dopiero w latach 60. przez Haradę [4]:

R—C

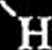


nh2
benzen
K
I
Na2S04
|
1) 6M HCI |
R' |
co2h |
H2/Pd(OH)2 |
|
2) wymiana jonowa |
Ar * N ń |
* R |
EtOH / H20 |
|
Schemat |
1 |
R' CN
HCN
BOH Al''* "N" * ^
ń
co2h
H2N * R
Podstawowa procedura tej syntezy polega na kondensacji optycznie czynnej aminy aromatycznej z aldehydem, a następnie działaniu na tak utworzoną zasadę SchifTa etanolowym roztworem cyjanowodoru. Otrzymany nitryl jest hydrolizowany 6 M HC1 i oczyszczany metodą chromatografii jonowymiennej. Katalityczna hydrogenoliza grupy N-benzylowej prowadzi do otrzymania a-a-minokwasu (a-AA) z wydajnością chemiczną 9-58% i czystością optyczną
op = 22-100% [5].
Późniejsze modyfikacje tej metody polegały m.in. na kondensacji a-mety-lobenzyloaminy z metyloketonami w obecności metanolowego roztworu NaCN (Weinges i wsp. [6]) lub kondensacji tej samej aminy z pochodnymi aldehydów benzylowych (Stout i wsp. [7]). Te nowe procedury poprawiały zarówno wydajność procesu, jak i czystość optyczną produktu finalnego.
Diastereoselektywność addycji CN- do iminy podwyższyć można również przez zastosowanie w analogicznych reakcjach (4S,5S)-5-amino-2£-dimety-lo-4-fenylo-l,3-dioksanu (Weinges i wsp. [8-11]):
Wyszukiwarka
Podobne podstrony:
ASYMETRYCZNA SYNTEZA a-AMINOKWASÓW 11 Alkilowanie enolanu litowego, tworzonego w reakcji związku
ASYMETRYCZNA SYNTEZA o-AMINOKWASÓW 15 H EtOH O HC1 H HC1-H-Ń C02Et H2 / Pd / C H2N n
ASYMETRYCZNA SYNTEZA a-AMINOKWASÓW 17 Tabela 4. Alkilowanie oksazyDonu Williamsa za pomocą reagentów
ASYMETRYCZNA SYNTEZA o-AMINOKWASÓW 19 Tabela 5. Substytucja w halogenowanych oksazynonach Williamsa
ASYMETRYCZNA SYNTEZA o-AMINOKWASÓW 25 5. REAKCJE NA P-WĘGLU Seryna i jej N-chronione pochodne, cyste
ASYMETRYCZNA SYNTEZA a-AMINOKWASÓW 27 sunobu, ale w obecności chlorku p-bromofenylosulfonowego
WIADOMOŚCI 1998, 52, 1-2 chemiczne pl ISSN 0043-5104 ASYMETRYCZNA SYNTEZA a-AMINOKWASÓW ASYMMETRIC
ASYMETRYCZNA SYNTEZA a-AMINOKWASÓW 3 Contrary to the “electrophilic”, a “nucleophilic amination”
ASYMETRYCZNA SYNTEZA ct-AMINOKWASÓW 9 b) działaniem bezwodnika kwasu benzoesowego w temp. 130°C z
ASYMETRYCZNA SYNTEZA ct-AMINOKWASÓW 23 Zastosowanie (lS,2S,5S)-2-hydroksy-3-pinanonu prowadziło do
ASYMETRYCZNA SYNTEZA ot-AMINOKWASÓW 31 jest budową przestrzenną produktu przejściowego, będącego
ASYMETRYCZNA SYNTEZA cc-AMINOKWASÓW 41 [8] K. Weinges, B. Stemmle, Chem. Ber., 197
9. Zastosowanie hydroksy- i dihydroksyacetonu w asymetrycznej syntezie związków polihydro-ksylowych
IMGI09 (3) Które 2 poniższych stwierdzeń dotyczących regulacji syntezy aminokwasów są PRA WDZIWE?
45336 Obraz (1063) RCCOOH RCHCOOHI 1 o nh, syn
DSC04563 (3) OTRZYJMY WANIĘ AMINOKWASÓW c.d L Syntezy aminokwasów- otrzymujemy D-, L-aminokwasy i ic
SYNTEZA AMINOKWASÓW NA DOWOLNYM PRZYKŁADZIE Aminokwasy to związki organiczne, których cząsteczki
więcej podobnych podstron