
1
WĘGLOWODORY, ALKOHOLE, FENOLE
I.
Wprowadzenie teoretyczne
Węglowodory
Węglowodory są to połączenia organiczne zbudowane z atomów węgla i wodoru. Ze
względu na różne sposoby łączenia się atomów węgla w tych związkach dzielimy je na:
1.
Łańcuchowe albo acykliczne:
a.
nasycone albo alkany (parafiny) – między atomami węgla występują jedynie wiązania
pojedyncze, szereg homologiczny C
n
H
2n+2
, atomy węgla występują w stanie
hybrydyzacji sp
3
(np. metan), reakcją charakterystyczną jest reakcja substytucji
wolnorodnikowej;
b.
nienasycone, które mają wiązania wielokrotne między atomami węgla:
•
alkeny – o jednym lub kilku wiązaniach podwójnych między atomami węgla, z
jednym wiązaniem podwójnym – szereg homologiczny odpowiadający
wzorowi C
2
H
2n
; atomy węgla przy wiązaniu podwójnym w stanie hybrydyzacji
sp
2
(np. eten);
•
alkiny – o jednym lub kilku wiązaniach potrójnych między atomami węgla, z
jednym wiązaniem potrójnym – szereg homologiczny odpowiadający wzorowi
C
n
H
2n-2
; atomy węgla przy wiązaniu potrójnym w stanie hybrydyzacji sp (np.
etyn czyli acetylen)
,
reakcją charakterystyczną jest reakcja addycji do wiązania
wielokrotnego.
2.
Pierścieniowe albo cykliczne:
a.
alicykliczne – zbudowane z pierścieni karbocyklicznych, których wszystkie wiązania
są pojedyncze (np. cyklopropan), tworzą szereg homologiczny o wzorze C
n
H
2n
;
b.
aromatyczne – pierścienie karbocykliczne, w których atomy węgla występują w stanie
hybrydyzacji sp
2
(np. benzen), reakcją charakterystyczną jest reakcja substytucji
elektrofilowej.
Nie znaleziono dotychczas, z nielicznymi wyjątkami, odpowiednich pochodnych do
charakterystyki węglowodorów alifatycznych i alicyklicznych. Ich identyfikacja opiera się na
oznaczeniu temperatury wrzenia, temperatury topnienia, gęstości współczynnika załamania
ś
wiatła oraz pomiarach widmowych (IR,
1
H NMR i
13
C NMR).
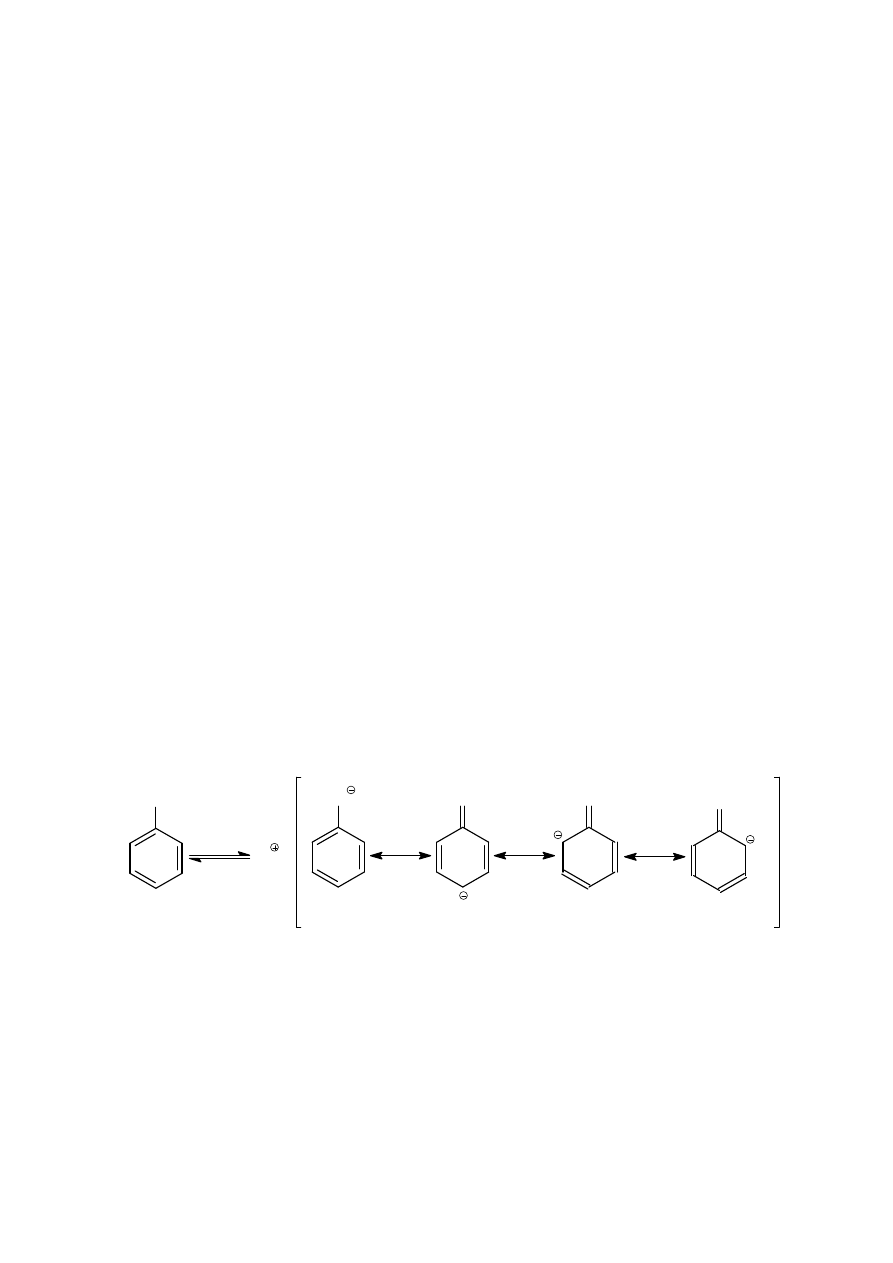
2
Alkohole
Alkohole są to związki alifatyczne lub alicykliczne zawierające jedną lub większą
ilość grup wodorotlenowych. W zależności od tego z jakim rodnikiem grupy wodorotlenowe
są połączone dzielimy je na nasycone, nienasycone i aromatyczne. Wyróżniamy również:
a.
alkohole I-rzędowe – alkohole, w których grupa –OH związana jest z atomem węgla
mającym co najmniej dwa atomy wodoru;
b.
alkohole II-rzędowe – alkohole, w których grupa –OH związana jest z atomem węgla
mającym jeden atom wodoru;
c.
alkohole III-rzędowe – alkohole, w których grupa –OH związana jest z atomem węgla
nie mającym atomów wodoru.
Fenole
Cechą charakterystyczną budowy chemicznej fenoli jest obecność grupy
−
OH
związanej bezpośrednio z pierścieniem aromatycznym. Grupa ta aktywuje związek w
reakcjach substytucji elektrofilowej. Podczas reakcji substytucji w pierścieniu, kwasowość
odgrywa ważną rolę; wskutek jonizacji fenolu powstaje grupa –O
Ө
, która dzięki całkowitemu
ładunkowi ujemnemu jest grupą bardziej elektronodonorową niż grupa –OH. Grupa
−
OH jest
podstawnikiem I-go rodzaju. Atom wodoru grupy
−
OH w fenolach ulega odszczepieniu
znacznie łatwiej niż w alkoholach. Fenole są na tyle silnymi kwasami, iż ich sole można
otrzymywać w reakcjach z wodorotlenkami metali. Taki wzrost kwasowości jest
spowodowany rezonansową stabilizacją anionu.
Fenole są trudno rozpuszczalne w wodzie. Rozpuszczalność fenoli w wodzie wzrasta wraz ze
wzrostem liczby grup OH w cząsteczce. Fenole łatwo natomiast rozpuszczają się w
alkoholach, eterze, chloroformie, roztworach wodorotlenków metali. Nie rozpuszczają się zaś
w węglanach, co odróżnia je od kwasów.
Najprostsze fenole są cieczami lub ciałami stałymi o niskich temperaturach topnienia.
Mają
wysokie
temperatury
wrzenia,
co
jest
spowodowane
występowaniem
OH
H +
O
O
O
O

3
międzycząsteczkowych
wiązań
wodorowych.
Jednowodorotlenowe
fenole
mają
charakterystyczny zapach, natomiast u fenoli wielowodorotlenowych zapach jest mniej
intensywny.
II.
Część praktyczna
Węglowodory
1.
Reakcja Lehmana z KMnO
4
– rozróżnienie węglowodorów.
Wyjaśnienie: Roztwór KMnO
4
w obecności wiązań wielokrotnych węglowodorów
nienasyconych ulega odbarwieniu zgodnie z równaniem reakcji:
2KMnO
4
+ H
2
O → 2KOH + 2MnO
2
+ 3O
H
2
C=CH
2
+ O + H
2
O → HOCH
2
-CH
2
OH → 2HCHO
CH
3
-C≡C-CH
3
+ H
2
O + 3O → 2CH
3
-COOH
Wykonanie: (wykonać z alkanem, alkenem i węglowodorem aromatycznym) Do ok. 1 cm
3
badanej próby dodawać kroplami 0.1% acetonowy roztwór KMnO
4
. Po dodaniu każdej porcji
roztworu nadmanganianu potasu, roztwór w probówce dokładnie wymieszać i odczekać do
zniknięcia różowego zabarwienia pochodzącego od KMnO
4
. Węglowodory nienasycone
powodują natychmiastowe odbarwienie roztworu i powstanie brunatnego osadu ditlenku
manganu. Węglowodory nasycone i aromatyczne reagują powoli, dopiero po podgrzaniu.
2.
Reakcja przyłączania bromu (reakcja addycji) – rozróżnienie rodzaju węglowodoru
(nasycone, nienasycone, aromatyczne).
Wyjaśnienie: Wiązania wielokrotne występujące w węglowodorach nienasyconych powodują
odbarwienie roztworu bromu wg reakcji:
H
2
C=CH
2
+ Br
2
→ BrH
2
C-CH
2
Br
Wykonanie: (wykonać z alkanem, alkenem i węglowodorem aromatycznym), (próbę należy
wykonać pod sprawnie działającym wyciągiem) Do około 0.5 cm
3
próby, dodać 0.5 cm
3
1%
roztworu
bromu
w
kwasie
octowym,
ostrożnie
wytrząsnąć.
Wystąpienie
natychmiastowego odbarwienia bromu – węglowodory nienasycone. Odbarwienie po
naświetleniu (ewentualnie także po ogrzaniu) – wydziela się bromowodór, którego obecność
stwierdzamy za pomocą wilgotnego papierka lakmusowego – świadczy o występowaniu w
badanej próbie węglowodorów nasyconych alifatycznych, alicyklicznych. Odbarwienie
4
bromu po ogrzaniu, zwykle po dodaniu wiórków żelaza – jednocześnie wydziela się
bromowodór – świadczy o występowaniu w badanej próbie węglowodorów aromatycznych.
Alkohole
1.
Reakcja acetylowania alkoholi chlorkiem acetylu (reakcja tworzenia estrów kwasu
octowego).
Wyjaśnienie: Chlorki kwasowe reagują z alkoholami w następujący sposób:
W wyniku powyższej reakcji tworzą się odpowiednie estry, które można zidentyfikować w
oparciu o charakterystyczny zapach. Reakcja estryfikacji chlorkiem acetylu jest reakcją
nieodwracalną i zachodzi z bardzo dużą wydajnością.
Wykonanie: (próbę należy wykonać pod sprawnie działającym wyciągiem) Do 1 cm
3
n-
propanolu, umieszczonego w suchej probówce, dodać kroplami 1 cm
3
chlorku acetylu.
Reakcja jest egzoenergetyczna i wydziela się chlorowodór. Po kilku minutach zawartość
probówki wylać do zlewki zawierającej 10 cm
3
H
2
O i obserwować wytwarzanie
nierozpuszczalnej warstwy cieczy. Nadmiar powstającego kwasu zobojętnić stałym Na
2
CO
3
(węglan sodu dodawać porcjami). Otrzymaną mieszaninę wylać na szkiełko zegarkowe i
zbadać woń produktu (powstały owocowy zapach jest charakterystyczny dla estrów).
2.
Rozróżnianie rzędowości alkoholi metodą Lucasa.
Wyjaśnienie: Próba ta polega na różnorodnym zachowaniu się I-, II- i III-rzędowych alkoholi
w obecności odczynnika Lucasa, którym jest roztwór bezwodnego ZnCl
2
w stężonym kwasie
solnym (68 g ZnCl
2
w 52.5 g stęż. HCl). W wyniku tej próby możemy zaobserwować:
a.
nie następuje żadna widoczna reakcja prócz lekkiego ściemnienia, roztwór pozostaje
klarowny – alkohole pierwszorzędowe, niższe od heksylowych;
b.
roztwór klarowny, po 1-1.5 godzinie następuje rozdzielenie warstw – alkohole
drugorzędowe;
Cl
O
C
H
3
C
+ C
2
H
5
OH
OC
2
H
5
O
C
H
3
C
HCl
+
H
3
C
C
H
3
C
OH
H
HCl
H
2
O
ZnCl
2
+
+
H
3
C
C
H
3
C
Cl
H

5
c.
wyraźne, natychmiastowe rozdzielenie warstw – alkohole trzeciorzędowe.
Uwaga: alkohole trzeciorzędowe reagują ze stężonym kwasem solnym nawet bez dodania
ZnCl
2
. Alkohole – allilowy, benzylowy i cynamonowy (alkohole pierwszorzędowe),
reagują podobnie jak alkohole II- i III-rzędowe.
Wykonanie: W trzech suchych probówkach umieścić odpowiednio po 0.5 cm
3
alkoholu
I-rzędowego, alkoholu II-rzędowego i alkoholu III-rzędowego oraz po 2.5 cm
3
odczynnika
Lucasa. Probówki wytrząsać przez 1 minutę w temperaturze 25
o
C (w łaźni wodnej), następnie
odstawić i obserwować zmiany zachodzące w ich wnętrzu.
3.
Identyfikacja alkoholi trzeciorzędowych metodą Bordwella i Wellmana (reakcja z
kwasem chromowym).
Wyjaśnienie: Alkohole I- i II-rzędowe reagują z odczynnikiem chromowym (1 g CrO
3
w 1
cm
3
stężonego H
2
SO
4
i 3 cm
3
H
2
O) dając błękitnozielone zabarwienie wg równań rekcji
chemicznych:
Alkohole pierwszorzędowe utleniają się do aldehydów, a alkohole drugorzędowe do
odpowiednich ketonów.
Uwaga: Alkohole trzeciorzędowe nie reagują z odczynnikiem chromowym (w probówce nie
obserwujemy żadnych zmian).
Wykonanie: W trzech probówkach umieścić po 1 cm
3
3% acetonowych roztworów
odpowiednich alkoholi (I-, II- i III-rzędowy), do każdej z nich dodać po 1 kropli odczynnika
chromowego. Po krótkim wytrząsaniu mieszanin obserwujemy zmiany w probówkach z
alkoholami reagującymi z kwasem chromowym.
H
3
C
C
H
3
C
OH
H
3
C
HCl
H
2
O
ZnCl
2
+
+
H
3
C
C
H
3
C
Cl
H
3
C
8 H
2
O
Cr
2
3
3
3
6H
2H
2
CrO
4
H
O
C
H
3
C
+
C
2
H
5
OH
+
+
+
8H
2
O
3
2Cr
+ 6H
3
3
2 H
2
CrO
4
+
+
H
3
C
C
H
3
C
O
+
H
3
C
C
H
3
C
OH
H
6
Fenole
1.
Reakcja fenoli z zasadami.
Wyjaśnienie: Fenole mają charakter silnych kwasów i reagują z zasadami tworząc
odpowiednie sole. Charakter kwasowy prostych fenoli nie jest wyraźny, gdyż ich sole
alkaliczne łatwo ulegają w wodnym roztworze daleko idącemu rozszczepieniu
hydrolitycznemu. Już kwas węglowy rozkłada te sole całkowicie, co pozwala odróżnić fenole
od kwasów karboksylowych.
Wykonanie: Do jednej probówki odmierzyć 1.5 cm
3
5% NaOH, do drugiej 1.5 cm
3
5%
NaHCO
3
. Do obydwu probówek dodać po 5 kropli 90% fenolu. Po wytrząśnięciu
zaobserwować rozpuszczanie się fenolu w NaOH, w NaHCO
3
fenol się nie rozpuszcza i nie
wydziela się CO
2
(w odróżnieniu od kwasów). Niektóre fenole z podstawionymi grupami
elektroujemnymi (np.
−
NO
2
) rozpuszczają się jednak w roztworze NaHCO
3
.
2.
Działanie chlorku żelaza(III) na fenole.
Wyjaśnienie: Fenol z FeCl
3
tworzy związek o zabarwieniu fioletowym zgodnie z reakcją:
Barwa tych połączeń zależy od rodzaju fenolu, użytego rozpuszczalnika i stężenia reagentów.
Zabarwienie to może być nietrwałe i należy je obserwować w chwili dodawania odczynnika.
Fenole zawierające co najmniej dwie grupy
−
OH w położeniu „orto” dają silnie zabarwione
roztwory, np. kwas galusowy daje tzw. „atrament żelazowy”.
Próbę z FeCl
3
dają również związki zdolne do enolizacji:
Wykonanie: Do 3 cm
3
1% wodnego roztworu fenolu dodać 2% roztworu FeCl
3
– powstaje
fioletowe zabarwienie.
O + H
2
O
OH
+
OH
3
6
O
O
+
3+
+
-
6H
+
OH
Fe
_
Fe
O
O
O
O
CH
2
CO HC = C
OH
Wyszukiwarka
Podobne podstrony:
instrukcja węglowodory, alkohole i fenole
instrukcja węglowodory, alkohole i fenole
Alkohole i fenole 3 id 58102 Nieznany
test alkohole i fenole chem, chemia gimnazjum
alkohole i fenole 2 id 58101 Nieznany (2)
Alkohole i fenole - test, Napisz brakujące nazwy następujących związków:
Alkohole i fenole - test, Napisz brakujące nazwy następujących związków:
alkohole i fenole, Chemia- liceum
Alkohole i Fenole
Alkohole i fenole
Alkohole i fenole - teoria, ALKOHOLE MONOHYDROKSYLOWE
alkohole i fenole 2 id 58114 Nieznany (2)
Alkohole, fenole, aldehydy, ketony, cukry
CHEMIA ALKOHOLEi Fenole
5 Alkohole fenole etery materiały
Alkohole i Fenole
Alkohole, fenole, etery
więcej podobnych podstron