
Trzustka
wiadomości ogólne

Trzustka łączy w sobie dwa oddzielne układy
czynnościowe:
zewnątrzwydzielniczy: sok trzustkowy, wytwarzany
w komórkach nabłonkowych, wydzielany jest do jelita
przez przewód wyprowadzający
wewnątrzwydzielniczy:
hormony,
wytwarzane
w komórkach
wysp
trzustkowych
Langerhansa,
wydzielane są bezpośrednio do krwi

Wyspy trzustkowe Langerhansa
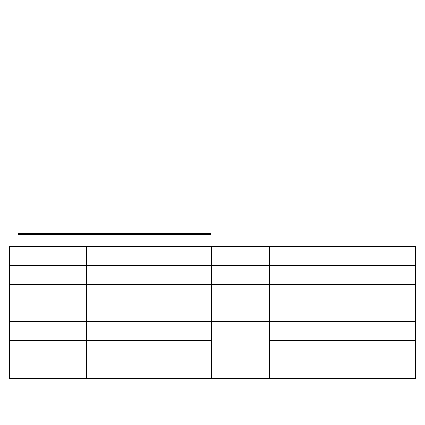
Wyspy trzustkowe Langerhansa:
grupy komórek o średnicy 75-300 µm
rozsiane w zewnątrzwydzielniczej tkance trzustki
(przede wszystkim w ogonie)
zaopatrywane licznymi naczyniami o szerokim świetle
stanowią 2-3% tkanki trzustki
Komórki wysp trzustkowych
Komórki
Charakterystyka
Masa
Hormon
β
słabo się barwią
70%
insulina, amylina
α
zawierają liczne
ziarnistości
20%
glukagon
D
10%
somatostatyna
PP (F)
polipeptyd
trzustkowy

Insulina
rys historyczny
(gdyby osoba układająca egzamin wpadła na pewien głupi pomysł żeby
porzucać nazwiskami, jak to bywało na innych przedmiotach :/)

Langerhans – odkrył grupy komórek w trzustce (1869)
Mering i Minkowski (1889)
wykazali, że usunięcie trzustki u psów wywołuje stan
chorobowy odpowiadający cukrzycy, oraz że wszczepienie
tkanki trzustki pod skórę powoduje ustąpienie wywołanych
objawów
nieudana próba osiągnięcia wyciągu z trzustki
Banting i Best (1921)
stwierdzili, ze substancja czynna (insulina) zawarta jest
w wyspach Langerhansa, a otrzymywane w tradycyjny
sposób wyciągi nie wykazują działania, gdyż zostaje ona
zniszczona przez enzymy trzustkowe przy sporządzaniu
przez
podwiązania
przewodu
wyprowadzającego
u zwierząt
doświadczalnych,
zniszczeniu
ulegała
wydzielnicza tkanka gruczołowa – z pozostałej tkanki udało
się uzyskać insulinę
Abel – otrzymał insulinę w formie krystalicznej (1926)
Sanger – ustalił sekwencję aminokwasową insuliny (1954)

Insulina
wiadomości ogólne

Insulina:
polipeptyd składający się z dwóch łańcuchów:
o łańcuch A -21 aminokwasów
o łańcuch B- 30 aminokwasów (połączone ze sobą
dwoma mostkami dwusiarczkowymi)
osoczowy okres półtrwania: 10 min
połowiczny czas działania: 40 min
rozkład odbywa się głównie w wątrobie i nerkach
trzustka zawiera około 80 IU insuliny, z czego dziennie
wydzielana jest mniej więcej połowa

Insulina
regulacja uwalniania

Bodźce uwalniające insulinę:
wzrost stężenia glukozy we krwi (główny bodziec)
wzrost stężenia aminokwasów (np. argininy, lizyny),
wolnych kwasów tłuszczowych i niektórych hormonów
przewodu pokarmowego (w szczególności tzw.
inkretyn) we krwi
glukagon (w dużych dawkach)
GIP (żołądkowy pepty hamujący)
GLP-1 (glukagonopodobny peptyd-1)
Bodźce hamujące uwalnianie insuliny:
somatostatyna
adrenalina
Ilość wydzielanej insuliny jest modulowana przez
autonomiczny układ nerwowy:
impulsacja z części przywspółczulnej i pobudzenie
receptorów β
2
części współczulnej wzmaga uwalnianie
pobudzenie receptorów α
2
hamuje wydzielanie

Insulina
mechanizm uwalniania

Uwolnienie insuliny następuje na skutek:
wzrostu stężenia glukozy we krwi
wzmożonego utleniania glukozy w komórkach β
zwiększonego wytwarzania ATP
zamknięcia kanałów potasowych zależnych od ATP
zmniejszenia przepuszczalności błony dla potasu
spadku potencjału spoczynkowego z -65 do -30mV
aktywacji zależnych od napięcia kanałów wapniowych
napływu
jonów
wapnia
z
przestrzeni
zewnątrzkomórkowej
i
uruchomieniu
procesu
egzocytozy

Insulina
działanie

Insulina:
hormon anaboliczny (zwiększający wzrost)
prowadzi do obniżenia stężenia glukozy we krwi
o poprawia wychwyt glukozy i aminokwasów
o wzmaga oksydacyjny rozkład glukozy
o zwiększa glikogenezę w wątrobie i mięśniach oraz
zapobiega glikogenolizie
o wzmaga wytwarzanie tłuszczów z glukozy
o hamuje przekształcanie białek w glukozę
wpływa na metabolizm tłuszczów
o zwiększa syntezę triglicerydów
przez aktywację osoczowych lipaz lipoproteinowych
zwiększa wnikanie WKT do komórek, gdzie są odkładane
w postaci triglicerydów (tłuszcz zapasowy)
na skutek nasilenia przemiany glukozy do acetylo-CoA
o przeciwdziała mobilizacji i rozkładowi tłuszczów
o hamuje lipolizę w wątrobie
nasila dokomórkowe wnikanie jonów potasu
zmniejsza
kataboliczne
działanie
glukokortykosteroidów
i hormonów tarczycy

Insulina
mechanizm działania

oddziaływanie hormon-receptor prowadzi do:
o autofosforylacji wewnątrzkomórkowych struktur
receptora (receptor nabiera właściwości kinazy
tyrozynowej)
o fosforylacji substratów (m.in. substratu receptora
insulinowego 1 i 2) i aktywacji enzymów biorących
udział w przemianie materii w kom. efektorowych
w komórkach tkanki tłuszczowej i mięśni kompleks
insulina-receptor powoduje:
o przemieszczenie
preformowanych
białek
transportujących glukozę (GLUT) z pęcherzyków
cytoplazmatycznych do błony komórkowej
o przyspieszenie transportu glukozy

Insulina
gęstość receptorów

u ludzi z prawidłową przemianą materii występuje
nadmiar receptorów insulinowych dzięki czemu do
wywołania
maksymalnego
efektu
wystarczy
pobudzenie tylko ich części
podwyższone
stężenie
insuliny
prowadzi
w następstwie internalizacji receptorów do spadku ich
liczby (down regulation), nadwaga także prowadzi do
zmniejszenia gęstości receptorów insulinowych

Glukagon
wiadomości ogólne,
regulacja uwalniania

Glukagon
polipeptyd złożony z 1 łańcucha- 29 aminokwasów
okres półtrwania: kilka minut
średnie stężenie glukagonu we krwi wynosi 43 ρmol/l
Regulacja uwalniania
uwalnianie glukagonu z komórek α pobudzają:
o hipoglikemia
o wzrost stężenia aminokwasów w osoczu
o wysiłek fizyczny, stres
o podrażnienie nerwu błędnego
o pobudzenie receptorów β-adrenergicznych
hamujący wpływ na wydzielanie wywierają:
o hiperglikemia
o agoniści receptorów α-adrenergicznych
o insulina
o inkretyna
o somatostatyna

Glukagon
działanie, mechanizm działania

Glukagon bierze udział w regulacji stężenia glukozy we
krwi, działając antagonistycznie w stosunku do insuliny:
wzmaga glikogenolizę w wątrobie (ale w przeciwieństwie
do adrenaliny, nie wzmaga jej w mięśniach)
zwiększa w wątrobie glukoneogenezę z aminokwasów
i mleczanu
zwiększa utlenianie kwasów tłuszczowych
zwiększa tworzenie ciał ketonowych w wątrobie
wzmaga lipolizę w tkance tłuszczowej
zwiększa proteolizę (która dostarcza aminokwasów do
glukoneogenezy)
Mechanizm działania:
reakcja między hormonem i sprzężonym z białkiem G
receptorem błonowym
aktywacja cyklazy adenylanowej i tworzenie cAMP
fosforylacja enzymów prowadząca do właściwych
efektów metabolicznych

Glukagon
zastosowanie

Zastosowanie:
leczenie groźnej dla życia hipoglikemii
o w przypadku hipoglikemii u chorych na cukrzycę
typu 1 (w odróżnieniu od pacjentów z cukrzycą
typu 2) – glukagon wykazuje słabe działanie
hiperglikemiczne i wówczas dla uzupełnienia
działania glukagonu niezbędne jest podanie glukozy
hamowanie
perystaltyki
podczas
diagnostyki
radiologicznej przewodu pokarmowego
stany skurczowe zwieracza wpustu
zatrucia lekami blokującymi receptory β-adrenergiczne

Stężenie glukozy we krwi
wartość referencyjna

Fizjologiczne stężenie glukozy we krwi na czczo:
3,05-3,55 mmol/l (55-100 mg/dl)

Hipoglikemia
wiadomości ogólne, podział

Hipoglikemia: gdy stężenie cukru we krwi (oznaczane
metodą enzymatyczną) spadnie < 2,5 mmol/l (45 mg/dl)
Podział:
hipoglikemia egzogenna:
o powstrzymywanie się od jedzenia
o nieprawidłowe podawanie insuliny lub doustnych
leków przeciwcukrzycowych
o nadużywanie alkoholu
hipoglikemia endogenna:
o obecność wyspiaka (insulinoma)
o ciężkie
schorzenia
wątroby
z
zaburzeniami
glukoneogenezy
o wrodzone choroby metaboliczne z defektami
enzymów
o niedoczynność przysadki i kory nadnerczy
o wzmożone zużycie glukozy spowodowane ciężką
pracą fizyczną lub glukozurią

Hipoglikemia
objawy

Objawy hipoglikemii:
autonomiczne (uwarunkowane aktywacją autonomicznego
układy nerwowego):
o niepokój, uczucie lęku
o kolatanie serca
o nudności
o dreszcze
o wilczy głód
o pocenie się
neuroglikopeniczne
(spowodowane
niedostatecznym
zaopatrzeniem mózgu w glukozę):
o osłabienie
o zaburzenie snu i myślenia
o splątanie
o zaburzenia widzenia
o zawroty głowy
o kurcze mięśniowe
Bardzo niskie stężenia glukozy (<1,95 mmol/l lub 35 mg/dl)
prowadza do wstrzału hipoglikemicznego ( śpiączki
hipoglikemicznej).

Hipoglikemia
leczenie

W leczeniu hipoglikemii zastosowanie znajdują:
glukagon
diazoksyd

Glukagon
dawka

Przeciętna dawka dzienna:
0,5- 1 mg s.c., i.m. lub i.v.

Glukagon
działania niepożądane

Działania niepożądane:
nudności, wymioty
reakcja nadwrażliwości

Glukagon
przeciwwskazania

Przeciwwskazania:
guz chromochłonny rdzenia nadnerczy (nagły wzrost
ciśnienia krwi, spowodowany uwolnieniem amin
katecholowych z guza)
guz trzustki (dożylne podanie początkowo powoduje
zwiększenie stężenia glukozy we krwi, a następnie
wskutek pobudzenia wydzielania insuliny powoduje
hipoglikemię wymagającą podania glukozy)

Glukagon
interakcje

indometacyna osłabia efekt działania glukagonu
glukagon nasila efekt przeciwkrzepliwy warfaryny

Diazoksyd
działanie, mechanizm działania

Działanie:
zwiększa stężenie glukozy we krwi poprzez hamowanie
wydzielania insuliny oraz zwiększanie glikogenolizy
w wątrobie
obniża ciśnienie krwi (ale nie jest stosowany
w schorzeniach kardiologicznych)
Po podaniu doustnym występuje hiperglikemiczne
działanie lecz nie występuje działanie hipotensyjne.
Mechanizm działania
otwarcie kanałów potasowych (zależnych od ATP)
w komórkach mięśni gładkich oraz w trzustce
depolaryzacja komórek wysp trzustki, a konsekwencji
zahamowanie uwalniania insuliny

Diazoksyd
zastosowanie

Zastosowanie:
ciężka idiopatyczna hipoglikemia u niemowląt i dzieci
hipoglikemia
u
dorosłych,
spowodowana
nowotworami trzustki
Ponadto Janiec podaje, że ze względu na działanie hipotensyjne
stosowany jest w przełomach nadciśnieniowych z:
ostrą niewydolnością krążenia
wylewem do mózgu
kłębuszkowym zapaleniem nerek
Mütschler co prawda twierdzi, że w schorzeniach kardiologicznych nie
jest stosowany, ale tak de facto te powyższe stany nie są ściśle
kardiologiczne… (?)

Diazoksyd
dawka

Dawkowanie ustala się indywidualnie:
dawka początkowa: 5mg/kg/dobę

Cukrzyca
definicja

Cukrzyca
zespół
chorobowy
charakteryzujący
się
(bez/względnym)
niedoborem
insuliny
ze
współistniejącą przewlekłą hiperglikemią i będącymi
tego następstwem zaburzeniami przemiany materii
oraz uszkodzeniem narządów
stężenie glukozy w krwi pełnej na czczo >6,15 mmol/l
lub >110 mg/dl

Cukrzyca
niedobór insuliny

bezwzględny niedobór: gdy trzustka wskutek
zniszczenia komórek wysp Langerhansa nie jest już
w stanie wydzielać insuliny
względny niedobór
o wytwarzanie insuliny jest zbyt małe w stosunku
do potrzeb
o działanie insuliny jest osłabione w przez
przeciwciała przeciwinsulinowe
o liczba receptorów w narządach efektorowych jest
zmniejszona
o występuje defekt receptora insulinowego albo
sprzężonego
z
receptorem
wewnątrzkomórkowego przekazywania sygnałów
(defekt postreceptorowy)

Cukrzyca
epidemiologia

najczęstsze i najistotniejsze pod względem swoich
następstw zaburzenie przemiany materii
choruje na nią 5-8% ludności i jest tendencja
wzrostowa
nieprawidłowa tolerancja glukozy dotyczy 16%
społeczeństwa

Cukrzyca
podział

Wyróżniamy:
cukrzycę typu 1
cukrzycę typu 2
inne rodzaje cukrzycy (typ 3)
cukrzycę ciężarnych

Cukrzyca
typ 1

cukrzyca typu 1
o A
→
uwarunkowana
czynnikami
immunologicznymi
o B → idiopatyczna
dawniej stosowane nazwy
o młodzieńcza
o insulino zależna (IDDM)
jest spowodowana brakiem insuliny i powstaje na
skutek zniszczenia przez przeciwciała komórek β wysp
Langerhansa w trzustce
szybko nasila się niedobór insuliny, aż do całkowitego
braku jej wydzielania
niezbędne jest leczenie substytucyjne insuliną

Cukrzyca
typ 2

cukrzyca typu 2
o typ 2a → bez otyłości (20%)
o typ 2b → z otyłością (80%)
dawniej stosowane nazwy
o wieku starczego
o insulino niezależna (NIDDM)
90% spośród wszystkich typów
progresja zaburzeń jest znacznie wolniejsza niż w typie 1
zazwyczaj jest tylko względny niedobór insuliny
(oporność na insulinę)
prawdopodobieństwo
dziedziczenia
(inaczej
niż
wg wcześniejszych poglądów) jest znacznie większe niż
w typie 1
o nie stwierdzono związku z układem HLA
o dziedziczenie ma charakter wielogenowy
o
decydującą
rolę
jako
czynniki
wyzwalające
odgrywają nadmierne odżywianie i nadwaga oraz
brak aktywności fizycznej

Cukrzyca
inne swoiste typy cukrzycy- typ 3

Będące następstwem
wad genetycznych
o zaburzenia komórek β (np. cukrzyca MODY)
o zaburzenia działania receptora insulinowego
schorzeń zewnątrzwydzielniczej części trzustki
endokrynopatii (np. akromegalia, zespół Cushinga)
działania
leków
i
środków
chemicznych
(np. glikokortykosteroidy, tiazydy)

Cukrzyca
predyspozycje

czynniki genetyczne
o HLA np. DR3, DR4 (natomiast DR2 ma wpływ
ochronny) → dotyczy cukrzycy typu 1
o decydujące
znaczenie
mają
czynniki
immunologiczne - autoimmunizacja i niszczenie
komórek β wysp Langerhansa przez limfocyty T
czynniki egzogenne
o mogą wywołać autoimmunizację
o wirus
Coxackie
lub
świnki:
już
przed
wystąpieniem
objawów
choroby
można
stwierdzić przeciwciała przeciw komórkom β,
insulinie
i
białku
wysp
trzustkowych
-
dekarboksylazie glutaminianowej, która jest
bardzo podobna pod względem budowy do białek
wirusa Coxackie
o szkodliwe czynniki środowiska

Zespół metaboliczny

Wstępną fazą pełnoobjawowej cukrzycy typu 2 jest tzw.
zespół metaboliczny (zespół X):
objawy
o otyłość
o hiperglikemia
o insulinooporność
o nadciśnienie
o dyslipidemia
o trombofilia
w Polsce u 5-9 mln ludzi

Cukrzyca
patofizjologia

zaburzenia wydzielania insuliny
o zaburzenie przekształcania proinsuliny w insulinę
o pulsacyjne wydzialanie insuliny
insulinooporność komórek docelowych - tkanki
wrażliwe na insulinę (wątroba, mięśnie i tkanka
tłuszczowa) reagują w mniejszym stopniu na insulinę
pomimo hiperglikemii w wątrobie nie jest hamowana
glukoneogeneza i uwalnianie glukozy do krwi
amylina- polipeptyd wydzielany z insuliną, blokuje
działanie insuliny w wątrobie i mięśniach
na początku choroby stwierdza się zwiększone
wydzielanie insuliny, mające na celu utrzymanie
prawidłowego poziomu glukozy we krwi
w późniejszych stadiach może ulec wyczerpaniu
zdolność komórek β trzustki do pełnienia swojej funkcji
→ stężenie insuliny obniża się wtedy do normy,
a stężenie glukozy wzrasta

Cukrzyca
typ 4- cukrzyca ciążowa

cukrzyca w przebiegu ciąży
gdy u kobiety po raz pierwszy stwierdzi się
hiperglikemię podczas ciąży
jeżeli nie rozpocznie się leczenia zwiększa się ryzyko
o stanu przedrzucawkowego
o wielowodzia
o porodów przedwczesnych
o zwiększonej masy ciała noworodka po urodzeniu
o śmiertelności wśród noworodków

Cukrzyca
zaburzenia przemiany materii
wywołane niedoborem insuliny
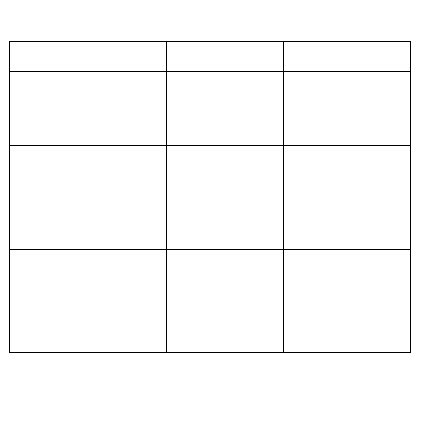
Zaburzenia
Prowadzą do
Z następującymi
objawami
Metabolizmu cukrów
wskutek upośledzonego
zużytkowania glukozy,
wzmożonej glukoneogenezy
i glikogenolizy
Hiperglikemii,
glikozurii
Poliurii, polidypsji,
świądu narządów
płciowych,
odwodnienia
Metabolizmu tłuszczów
wskutek hamowania syntezy
lipidów, zwiększonej lipolizy
i wzmożonego tworzenia ciał
ketonowych
Hiperlipidemii,
hiperketonemii,
ketonurii, kwasicy
ketonowej
Nudności, wzbudzenia
odruchu wymiotnego,
zmniejszenia masy
ciała, zapachu
acetonu
w wydychanym
powietrzu
Metabolizmu białek wskutek
wzmożonego rozkładu
białek, zwiększonej
glukoneogenezy,
zmniejszonej syntezy białek
Hiperglikemii,
glikozurii,
aminoacydurii,
wzrostu stężenia
produktów
przemian
azotowych we krwi
Adynamii,
zmniejszenia masy
ciała, zaniku mięśni

Cukrzyca
zaburzenia przemiany lipidów

wzmożona lipoliza w tkance tłuszczowej, wątrobie
i mięśniach → wzrost stężenia WKT w osoczu
w ciężkich przypadkach w wyniku zwiększonego
rozkładu kwasów tłuszczowych i ograniczonego
utleniania acetylo- CoA powstaje acetooctan, który
w następstwie redukcji zostaje przekształcony w β-
hydroksymaślan,
a
wskutek
dekarboksylacji
w aceton- ciała ketonowe
w następstwie zwiększonej dostępności kwasó o
tłuszczowych w wątrobie wzrasta również tworzenie
lipoprotein bogatych w TG, a to prowadzi do
zwiększenia zawartości lipoprotein we krwi

Śpiączka cukrzycowa
podział

Śpiączka cukrzycowa (coma diabeticum)
najcięższa postać ostrych zaburzeń przemiany materii w
przebiegu cukrzycy, w której stwierdza się ekstremalne
zaburzenia zużytkowania glukozy
Wyrózniamy dwie postacie:
śpiączka z kwasicą ketonową
o 80-90% przypadków
o głównie w przebiegu cukrzycy typu 1
o wydalanie kwasów w postaci soli soodowych
i potasowych prowadzi do utraty Na
+
i K
+
o utrata glukozy z moczem powoduje diurezę
osmotyczną prowadzącą do utraty wody
o zmniejszenie ukrwienia mózgu z hipoksją
śpiączka hiperosmolarna
o głównie w przebiegu cukrzyca typu 2
o ilość insuliny wystarcza do tego, żeby zapobiec
tworzeniu się ciał ketonowych
o
stężenie glukozy przekracza 6g/l i jest wyraźnie
większe niż w przebiegu cukrzycy z kwasicą

Śpiączka cukrzycowa
objawy

śpiączka cukrzycowa powstaje zazwyczaj stopniowo
i jest poprzedzona stadium objawów prodromalnych
o utrata apetytu
o nudności, wymioty
o osłabienie siły mięśniowej
o senność
o nadmierne pragnienie
podczas śpiączki
o skóra, śluzówki i język są suche
o gałki oczne miękkie
o oddech spowolniony i pogłębiony (wydychane
powietrze o zapachu acetonu u pacjentów
z kwasicą ketonową)

Cukrzyca
późne powikłania

ich główną przyczyną jest hiperglikemia
glukoza, szczególnie w wyższym stężeniu może wejść
w nieenzymatyczną reakcję z szeregiem endogennych
białek, również Hb - zmiana ich struktury i funkcji
im niższa HbA
1c
, tym lepsza kontrola cukrzycy
u pacjenta (pożądana wartość <6,5%)
do późnych powikłań należą:
o mikroangiopatia (swoista dla cukrzycy)
nefropatia
retinopatia
o neuropatia
o makroangiopatia (nieswoista dla cukrzycy)
o zespół stopy cukrzycowej (wskutek zmian
mikro- i makroangiopatycznych oraz neuropatii)
o powikłania kostne, stawowe i skórne (np.
wypryski, zakażenia bakteryjne i grzybicze)

Późne powikłania cukrzycy
patogeneza
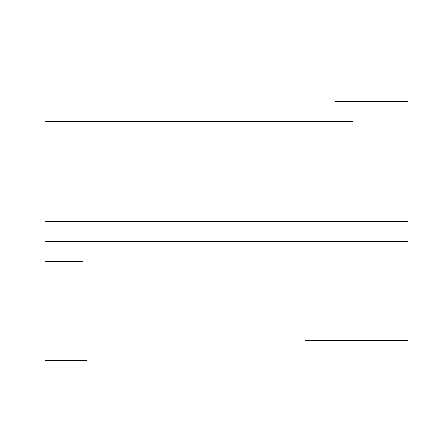
dyslipoproteinemia
→ miażdżyca tętnic →
niespecyficzna
makroangiopatia
→ zaburzenia
ukrwienia serca, mózgu i tkanek obwodowych
nieenzymatyczna glikozylacja białek → pogrubienie
błony podstawnej i błony wewnętrznej w naczyniach
końcowych → specyficzna mikroangiopatia →
retinopatia,
ślepota,
polineuropatia,
zaćma,
stwardnienie kłębuszków nerkowych, niewydolność
nerek
→
nadciśnienie
→
niespecyficzna
makroangiopatia
gromadzenie sorbitolu → osmotyczne uszkodzenie
komórek, pęcznienie komórek → polineuropatia,
zaćma

Późne powikłania cukrzycy
mikroangiopatia cukrzycowa

Nefropatia cukrzycowa
proteinuria
nadciśnienie
postępująca niewydolność nerek w następstwie
stwardnienia kłębuszków nerkowych
jedna z głównych przyczyn niewydolności nerek
wymagającej dializoterapii
Retinopatia cukrzycowa
o mikrotętniaki
o zamknięcie światła naczyń włosowatych
o uwarunkowane hipoksją tworzenie nowych
naczyń w siatkówce wiąże się, z powodu ich
kruchości, z niebezpieczeństwem krwawień
i następczego powstania ślepoty

Późne powikłania cukrzycy
makroangiopatia cukrzycowa

odpowiada miażdżycy tętnic u ludzi niechorujących na
cukrzycę
o większe nasilenie,
o pojawia się wcześniej i częściej niż zmiany
występujące w populacji ogólnej
czynnik predysponujący → zespół metaboliczny
często dochodzi do
o zawałów mięśnia sercowego,
o rozwoju miażdżycy zarostowej tętnic
o udarów mózgu
z powodu współistniejącej neuropatii w wielu
przypadkach chorzy nie odczuwają bólu typowego dla
zaburzeń ukrwienia np. w przebiegu choroby
niedokrwiennej serca → nieme niedokrwienie

Późne powikłania cukrzycy
neuropatia

następstwo mikroangiopatii
u 60-90% chorych n a cukrzycę
najczęściej rozwija się polineuropatia obwodowa
z dominującymi zaburzeniami czucia
o parestezje
o drętwienie
o nocne kurcze mięśni łydek
o zanik odruchów
rzadziej występują zaburzenia motoryczne
o osłabienie mięśni
o niedowłady
lub neuropatia autonomicznego układu nerwowego
o zaburzenia perystaltyki przewodu pokarmowego
o ortostatyczne spadki ciśnienia
o zaburzenia rytmu serca
o impotencja

Późne powikłania cukrzycy
stopa cukrzycowa

Stopa cukrzycowa
atroficzne, wrzodziejące i zgorzelinowe zmiany skórne
z wtórnymi powikłaniami
o nadkażenie
o zapalenie szpiku i kości
przyczyny
o 60% → zakażenie
o 25%
→
zaburzenia
neuro-wegetatywno-
niedokrwienne
o u pozostałych zaburzenia makroangiopatyczno-
niedokrwienne,
które
stosunkowo
często
wymagają amputacji kończyny
Wyszukiwarka
Podobne podstrony:
FARMAKOLOGIA wykład 07, FARMAKOLOGIA wykład 7 (26 XI 01) LECZENIE CUKRZYCY cz
Ostre powikłania cukrzycy cz.1
Cukrzyca cz II 11'03
Cukrzyca cz III 11'03
Leczenie Cukrzycy, FARMAKOLOGIA wykład 6 (12 XI 01) LECZENIE CUKRZYCY cz
cukrzyca cz 2
FARMAKOLOGIA wykład 06, FARMAKOLOGIA wykład 6 (12 XI 01) LECZENIE CUKRZYCY cz
cukrzyca typ 2, FARMAKOLOGIA wykład 7 (26 XI 01) LECZENIE CUKRZYCY cz
cukrzyca cz 4
cukrzyca cz 3
Cukrzyca cz I 11'03
{Eioba pl} Medyczna marihuana i cukrzyca (cz 1)
Cukrzyca cz II 11 03
Cukrzyca cz III 11 03
{Eioba pl} Medyczna marihuana i cukrzyca (cz 2)
CUKRZYCA Przełom w terapii cukrzycy typu 2 cz 1 i 2
CUDA ZE SKARBCA NATURY cz 7 CUKRZYCA
Biol kom cz 1
więcej podobnych podstron