
Fenol
Fenol (hydroksybenzen, dawna nazwa kwas karbolowy) ma posta bezbarwnych kryształków
o charakterystycznym, ostrym zapachu, o temperaturze topnienia 41
o
C i temperaturze wrzenia
182
o
C. Przy dłu szym przechowywaniu, zwłaszcza na wietle przybiera ró owe zabarwienie.
Wykazuje działanie antyseptyczne (ma zdolno koagulowania białka), co zostało wykorzystane w
lecznictwie pod koniec XIX w. Fenol jest silnie truj cy. Ma wyj tkow du zdolno dyfuzji przez
skór – 1 g fenolu przyj ty na wie ran mo e spowodowa mier . Obok oparze skóry, po
wnikni ciu do wn trza organizmu atakuje układ nerwowy, trawienny i kr enia. Zatrucie mo e
wywoła równie „mgła” fenolowa tworz ca si przy skraplaniu par fenolu w zimnym powietrzu.
Pary fenolu tworz z powietrzem mieszaniny wybuchowe w zakresie st e 0,3-2,3% obj.
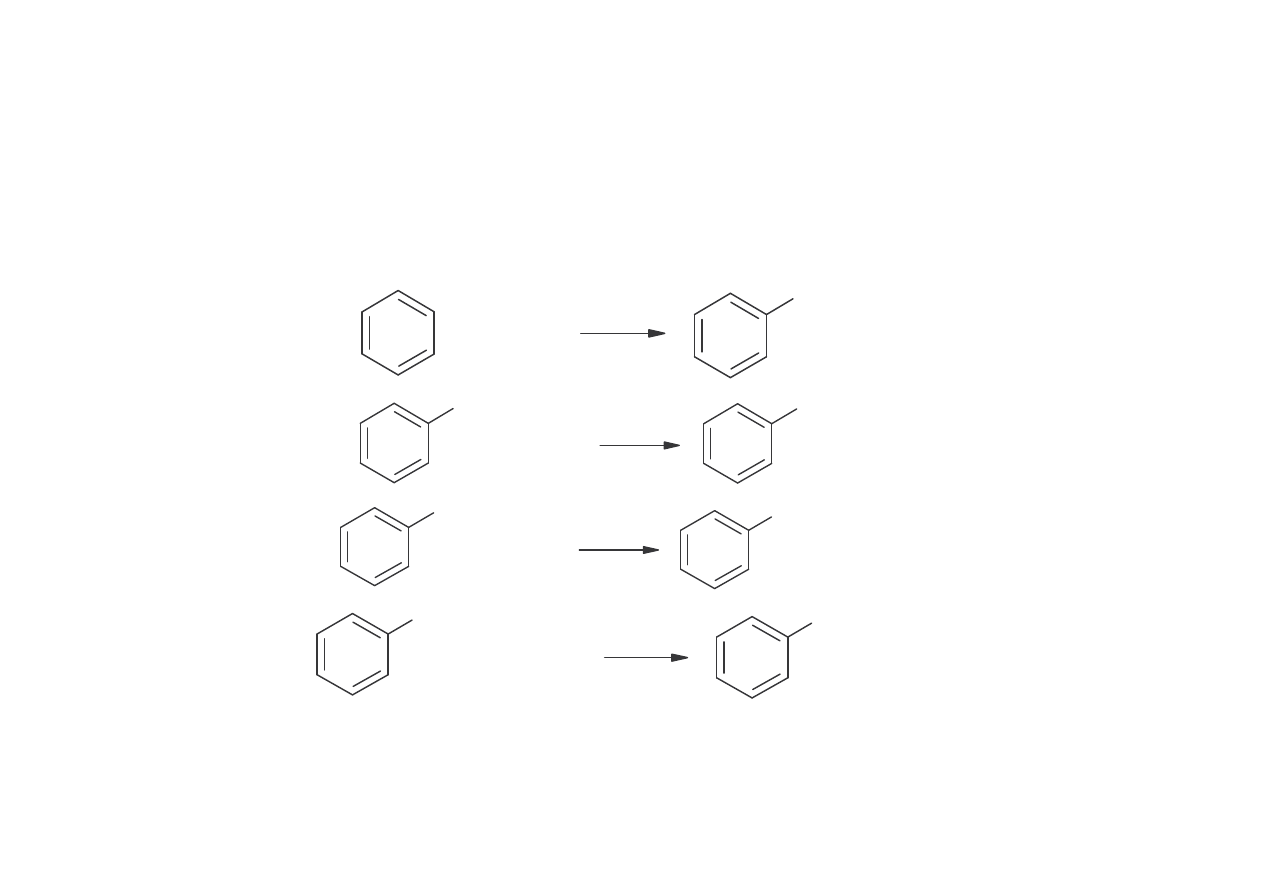
METODY OTRZYMYWANIA FENOLU
Fenol karbochemiczny, tzw. naturalny
Metoda sulfonacyjna (BASF)
SO
3
H
+ H
2
SO
4
+ H
2
O
SO
3
H
SO
3
Na
+ H
2
O
+ NaOH
SO
3
Na
ONa
+ NaHSO
3
+ NaOH
ONa
OH
+ NaHSO
3
+ SO
2
+ H
2
O
Wydajno fenolu wynosi 85-90%.

Wad procesu jest otrzymywanie du ej ilo ci produktów ubocznych Na
2
SO
3
i
Na
2
SO
4
.
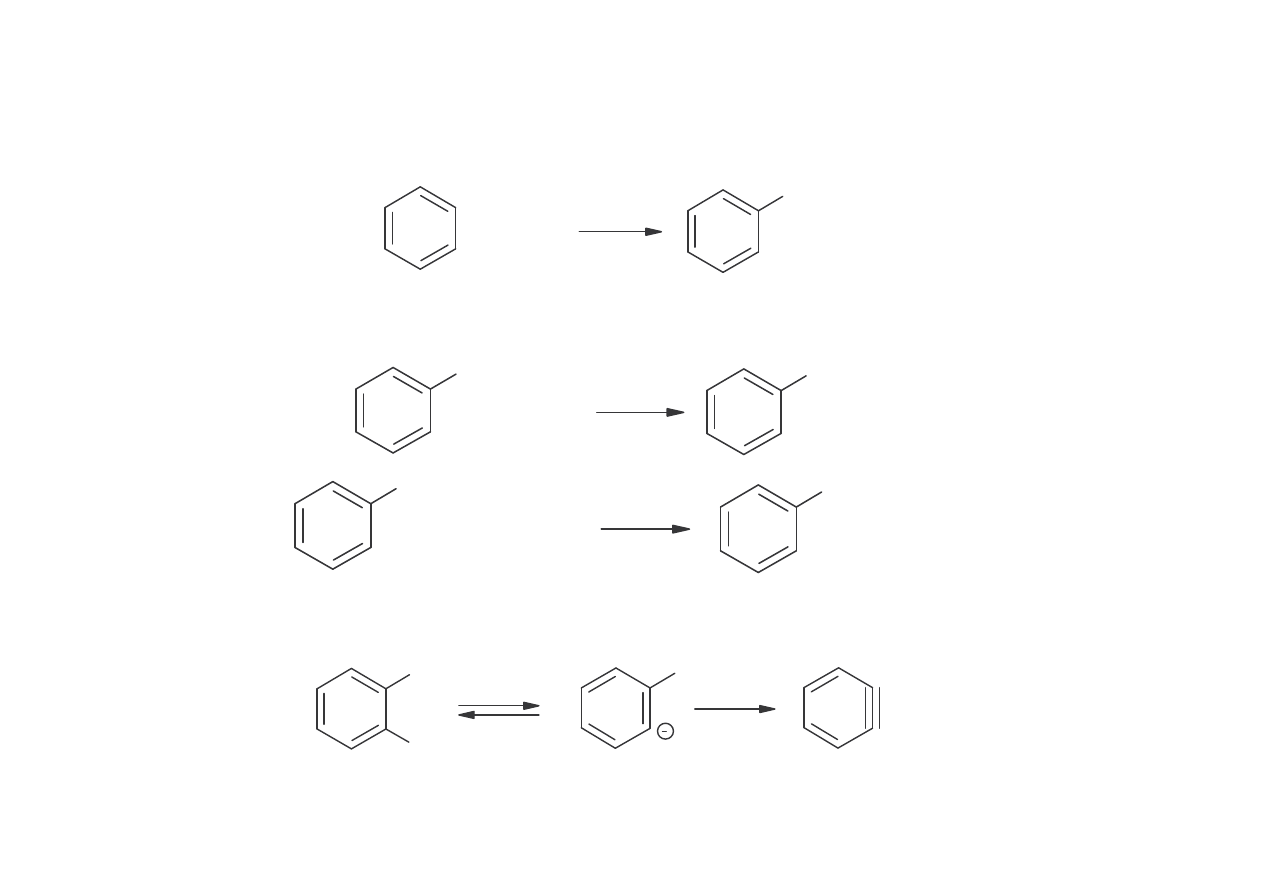
Metoda chlorowa (Dow Chemical Co)
Cl
+ HCl
+ Cl
2
zmydlanie chlorobenzenu za pomoc 10-15% wodnego roztworu NaOH w
temperaturze 360-390
o
C, pod ci nieniem 25-30 MPa.
ONa
Cl
+ HCl
+ NaOH
ONa
OH
+ NaHCO
3
+ CO
2
+ H
2
O
Cl
H
Cl
OH
-
+ Cl
-
benzyn
-H
2
O
OH
OH
H
+
+ OH
-
Produkty uboczne: wielochlorobenzeny, eter difenylowy i hydroksyfenole (orto i
para).
Wydajno fenolu wynosi 90-98%.
Metoda Raschiga
Cl
+ HCl + 0,5 O
2
+ H
2
O
katalizator - (CuCl
2
-FeCl
3
/Al
2
O
3
),
temperatura - 200-230
o
C.
konwersja benzenu wynosi od 10 do 15%, selektywno 70-85%.
hydroliza w fazie gazowej w obecno ci elu krzemionkowego lub fosforanu
wapnia (Ca
3
(PO
4
)
2
/SiO
2
) w temperaturze 400-450
o
C.
OH
Cl
+ H
2
O
+ HCl
Wydajno fenolu wynosi od 75-85%.
Wada metody Raschiga - du e zu ycie pary wodnej i wody chłodz cej, ponadto
problemy korozyjne, narzucaj ce konieczno wykonywania aparatury ze
specjalnych materiałów.

Metoda kumenowa
Odkryta w 1943 r. w Niemczech przez Hocka i Langa
Etapy otrzymywania fenolu:
1.alkilowanie benzenu za pomoc propylenu do kumenu,
2.utlenianie kumenu za pomoc tlenu cz steczkowego do wodoronadtlenku kumenu,
3.rozkład wodoronadtlenku kumenu za pomoc silnych kwasów do fenolu i acetonu.
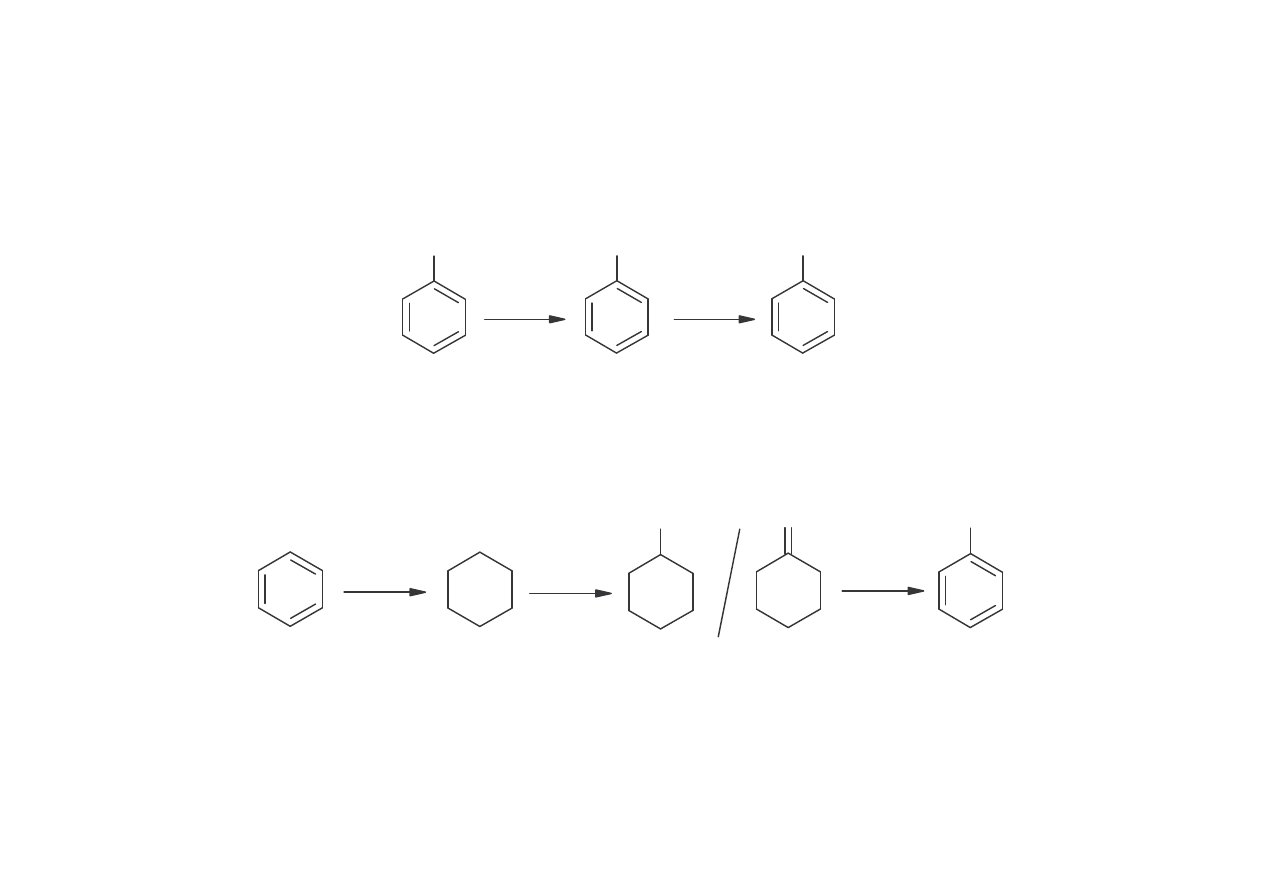
INNE METODY OTRZYMYWANIA FENOLU
Utlenianie toluenu poprzez kwas benzoesowy (metoda Dow)
CH
3
COOH
OH
O
2
+ CO
2
Z benzenu poprzez cykloheksanol/-on (Scientific Design)
OH
OH
O
O
2
+ 3 H
2
- H
2
Jednostopniowy proces z benzenu
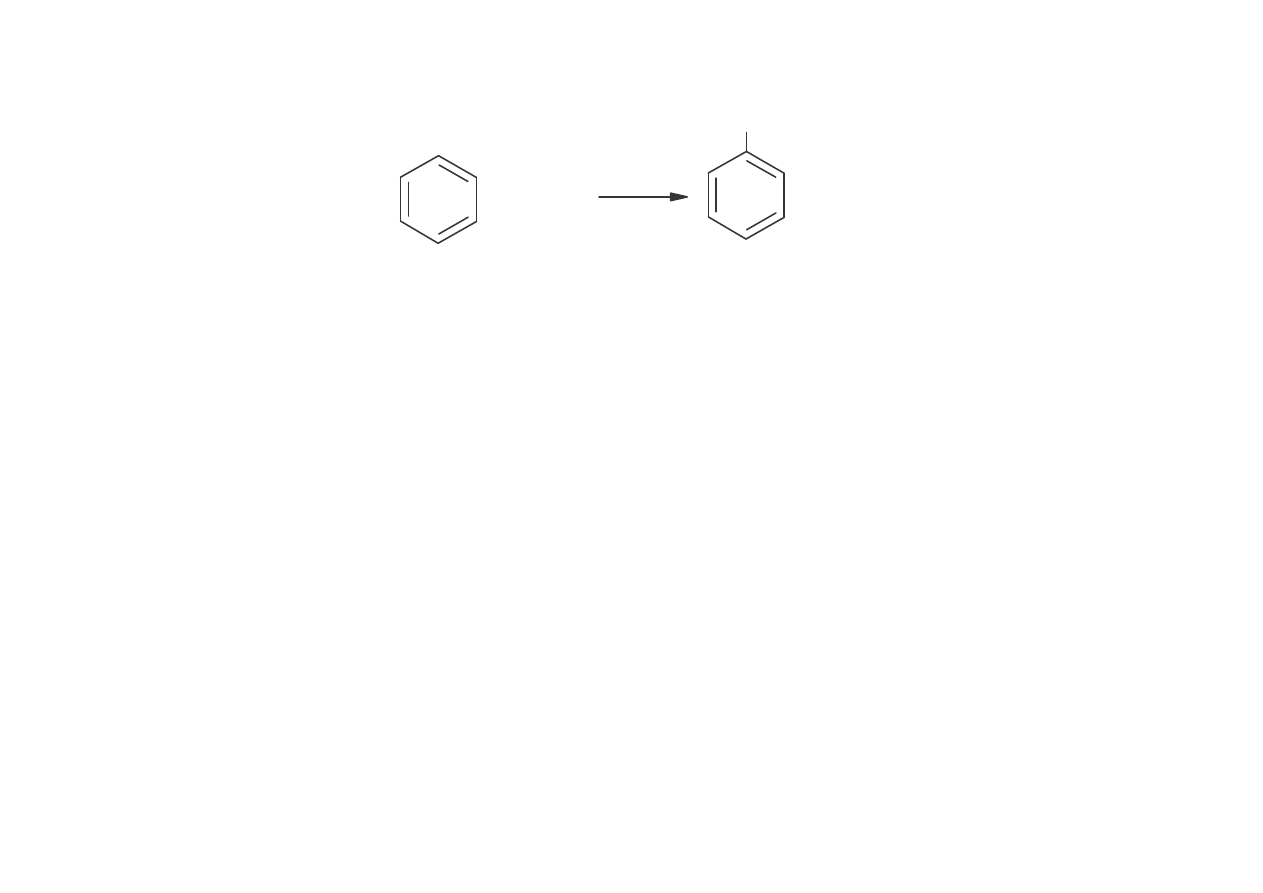
OH
+ N
2
O
+ N
2

ZASTOSOWANIE FENOLU
wiatowa produkcja fenolu w 1997 r. wynosiła 7 mln t,
i
z czego 36% przypadało na
USA, 31% – na Europ Zachodni , 14% – na Japoni , 8% – na Azj (z wyj tkiem
Japonii), 7% – na Europ Wschodni , 2% – na Brazyli i 2% – na inne kraje.
Dziesi ciu najwi kszych producentów fenolu (w nawiasie zdolno ci produkcyjne w
tysi cach ton rocznie): Phenolchemie (700), EniChem (380), Allied Signal (370), Shell
(355), Aristech/Mitsubishi (330), GE Plastics (290), Mitsui Petrochemical (285),
Georgia Gulf (270), Dow Chemical (250) i Rhône-Poulenc (250).
2
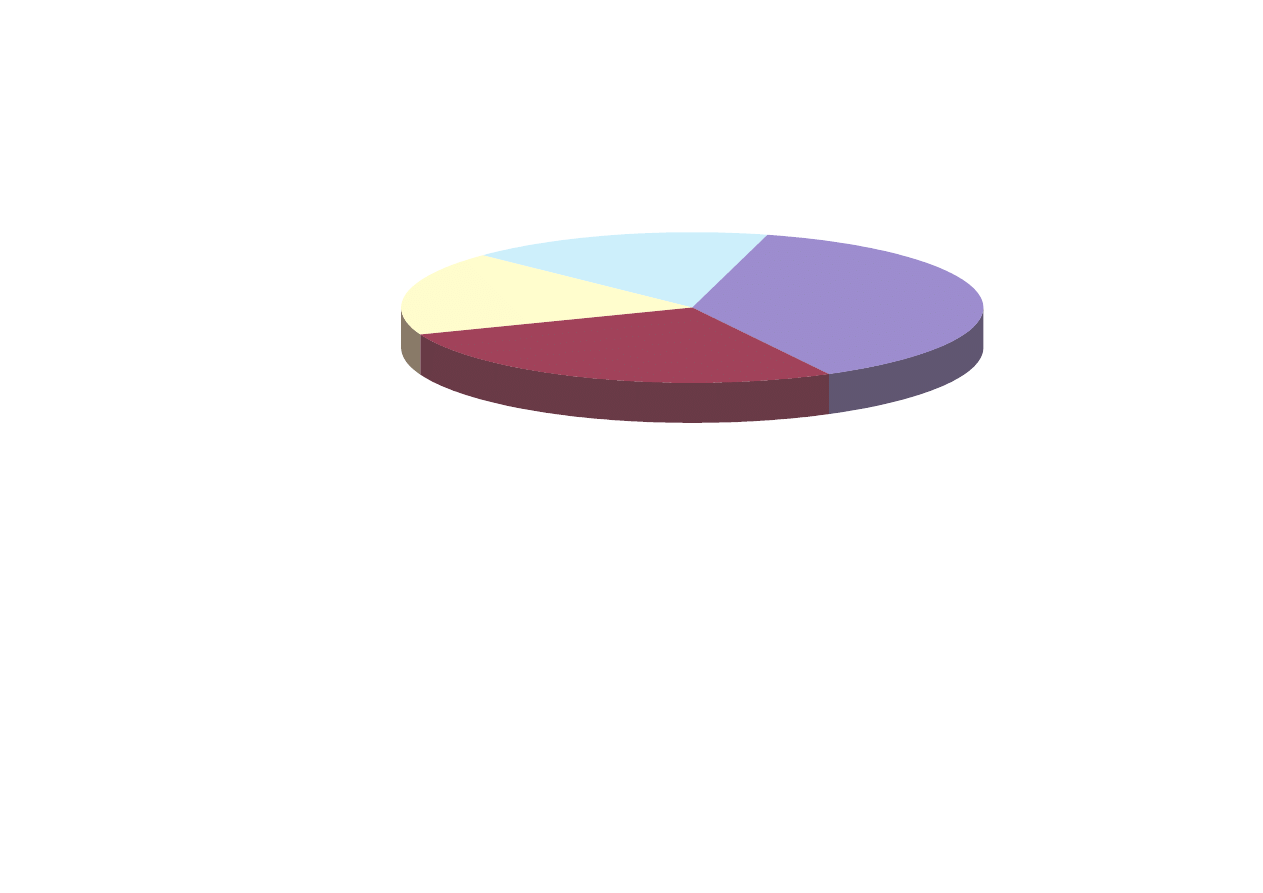
Główne kierunki zu ycia fenolu przedstawia rys.
Bisfenol A
38%
ywice fenolowe,
27%
Cykloheksanon
18%
Inne, 17%
Rys. Struktura zu ycia fenolu na wiecie w 1998 r.
Na podstawie: Chem. Eng. News 1998, 76(14), 21.
Kondensacja fenolu z acetonem do Bisfenolu A (dianu);
ywice fenolowe (stanowi one jedn z najstarszych odmian tworzyw sztucznych;
pierwszy patent w 1909 r. przez Beakeland`a);
+ HCHO
+ HCHO
OH
OH
CH
2
OH
OH
CH
2
OH
CH
2
OH
OH
CH
2
OH
HOCH
2
CH
2
OH
+ HCHO
OH
CH
2
OH
2
OH
CH
2
OH
OH
CH
2
+ H
2
O
Rezole – hydroksymetylolofenole z niewielka zawarto ci produktów dalszej reakcji
o małym ci arze cz steczkowym.
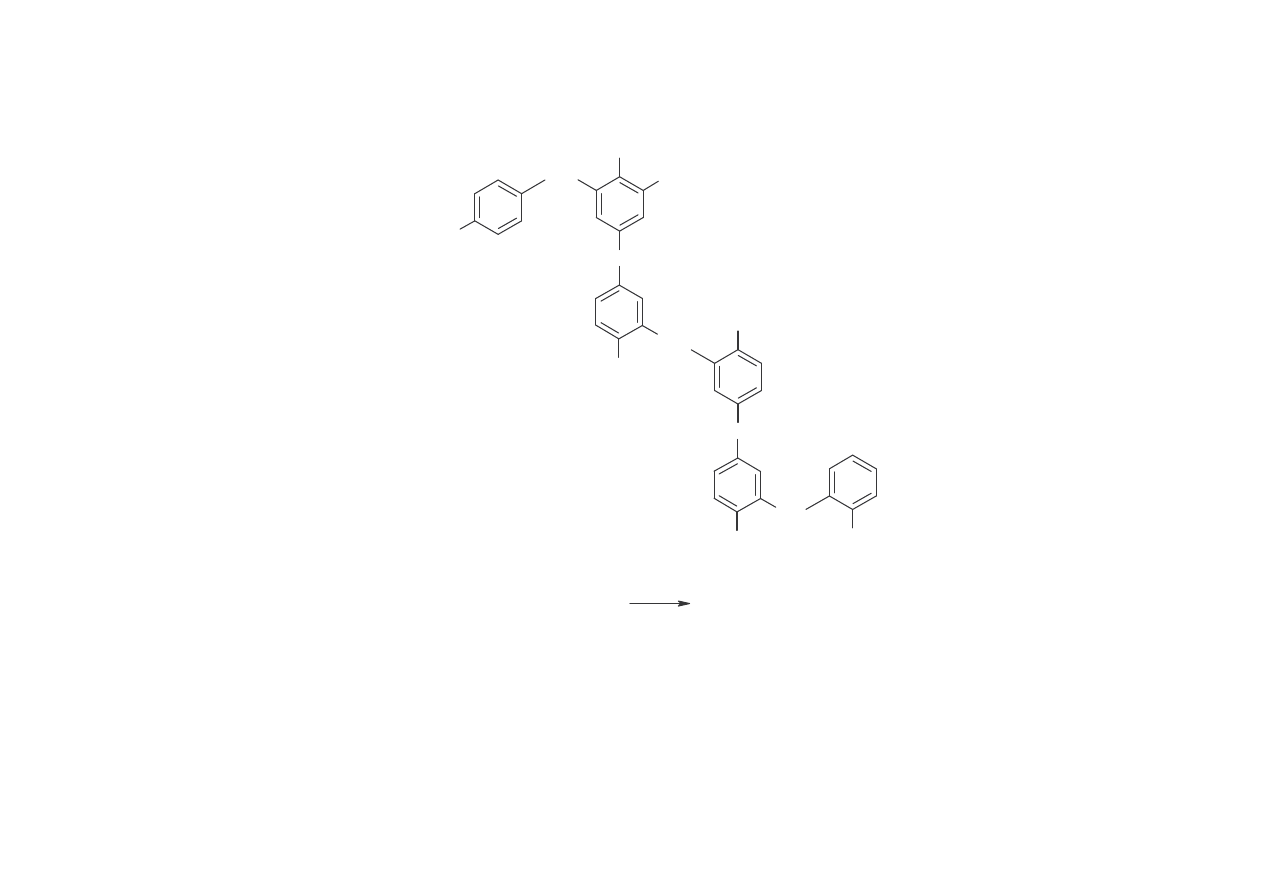
Nowolaki ( ywic nowolakowych)
CH
2
CH
2
OH
OH
CH
2
CH
2
O
H
OH
CH
2
OH
CH
2
OH
(CH
2
)
6
N
4
+ 6 H
2
O
2 HCHO + 4 NH
3

ywice fenolowo-formaldehydowe wykorzystywane s jako kleje do drewna,
laminaty, materiały izolacyjne, garbniki.
wiatowa produkcja ywic fenolowo-formaldehydowych w 1997 r. wynosiła 2,4 mln
t.
ii
Alkilowania fenolu olefinami do tzw. alkilofenole. Około 60% ich całkowitej
produkcji stanowi : izooktylofenol, izononylofenol i izododecylofenol, powstaj ce w
reakcji alkilowania fenolu dimerem izobutenu oraz trimerem i tetramerem propylenu.
Zwi zki te wykorzystuje si jako dodatki do olejów smarowych, jako antyutleniacze i
substancje pomocnicze w przetwórstwie kauczuków i tworzyw sztucznych.

Alkilofenole zawieraj ce ła cuch alkilowy C
6
-C
20
(szczególnie C
9
) poddaje si
β-
oksyalkilowaniu za pomoc tlenku etylenu:
OH
C
9
H
19
C
9
H
19
O-(CH
2
CH
2
O)-H
CH
2
C
H
2
O
n
+
n
NaOH
w wyniku czego powstaj pochodne fenolu z hydrofilowym ła cuchem
polioksyetylenowym, b d ce niejonowymi rodkami powierzchniowo-czynnymi,
wykorzystywanymi jako składniki wielu rodków pior cych i emulgatorów.
Fenol wykorzystywany jest w lecznictwie ju od 1865 r. Przez wiele lat był
podstawowym antyseptykiem, stosowanym zwłaszcza w chirurgii. W wyniku
chemicznej modyfikacji cz steczki fenolu zsyntezowano du grup zwi zków, z
których wiele zyskało trwał pozycj w lecznictwie jako rodki dezynfekuj ce, gdy
wykazuje działanie bakteriobójcze i grzybobójcze.
Surowy fenol stosuje si do odka ania urz dze sanitarnych, natomiast fenol płynny
(roztwór wodny fenolu) do dezynfekcji sprz tu medycznego.

W wyniku karboksylowania fenolu otrzymuje si kwas salicylowy:
OH
COOH
który wykazuje słabe wła ciwo ci antyseptyczne, powstrzymuje procesy gnilne, działa
przeciwgor czkowo. Wykorzystuje si go do produkcji rodków leczniczych (m.in.
polopiryny), estrów zapachowych, barwników, a ponadto słu y do konserwacji
artykułów spo ywczych.
Inne kierunki wykorzystania fenolu:
•
chlorofenole – zwi zków znajduj cych zastosowanie jako herbicydy, fungicydy,
półprodukty barwnikarskie, rodki przeciwgrzybiczne, dezynfekcyjne, rodki
ochrony drzewa, rodki konserw,
•
nitrofenole – produkty barwnikarskie oraz materiały wybuchowe, barwniki azowe
do włosów i futer, wywoływacze fotograficzne,
•
fenoloftaleiny,
•
bawniki siarkowe, rodki pomocniczych dla przemysłu tekstylnego, otrzymywane
w wyniku siarkowania fenolu.
iii,iv

PRODUKCJA FENOLU I JEGO POCHODNYCH W POLSCE
Zakłady Chemiczne „O wi cim” - metod chlorowania benzenu
Nadodrza skie Zakłady Przemysłu Organicznego „Rokita” w Brzegu Dolnym i
Bydgoskie
Zakłady Chemiczne – poprzez sulfonowanie benzenu.
Mazowieckie Zakłady Rafineryjne i Petrochemiczne w Płocku – metod kumenow .
Produkcja fenolu w Polsce w 1998 r. wynosiła 47,3 tys. ton.
W kraju fenol zu ywany jest głównie do produkcji kaprolaktamu w Zakładach
Azotowych Tarnowie (60%), Bisfenolu A w Blachowni oraz ró nych pochodnych
fenolu w Zakładach Chemicznych ”Rokita”.
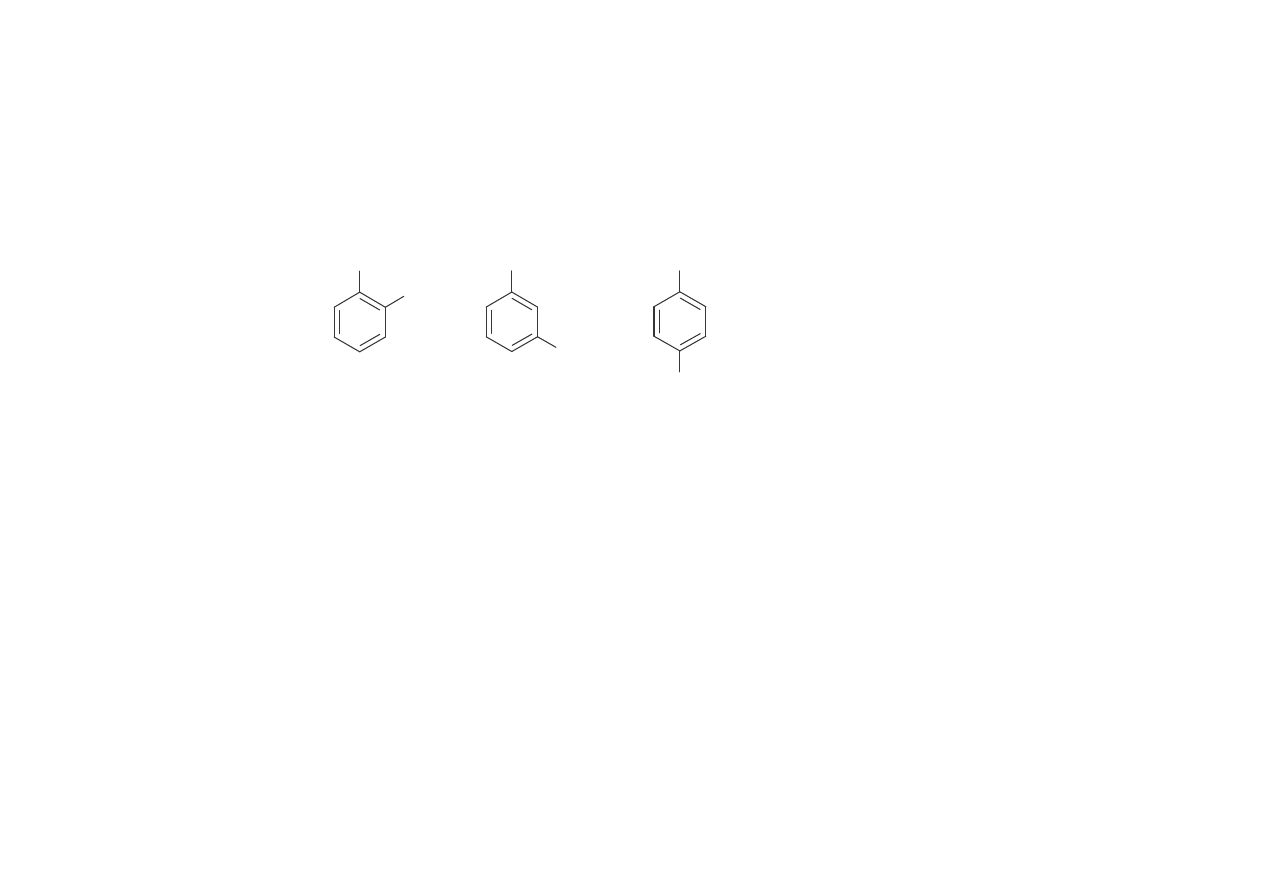
Krezole
Krezole, czyli metylofenole wyst puj jako trzy izomery:
OH
CH
3
OH
CH
3
*
*
*
OH
CH
3
o-krezol
m-krezol
p-krezol
Temperatura
topnienia,
o
C
31
12
35
Temperatura
wrzenia,
o
C
191
202,5
202
Najwi ksze znaczenie przemysłowe ma m-krezol, jako zwi zek trójfunkcyjny, do
wyrobu ywic fenolowo-formaldehydowych.
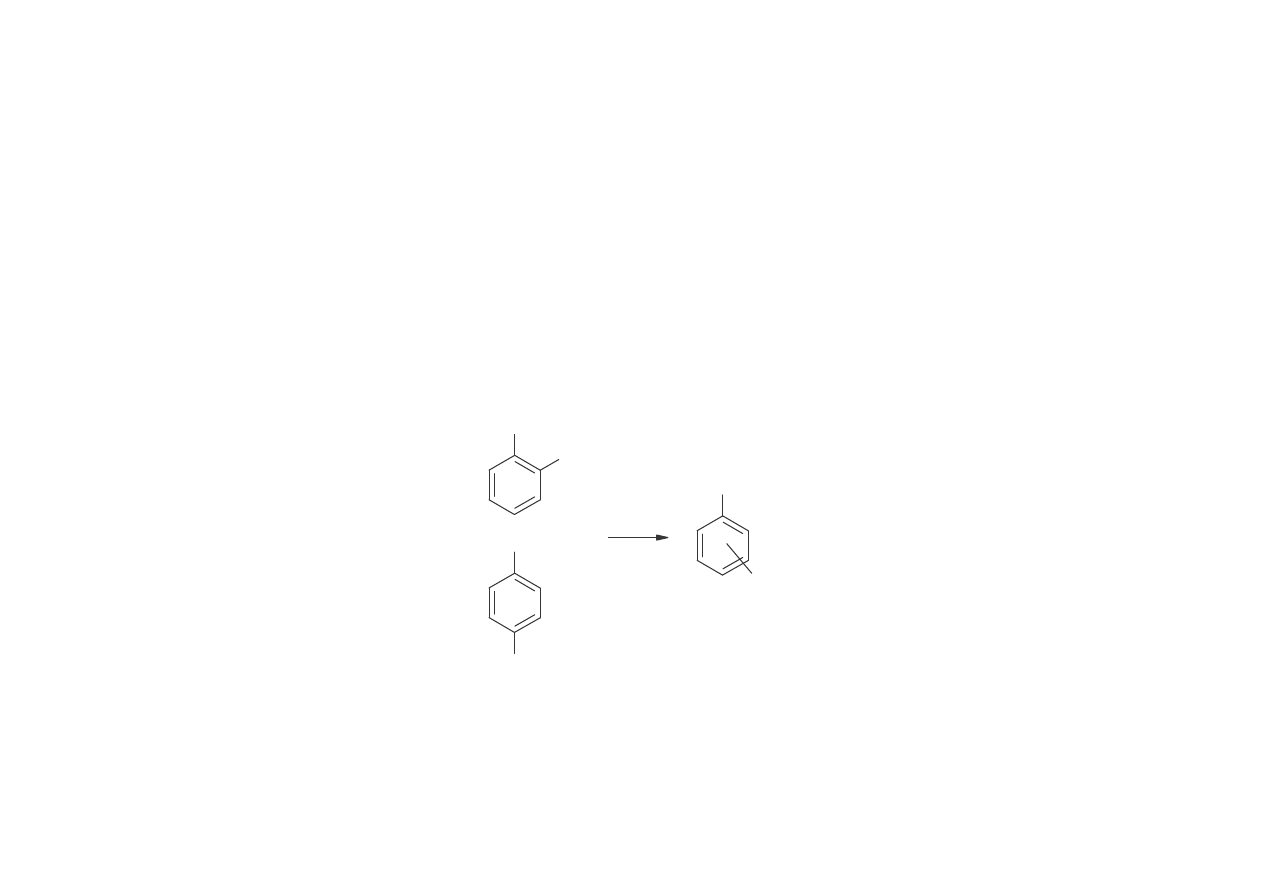
OTRZYMYWANIE KREZOLI
1.o-, m-, p-Krezole otrzymuje si przy przeróbce smoły w glowej z oleju
karbolowego.
2.Krezole wydzielane s tak e z ekstraktów alkalicznych produktów krakowania
frakcji naftowych (w USA). W ten sposób otrzymuje si głównie m- i p-krezol.
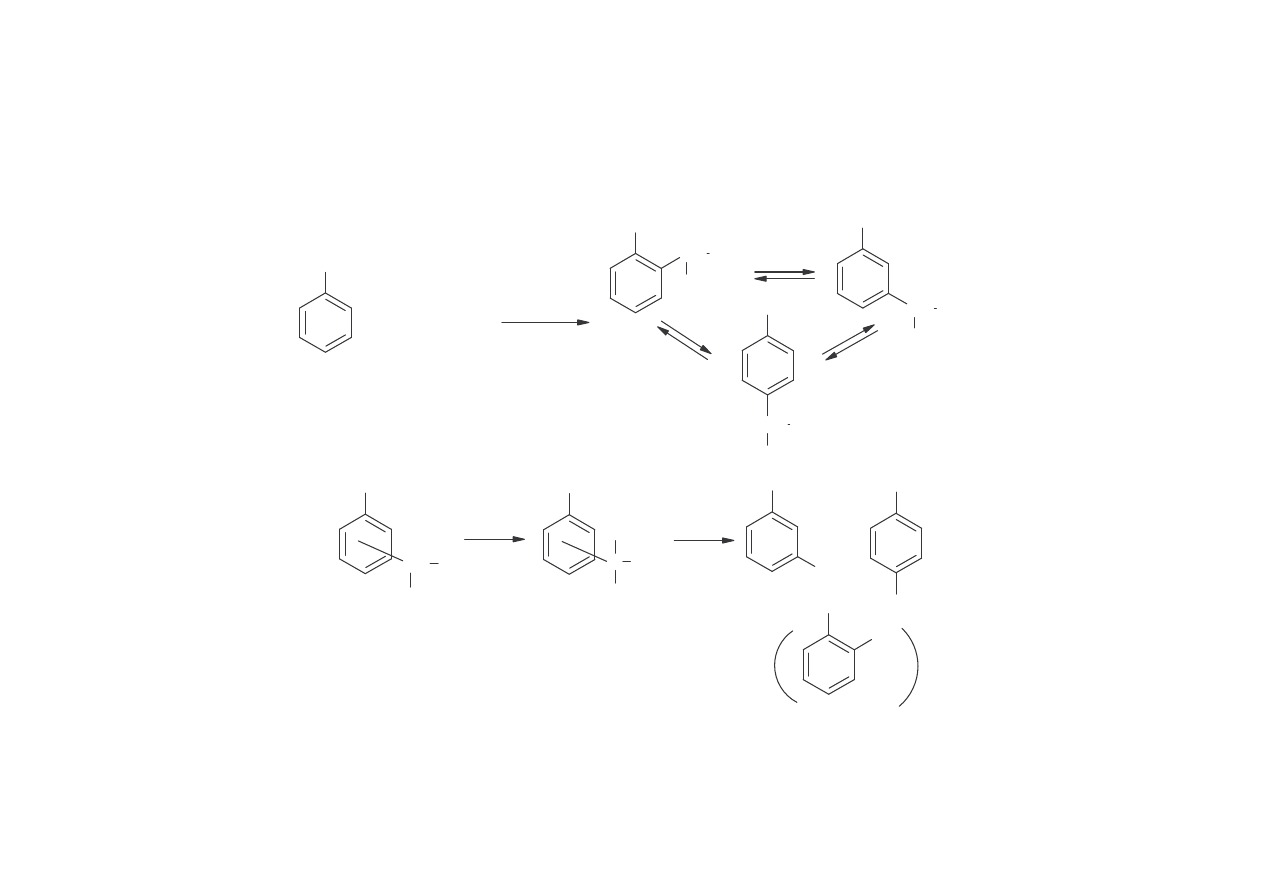
3.Z o- i p-chlorotoluenu przez hydroliz alkaliczn , podobnie jak w metodzie Dow-
Bayer – hydrolizy chlorobenzenu, otrzymuje si głównie m-krezol. Proces prowadzi
si w temperaturze 360-390
o
C, pod ci nieniem 28-30 MPa.
CH
3
Cl
CH
3
Cl
CH
3
NaOH
-NaCl
OH
Po zakwaszeniu otrzymuje si mieszanin o-, m-, p- w stosunku molowym 1:2:1. Po
oddzieleniu destylacyjnym o-krezolu, otrzymuje si mieszanin zawieraj c ok. 70%
izomeru meta.
4.Propylowanie toluenu do cymenu (głównie p- i m-, z oddzieleniem o-) i nast pnie
jego utlenienie, analogicznie do metody kumenowej (met. Hocka), poprzez
wodoronadtlenki prowadzi do m- i p-krezolu.
CH
3
CH
3
CH
CH
3
CH
3
CH
3
CH
CH
3
CH
3
CH
3
CH
CH
3
CH
3
+ CH
2
=CH-CH
3
60-80
o
C
AlCl
3
/HCl
CH
3
CH CH
3
CH
3
+ O
2
CH
3
C
CH
3
OOH
CH
3
CH
3
OH
CH
3
OH
CH
3
OH
+
+
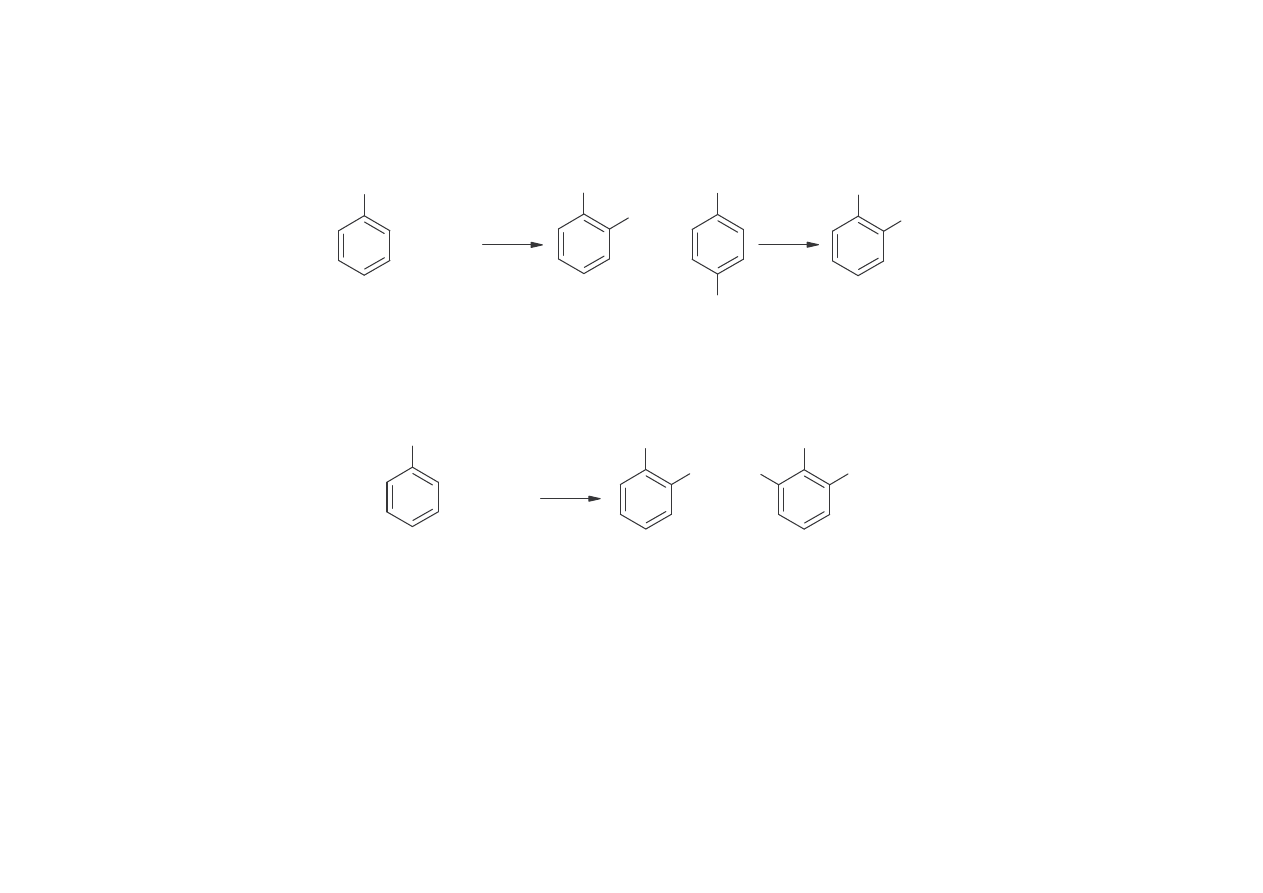
5.Sulfonowanie toluenu i hydroliza w stopie kwasu toluenosulfonowego daje głównie
o-krezol
CH
3
CH
3
SO
3
H
CH
3
SO
3
H
CH
3
OH
+ H
2
SO
4
+
NaOH
6.Metylowanie fenolu metanolem prowadzi głównie do o-krezolu i 2,6-ksylenolu.
Proces prowadzony jest w obecno ci
γ-Al
2
O
3
, modyfikowany ró nymi alkaliami, np.
LiOH, NaOH i KOH w temperaturze 220-280
o
C.
v
OH
OH
CH
3
OH
CH
3
C
H
3
+ CH
3
OH
+
- H
2
O

ZASTOSOWANIE KREZOLI
Krezole stosowane s do wyrobu ywic fenolowych, fosforanu trikrezylu,
rodków dezynfekuj cych i do flotacji, jako półprodukt do syntez organicznych, m-
krezol jako wywoływacz w fotografii. Mieszanina trzech izomerów słu y ponadto do
dezynfekcji pomieszcze oraz jako rodek odka aj cy w weterynarii. Podobnie jak
fenol działa dra ni co i wchłania si przez skór , dlatego nie mo e by stosowany jako
antyseptyk zewn trzny.
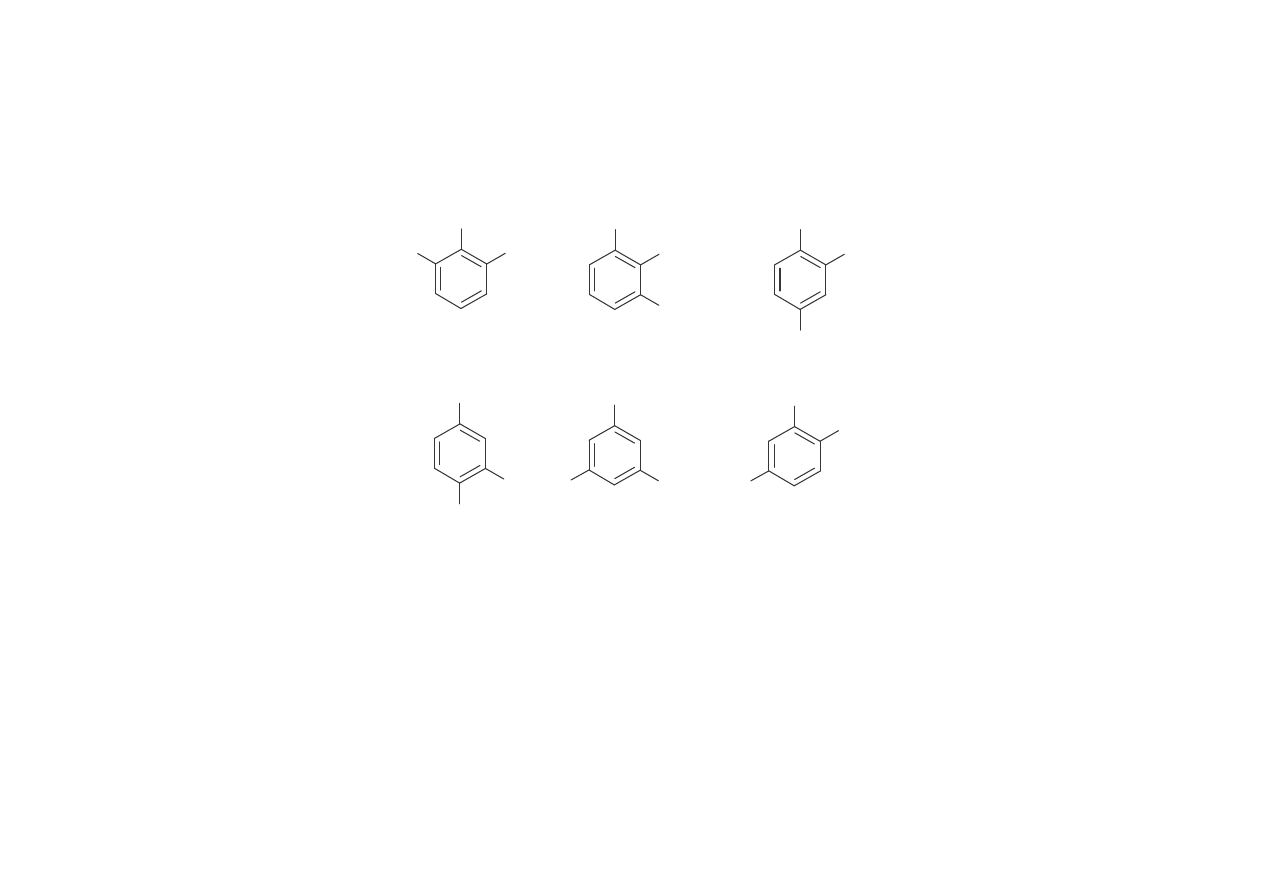
KSYLENOLE
Podobnie jak krezole, ksylenole wyst puj w postaci form izomerycznych:
OH
C
H
3
CH
3
OH
CH
3
CH
3
OH
CH
3
CH
3
OH
CH
3
CH
3
OH
C
H
3
CH
3
OH
CH
3
C
H
3
2,6-ksylenol
2,3-ksylenol
2,4-ksylenol
2,5-ksylenol
3,5-ksylenol
3,4-ksylenol
Najwi ksze znaczenie przemysłowe maj 2,6- i 3,5-ksylenole.
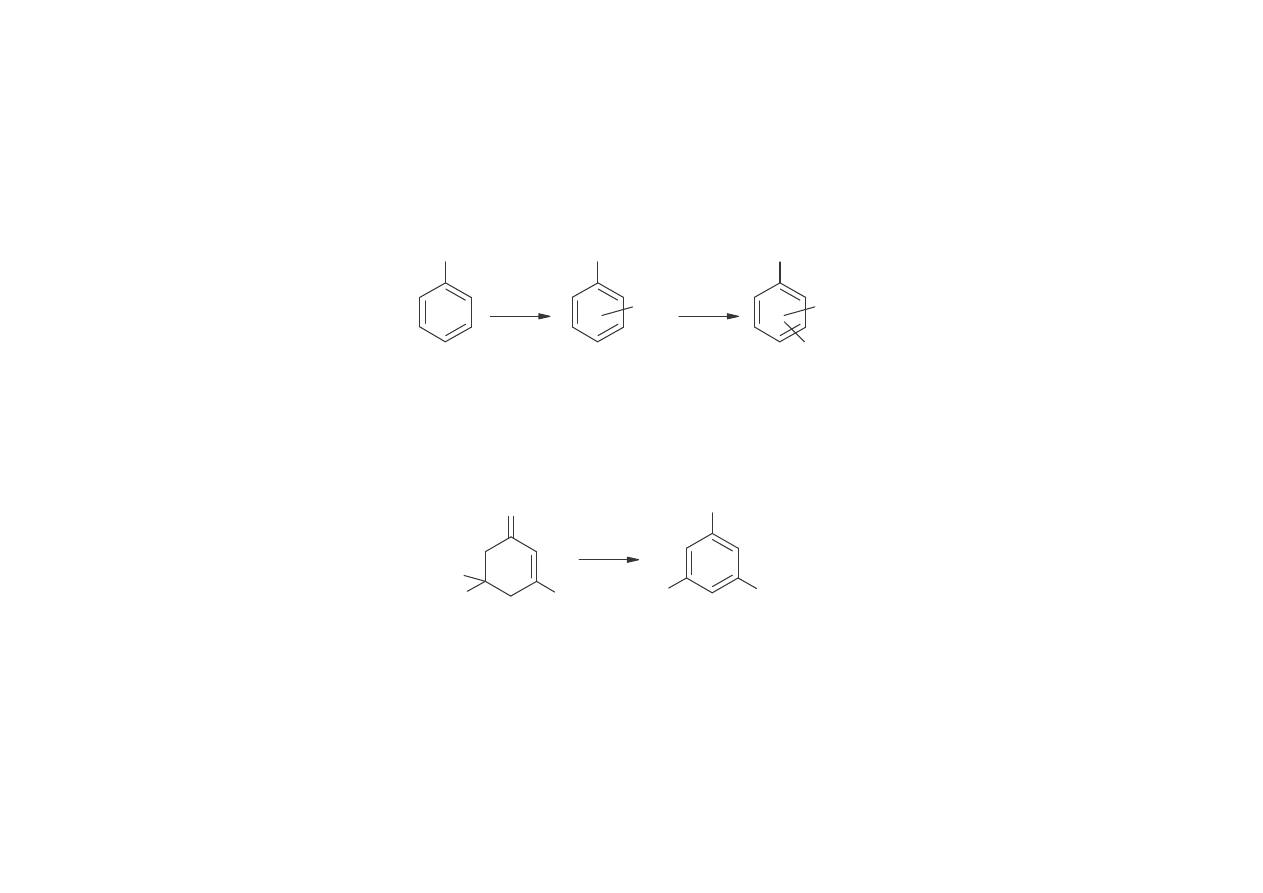
METODY OTRZYMYWANIA 2,6- I 3,5-KSYLENOLI
2,6-Ksylenol otrzymuje si przez metylowanie fenolu CH
3
OH.
OH
CH
3
OH
OH
CH
3
CH
3
OH
OH
CH
3
CH
3
głównie o-
głównie 2,6-
3,5-Ksylenol
3,5-Ksylenol mo na otrzymywa :
1.poprzez demetanizacj izoforonu (metoda MYTD Shell, opracowana w 1969 r.):
O
C
H
3
C
H
3
CH
3
OH
C
H
3
CH
3
+ CH
4
Reakcj prowadzi si katalitycznie w temperaturze 450-650
o
C.
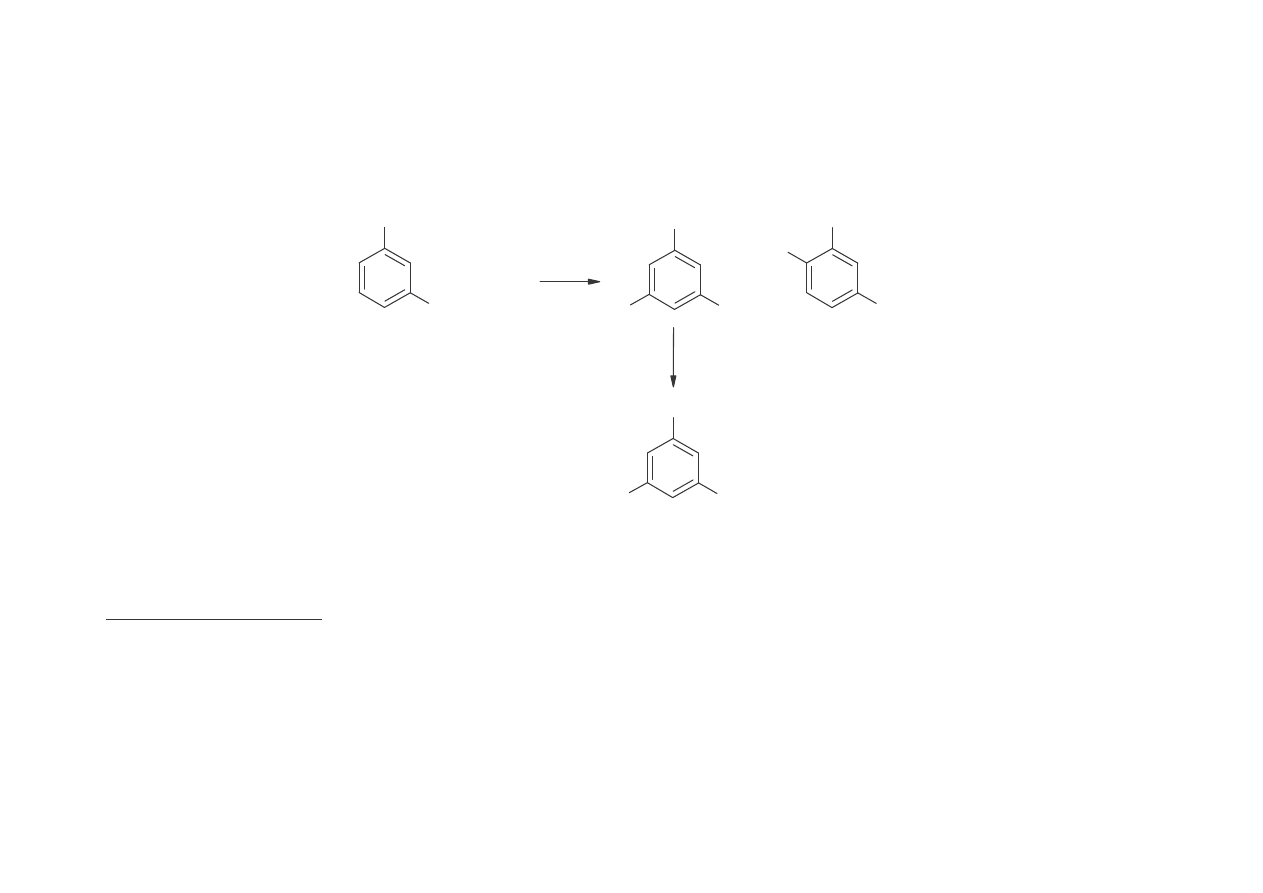
2.poprzez sulfonowanie m-ksylenu do mieszaniny kwasu 2,4- i 3,5-
dimetylosulfonowego, a nast pnie izomeryzacja w 220
o
C 2,4- do 3,5-izomeru, który
przez stapianie z NaOH daje 3,5-ksylenol
CH
3
CH
3
CH
3
HO
3
S
CH
3
HO
3
S
CH
3
CH
3
CH
3
O
H
CH
3
+ H
2
SO
4
+
NaOH
Ksylenole (wszystkie izomery) otrzymuje si ponadto z oleju karbolowego i w
niewielkich ilo ciach jako produkty z rafinerii naftowych.
i
CIN, 1999, 1-3.
ii
CIN, 1999, 1-3.
iii
Bogoczek R., Kociołek-Balawejder E., Technologia chemiczna organiczna, Wrocław 1992.
iv
Wiszniowski K., Wydzielanie indywidualnych zwi azków ze smoły w glowej w kraju, Chemik
v
Chim. Prom. 1989, 65(5), 15; Przemysł Chemiczny, (1990?).
Wyszukiwarka
Podobne podstrony:
Analiza Pytlik Pochodna id 6116 Nieznany
Instrumenty pochodne id 217770 Nieznany
AMI 17 1 Pochodne id 59051 Nieznany (2)
pochodna id 364359 Nieznany
pochodne wyzszych rzedow id 364 Nieznany
Calculus Pochodne Odp id 107876 Nieznany
4 pochodne wektorow id 38223 Nieznany (2)
pochodne wzory 4 id 364477 Nieznany
Emocje podstawowe i pochodne id Nieznany
pochodne wzory domek id 364486 Nieznany
Pochodne funkcji 4 id 364442 Nieznany
Calculus Pochodne Zad id 107877 Nieznany
pochodna funkcji, wyklad id 364 Nieznany
pochodne wyzszych rzedow id 364 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
więcej podobnych podstron