2014-01-30
1
Immunologia zakażeń
- wybrane elementy
Ryszard Międzybrodzki
Zakład Immunologii Klinicznej
Instytut Transplantologii, Warszawski Uniwersytet Medyczny
Samodzielne Laboratorium Bakteriofagowe
Instytut Immunologii i Terapii Doświadczalnej PAN we Wrocławiu
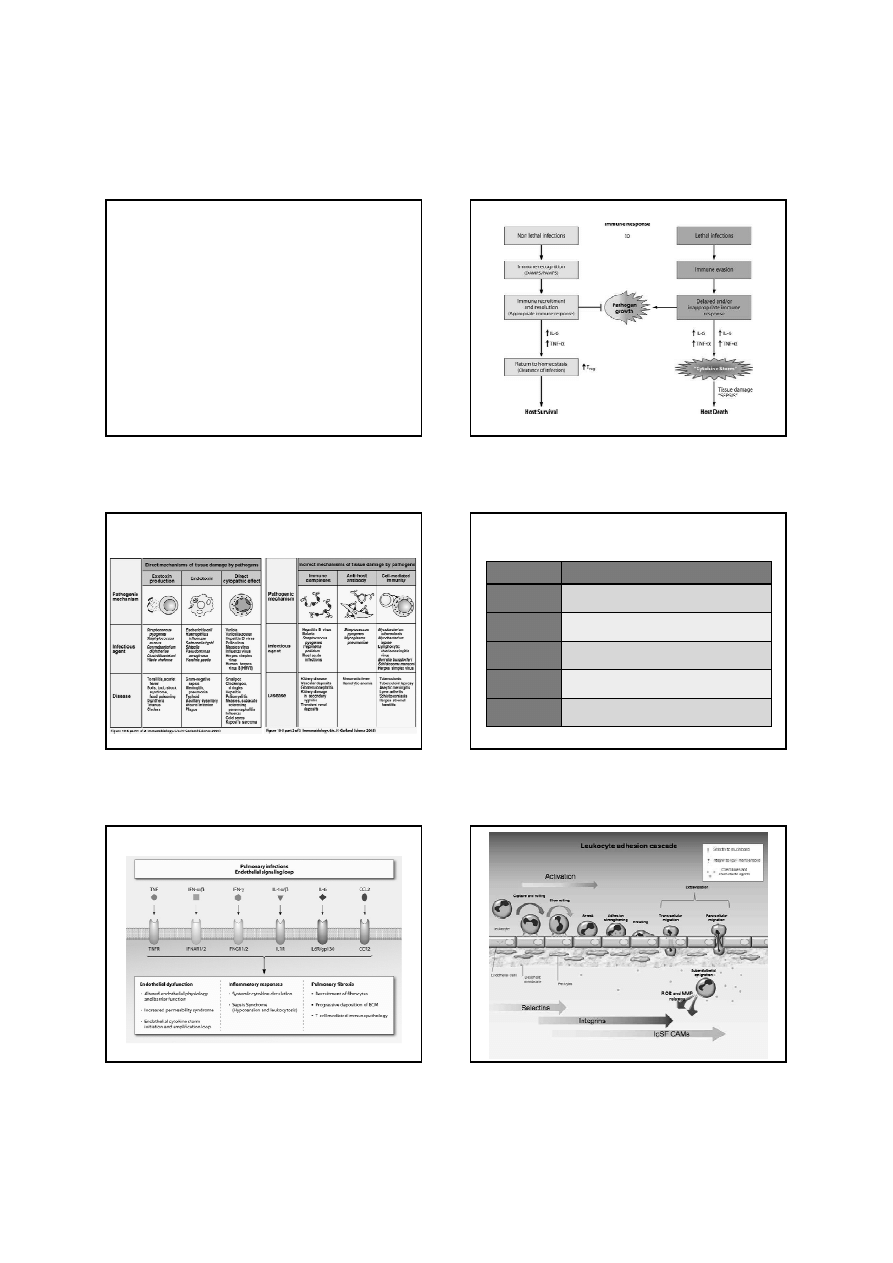
Mechanizmy powodujące uszkodzenie tkanek przez patogenne
drobnoustroje
Rodzaje cytokin
4
Typ
Działanie
Interferony
Regulacja j odporności wrodzonej, aktywacja odpowiedzi przeciw
wirusom, działanie antyproliferacyjne.
Interleukiny
Wzrost i różnicowanie leukocytów; wiele z nich ma działanie
prozapalne.
Chemokiny
Kontrolują chemotaksję, rekrutację leukocytów; wiele z nich ma
działanie prozapalne.
Czynniki stymulujące
wzrost kolonii
Stimulacja proliferacji i różnicowania progenitorowych komórek
hematopoetycznych.
Czynnik martwicy
nowotworu
Działanie prozapalne, aktywacja cytotoksycznych limfocytów T.
Przykład najwa
ż
niejszych miediatorów „burzy cytokinowej” bior
ą
cych udział w zapaleniu płuc.
Tisoncik J R et al. Microbiol. Mol. Biol. Rev. 2012;76:16-32
6
2014-01-30
2
Interleukina 8
•
Jest najlepiej poznaną chemokiną.
•
Jej wydzielanie wzmaga IL-1 i TNF.
•
Jest wytwarzana przez monocyty (72 aminokwasy) i
środbłonek (77 aminokwasów).
•
Działa na neutrofile: powoduje ich chemoatraksję
(najsilniej ze wszystkich cytokin) i degranulację, zmianę
kształtu komórek, uwolnienie enzymów lizosomalnych,
działanie cytotoksyczne.
Inne czynniki chemotaktyczne działające na granulocyty
lub monocyty
•
fragmenty C5a i C3a dopełniacza,
•
N-formylowane peptydy uwalniane przez bakterie (np. N-
formylometionyloleucyno- fenyloalanina - FMLP),
•
defensyny wytwarzane przez komórki nabłonkowe i neutrofile,
•
IL-1, TNF-a, TGF-p, CXCL1 i CXCL5 i inne chemokiny uwalniane
przez monocyty i makrofagi,
•
tripeptyd prolina-glicyna-prolina uwalniany enzymatycznie z
kolagenu,
•
leukotrien LTB
4
i czynnik aktywujący płytki (PAF) uwalniane przez
różne komórki, w tym również przez neutrofile,
•
chemeryna (działa chemotaktycznie na makrofagi i komórki
dendrytyczne oraz uczestniczy w różnicowaniu komórek tkanki
tłuszczowej),
•
osteopontyna (występuje w kościach i bierze udział w ich
przebudowie).
•
Interleukina 1 (IL-1)
•
Interleukina 2 (IL-2)
•
Interleukina 6 (IL-6)
•
Interleukina 17 (IL-17)
Najważniejsze
interleukiny o działaniu
prozapalnym
9
•
Interleukina 4 (IL-4)
•
Interleukina 10 (IL-10)
•
Interleukina 6 (IL-6)
•
Interleukina 17 (IL-17)
Najważniejsze
interleukiny o działaniu
przeciwzapalnym
Także rozpuszczalne
receptory jak np. sIL-1R
•
Należy do nadrodziny, która obejmuje kilkadziesiąt związków o podobnej
budowie (najważniejszym obok TNF-
α
określanego obecnie jako kacheksyna
lub po prostu jako TNF jest TNF-
β
określany jako limfotoksyna).
•
Wydzielany jest głównie przez monocyty i makrofagi, ale może być także
produkowany przez limfocyty T i B, fibroblasty czy keratynocyty.
•
Występuje zarówno w formie błonowej na powierzchni komórki, jak i w formie
rozpusz-czalnej. Ma dwa receptory, które również mogą występować w formie
rozpuszczonej.
•
Receptor TNFR1 znajduje się na większości ko-mórek organizmu i wiąże obie
formy TNF aktywując m.in. czynnik transkrypcyjny NF-kappaB i/lub apoptozę
(np. komórek nowotworowych).
•
TNFR2 jest obecny głównie na powierzchni leukocytów i ko-mórek śródbłonka.
Reaguje przede wszystkim z formą błonową TNF, co najprawdopodobniej
prowadzi z jednej strony do pobu-dzenia komórek układu immunologicznego
oraz z drugiej strony do zahamo-wania apoptozy.
Czynnik martwicy nowotworu (TNF) a zajmuje centralne
miejsce wśród cytokin regulujących odpowiedź zapalną
10
•
Najsilniejszym bodźcem do wydzielania tej cytokiny jest endotoksyna, w
mniejszym stopniu także GM-CSF i sam TNF.
•
Indukuje syntezę cytokin przez inne komórki (limfocyty T pobudza do syntezy
m.in. IL-2, IFN-gamma, IL-6, makrofagi - do produkcji TNF, IL-1, IL-6, GM-CSF).
•
Pobudza uwalnianie przeciwciał przez limfocyty B.
•
Zwiększa ekspresję molekuł adhezji na komór-kach śródbłonka.
•
Stymuluje produkcję białek ostrej fazy w wątrobie (w tym białka C-
reaktywnego) i procesy resorpcji kości.
•
Bierze udział w proteolizie komórek mięśniowych i regulacji metabolizmu
tkanki tłuszczowej,
•
Jest jedmym z ważniejszych endogennych pirogenów.
Czynnik martwicy nowotworu (TNF) - cd.
11
Etanercept
(Enbrel
®
)
Infliximab
(Remicade
®
)
•Rekombinowane białko
fuzyjne receptor/fragment Fc
IgG1
•Przeciwciało
monoklonalne
Adalimumab
(Humira
®
)
= mysie
= ludzkie
Hamowanie TNF w praktyce klinicznej
IgG1
Fc
IgG1
Fc
Fab
Receptor
•PEGylowny Fab′ fragment, brak
Fc
•40 kDa PEG
•(2x20 kDa)
Certolizumab pegol
(Cimzia™)
PEG
12
2014-01-30
3
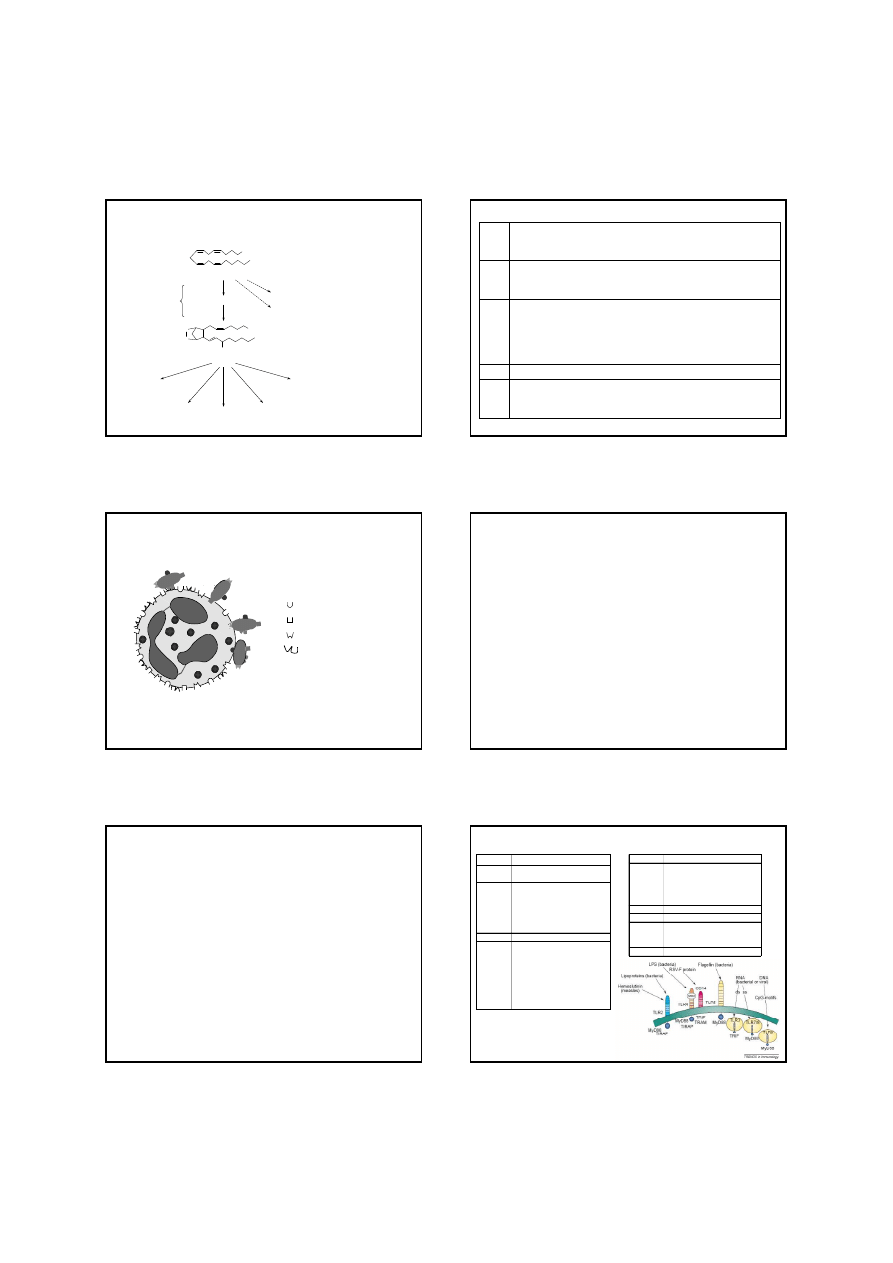
COOH
kwas arachidonowy
PGG
2
PGH
2
PGD
2
PGE
2
PGF
2
α
αα
α
TXA
2
PGI
2
szlak lipoksygenazy
SYNTAZA TROMBOKSANU
SYNTAZA PROSTACYKLINY
IZOMERAZA
PGH-PGD
IZOMERAZA
PGH-PGE
REDUKTAZA
reakcja
cyklooksygenacji
CYKLOOKSYGENAZA
reakcja
peroksydacji
OH
COOH
O
O
szlak epoksygenazy
Prostanoidy uwalniane podczas procesu zapalnego
– „szlak cyklooksygenazy”
(uwalniany z fosfolipidów błony komórkowej przez fosfolipazę A
2
- PLA
2
)
PGI
2
-
hamowanie agregacji płytek krwi
-
rozszerzanie naczyń - w stężeniach nanomolowych
-
obkurczanie naczyń - w stężeniach mikromolowych
-
pobudzanie sekrecji jelit
-
powodowanie nadwrażliwości na ból
PGD
2
-
skurcz mięśni gładkich oskrzeli
-
hamowanie agregacji płytek krwi
-
rozszerzenie naczyń (rumień alergiczny)
-
hamowanie uwalniania neuroprzekaźników
-
spadek ciśnienia, ból głowy i tachykardia (w dużych dawkach)
PGE
2
-
wpływ na napięcie mięśni gładkich (skurcz lub rozkurcz w zależności od pobudzanego receptora)
-
rozszerzanie naczyń (powodowanie niedociśnienia)
-
wzmaganie przepuszczalności naczyń mediowanej przez autakoidy
-
powodowanie nadwrażliwości na ból
-
gorączka
-
immunomodulacja (m .in. hamowanie aktywności granulocytów, makrofagów i limfocytów T w małych stężeniach)
-
działanie cytoprotekcyjne (wzmaganie wydzielania śluzu), nasilanie produkcji wodorowęglanów w błonie śluzowej
żołądka
PGF
2
α
-
skurcz mięśni gładkich oskrzeli, macicy i naczyń
-
indukcja luteolizy (regresji ciałka żółtego)
TXA
2
-
skurcz mięśni gładkich naczyń (tętnic, żył i naczyń limfatycznych)
-
skurcz mięśni gładkich dróg oddechowych
-
powodowanie agregacji płytek krwi
-
filtracja kłębkowa w nerkach
-
wydzielanie jelitowe
Aktywność biologiczna prostanoidów
Opracowano na podstawie Schröra i Smitha, (1990), Tchórzerzewskiego (1998), Davies i współpr. (1984), Salmona i Higgsa, (1987).
receptor dla IgG Fc
receptory zmiatacze
receptor dopełniacza (CR)
receptor Toll-podobny (TLR)
Neutrofile i fagocytoza
Cz
ą
steczki PAMP s
ą
starannie wybranym i strategicznym
celem. Maj
ą
one kilka charakterystycznych cech:
• s
ą
niezb
ę
dne do prze
ż
ycia drobnoustrojów,
• s
ą
niezmienne ewolucyjnie,
• s
ą
typowe dla du
ż
ych grup drobnoustrojów,
• nie wyst
ę
puj
ą
u człowieka.
Wzorce molekularne zwi
ą
zane z patogenami
(pathogen associated molecular patterns - PAMP)
• PRM to białka wi
ążą
ce PAMP.
• Pełni
ą
funkcje receptorów rozpoznaj
ą
cych wzorce
(pattern recognition receptors – PRR) - w błonie
komórkowej leukocytów, w ich wn
ę
trzu (najcz
ęś
ciej w
błonie lizosomów i siateczki
ś
ródplazmatycznej, tak
ż
e
w cytoplazmie).
• Mog
ą
by
ć
wydzielane do kr
ąż
enia b
ą
d
ź
do przestrzeni
ś
ródmi
ąż
szowej otaczaj
ą
cej komórki.
• Geny koduj
ą
ce PRM s
ą
niezmienne i zachowane przez
całe
ż
ycie osobnika w konfiguracji zarodkowej (w
przeciwie
ń
stwie do TCR i BCR) dlatego liczba ró
ż
nych
cz
ą
steczek PRM jest relatywnie niewielka (setki).
Cz
ą
steczki rozpoznaj
ą
ce wzorce
(pattem recognition molecules - PRM)
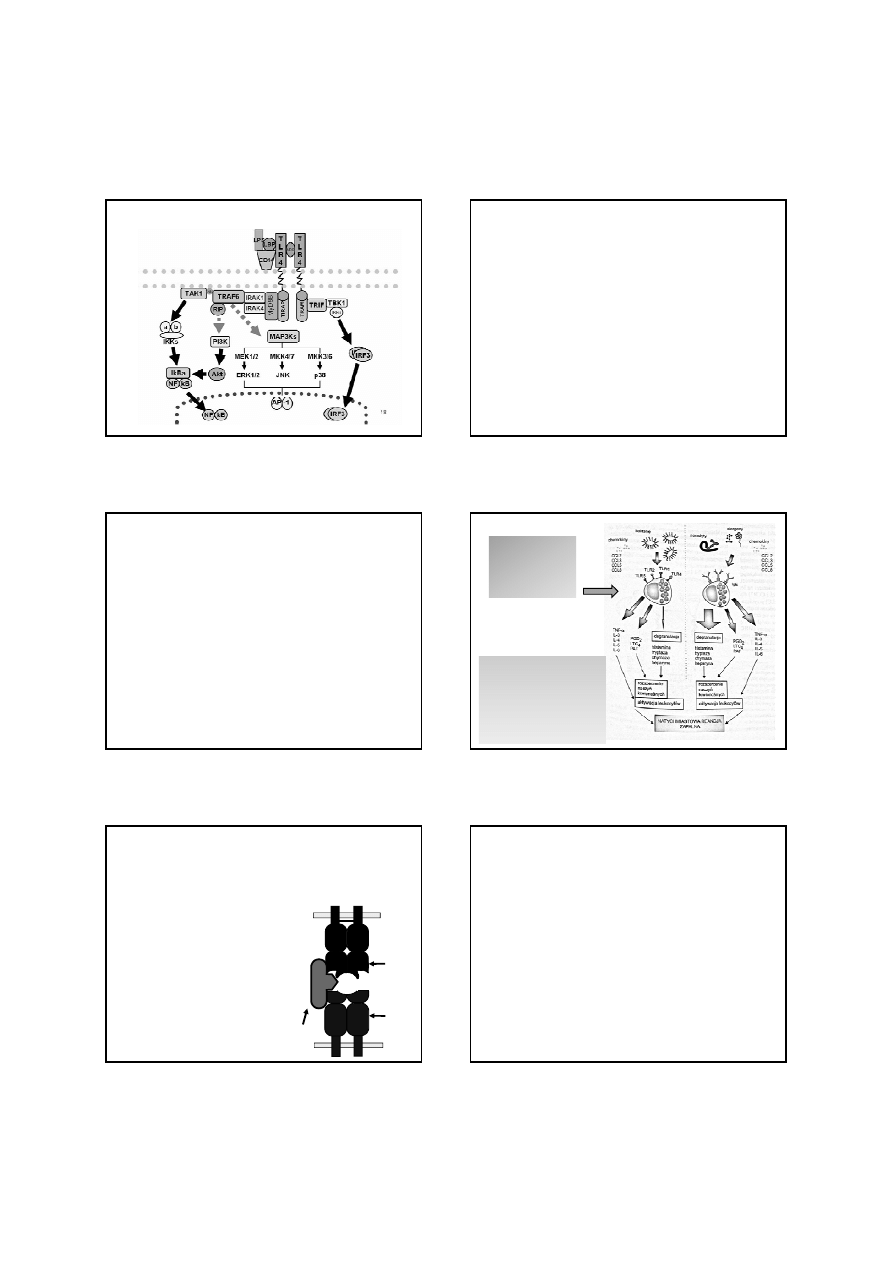
Receptor
Cząsteczka PAMP
TLR1/TLR6 Triacylowane peptydy
mikobakterii
TLR2
Peptydoglikan bakterii G(+)
Poryny N. meningitidis i N.
gonorrhaeae
Lipoarabinomannan mikobakterii
Fosfolipomannan drożdżaków
Hemaglutynina wirusa odry
TLR3
dsRNA niektórych wirusów
TLR4
LPS
Mannan drożdżaków
Glikoinozytolofosfolipidy
Trypanosoma
Białka otoczki wirusów RSV,
MMTV
Białka szoku cieplnego HSP60,
HSP70
Receptor
Cząsteczka PAMP
TLR6/TLR2 Diacylowane lipopeptydy
Mycoplasma
Kwasy tejchojowe paciorkowców
grupy B
Zymosan drożdżaków
TLR7
Wirusowe ssRNA
TLR8
Wirusowe ssRNA
TLR9
CpG-DNA większości bakterii
Hemozoina zarodźców malarii
DNA wirusów
TLR10
nieznana
Receptory Toll-podobne
2014-01-30
4
Wiązanie LPS z TLR4
Mechanizmy zabijania wewnątrzkomórkowego neutrofili
1.
Tlenowe:
a) wytwarzanie reaktywnych form tlenu:
•
anionorodnik ponadtlenkowy (O
2
•−
),
•
nadtlenek wodoru (H
2
O
2
),
•
rodnik hydroksylowy (OH
•
),
b) wytwarzanie reaktywnych form azotu:
•
tlenek azotu (NO)
•
dwutlenek azotu (NO2)
•
kwas nadtlenoazotawy (HONO
2
)
•
jon nadtlenoazotynowy (ONOO
-
)
c) kwas podchlorawy (HOCl)
2.
Beztlenowe (białka i enzymy o działaniu bakteriobójczym):
•
obecne w lizosomach, czy ziarnach neutrofilów, np. lizozym, elastaza,
proteazy, kolagenaza, laktoferyna, fosfolipazy, mieloperoksydaza, czynnik
bakteriobójczy zwiększający przepuszczalność (BPI),
•
działające na fagocytowane mikrooorganizmy w fagolizosomie.
• Niszczenie drobnoustrojów
• Działanie chemotaktyczne na komórki
dendrytyczne i limfocyty T
• Udział w gojeniu
• Aktywacja dopełniacza
• Aktywacja wła
ś
ciwo
ś
ci
ż
ernych makrofagów
• Zahamowanie wytwarzania glikokortykosteroidów
• Degranulacja komórek tucznych
• Hamowanie fibrynolizy
DEFENSYNY
peptydy kationowe
Rola eozynofili
w obronie przed
patogenami
Bazofile i mastocyty
Ich zadanie polega na bardzo szybkim
(natychmiastowym) uwolnieniu media-
torów
ułatwiaj
ą
cych
(m.in.
przez
odpowiednie
zmiany
w
tkankach)
komórkom (i przeciwciałom) bior
ą
cym
udział w reakcji zapalnej napływ do
miejsca wytargni
ę
cia drobnoustrojów i
efektywne działanie.
Superantygeny
•
Mogą być pochodzenia bakteryjnego,
mikoplazmatycznego, wirusowego lub
roślinnego.
•
Należą do nich m.in..:
- egzotoksyny wytwarzane przez
paciorkowce (np.: białko M),
- enterotoksyny gronkowcowe.
•
Wykazują niespecyficzny sposób wiązania
się z kompleksem TCR - cząsteczka MHC
klasy II.
•
Reagują z zewnętrzną powierzchnią odcinka
V łańcucha beta.
•
Mogą pobudzać zarówno limfocyty T CD4,
jak i limfocyty T CD8.
•
Stymulują wydzielanie silnie „toksycznych”
cytokin TNF, IL-2 i IFN-
γ
.
MHC II
TCR
limfocyt
T
APC
V
β
V
α
superantygen
Pobudzanie limfocytów T przez
antygeny, superantygeny i mitogeny
• Zwykłe antygeny: 0.001% to 0.01% populacji komórek
• Alloantygeny: 1% to 5% populacji komórek
• Superantygeny: 5% to 25% populacji komórek
• Mitogeny: prawie 100% populacji komórek
2014-01-30
5
25
Odpowiedź immunologiczna
przeciwko bakteriom
zewnątrzkomórkowym
A. Elementy odpowiedzi nieswoistej:
•
aktywacja dopełniacza
•
fagocytoza
•
reakcja zapalna
B. Odpowiedź swoista:
1. głównie odpowiedź humoralna –
przeciwciała:
•
neutralizujące toksyny bakteryjne,
•
wiążące się do powierzchni bakterii i
działające jako,opsoniny ułatwiające
fagocytozę (>100x),
•
hamujące adhezję bakterii do komórek
docelowych aktywujące dopełniacz i
lizę bakterii,
•
aglutynujące bakterie,
2. mniejsze znaczenie odpowiedzi
komórkowej:
•
antygeny sfagocytowanych przez APC,
bakterii są prezentowane limfocytom
pomocniczym,
•
aktywacja limfocytów cytotoksycznych
prowadzi do:
- pobudzenia fagocytozy,
- stymulowania produkcji przeciwciał,
- indukcji miejscowej reakcji zapalnej.
26
Dotyczy np. prątków gruźlicy, pratków trądu i pałeczek Listeria monocytogenes.
1) Odpowiedź nieswoista – głównie z udziałem komórek NK:
- niszczą zakażone komórki i wydzielają IFN-γ
- IFN-γ pobudza fagocytozę i zabijanie wewnątrzkomórkowych bakterii
2) Odpowiedź swoista – głównie odpowiedź odpornościowa typu komórkowego prowadzi do:
- stymulowania makrofagów do zabijania wewnątrzkomórkowych bakterii,
- lizy zainfekowanych komórek przez limfocyty cytotoksyczne,
- ponieważ większość tego typu bakterii jest oporna na fagocytozę prowadzi to do
przewlekłego zakażenia i tworzenia ziarniniaków.
Eliminacja bakterii wewnątrzkomórkowych
Niektóre mechanizmy zapobiegania indukcji reakcji immunologicznej przez bakterie
Unikanie wywołania du
ż
ej odpowiedzi przeciwciał.
Przeciwciała, które powstaj
ą
, blokuj
ą
funkcj
ę
przeciwciał uszkadzaj
ą
cych. Wytwarzanie
proteaz uszkadzaj
ą
cych przeciwciała slgA.
Uwalnianie błonowych p
ę
cherzyków maj
ą
cych zdolno
ść
adsorbowania miejscowych
przeciwciał.
Zmiana składu antygenowego:
przez sializacj
ę
LPS (przypomina wtedy oligosacharydy ssaków i ułatwia szybkie
usuwanie dopełniacza
przez zmian
ę
fazy ekspresji antygenu, co powoduje alternatywne umiejscowienie
cz
ą
steczek powierzchniowych
geny koduj
ą
ce piliny, podjednostki rz
ę
ski bakteryjnej, przechodz
ą
homologiczne
rekombinacje, aby wytworzy
ć
warianty
Zaburzanie aktywacji limfocytów T przez produkowanie białek hamuj
ą
cych ich
koreceptory (np. CEACAM-1) na powierzchni limfocytów.
Unikanie uszkodzenia przez dopełniacz:
przez tworzenie zewn
ę
trznej otoczki,
budowa powierzchni zewn
ę
trze w sposób uniemo
ż
liwiaj
ą
cy dost
ę
p makrofagów i ich
receptorów do C3b zwi
ą
zanego z bakteri
ą
wytwarzanie struktur powierzchniowych uniemo
ż
liwiaj
ą
cych si
ę
przył
ą
czenie MAC do
błony komórkowej
wytwarzanie enzymów degraduj
ą
cych dopełniacz lub go usuwaj
ą
cych z powierzchni
komórek,,
wydzielanie białek wabikowych wi
ążą
cych si
ę
z dopełniaczem.
28
Odpowiedź immunologiczna przeciwko wirusom
Interferon (IFN)
Typ I interferonów:
• IFN
α
(leukocytarny) - wytwarzany jest w nast
ę
pstwie zaka
ż
enia wirusowego;
• IFN
β
(fibroblastyczny) - wytwarzany jest w nast
ę
pstwie zaka
ż
enia wirusowego;
• IFN
τ
/
ε
(trofoblastyczny);
• FN
κ
(keratynocyty).
Typ II interferonów:
• IFN
γ
- jest wytwarzany tylko po antygenowym lub mitogenowym pobudzeniu
limfocytów T i komórek NK.
Typ III interferonów:
• IFN
λ
.
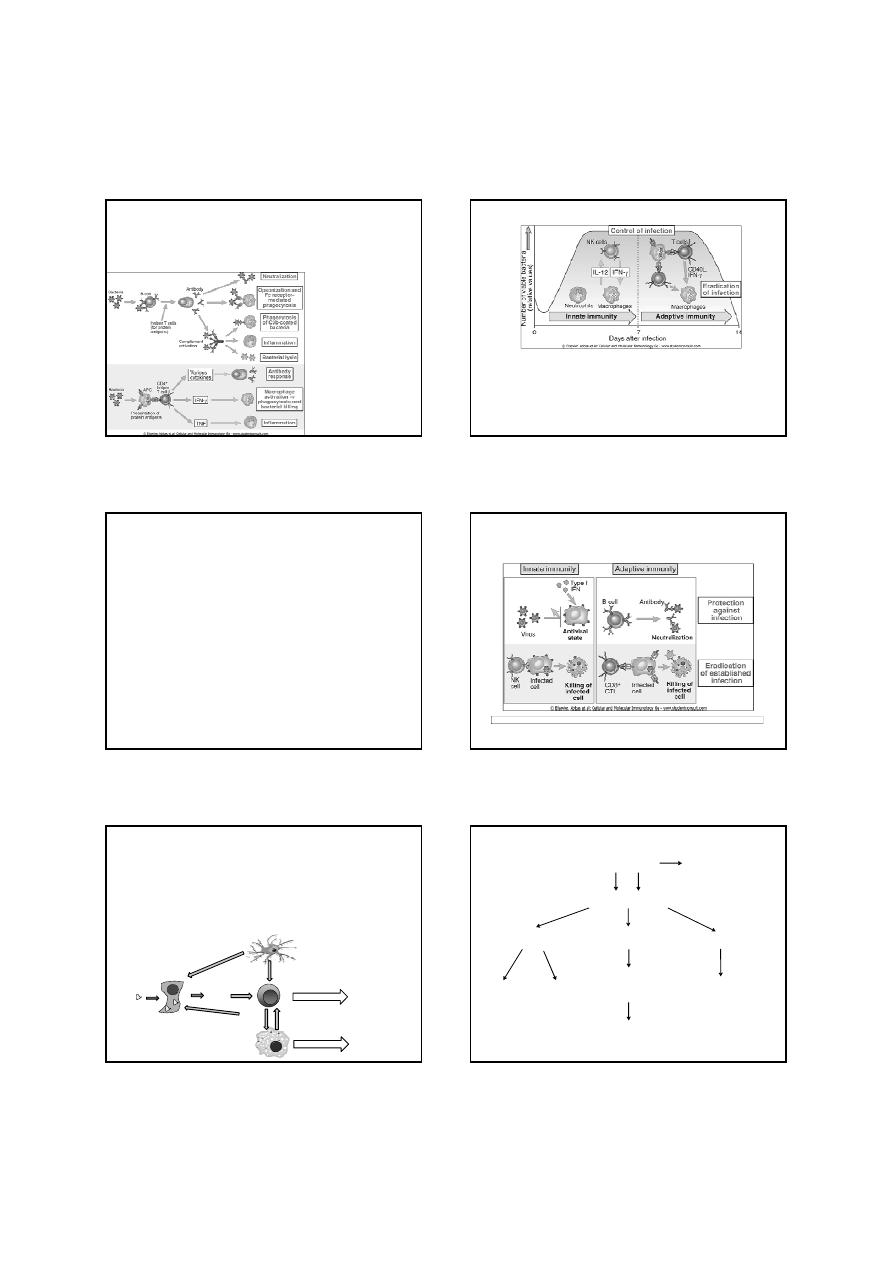
NK
IFN II
IFN I
IFN I
IL-12
IL-12
komórka
dendrytyczna
zaka
ż
ona
komórka
makrofag
wirus
Aktywno
ść
przeciwwirusowa
IFN
α
, IFN
β
obrona wewn
ą
trzkomórkowa
PKR
(kinaza białkowa)
syntetaza
2’,5’-oligoadenylowa
białko Mx
chroni s
ą
siaduj
ą
ce,
niezaka
ż
one komórki
apoptoza
blokowanie
syntezy
białek
wirusa
RNazaL
(latentna
endonukleaza)
blokuje
transkrypcj
ę
wirusa
degraduje
wirusowe dRNA
2014-01-30
6
Mechanizmy zapobiegania indukcji reakcji immunologicznej przez wirusy Herpes
Mechanizmy zapobiegania indukcji reakcji immunologicznej przez wirusy Herpes
Mechanizmy zapobiegania indukcji reakcji immunologicznej przez wirusy Herpes
Mechanizmy pozwalające grzybom przetrwać
•
Cryptococcus neoformans - wytwarza otoczkępolisacharydową, która
hamuje fagocytozę (zasada podobna do tej, która dotyczy bakterii
otoczkowych); przeciwdziała temu opsonizacyjny wpływ dopełniacza i
przeciwciał.
•
Histoplasma capsulatum - jest wewnątrzkomórkowym patogenem, który
unika zabijania przez makrofagi poprzez wejście do komórki przez CR3 i
następnie zaburzenie prawidłowego dojrzewania fagosomu (podobnie jak
M. tuh\berculosis).
•
Dermatofity hamują odpowiedź limfocytów T gospodarza, opóźniając
destrukcję zależną od odpowiedzi komórkowej.
36
Odpowiedź immunologiczna przeciw pasożytom
•
Przewlekłe zakażenia pasożytami cechują się słabą odpowiedź immunologiczną
oraz dużą zdolności pasożytów do unikania jej indukowania.
•
Pasożyty mogą unikać zniszczenia przez dopełniacz.
•
Pierwszą linią obrony jest odpowiedź nieswoista (receptory Toll, i receptory
zmiatacze.
•
W przypadku pierwotniaków, które stymulują komórki dendrytyczne do produkcji
IL-12 rozwija się odpowiedź typu T
H
1 (co objawia się produkcją głównie IFNγ i IL-2)
i pobudzane są makrofagi.
•
Cząsteczki PAMP pasożytniczych robaków nie stymulują komórek dendrytycznych
do produkcji dlatego rozwijana jest odpowiedź typu T
H
2 (co objawia się produkcją
głównie IL-4, IL-5, IL-9, IL-13), a to prowadzi do aktywacji eozynifili, produkcji IgE
oraz pobudzenia komórek tucznych i bazofilów.
•
Obrona gospodarza może zależeć od szczególnych cech genetycznych (np. malaria).
•
Szczepionki przeciwko ludzkim pasożytom nie są jeszcze dostępne. GlaxoSmithKline
ukończyło pomyślnie badania i zamierza zarejestrować pierwszą szczepionkę
przeciwko malarii (RTS).
2014-01-30
7
•
Ilość mikroorganizmów flory jelitowej przekracza 10-
krotnie liczbę komórek budujących nasze ciało.
•
Bakterie flory jelitowej znajdują się przede wszystkim
w jelicie grubym i stanowią 60% masy kału.
•
300-1000 gatunków bakterii wchodzi w skład flory
jelitowej z czego najczęściej wymienia się ok. 500
gatunków.
•
30-40 gatunków składa się na 99% wszystkich bakterii flory jelitowej.
•
Większość bakterii należy do rodzaju Bacteroides, Clostridium, Fusobacterium, Eubacterium,
Ruminococcus, Peptococcus, Peptostreptococcus i Bifidobacterium
•
W mniejszej ilości występują Escherichia i Lactobacillus.
•
Gatunki należące do rodzaju Bacteroides stanowią około 30 % wszystkich bakterii w jelitach.
•
Oprócz bakterii w skład mikroflory jelitowej mogą wchodzić:
•
grzyby ( Candida, Saccharomyces, Aspergillus) i pierwotniaki .
•
Obecne są również bakteriofagi – najczęściej w postaci profagów.
Mikroflora jelitowa
•
Badania dotyczące flory jelitowej ludzi cierpiących na cukrzycę typu 2 wykazały spadek
liczebności bakterii Firmicutes i Clostridia (Larsen i wsp. 2010). Również Fueret i wsp.
(2010) wykazali zredukowaną liczebność bakterii Faecalibacterium prausnitzii należących
do typu Firmicutes u osób chorujących na cukrzycę typu 2. Natomiast analiza składu
bakteryjnego kału osób chorych na cukrzycę typu 2 i zdrowych, wykonana metodami PCR
przez Wu i wsp. (2010) wykazała, że w kale osób z cukrzycą było mniej bakterii
Bacteroides vulgatus i Bifidobacterium.
•
Proporcja bakterii Bacteroides do Firmicutes znajdujących się w przewodzie pokarmowym
może także odgrywać ważną rolę w pojawieniu się cukrzycy typu 1. Eksperyment
przeprowadzony na szczurach rasy BB-DP (Bio-Breeding diabetes-prone) genetycznie
predysponowanych do spontanicznego zachorowania na cukrzycę typu 1 wykazał, że
zwierzęta u których rozwinęła się cukrzyca miały znacznie wyższy odsetek bakterii
Bacteroides ssp niż osobniki zdrowe (Brugman et al. 2006).
•
Badania przeprowadzone przez Brugman i wsp. wskazały, że doustne podanie
antybiotyków może zmniejszać prawie o 50% zachorowalność na cukrzycę u szczurów
rasy BB-DP genetycznie predysponowanych do spontanicznego zachorowania na cukrzycę
typu 1. Również w przypadku cukrzycy typu 2 (myszy ob/ob) podawanie antybiotyków
prowadziło do poprawy tolerancji glukozy (Membrez et al. 2008).
Mikroflora jelit a cukrzyca
Rola limfocytów T
γδ
w obronie przed patogenami przewodu pokarmowego
Rola IgA w obronie przed patogenami przewodu pokarmowego
IgA nie wiąże dopełniacza!
Bakteriofagi:
-
biologia
-
wpływ na układ immunologiczny
-
możliwości zastosowania w terapii
Prof. Ludwik Hirszfeld, Immunology, 1949:
„The anti-bacterial activity of the immune system is
much weaker than bacteriophages.
The practical implications of this phenomenon
should be further explored.”
Bakteriofagi (w skrócie fagi) s
ą
wirusami
infekuj
ą
cymi tylko komórki bakteryjne.
S
ą
najliczniejsz
ą
grup
ą
wirusów (na Ziemi
wyst
ę
puje 4-6 x10
30
wirionów).
Dotychczas opisano ponad 5000 ró
ż
nych
bakteriofagów.
Wi
ę
kszo
ść
fagów (ponad 95%) to fagi
ogonkowe, ale mog
ą
te
ż
by
ć
wielo
ś
cienne,
włókienkowe i pleomorficzne.
Wyst
ę
puj
ą
powszechnie w
ś
rodowisku:
-
ś
rodowiska wodne - 10
4
-10
7
cz
ą
stek/ml,
- gleba - nawet 10
7
cz
ą
stek/g.
Mog
ą
naturalnie wyst
ę
powa
ć
w pokarmie i
organizmie człowieka (np. w kale w proporcji
1 cz
ą
stka faga na 1 bakteri
ę
).
Nie wykazano ich niekorzystnego działania na
komórki ludzkie.
BAKTERIOFAGI
(wg. Ackermanna
i Dubowa, 1987)
2014-01-30
8
Cykle
ż
yciowe bakteriofagów: cykl lityczny
●
W ten sposób namna
ż
aj
ą
si
ę
zarówno
fagi lityczne (tzw. fagi zjadliwe) jak i fagi
lizogenizuj
ą
ce (tzw. fagi łagodne).
●
Prowadzi do szybkiego zniszczenia
komórki bakteryjnej.
●
Proces oparty jest na kaskadowej
transkrypcji genów fagowych.
●
W fazie wczesnej syntezowane s
ą
białka
regulatorowe faga, nast
ę
pnie
syntetyzowane s
ą
białka strukturalne a w
fazie pó
ź
nej składane kompletne wiriony.
●
Przykładem faga litycznego jest
bakteriofag T4.
adsorpcja
faga
infekcja
namnożenie
materiału
genetycznego
i białek
kapsydu
formowanie
nowych
fagów
uwolnienie fagów
potomnych - liza
Liza komórki bakteryjnej - uwolnienie fagów potomnych.
Zdj
ę
cie z archiwum IITD PAN.
Cykle
ż
yciowe bakteriofagów: cykl lizogenny
●
W ten sposób namna
ż
aj
ą
si
ę
wył
ą
cznie
fagi lizogenizuj
ą
ce.
●
Materiał genetyczny faga wł
ą
czany jest do
chromosomu bakteryjnego (profag) i jest
powielany jednocze
ś
nie z namna
ż
aj
ą
c
ą
si
ę
bakteri
ą
.
●
Wi
ę
kszo
ść
genów fagowych ulega
czasowej supresji, a jedynym
ekspresjonowanym wydajnie genem jest
represor.
●
Warunki stresowe (typu fizycznego lub
chemicznego) doprowadzaj
ą
do
uwolnienia kwasu nukleinowego wirusa,
wej
ś
cia w cykl lityczny i zniszczenia
bakterii.
●
Profagi mog
ą
przenosi
ć
m.in. geny
koduj
ą
ce toksyny (np. werotoksyn
ę
).
●
Przykładem faga lizogennego jest fag
λ
.
infekcja
lizogenia
indukcja
liza
PROFAG
Bakteriofagi terapeutyczne
●
W terapii zastosowanie znajduj
ą
fagi lityczne, które szybko niszcz
ą
bakterie.
●
Ich farmakokinetyka jest trudna do scharakteryzowania.
●
Mog
ą
mno
ż
y
ć
si
ę
w miejscu zaka
ż
enia.
●
Mechanizm bakteriobójczego działania bakteriofagów jest odmienny od
antybiotyków.
●
Posiadaj
ą
zdolno
ść
zabijania bakterii opornych na antybiotyki (MRSA,
VRE, E. coli ESBL, MDR P. aeruginosa).
●
Niektóre fagi terapeutyczne s
ą
wra
ż
liwe na niskie pH (< 4) – podawane
doustnie mog
ą
by
ć
inaktywowane przez sok
ż
oł
ą
dkowy.
●
Istnieje mo
ż
liwo
ść
rozwoju oporno
ś
ci bakterii na faga. W niektórych
przypadkach, rozwój oporno
ś
ci na bakteriofagi wi
ąż
e si
ę
ze zmniejszeniem
zjadliwo
ś
ci bakterii.
●
Działanie lityczne fagów jest swoiste tzn. fagi s
ą
aktywne wobec jednego
lub kilku spokrewnionych szczepów bakterii (najcz
ęś
ciej w obr
ę
bie tego
samego gatunku). Jest to jednak korzystne, gdy
ż
umo
ż
liwia eliminacj
ę
bakterii patogennych bez naruszenia równowagi naturalnej mikroflory, co
mo
ż
e by
ć
konsekwencj
ą
antybiotykoterapii.
Penetracja fagów do krwi i w
ą
troby u myszy
po podaniu doustnym
Kłak M., Mi
ę
dzybrodzki R., Bubak B., Jo
ń
czyk E., Weber-D
ą
browska B., Górski A. Studies on the
gastrointestinal transit and blood penetration of a therapeutic staphylococcal bacteriophage. First
International Congresss on Viruses of Microbes, Pary
ż
21-25 czerwiec 2010
Lizat fagowy (10
7
pfu/ml) podawano w obj
ę
to
ś
ci 0,2 ml. Do
neutralizacji soku
ż
oł
ą
dkowego u
ż
yto zawiesiny Alugastrinu
(dihydroxyaluminum sodium carbonate), który podawano
doustnie 10 min. rzed podaniem fagów.
Myszom w grupie kontrolnej podano tylko preparat fagowy.
Po 1 godz. myszy u
ś
miercano i pobierano do oznacze
ń
próbk
ę
pełnej heparynizowanej krwi i fragment w
ą
troby,
który homogenizowano i zawieszano w PBS w stosunku
1:1.
Hamuj
ą
cy wpływ fagów na tworzenie wolnych rodników przez granulocyty
stymulowane endotoksyn
ą
Mi
ę
dzybrodzki R.,
Ś
witała-Jele
ń
K., W. Fortuna, Weber-D
ą
browska B., Przerwa A., Kurz
ę
pa A., Łusiak-Szelachowska M.,
D
ą
browska K., Boraty
ń
ski J., Syper D., Ługowski C., Po
ź
niak G., Górski A.: Bacteriophage inhibition of reactive oxygen
species generation by endotoxin-stimulated polymorphonuclear leukocytes. Virus Res. 2008; 131: 233-242.
0
500
1000
1500
2000
2500
3000
A
U
C
C
L
[R
L
U
××××
m
in
]
p<0.05
p<0.001
p<0.01
p<0.05
p<0.001
0
2000
4000
6000
8000
10000
12000
14000
A
UC
C
L
[RL
U
××××
m
in
]
p<0.001
p<0.001
p<0.001
p<0.001
p<0.001
Wpływ faga T4 na chemiluminescencj
ę
ludzkich granulocytów
stymulowanych
lipopolisacharydem
(LPS)
izolowanym
ze
ś
ciany bakteryjnej.
Komórki
były
stymulowane
LPS
izolowanym
z
bakterii
homologicznych - E. coli J5 lub heterologicznych - E. coli R4
preinkubowanymi (30 min) w 37°C lub nie preinkubowanymi (0
min) z fagiem T4 (oczyszczony). Stymulacj
ę
komórek samym
LPS lub mieszanin
ą
fagów i LPS rozpoczynano 15 min przed
dodaniem luminolu.
Kontrola: komórki
nie stymulowane.
Nat
ęż
enie chemiluminescencji wyra
ż
ano jako
ś
rednie pole pod
krzyw
ą
(AUC
CL
) mierzone w czasie od “0” do 60 min po
dodaniu luminolu. Pokazano tylko istotne warto
ś
ci p.
Wpływ faga T4 na chemiluminescencj
ę
ludzkich granulocytów
stymulowanych bakteriami.
Komórki były stymulowane
ż
ywymi bakteriami homologicznymi
E. coli J5 lub heterologicznymi E. coli R4 preinkubowanymi (30
min) w 37°C lub nie preinkubowanymi (0 min) z fagiem T4
(oczyszczony). Referencyjna zawiesina bakterii w PBS była
inkubowana przez 30 min w 4
°°°°
C w celu wstrzymania namna
ż
ania
si
ę
bakterii.
Stymulacj
ę
komórek
zawiesin
ą
bakterii
lub
mieszaniny fagów i bakterii rozpoczynano 15 min przed dodaniem
luminolu.
Kontrola:
komórki
nie
stymulowane.
Nat
ęż
enie
chemiluminescencji wyra
ż
ano jako
ś
rednie pole pod krzyw
ą
(AUC
CL
) mierzone w czasie od “0” do 60 min po dodaniu
luminolu. Pokazano tylko istotne warto
ś
ci p.
Wpływ podawania terapeutycznego preparatu oczyszczonego faga T4
na przebieg zapalenia stawów indukowanego kolagenem (CIA) u myszy
Mi
ę
dzybrodzki R. i współpr. In vivo studies on the influence of bacteriophage preparations on inflammatory
process. XI Kongres Polskiego Towarzystwa Transplantologicznego, Bydgoszcz 29-30 listopad 2013 r.
Łapa zdrowa
Łapa z zapaleniem
stawów
0
2
4
6
8
10
12
0
7
14
21
28
35
42
49
56
a
rt
h
ri
ti
s
s
c
o
re
days since arthritis induction
Control
Purified T4 preparation
Methotrexate
**
*
*
preparation administration
*
control (0,25 ml PBS i.p.)
purified T4 phage (2x10
9
pfu/mouse i.p. once daily)
MTX (10 mg/kg i.v. 3 times a week)
Immunizacja kolagenem w dniu 0, dawka przypominaj
ą
ca w dniu 21 (strzałka).
Dawkowanie faga T4: 2x10
9
pfu/mysz i.p. (w 0,25 ml PBS) codziennie od dnia 21 do 41.
Kontrola: 0,25 ml PBS (i.p.) Ilo
ść
myszy w grupach: n=10-11.
Dla porównania przedstawiono efekt przeciwzapalny metotreksatu podawanego w dawce 10 mg/kg m.c. (i.v.)
3 razy w tygodniu (co 2-3 dni) od dnia 21 do 41 (n=7).
* p<0,05 w porównaniu do kontroli.
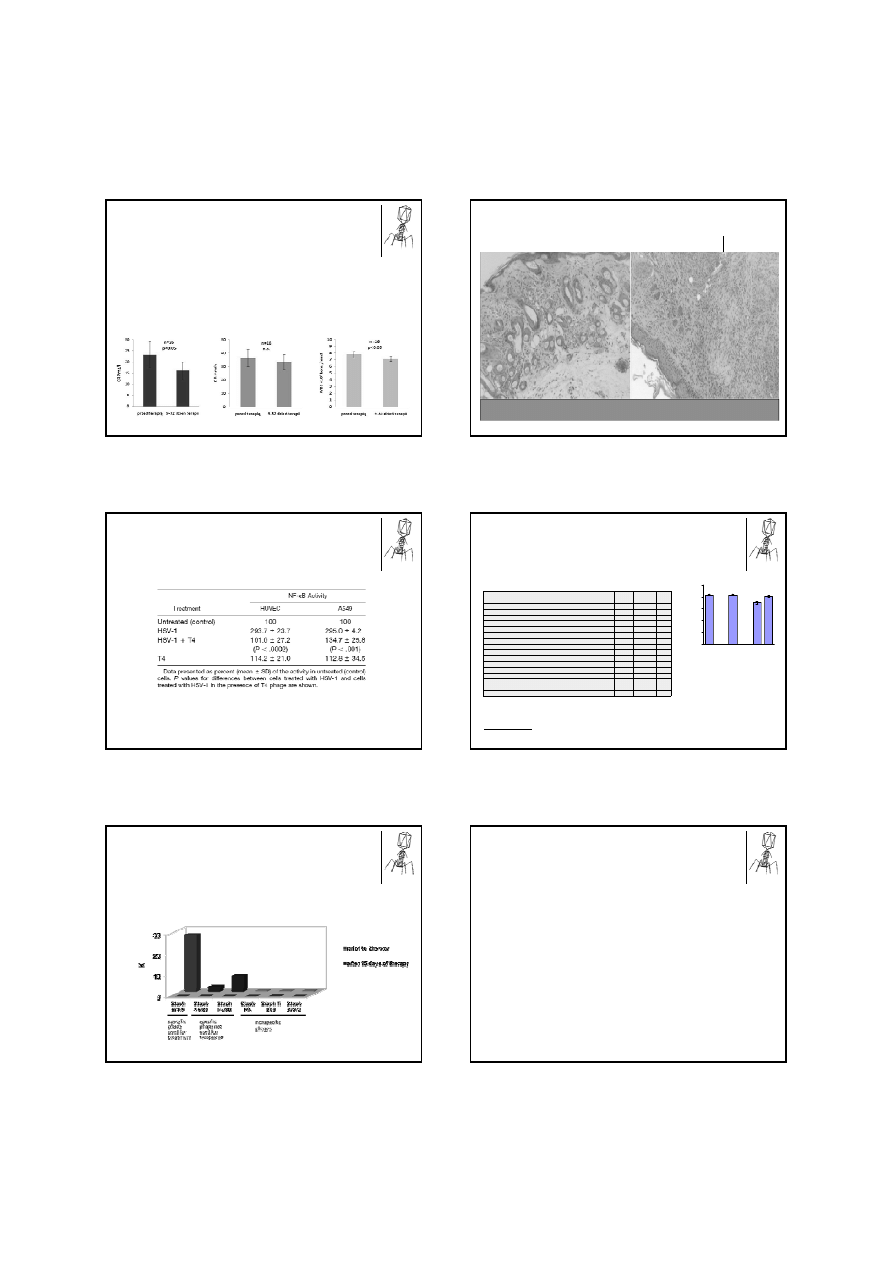
2014-01-30
9
• Analizowano dane pochodz
ą
ce od 37 pacjentów z zapaleniem ko
ś
ci i szpiku, zaka
ż
eniem okołoprotezowym,
zaka
ż
eniem tkanek mi
ę
kkich lub infekcj
ą
dolnych dróg oddechowych wywołanych przez S. aureus, S. epidermidis,
E. faecalis, E. coli, lub P. aeruginosa przed i w trakcie stosowania preparatów fagowych.
• Preparaty fagowe (naturalne lizaty fagowe) były podawane doustnie (10-ml trzy razy dziennie po neutralizacji soku
ż
oł
ą
dkowego za pomoc
ą
10 ml zawiesiny w
ę
glanu dihydroksysodowo-glinowego) i/lub miejscowo (dwa razy
dziennie przymoczki lub płukanie przetoki).
• Na rycinie poni
ż
ej przedstawiono
ś
rednie warto
ś
ci (±SE) st
ęż
enia CRP w surowicy, OB i liczby leukocytów we krwi
obwodowej chorych mierzone przed oraz pomi
ę
dzy 9 a 32 dniem leczenia. Ró
ż
nice analizowano za pomoc
ą
testu
Wilcoxona (n – ilo
ść
analizowanych przypadków).
Mi
ę
dzybrodzki R, Fortuna W , W eber-D
ą
browska B, Górski A. A retrospective analysis of changes in
inflammatory markers in patients treated with bacterial viruses. Clin Exp Med. 2009, 9(4): 303-312
Zmiany markerów zapalnych u pacjentów w czasie
terapii fagowej
CRP w surowicy
OB
Leukocyty we krwi obwodowej
Phage day 8 post-TX Saline day 8 post-TX
Górski, A., Kniotek, M., Perkowska-Ptasi
ń
ska, A., Mróz, A., Przerwa, A., Gorczyca, W., D
ą
browska, K., Weber-D
ą
browska, B.,
Nowaczyk, M. Bacteriophages and transplantation tolerance. Transplant Proc 2006: 38: 331-333.
Effect of bacteriophages on skin allograft survival in mice
Effect T4 phage and HSV-1 on NF-
κ
B activity
in HUVEC and A549 line
The HUVEC and human epithelial-like lung cancer line A549 cells were incubated for 8 hours
at 37°C either in the absence (control) or in the presence of phage T4 (10
2
–10
3
pfu/cell).
HSV-1 (2 virions/cell) was added after 1 hour of preincubation with or without the phage, and
the cells were incubated for 7 consecutive hours. Then the NF-
κ
B activity was determined by
means of electromobility shift assay (EMSA).
Górski, A., Kniotek, M., Perkowska-Ptasi
ń
ska, A., Mróz, A., Przerwa, A., Gorczyca, W., D
ą
browska, K., Weber-
D
ą
browska, B., Nowaczyk, M. (2006). Bacteriophages and transplantation tolerance. Transplant Proc 38, 331-333.
Badanie wpływu bakteriofagów na zdolność wirusów do
zakażania komórek nabłonkowych człowieka in vitro
n
Ś
redni
CPE
SE
A. Komórki zaka
ż
ane wirusem VSV:
1. nie inkubowane z fagiem (kontrola)
12
2,08
0,15
2. preinkubowane z fagiem przed zaka
ż
eniem
8
2,31
0,09
3. inkubowane z fagiem przed, w trakcie i po zaka
ż
eniu
10
2,35
0,11
4. inkubowane po zaka
ż
eniu
10
2,10
0,19
B. Komórki zaka
ż
ane wirusem HSV-1:
1. nie inkubowane z fagiem (kontrola)
12
2,29
0,11
2. preinkubowane z fagiem przed zaka
ż
eniem
8
2,63
0,13
3. inkubowane z fagiem przed, w trakcie i po zaka
ż
eniu
10
2,55
0,17
4. inkubowane po zaka
ż
eniu
8
2,25
0,27
C. Komórki zaka
ż
ane adenowirusem typu 5:
1. nie inkubowane z fagiem (kontrola)
11
1,86
0,12
2. preinkubowane z fagiem przed zaka
ż
eniem
7
1,86
0,18
3. inkubowane z fagiem przed, w trakcie i po
zaka
ż
eniu
10
1,45 *
0,14
4. inkubowane po zaka
ż
eniu
10
1,70
0,15
Wpływ faga T4 na efekt cytopatyczny (CPE) ró
ż
nych wirusów na komórki
A549. * p<0,05 (test U Manna-Whitneya)
0,000
0,200
0,400
0,600
0,800
1,000
Ko
nt
ro
la
Fa
g
T4
A
5
A
5
+
Fa
g
e
k
s
ty
n
k
c
ja
*
Ż
ywotno
ść
komórek A549
preinkubowanych przez 24 godz. z
fagiem T4 (8x10
8
pfu/dołek), a
nast
ę
pnie 45 min. z adenowirusem
typu 5 (A5) oznaczana metod
ą
z
u
ż
yciem MTT po 24 godz. od
zaka
ż
enia. Przedstawiono
ś
redni
ą
ekstynkcj
ę
z 4 powtórze
ń
(±SE). *
p<0,05 w porównaniu do A5 (test
Scheffego).
Mi
ę
dzybrodzki R. i współpr. The in vitro studies on bacteriophage influence on the ability of human viruses to
infect epithelial cells. 20
th
Biennial Evergreen International Phage Meeting. USA, sierpie
ń
2013 r.
Praca przegladowa
Mi
ę
dzybrodzki R., Fortuna W., Weber-D
ą
browska B., Górski A.: Bacterial
viruses against viruses pathogenic for man? Virus Res. 2005; 110: 1-8.
Phage inactivation by sera from patients receiving
phage therapy
Łusiak-Szelachowska M., Weber-D
ą
browska B., Mi
ę
dzybrodzki R.,
Ż
aczek M., Mazur A., Górski A. Phage neutralization by
sera of patients receiving phage therapy (poster presentation No. 230). Viruses of Microbes, 16-20 July, 2012 , Brussels
Rates of phage inactivation (K) by serum of patient treated topically
with S. aureus phage 676/Z.
Praktyczne zastosowanie bakteriofagów
Identyfikacja bakterii
Dochodzenia epidemiologiczne
Badania taksonomiczne
Rolnictwo i przemysł spo
ż
ywczy
Leczenie i profilaktyka zaka
ż
e
ń
bakteryjnych u ludzi i zwierz
ą
t

2014-01-30
10
HISTORIA TERAPII FAGOWEJ
Odkrycie bakteriofagów:
W roku 1896 Ernest Hankin, zwalczaj
ą
cy epidemi
ę
cholery w Indiach, opublikował swoje obserwacje o
tym,
ż
e Hindusi pij
ą
cy wod
ę
z Gangesu rzadziej
zapadaj
ą
na t
ę
chorob
ę
.
W roku 1915 Frederick William Twort, a w roku
1917 Felix d’Herelle opisali niezale
ż
nie nieznany
czynnik niszcz
ą
cy bakterie, który przechodzi przez
filtry zatrzymuj
ą
ce komórki bakteryjne i daje si
ę
seryjnie pasa
ż
owa
ć
na bakteriach.
Felix d’Herelle jako pierwszy zastosował fagi do
leczenia czerwonki w 1919 roku.
F. W. Twort
F. d’Herelle
Pocz
ą
tkowy okres stosowania terapii fagowej:
Szybkie pojawienie si
ę
na rynku komercyjnych preparatów
fagowych ju
ż
w latach 20. XX wieku produkowanych przez du
ż
e
koncerny (np. przez Eli Lilly and Company w USA, L'Oréal we
Francji).
Niedostateczna wiedza w zakresie biologii fagów, co powodowało,
ż
e stosowano je nie tylko w leczeniu zaka
ż
e
ń
bakteryjnych.
Zmniejszenie zainteresowanie bakteriofagami w medycynie
zachodniej po wprowadzeniu do lecznictwa antybiotyków.
Kontynuacja terapii fagowej w Europie
Ś
rodkowo-Wschodniej:
Instytut im. Eliavy w Tbilisi (zało
ż
ony przez Georgija Eliaw
ę
i
otwarty w 1923 roku);
Instytut Immunologii i Terapii Do
ś
wiadczalnej PAN we
Wrocławiu (od 2005 – O
ś
rodek Terapii Fagowej).
HISTORIA TERAPII FAGOWEJ
Próby zastosowania bakteriofagii w chirurgii
Dr Jerzy Jasie
ń
ski
POLSKA GAZETA LEKARSKA 1927, 4: 67-73
HISTORIA TERAPII FAGOWEJ
Komercyjne preparaty fagowe dopuszczone do
stosowania w przemy
ś
le spo
ż
ywczym i do ochrony
ro
ś
lin
• LISTEX
TM
P100 (EBI Food Safety) i LPM-102
TM
(Intralytix, Inc.) –
preparaty oczyszczonych
ż
ywych fagów swoistych dla szerokiego
spektrum szczepów Listeria dopuszczone w 2006 roku przez
Administracj
ę
Leków i
Ż
ywno
ś
ci USA (FDA) do stosowania jako
dodatek do gotowych do spo
ż
ycia produktów
ż
ywno
ś
ciowych do
eliminacji Listeria monocytogenes.
• Finalyse
(Elanco Food Solutions) – mieszanina fagów przeciwko E. coli O157:H7 do
redukcji zanieczyszczenia bydła t
ą
bakteri
ą
. Podobny preparat, EcoShield™, został
wprowadzany przez firm
ę
Inralytix do stosowania w celu zmniejszenia zanieczyszczenia
mi
ę
sa t
ą
bakteri
ą
.
• AgriPhage
TM
(OmniLytics, Inc.) – preparat
ż
ywych fagów
fagowy przeciwko Xanthomonas campestris pv. vesicatoria i
Pseudomonas syringae pv. tomato dopuszczony w 2006 roku
przez Agencj
ę
Ochrony
Ś
rodowiska USA do ochrony plantacji
papryki i pomidorów przed plamisto
ś
ci
ą
bakteryjn
ą
.
Nazwa badania
Sponsor
Realizacja
Opis wyników i
ź
ródło
A single-center
randomized and
placebo-controlled
trial on the safety
and the
bioavailability
measure of oral
phage
Nestlé Research
Center, Nestec Ltd.,
Lausanne,
Switzerland
VI 2003
Fifteen healthy adult volunteers received two doses (10
3
and 10
5
PFU/ml) of purified Escherichia coli T4 phage, and placebo in 150
ml of drinking water. Neither adverse events nor significant change in
population of commensal E. coli related to phage application were
observed. Phages were detected in stools 1 day after exposure in all
volunteers receiving the higher phage dose but a week after a 2-day
course of phage application no phage was detected.
Ref.: Bruttin A and Brüssow H. Antimicrob Agents Chemother
2005;49: 2874-2878
A double-blind
placebo-controlled
initial phase I/II
clinical trial
targeting chronic
ear infections
caused by P.
aeruginosa
Biocontrol Ltd.,
London, UK
VII 2006
– X 2007
Twelve patients suffering from otitis media caused by antibiotic
refractory P. aeruginosa were treated with a single dose of
bacteriophage mixture prepared by Biocontrol Ltd. and another
twelve with placebo. It was presented that phage administration was
safe, and there was significant reduction of clinical symptoms at day
42 in bacteriophage treated group (55% of total clinical score at the
day zero) compared to the control group (104%). There was also
76% decrease in mean count of bacteria in samples taken from the
patient’s ears 6 weeks after phage application when in controls even
small increase (9%) was observed.
Ref.: Wright A et al. Clin Otolaryngol. 2009;34:349-57.
A prospective,
randomized,
double-blind
controlled study of
WPP-201 for the
safety and efficacy
of treatment of
venous leg ulcers
Southwest Regional
Wound Care Centre
in Lubbock, Texas,
USA
IX 2006
– V 2008
This was a phase I study of WPP-201 - a cocktail of 8 lytic
bacteriophages against P. aeruginosa, S. aureus, and E. coli.
developed by Intralytix Inc., USA. It contained a concentration of
approximately 1
×
10
9
PFU/ml of each of the component monophages
isolated from environment and not genetically modified. The primary
objective of this study was to evaluate the safety of the topical use of
WPP-201 on the healing of the full thickness venous leg ulcers of
greater than 30 days duration.
Ref.: Rhoads DD et al. J Wound Care. 2009;18:237-8, 240-3.
Randomizowane badania kliniczne w zakresie terapii fagowej
Nazwa badania
Sponsor
Opis badania i
ź
ródło
A limited clinical trial
using bacteriophages
against methycyllin-
resistant S. aureus and
multi drug-resistant P.
aeruginosa on burn
wounds
Burn Wound Centre of
the Queen Astrid Military
Hospital, Brussels,
Belgium
A well-defined cocktail of lytic bacteriophages against methycyllin-
resistant S. aureus and multi drug-resistant P. aeruginosa will be
applied on burn wounds in 20 patients at the Burn Wound Centre of
the Queen Astrid Military Hospital. Phages will be characterized by the
fingerprint and electron microscopy and targeted against bacteria
occurring in the Hospital. Sterility and apyrogenicity of the phage
preparation will be certified.
Ref.: Verbeken G et al. Future Microbiol 2007;2(5):485-91.
Merabishvili M et al. PLoS ONE 2009;4(3): e4944.
Randomized, Double
Blind Placebo-
controlled Studies to
Evaluate the Effect of
an Orally-fed
Escherichia Coli (E.
Coli) Phage in the
Management of ETEC
and EPEC Induced
Diarrhea in Children
Nestlé Nutrition
Corporate,
Lausanne, Switzerland
This trial aims to evaluate the effect of oral administered E. coli phage
in children aged 4-60 months of age with proven ETEC and EPEC
diarrhea. Enrolled children will be randomly assigned, in equal
numbers, to receive either: (i) a new T4 phage cocktail or (ii)
Russian anti-E. coli phage cocktail (Microgen) at the dose
recommended by the manufacturer or (iii) only oral rehydration
solution (placebo) for 5 days in addition to management of dehydration
and continued feeding in accordance with WHO guidelines.
Ref.: ClinicalTrials.gov Identifier: NCT00937274
Badania kliniczne w trakcie realizacji
2014-01-30
11
1.
Ś
lopek
S.,
Weber-D
ą
browska
B.,
D
ą
browski
M.,
Kucharewicz-Krukowska
A.:
Results
of
bacteriophage treatment of suppurative bacterial infections in the years 1981-1986. Arch Immunol
Ther Exp 1987; 35: 569-583 (analiza 550 przypadków).
2.
Ś
lopek
S.,
Kucharewicz-Krukowska
A.
Weber-D
ą
browska
B.,
D
ą
browski
M.:
Results
of
bacteriophage treatment of suppurative bacterial infections. V. Evaluation of the results obtained
in children. Arch Immunol Ther Exp 1985; 33: 241-259 (analiza 114 przypadków).
3. Weber-D
ą
browska B., Mulczyk M., Górski A.: Bacteriophage therapy of bacterial infections: an
update of our Institute`s experience. Arch Immunol Ther Exp 2000; 48: 547-551 (podsumowanie
wyników leczenia 1307 przypadków).
4. Weber-D
ą
browska B., Mulczyk M., Górski A. Bacteriophages as an efficient therapy for antibiotic-
resistant septicemia in man. Transplant Proc. 2003; 35: 1385-1386 (podsumowanie wyników leczenia
94 przypadków).
HISTORIA TERAPII FAGOWEJ
Oto najwa
ż
niejsze prace podsumowuj
ą
ce wyniki leczenia z tego okresu:
W latach 80. - 90. XX wieku we współpracy z klinikami Akademii Medycznej we
Wrocławiu i innymi szpitalami preparaty bakteriofagowe przygotowywane w
Instytucie Immunologii i Terapii Do
ś
wiadczalnej PAN stosowano szeroko u
dorosłych i dzieci w leczeniu ró
ż
nych zaka
ż
e
ń
o charakterze ostrym i
przewlekłym (wywołanych głównie przez Staphylococcus, Klebsiella, Echerichia,
Pseudomonas i Proteus).
●
Terapia fagowa prowadzona jest w ramach projektu „Eksperymentalna terapia fagowa infekcji
bakteryjnych
opornych
na
antybiotykoterapi
ę
,
w
tym
zaka
ż
e
ń
MRSA”,
według
protokółu
zatwierdzonego przez komisj
ę
bioetyczn
ą
.
●
Poniewa
ż
dotychczas nie s
ą
dost
ę
pne wyniki standardowych bada
ń
klinicznych preparatów fagowych ta
forma terapii dost
ę
pna jest wył
ą
cznie w ramach eksperymentu leczniczego.
●
Jego celem jest leczenie za pomoc
ą
bakteriofagów dorosłych pacjentów z objawowym zaka
ż
eniem
bakteryjnym skóry lub tkanki podskórnej, ko
ś
ci i szpiku, stawów, przetok, ran i odle
ż
yn, dróg moczowo-
płciowych, przewodu pokarmowego, ucha
ś
rodkowego, zatok, migdałków, górnych lub dolnych dróg
oddechowych,
u
których
intensywna
antybiotykoterapia
okazała
si
ę
nieskuteczna
lub
istniej
ą
przeciwskazania do stosowania celowanych antybiotyków.
●
Leczenie prowadzone jest w trybie ambulatoryjnym.
●
Preparaty fagowe s
ą
stosowane doustnie, doodbytniczo lub miejscowo (w formie przymoczek, kompresów
nas
ą
czonych preparatem, aerozolu, kropli do nosa lub ucha, oraz do płukania gardła, pochwy, przetok i
jam ropni).
O
ś
rodek Terapii Fagowej
Centrum Medyczne Instytutu Immunologii i Terapii Do
ś
wiadczalnej PAN
ul. Weigla 12, 53-114 Wrocław
Kierownik:
prof. dr hab. n. med. Andrzej Górski
e-mail: agorski@ikp.pl
Informacja/Rejestracja:
tel. 071 370 99 01
e-mail: cm@iitd.pan.wroc.pl
Bank fagowy IITD PAN w 2013 roku
Lp.
Rodzaj/gatunek gospodarza bakteryjnego
Liczba fagów
1.
Staphylococcus
7
2.
Enterococcus (faecalis i faecium)
73
3.
Escherichia coli
121
4.
Klebsiella (pneumoniae i oxytoca)
95
5.
Enterobacter cloacae
48
6.
Shigella (flexneri i sonnei)
39
7.
Citrobacter freundii
38
8.
Pseudomonas (aeruginosa i fluorescens)
37
9.
Salmonella (enteritidis i typhimurium)
32
10.
Stenotrophomonas maltophilia
18
11.
Serratia (marcescens i liquefaciens)
17
12.
Proteus mirabilis
17
13.
Morganella morganii
14
14.
Acinetobacter baumannii
5
15.
Burkholderia cepacia
2
Typowanie fagowe
i przygotowanie preparatu fagowego
1. Izolacja patogennego szczepu
bakteryjnego z materiału
biologicznego od pacjenta
i dostarczenie do Laboratorium
Bakteriofagowego.
2. Typowanie fagowe – dobranie swoistego
faga z dost
ę
pnej w laboratorium kolekcji tj.
takiego który najsilniej lizuje dan
ą
bakteri
ę
.
3. Przygotowanie preparatu fagowego - tzw. lizatu
fagowego - namno
ż
enie fagów efektywnych na
szczepie chorobotwórczym od pacjenta lub
szczepie laboratoryjnym, przes
ą
czenie przez filtry
bakteryjne i ampułkowanie. Preparaty najcz
ęś
ciej
stosowanych bakteriofagów przygotowywane s
ą
w
warunkach GMP w firmie BIOMED S.A. w
Krakowie.
Kategoria odpowiedzi na leczenie
Analiza ogólna
(n=153)
n
%
A – eradykacja patogenu/wyleczenie
28
18.3%
B – dobra odpowied
ź
kliniczna
13
8.5%
C – poprawa kliniczna
20
13.1%
D – w
ą
tpliwa poprawa
10
6.5%
E – przej
ś
ciowa poprawa
33
21.6%
F – brak odpowiedzi na leczenie
39
25.5%
G - pogorszenie
10
6.5%
Dobra odpowied
ź
(total A-C):
61
39.9%
Niewystarczaj
ą
ca odpowied
ź
(total D-G):
92
60.1%
Mi
ę
dzybrodzki R, Borysowski J, W eber-D
ą
browska B, Fortuna W , Letkiewicz S, Szufnarowski K, Pawełczyk Z, Rogó
ż
P, Kłak M, W ojtasik E, Górski A. Clinical aspects of phage therapy. Advances in Virus Research, 2012; 83:73-121
• 157 pacjentów zakwalifikowanych do
terapii (w 4 przypadkach brak informacji o
wyniku leczenia) w latach 2008-2010.
• 447
pacjentów
zdyskwalifikowanych
(spo
ś
ród
tych,
którzy
zgłosili
si
ę
w
analizowanym okresie czasu).
• 68 kobiet, 85 m
ęż
czyzn
• Mediana wieku: 46 lat (zakres: 20-82 lat).
• Mediana czasu trwania choroby przed
rozpocz
ę
ciem
terapii
fagowej:
43
miesi
ą
ce (zakres: 4-600 mies.)
• Mediana
skumulowanego
czasu
stosowania preparatu fagowego: 55 dni
(zakres: 3-328 dni).
• Monoinfekcje (80%, z tego 50% zaka
ż
enie
S. aureus), infekcje mieszane (20%)
Wyniki terapii fagowej w OTF w latach 2008-2010
Mi
ę
dzybrodzki R. et al. Advances in Virus Research, 2012; 83:73-121.
Szczegółowa analiza wyników terapii
Kategoria odpowiedzi na leczenie
Zaka
ż
enia
układu
moczowo-
płciowego u
m
ęż
czyzn
(n=29)
Zaka
ż
enia
układu
moczowo-
płciowego u
kobiet
(n=22)
Infekcje
tkanek
mi
ę
kkich
(n=30)
Zaka
ż
enia
skóry
(n=10)
Zaka
ż
enia
układu
kostno-
stawowego
(n=37)
Zaka
ż
enia
układu
oddechowe-
go
(n=24)
n
%
n
%
n
%
n
%
n
%
n
%
A – eradykacja patogenu/wyleczenie
11
37.9%
3
13.6%
5
16,7%
0
0.0%
7
18.9%
2
8.3%
B – dobra odpowied
ź
kliniczna
2
6.9%
0
0.0%
2
6,7%
2
20.0%
3
8.1%
3
12.5%
C – poprawa kliniczna
1
3.4%
5
22.7%
4
13,3%
1
10.0%
7
18.9%
2
8.3%
D – w
ą
tpliwa poprawa
2
6.9%
0
0.0%
2
6,7%
0
0.0%
3
8.1%
3
12.5%
E – przej
ś
ciowa poprawa
5
17.2%
4
18.2%
8
26,7%
5
50.0%
8
21.6%
3
12.5%
F – brak odpowiedzi na leczenie
8
27.6%
10
45.5%
6
20,0%
1
10.0%
7
18.9%
7
29.2%
G - pogorszenie
0
0.0%
0
0.0%
3
10,0%
1
10.0%
2
5.4%
4
16.7%
Dobra odpowied
ź
(A-C):
14
48.3%
8
36.4%
11
36,7%
3
30.0%
17
45.9%
7
29.2%
Niewystarczaj
ą
ca odpowied
ź
(D-G):
15
51.7%
14
63.6%
19
63,3%
7
70.0%
20
54.1%
17
70.8%
2014-01-30
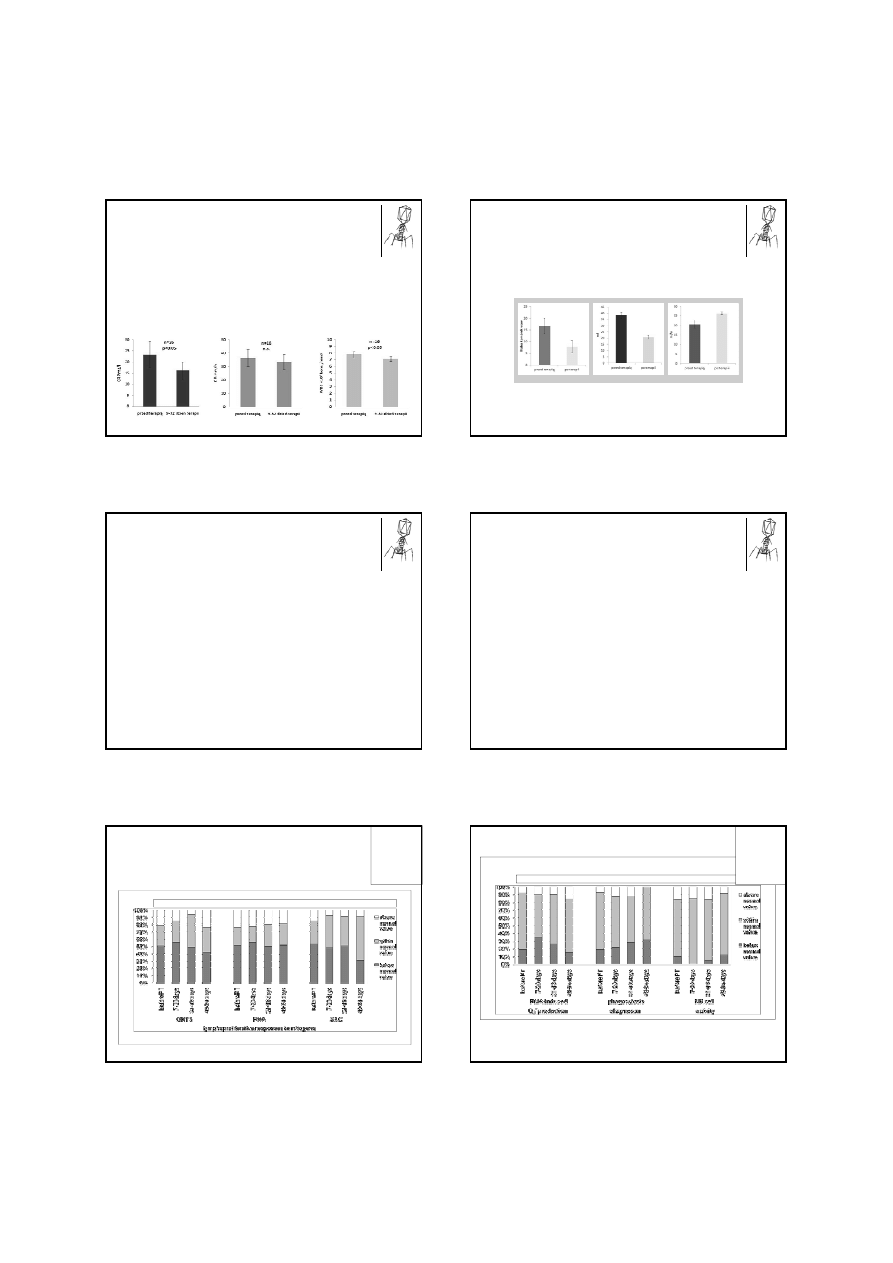
12
• Analizowano dane pochodz
ą
ce od 37 pacjentów z zapaleniem ko
ś
ci i szpiku, zaka
ż
eniem okołoprotezowym,
zaka
ż
eniem tkanek mi
ę
kkich lub infekcj
ą
dolnych dróg oddechowych wywołanych przez S. aureus, S. epidermidis,
E. faecalis, E. coli, lub P. aeruginosa przed i w trakcie stosowania preparatów fagowych.
• Preparaty fagowe (naturalne lizaty fagowe) były podawane doustnie (10-ml trzy razy dziennie po neutralizacji soku
ż
oł
ą
dkowego za pomoc
ą
10 ml zawiesiny w
ę
glanu dihydroksysodowo-glinowego) i/lub miejscowo (dwa razy
dziennie przymoczki lub płukanie przetoki).
• Na rycinie poni
ż
ej przedstawiono
ś
rednie warto
ś
ci (±SE) st
ęż
enia CRP w surowicy, OB i liczby leukocytów we krwi
obwodowej chorych mierzone przed oraz pomi
ę
dzy 9 a 32 dniem leczenia. Ró
ż
nice analizowano za pomoc
ą
testu
Wilcoxona (n – ilo
ść
analizowanych przypadków).
Mi
ę
dzybrodzki R, Fortuna W , W eber-D
ą
browska B, Górski A. A retrospective analysis of changes in
inflammatory markers in patients treated with bacterial viruses. Clin Exp Med. 2009, 9(4): 303-312
Zmiany markerów zapalnych u pacjentów w czasie
terapii fagowej
CRP w surowicy
OB
Leukocyty we krwi
●
Chorzy: 22 m
ęż
czyzn z rozpoznanym PZBGK.
●
Czynniki patogenne izolowane z wydzieliny gr. krokowego: E. faecalis (n=16), E. coli (n=5), K. pneumoniae
(n=2), P. aeruginosa (n=1), S. haemoliticus (n=1)
●
Droga stosowania preparatów specyficznych bakteriofagów: doodbytnicza (n=20), doustna (n=5), i/lub
miejscowa na błon
ę ś
luzow
ą ż
oł
ę
dzi pr
ą
cia (n=2).
● Ś
redni czas trwania leczenia: 47 dni (22-99 dni).
Wynik: Eradykacj
ę
patogennej bakterii (potwierdzon
ą
co najmniej 2 ujemnymi wynikami posiewów wydz. gr.
krokowego wykonanymi w trakcie lub po zako
ń
czeniu terapii w odst
ę
pach nie mniejszych ni
ż
2 tyg.)
uzyskano u 50% chorych (11/22). U sze
ś
ciu chorych (6/22) eradykacj
ę
potwierdzono w jednym
posiewie. Poza tym obserwowano statystycznie istotne zmniejszenie ilo
ś
ci komórek w wydzielinie
gruczołu krokowego, zmniejszenie obj
ę
to
ś
ci gr. krokowego i wzrost maksymalnego przepływu
cewkowego (Qmax).
Wyniki zastosowania terapii fagowej u pacjentów z przewlekłym
bakteryjnym zapaleniem gruczołu krokowego (PZBGK)
Letkiewicz S., Mi
ę
dzybrodzki R., Kłak M., Weber-D
ą
browska B., Górski A. Pathogen eradication by phage therapy in patients
with chronic bacterial prostatitis (CBP).25
th
Anniversary EAU Congress,Barcelona 2010. DOI: 10.3252/pso.eu.25eau.2010
leukocyty w wydz. gr. krok. obj
ę
to
ść
gr. krokowego Qmax
p<0.05
n=6
p<0.05
n=11
p<0.05
n=9
Z ogółu 157 chorych zakwalifikowanych do terapii fagowej w OTF w latach 2008-2010
dane dotycz
ą
ce tolerancji terapii były dost
ę
pne dla 153 chorych. Ich retrospektywna
analiza wykazała,
ż
e:
- dobr
ą
tolerancj
ę
(brak skarg w zwi
ą
zku ze stosowaniem preparatów fagowych,
brak objawów niepo
żą
danych lub wyst
ę
powanie objawów niepo
żą
danych nie
powoduj
ą
cych dolegliwo
ś
ci u pacjenta) obserwowano u 77,8% chorych;
- dostateczn
ą
tolerancj
ę
(pacjent zgłaszał skargi w zwi
ą
zku ze stosowaniem
preparatów fagowych ale nie miały one charakteru działa
ń
niepo
żą
danych – np.
skar
ż
ył si
ę
na zły smak preparatu, wyst
ę
powały objawy niepo
żą
dane powoduj
ą
cych
dolegliwo
ś
ci u pacjenta) obserwowano u 18,3% chorych;
- brak tolerancji (wyst
ą
pienie objawów niepo
żą
danych o charakterze lub nasileniu
wymagaj
ą
cym przerwania terapii) obserwowano u 3,9% chorych.
BEZPIECZE
Ń
STWO TERAPII FAGOWEJ
Najcz
ę
stsze działania niepo
żą
dane
(których prawdopodobn
ą
przyczyn
ą
mogło by
ć
stosowanie preparatów fagowych)
Reakcje miejscowe (18,4% chorych) wyst
ę
powały w okolicy gdzie był stosowany preparat
fagowy (miejscowo i/lub doodbytniczo). Obejmowały one uczucie dyskomfortu przy
stosowaniu dopochwowym, zaczerwienienie, pieczenie a nawet ból, szczypanie, sw
ę
dzenie
i podra
ż
nienie skóry, wysychanie/podra
ż
nienie błon
ś
luzowych górnych dróg oddechowych,
pojawienie si
ę
b
ą
bli pokrzywkowych i p
ę
cherzyków ropnych, zaostrzenie atopowego
zapalenia skóry. W wi
ę
kszo
ś
ci przypadków dolegliwo
ś
ci były krótkotrwałe (do
kilkudziesi
ę
ciu minut) lub ust
ę
powały po kilku dniach stosowania preparatu albo jego
zamianie na inny.
Wzrost temperatury ciała (stan podgor
ą
czkowy lub gor
ą
czka bez objawów choroby
przezi
ę
bieniowej) zanotowano u 6,5% chorych, przy czym gor
ą
czka wyst
ę
powała u połowy
z nich. Z reguły wzrost temperatury ciała obserwowano po podaniu kilku pierwszych dawek
preparatu fagowego. Temperatura wracała do normy w ci
ą
gu kilku dni: samoistnie, po
podaniu leków przeciwgor
ą
czkowych lub zmianie preparatu.
Nadka
ż
enie wymagaj
ą
ce modyfikacji leczenia (przerwania terapii lub zastosowania
antybiotyków lub leków przeciwgrzybicznych) wyst
ą
piło u 4,6% chorych. Najcz
ęś
ciej
pojawiało si
ę
w przypadku miejscowego stosowania preparatów fagowych.
52 19 40 26 52 19 40 26 52
19 40 26 = n
Wpływ terapii fagowej na układ immunologiczny (1)
Górski A., Mi
ę
dzybrodzki R., Borysowski J., D
ą
browska K., Wierzbicki P., Ohams M., Korczak-Kowalska G.,
Olszowska-Zaremba N., Łusiak-Szelachowska M., Kłak M., Jo
ń
czyk E., Kaniuga E., Goła
ś
A., Purchla S.,
Weber-D
ą
browska B., Letkiewicz S., Fortuna W., Szufnarowski K., Pawełczyk Z., Rogo
ż
P., Kłosowska D.
Phage as a modulator of immune responses: practical implications for phage therapy. Adv Virus Res. 2012;
83:41-71
52 19 40 26 52 19 40 26 52
19 40 26 = n
Górski A., Mi
ę
dzybrodzki R., Borysowski J. et al.Phage as a modulator of immune responses: practical
implications for phage therapy. Adv Virus Res. 2012; 83:41-71
Wpływ terapii fagowej na układ immunologiczny (2)
Ponadto obserwowano m.in.,
ż
e wzrost fagocytozy w pierwszych 7-20 dniach terapii
fagowej był zwi
ą
zany z dobr
ą
prognoz
ą
leczenia (stopie
ń
C-A odpowiedzi na terapi
ę
).

2014-01-30
13
Inne kierunki i „cele bakteryjne”
Poszukiwanie bakteriofagów Helicobacter pylori
(Proteon Pharmaceuticals S.A.)
Badania fagów przeciwko Clostridium difficile
(
Ropp P. Treatment of Clostridium difficile infection by use of novel phage therapy. Basic
Biotechnology. 2011;7:1-5)
PhagoBioDerm™ - opatrunek zawirej
ą
cy fagi przeciwko
Staphylococcus, Streptococcus, Pseudomonas, E. coli, Proteus, oraz
antybiotyk (ciprofloksacyn
ę
),
ś
rodek miejscowo znieczulaj
ą
cy
(benzokain
ę
), chymotrypsyn
ę
i wodorow
ę
glan sodu opracowany przez
Intralytix, Inc. (USA), Instytut im. Eliavy w Tibilisi i Politechnik
ę
Gruzi
ń
sk
ą
(
Markoishvili K, Tsitlanadze G, Katsarava R, Morris JG Jr, Sulakvelidze A: A novel
sustained-release matrix based on biodegradable poly(ester amide)s and impregnated
with bacteriophages and an antibiotic shows promise in management of infected venous
stasis ulcers and other poorly healing wounds. Int J Dermatol. 2002;41:453-458)
Endolizyny
(Fischetti V. Phage factor. Interview by Brendan Borrell. Sci Am. 2012;307:80-83)
Wyszukiwarka
Podobne podstrony:
Immunologia zakażeń pasożytniczych wykład z 12 12
Biologia molekularna i immunologia zakazen wykład profa
02 patogeneza zakazenia
05 Odpowiedź immunologiczna w zakażeniu HIV i przebiegu AIDS
Biologia wykład V Immunologia w zakazeniach pasozytniczych
02 Immunologia prelekcja 10 08 2007id 3412 (2)
Immunologia zakażeń pasożytniczych wykład z 12 12
03 0000 035 02 Leczenie immunosupresyjne sirolimusem
03 0000 034 02 Leczenie immunosupresyjne mykofenolanem mofetylu lub mykofenolanem sodu
03 0000 014 02 Leczenie pierwotnych niedoborow odpornosci u dzieci immunoglobulinami
10.Immunologia - prelekcja 12.02.2007(1), 1.Lekarski, II rok, Immunologia, Prelekcje
MECHANIZMY IMMUNOLOGICZNE ZWALCZAJĄCE ZAKAŻENIA
10 Immunologia prelekcja 12 02 2007id 10554 (2)
03 0000 036 02 Leczenie immunosupresyjne tacrolimusem
Odpowiedź immunologiczna na zakażenia wirusowe
2005 02 Status immunologiczny
Przydatność immunoprofilaktyki w ograniczaniu strat świń na tle zakażeń Brachyspira hyodysenteriae
więcej podobnych podstron