
1. Cykloalkany
1.1. Teoria naprężeń Baeyra
Zgodnie z teorią wartościowości Kekulego, Butlerowa i Coupera atomy węgla w związkach
organicznych mogą się ze sobą łączyć w łańcuchy i pierścienie. Mogą też być połączone ze sobą
wiązaniem pojedynczym, podwójnym lub potrójnym.
Pod koniec XIX wieku obok węglowodorów łańcuchowych poznano również związki
pierścieniowe. Były to: benzen i jego homologi, oraz produkty ich uwodornienia, a także związki
szeregu cyklopentanu. Pierścieni z inną liczbą członów nie znano. Nie próbowano nawet szukać. A
nie szukano, ponieważ w 1875 roku Meyer ogłosił, (jak się później okazało, fałszywą teorię), że są
trwałe i mogą istnieć jedynie pierścienie pięcio- i sześcioczłonowe.
Odkrycie w 1881 roku pochodnej cyklobutanu, a rok później cyklopropanu całkowicie zaprzeczyło
teorii Meyera. łatwość z jaką tworzą się pierścienie pięcio- i sześcioczłonowe, oraz trudności
napotykane przy syntezie mniejszych lub większych pierścieni została wytłumaczona teorią
naprężeń Bayera.
Zgodnie z rozważaniem Bayera, kąty między wiązaniami C-C-C muszą odchylać się od swojej
normalnej wartości 109,5
o
, przy czym wielkość tego odchylenia zależy od liczby członów w
pierścieniu. Kąty między wiązaniami w cykloalkanie, podobnie jak kąt między bokami w
wielokącie, można obliczyć z prostego wzoru:
Kąt odchylenia od wartości tetraedrycznej przypadający na jedno wiązanie można wyliczyć ze
wzoru:
Odchylenie wiązań w cykloalkanach od ich normalnego położenia w modelu tetraedrycznym atomu
węgla, obliczone przez Baeyra jest największe dla pierścienia trójczłonowego i zmniejsza się wraz
ze wzrostem pierścienia, aby osiągnąć minimum dla pierścienia pięcioczłonowego. W miarę
dalszego zwiększania się liczby członów poczynając od pierścienia sześcioczłonowego, odchylenia
ponownie zaczynają wzrastać, lecz tym razem kąty między wiązaniami C-C-C są większe od
109,5
o
.
n (liczba członów w
pierścieniu
kąt odchylenia od wartości
tetraedrycznej α
3
24,8
4
9,8
5
0,8
6
-5,3
7
-9,5
8
-12,8

W celu zmierzenia wielkości energii naprężenia cykloalkanów musimy zmierzyć energię całkowitą
związku i porównać ją z energią całkowitą związku pozbawionego naprężeń. Różnica między tymi
dwiema wartościami będzie wskazywała ilość nadmiarowej energii jaką posiada ten związek, czyli
energię naprężenia. Najprościej będzie nam zmierzyć ciepło spalania. W czasie spalania wydziela
się energia pochodząca od utlenienia grupy CH
2
, oraz zostaje uwolniona energia naprężenia. Ilość
energii pochodzącej od spalania grupy CH
2
łatwo zmierzyć spalając dwa sąsiadujące ze sobą w
szeregu homologicznym węglowodory (różnią się one właśnie grupą CH
2
). Ze spalania heksanu
uzyskuje się o 157,4kcal/
więcej energii na sposób ciepła niż ze spalania pentanu,
czyli ze spalania grupy CH
2
uzyskuje się właśnie energię ΔH=157,4kcal/mol.
n
ΔH
CH2
[kcal/mol]
ΔH
spalania
/n
nadmiar energii [kcal/mol]
n
.
(ΔH
CH2
- 157,4)
3 166,6
27,6
4 163,9
26,0
5 158,7
6,5
6 157,4
0
7 158,3
6,3
8 158,6
9,6
15 157,5
1,5
16 157,2
-3,2
Dane termochemiczne (pomiary ciepła spalania) potwierdzają teorię Baeyra dla małych pierścieni.
Jednak w przypadku pierścienia sześcioczłonowego, wartość ciepła spalania wskazuje na brak
jakichkolwiek naprężeń, co nie jest zgodne z obliczeniami Baeyra. Trwałe okazały się również
pierścienie wieloczłonowe, w których według Baeyra powinno występować silne naprężenie
destabilizujące je. Okazuje się jednak, że jeżeli odstąpimy od założonej przez Beyera płaskiej
budowy pierścieni, wszystkie pierścienie, począwszy od sześcioczłonowego można zbudować bez
deformacji tetraedrycznego modelu atomu węgla i dlatego nie występuje w nich naprężenie kątowe.
1.2. Nazewnictwo cykloalkanów
1. Nazwy cykloalkanów tworzymy z nazw odpowiednich alkanów, zawierających taką samą
ilość atomów węgla jak pierścień, dodając przedrostek cyklo-. Wzory natomiast, najczęściej
rysujemy w postaci szkieletowej. Pamiętajmy jednak podczas liczenia ładunku formalnego,
że przy atomach węgla istnieją atomy wodorów.
cyklo
prop
an
cyklo
but
a
n
cyklo
pent
a
n
cyklo
heks
an
cyklo
hept
a
n
2. Nazwy grup jednowartościowych pochodzących od cykloalkanów (bez łańcuchów
bocznych), tworzy się przez wymianę przyrostka -an na
-yl
lub
-il
(-il po apółgłoskach g, k,
l). Atom węgla z wolną wartościowością oznacza się lokantem 1.
cykloprop
yl
cyklopent
yl
cykloheks
yl
cyklodek
il
3. W przypadku cykloalkanów podstawionych grupami alkilowymi, należy ustalić liczbę
atomów węgla wchodzących w skład pierścienia i największego podstawnika:
•
Jeżeli liczba atomów węgla w pierścieniu jest większa lub równa liczbie atomów węgla w
największym podstawniku, związek przyjmuje nazwę od cykloalkanu podstawionego
grupami alkilowymi.
•
Jeżeli liczba atomów węgla w największym podstawniku jest większa niż w pierścieniu,
związek przyjmuje nazwę od alkanu podstawionego grupą cykloalkilową.
•
Dla cykloalkanów podstawionych wieloma grupami, oznaczenie pozycji zaczyna się od
punktu dołączenia podstawnika. Miejsca dołączenia podstawników numeruje się tak by
zbiór numerów lokantów tworzyły najmniejsze liczby. W nazwie, podstawniki podajemy w
kolejności alfabetycznej. Przy alternatywnej numeracji wybieramy tę dla której pierwszy
podstawnik ma mniejszy lokant. Jeżeli obecny jest tylko jeden podstawnik, jego położenia
nie pokazuje się.
2-
cyklopropylobutan
(1-
metylobutylo)cyklo
pentan
2-chloro-4-etylo-1-
metylochykloheksan
1.3. Budowa cykloalkanów
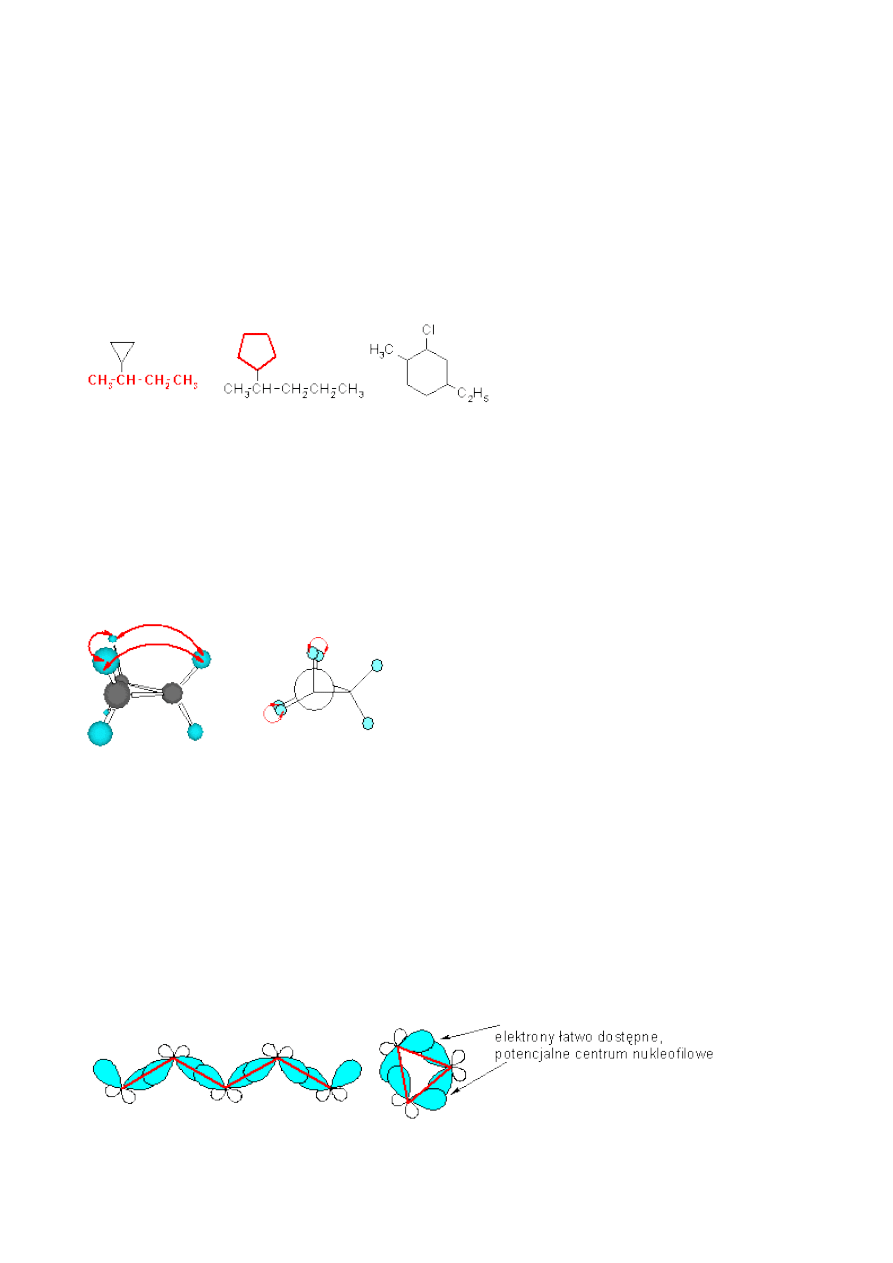
Cząsteczka cyklopropanu składa się jedynie z trzech atomów węgla w pierścieniu, a atomy te
muszą leżeć na jednej płaszczyźnie (zawsze przez dowolne trzy punkty można przeprowadzić
płaszczyznę). Oprócz naprężeń Baeyra (kątowych) destabilizujących pierścień, w cząsteczce
cyklopropanu atomy wodoru leżą naprzeciw siebie, podobnie jak w cząsteczce etanu w konformacji
synperiplanarnej.
widok cząsteczki
cyklopropanu
projekcja Newmana
cyklopropanu
Oprócz naprężeń Baeyra, w cząsteczce cyklopropanu występują oddziaływania naprzeciwległych
atomów wodoru, zwane naprężeniami
Pitzera
.
Proszę zwrócić uwagę, że najbardziej godne uwagi w pierścieniu cyklopropanu jest skrócenie
wiązań C-C ze 154pm do 151pm. Wiązania C-C upodabniają się do wiązań C=C nie tylko pod
względem długości, ale również pod względem reaktywności. Kąt między orbitalami
zhybrydyzowanymi sp
3
wynosi 109,5
o
. Poprzez nakładanie czołowe tych orbitali tworzy się
wiązanie σ i dlatego łańcuch węglowodorowy jest pofałdowany (forma zygzaka). Tak
zhybrydyzowane orbitale nie mogą nałożyć się czołowo w celu utworzenia cząsteczki
cyklopropanu. Nakładają się one na siebie bocznie w związku z czym, tak utworzone wiązania są
nieznacznie krótsze:
sposób nakładania orbitali
zhybrydyzowanych sp
3
w cząsteczce
nakładanie się orbitali zhybrydyzowanych sp
3
w cząsteczce cyklopropanu
alkanu
Wiązania utworzone przez takie nakrywanie się orbitali noszą nazwę wiązań bananowych.
Wiązania te, z uwagi na to, że tworzące je orbitale nie nakrywają się maksymalnie na siebie, są
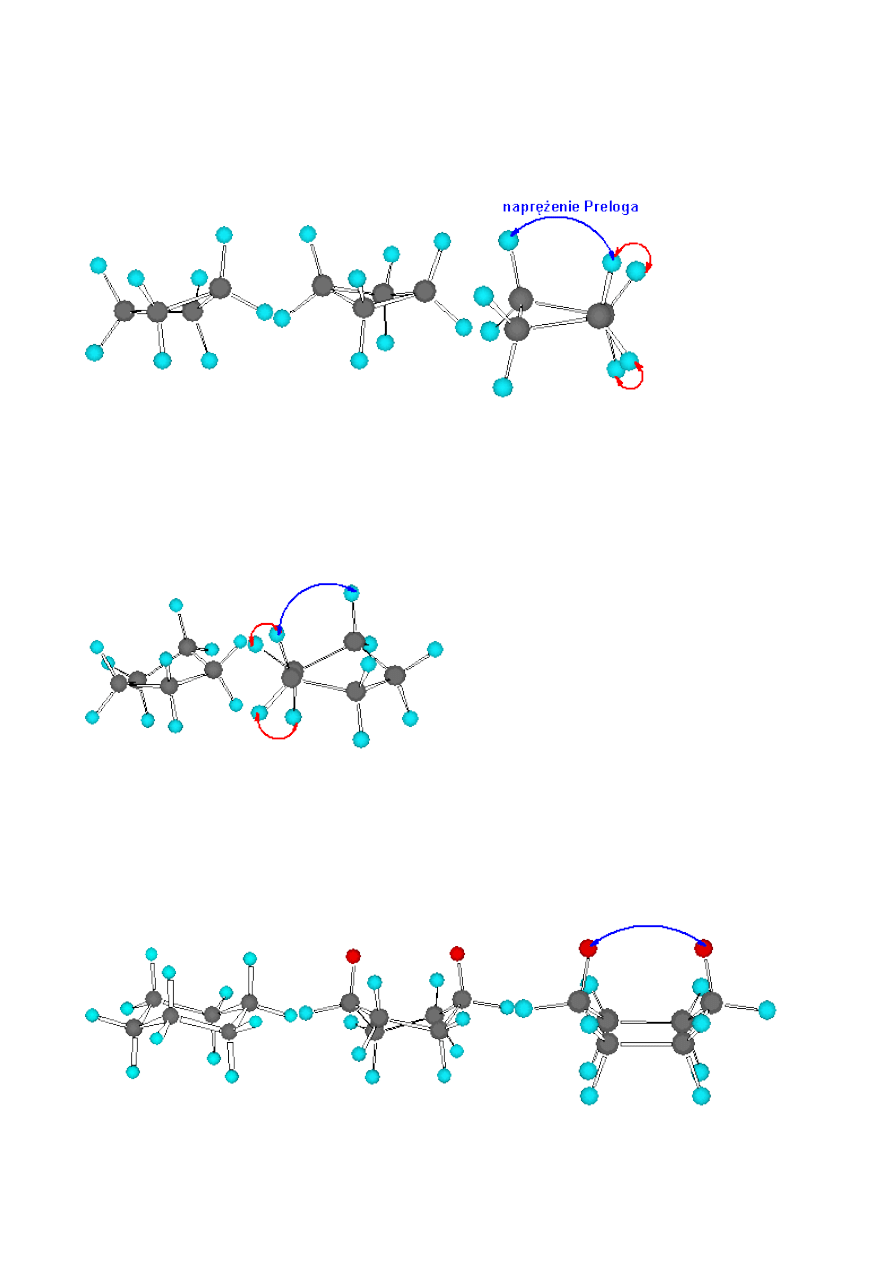
stosunkowo słabe. Cyklobutan, w przeciwieństwie do poprzedniego związku ma już budowę
niepłaską:
Widok cząsteczki cyklobutanu
Naprężenia
Preloga
i
Pitzera
Chociaż w cząsteczce cyklobutanu naprężenia Baeyra i Pitzera są już mniejsze to jednak pojawiają
się w nich odpychające oddziaływania atomów zbliżonych do siebie, czyli naprężenia
Preloga
.
W cząsteczce cyklopentanu brak jest już naprężeń Baeyra. Naprężenia Pitzera również są znikome
(ułożenie atomów wodoru przy sąsiadujących atomach węgla przypomina konformację
naprzemianległą etanu (antiperiplanarną), dlatego pierścień cyklpentanu ma już znikomy nadmiar
energii (6,5kcal/mol)
widok cząsteczki
cyklopentanu
naprężenia w cząsteczce
cyklopentanu
Cykloheksan, jak wynika z ciepła spalania pozbawiony jest całkowicie naprężeń. Pofałdowanie
pierścienia powoduje, że jest on pozbawiony nie tylko naprężeń kątowych, ale musi być również
pozbawiony naprężeń wynikających z oddziaływania Pitzera i Preloga. Cząsteczki cykloheksanu
możemy wyobrazić sobie w postaci wielu różnych konformerów z łatwością przechodzących
wzajemnie w siebie. Główne jednak konformacje cykloheksenu pozbawione całkowicie naprężeń
lub mające niewielki nadmiar energii to konformacje: krzesłowa, łódkowa i skręconej łódki:
konformacje: krzesłowa
skręconej łódki
łódkowa
Forma krzesłowa cykloheksanu jest bardziej korzystna energetycznie (uprzywilejowana) od formy
łódkowej. Chociaż obydwie formy pozbawione są naprężeń Baeyra, to w konformacji krzesłowej w
przeciwieństwie do konformacji łódkowej, brak jest również naprężeń Preloga.
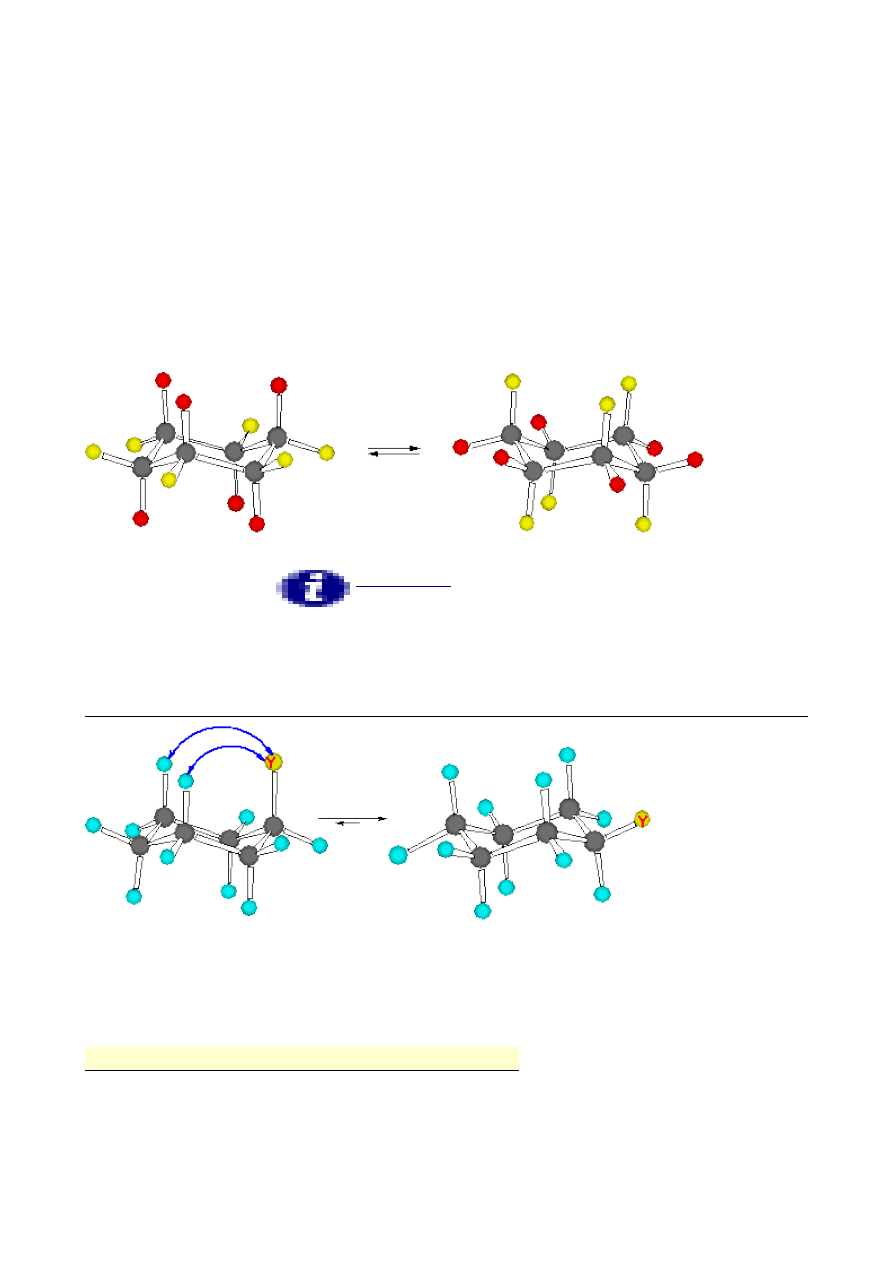
W formie krzesłowej możemy wyróżnić dwa rodzaje atomów wodoru: patrz rysunek poniżej
(kolory żółty i czerwony ). Jedne atomy, nazywane ekwatorialnymi leżą praktycznie na
płaszczyźnie poziomej i powiązane z atomami węgla wiązaniami, które również noszą nazwę
wiązań ekwatorialnych. Natomiast drugi rodzaj atomów wodoru związany jest z atomami węgla
wiązaniami skierowanymi pionowo ( góra - dół, przemiennie ). Wiązania te noszą nazwę wiązań
aksjalnych, a atomy wodoru nazywane są aksjalnymi atomami wodoru. Znamienne jest to, że jedna
forma krzesłowa łatwo przechodzi w drugą formę krzesłową w wyniku wygięcia pierścienia. Atom
węgla, który w jednej formie pełnił rolę “oparcia w krześle&tdquo; staje się “podnóżkiem”. Przy
takiej zmianie konformacji atomy wodoru z pozycji aksjalnej przechodzą w pozycje ekwatorialną,
natomiast te, które były w pozycji ekwatorialnej znajdą się w pozycji aksjalnej. Pomimo tego, że
taka zmiana konfiguracji w wyniku wygięcia pierścienia przechodzi przez formę cykloheksanu
wyżej energetyczną, to w temperaturze pokojowej zachodzi bez trudu.
Inaczej wygląda sytuacja gdy pierścień cykloheksanu podstawiony jest jakąś grupą inną niż atom
wodoru, ponieważ wtedy
cykloheksanu, w której nowy podstawnik
znajduje się w pozycji aksjalnej jest wysoce niekorzystna energetyczne. Istnieje naprężenie Preloga
tego podstawnika z aksjalnymi atomami wodoru w pozycji 3 i 5. Naprężenieto często zwane
oddziaływaniem 1,3-diaksjalnym zależne jest od wielkości podstawnika. Gdy podstawnikiem Y jest
grupa tert-butylowa, to w temperaturze pokojowej, konformacja z podstawnikiem w pozycji
aksjalnej praktycznie nie istnieje:
Grupa Y w pozycji ekwatorialnej pozbawiona jest tego typu naprężeń. Różnica energii cząsteczek z
podstawnikami w położeniu aksialnym i ekwatorialnym nosi nazwę energii konformacyjnej.
Energia konformacyjna zależy od rodzaju podstawnika. Im energia jest wyższa, tym mniej chętnie
podstawnik zajmuje pozycję aksjalną. Wartości energii konformacyjnej dla wybranych
podstawników zostały zebrane w poniższej tabeli:
Podstawnik
ΔG [kJ/mol]
Podstawnik
ΔG [kJ/mol]
CH
3
7,1
C
6
H
5
13,0
C
2
H
5
7,3
Cl, Br, I
1,7
i-C
3
H
7
9,0
OH
2,2 (3,7)*
t-C
4
H
9
23,1
HgBr
0
* Wartość zależy od rozpuszczalnika
Z podanych tutaj wartości można łatwo wyliczyć (rozkład normalny Boltzmana), że na 1000
cząsteczek z grypą metylową w pozycji ekwatorialnej przypadają 54 cząsteczki z tą grupą w pozycji
aksjalnej. Grupę tert-butylową na 100000 cząsteczek ma w pozycji aksjalnej tylko 8 z nich.
Zaskakująco małą energię dla dużego podstawnika jakim jest grupa bromortęciowa tłumaczy się
długim wiązaniem C-Hg. Pomimo swych dużych rozmiarów, grupa ta znajduje się daleko od
atomów wodoru z pozycji 3 i 5.
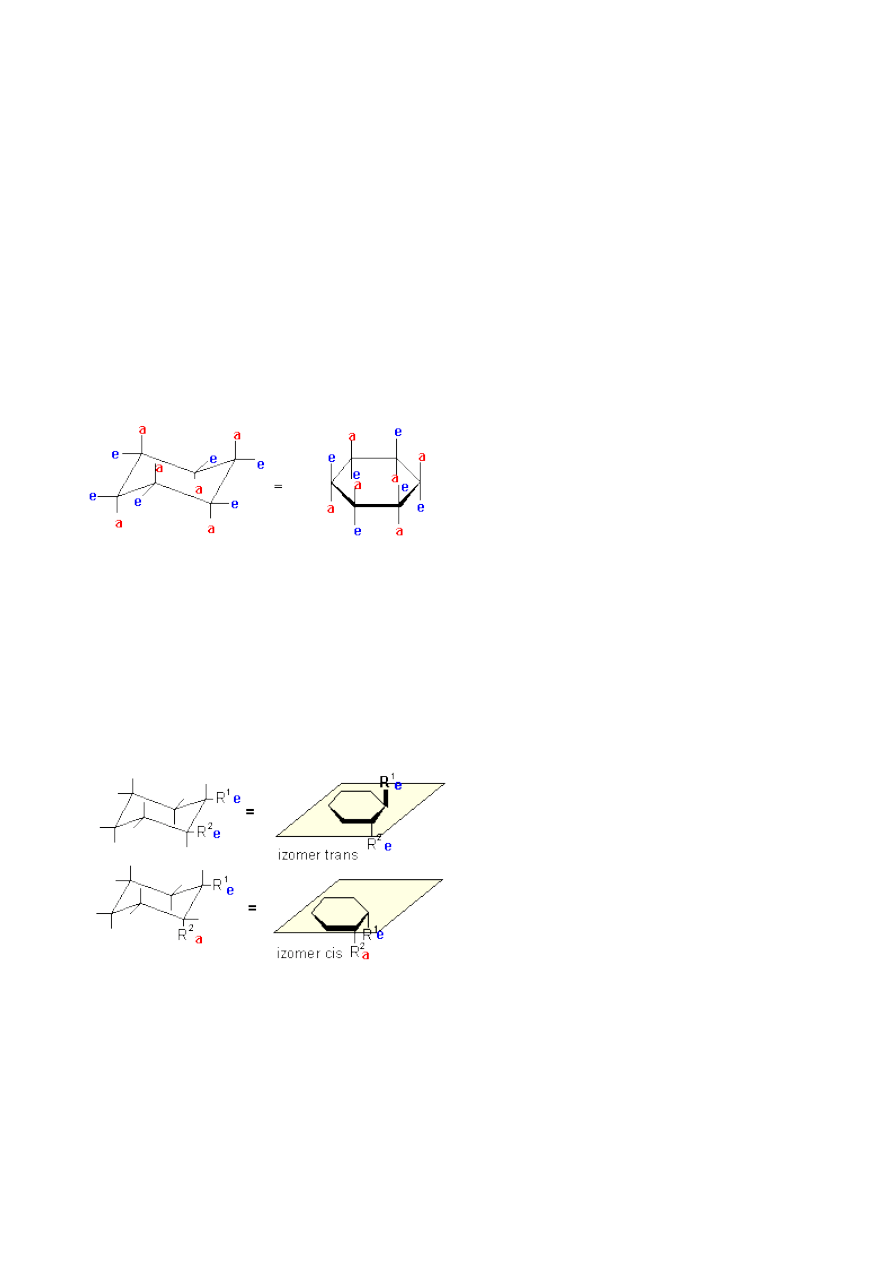
Rysowanie wzoru cykloheksanu w konformacji krzesłowej, przedstawiającej rzeczywistą budowę
(kształt) cząsteczki nie zawsze jest wygodne. Pierścień cykloheksanu często rysuje się płaski.
Należy jednak pamiętać, że pomimo swojej płaskości, przy każdym atomie węgla istnieją nadal
dwa rodzaje wiązań: aksjalne i ekwatorialne. Pomocne może być spostrzeżenie, że wiązania
aksjalne są zawsze na przemian: jedno skierowane do góry, przy drugim węglu do dołu, przy
następnym do góry i tak dalej:
W przypadku rysowania płaskiego pierścienia nie podstawionego cykloheksanu nie ma znaczenia,
które wiązania będą aksjalne a które ekwatorialne. Jednak gdy obecny jest jakikolwiek podstawnik,
to zawsze zajmie on pozycję ekwatorialną i od niego musimy zacząć przypisywanie pozycji. Gdy w
pierścieniu cykloheksanu znajdą się obok siebie dwa podstawniki, jeden z nich zawsze będzie w
pozycji ekwatorialnej, natomiast drugi może być w pozycji ekwatorialnej bądź aksjalnej. Obydwa te
związki mają identyczny skład, identyczną konstytucję lecz różne ułożenie podstawników w
przestrzeni. Takie związki nazywamy izomerami. Aby podkreślić fakt, że podstawniki w nich
zajmują różne położenie w przestrzeni, nazywamy je stereoizomerami. Ten typ stereoizomerii w
którym grupy znajdują się po tej samej lub przeciwnej stronie płaszczyzny, nazywany jest izomerią
geometryczną.
Jeżeli dwa podstawniki znajdą się po tej samej stronie płaszczyzny w której leży cząsteczka, to taki
izomer nazywamy izomerem cis. Gdy podstawniki leżą po przeciwnych stronach płaszczyzny, to
stereoizomer nazywany jest izomerem trans. Oczywiście izomer trans 1,2-dipodstawionego
cykloheksanu jest termodynamicznie trwalszy od izomeru cis. Proponuję zastanowienie się nad
tym, jak przedstawia się trwałość termodynamiczna dla izomerów 1,3-dipodstawionego
cykloheksanu!
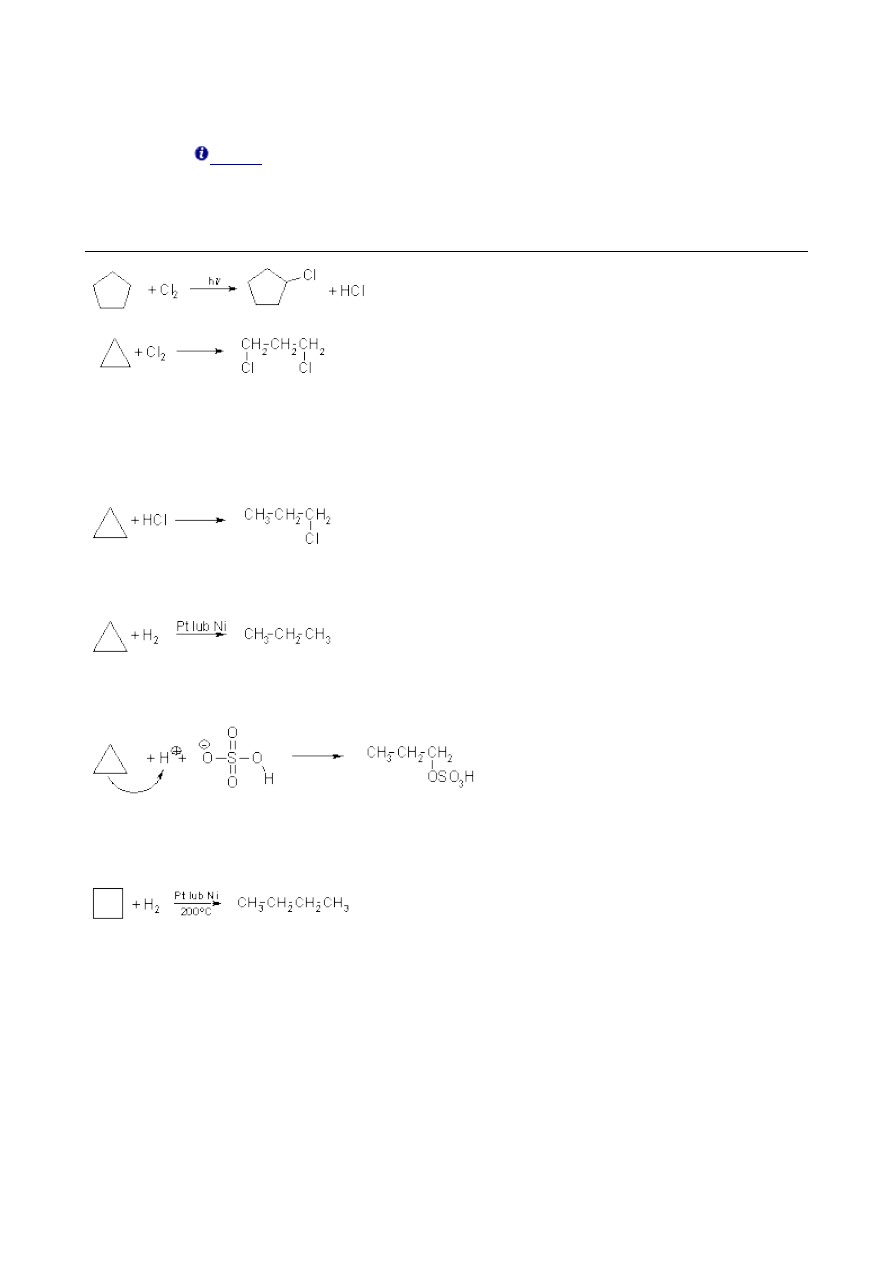
1.4. Właściwości chemiczne cykloalkanów.
Cykloalkany o pierścieniach pięcioczłonowych i większych mają identyczne właściwości
chemiczne jak
, a co za tym idzie, ulegają reakcjom substytucji rodnikowej: chlorowaniu i
nitrowaniu. Mechanizm tej reakcji jest identyczny jak mechanizm chlorowania alkanów. Natomiast
chyklopropan ze względu na specyficzny rodzaj wiązań C-C (wiązania bananowe), który raczej
przypomina wiązanie π niż σ, łatwiej ulega reakcjom z rozerwaniem pierścienia, czyli addycji niż
reakcjom substytucji:
Addycja ta zachodzi bardzo łatwo w obecności chlorku glinu, AlCl
3
.
Nukleofilowy charakter wiązania C-C w cyklopropanie powoduje, że reaguje on również z
chlorowodorem lub z bromowodorem. Reakcje tę zaliczamy również do reakcji addycji. Z uwagi na
charakter odczynnika, addycja ta klasyfikowana jest jako addycja elektrofilowa:
W obecności katalizatora, nawet w łagodnych warunkach przyłącza wodór i redukuje się do
propanu:
Cyklopropan jest jedynym węglowodorem, który dzięki temu rozpuszcza się w stężonym kwasie
siarkowym:
Cyklobutan ulega podobnym reakcjom jak inne, wyższe cykloalkany. Jedynym wyjątkiem jest
reakcja uwodornienia na katalizatorze. Wyższe cykloalkany nie ulegają tej reakcji, natomiast
cyklobutan, dość łatwo się uwodornia w wyższej temperaturze:
1.4. Metody syntezy cykloalkanów
Cyklizacji najłatwiej ulegają łańcuchy z których mogą powstać pierścienie pięcio- i
sześcioczłonowe. O wiele trudniej tworzone są pierścienie trój- i czteroczłonowe, czego powodem
jest ich wysoka energia wewnętrzna. Jednakże pierścienie o dużej liczbie członów pomimo, że nie
posiadają żadnych naprężeń, tworzą się trudno. Spowodowane jest to dużą zmianą entropii podczas
cyklizacji:

Document Outline
Wyszukiwarka
Podobne podstrony:
cykloalkeny
Alkany i cykloalkany(1)
CYKLOALKANY
chorg w 5 cykloalkany
Cykloalkany
cykloalkany
ALKENY I CYKLOALKENY
Cykloalkany
Alkany i cykloalkany, chemia, chemia organiczna
cykloalkany zadania
Zadania dieny i cykloalkany
ALKANY I CYKLOALKANY
cykloalkany ppt
CYKLOALKANY
Cykloalkany
14b Węglowodory alifatyczne alkany i cykloalkany
cykloalkany
cykloalkeny
więcej podobnych podstron