K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
XI.
XI.1. ATOM WODOROPODOBNY
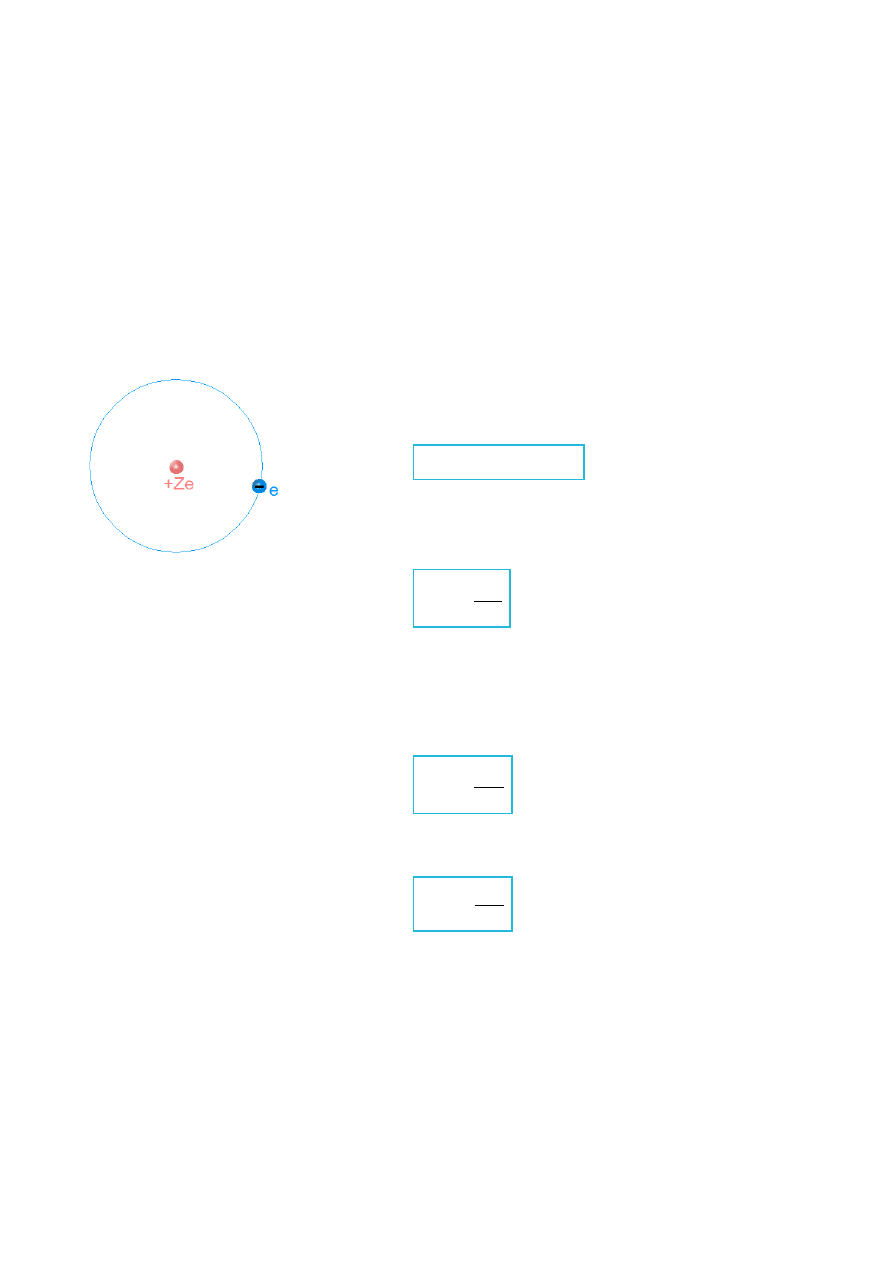
Atomy wodoropodobne, to pierwiastki posiadające tylko jeden elektron, np. He
+
, Na
++
, itd.
Energię możemy wyrazić z pomocą wzoru:
E
'
= E
K
1
+ E
K
2
+ V
(XI.1)
gdzie
E
K
1
– energia kinetyczna elektronu
E
K
1
=
p
1
2
2m
(XI.1.2a)
m – masa elektronu
p – pęd elektronu
E
K
2
– energia kinetyczna jadra atomowego
E
K
2
=
p
2
2
2M
(XI.1.2b)
V – energia potencjalna (potencjał)
V
= −
Ze
2
r
(XI.1.2c)
Masa jądra atomowego M jest znacznie większa od masy elektronu m.
– 1 –
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
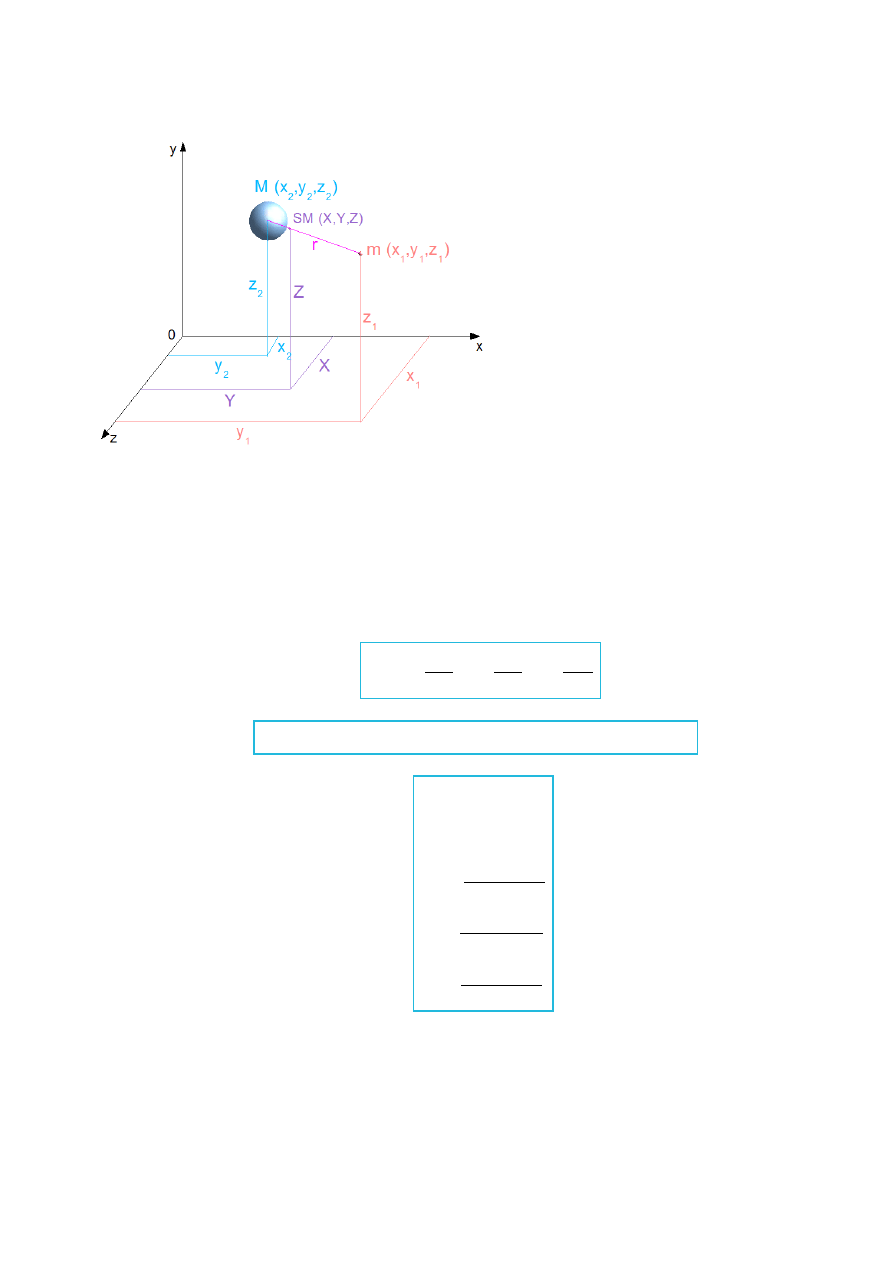
Rys.XI.1. Schematyczna ilustracja atomu wodoropodobnego umieszczonego w kartezjańskim układzie
współrzędnych.
Równanie Schrődingera dla atomu wodoropodobnego znajdujemy posługując się regułami
Jordana:
E
'
H
p
1
p
1
, p
2
p
2
, p
3
p
3
H =− ℏ
2
2m
1
−
ℏ
2
2m
2
−
Ze
2
r
(XI.1.3)
H x
1
, y
1
, z
1
; x
2
, y
2
, z
2
= E
'
x
1
, y
1
, z
1
; x
2
, y
2
, z
2
(XI.1.4)
x
= x
2
− x
1
y
= y
2
− y
1
z
= z
2
−z
1
X
=
m
x
1
M
x
2
m
M
Y
=
m
y
1
M
y
2
m
M
Z
=
m
z
1
M
z
2
m
M
(XI.1.5)
We wzorze (XI.1.5) współrzędne x, y, z to współrzędne względne (położenie elektronu
względem jądra lub odwrotnie).
– 2 –
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
separujemy zmienne:
x , y , z , X ,Y , Z = x , y , z⋅ X ,Y ,Z
(XI.1.6)
Ze wzorów (XI.1.3) oraz (XI.1.6) otrzymujemy:
−ℏ
2
m
M
X ,Y , Z = E
'
− E X ,Y , Z
(XI.1.7a)
−ℏ
2
2
[
−
Ze
2
r
]
x , y , z = E x , y , z
(XI.1.7b)
Równanie (XI.1.7a) opisuje ruch atomu jako całości, z energią kinetyczną równą (E' – E).
Uwaga:
XI.1.7a = ∂
2
∂ X
2
+ ∂
2
∂Y
2
+ ∂
2
∂ Z
2
XI.1.7b = ∂
2
∂ x
2
+ ∂
2
∂ y
2
+ ∂
2
∂ z
2
= X ,Y , Z = exp
[
i
k
x
x
k
y
y
k
z
z
]
(XI.1.8)
Wyrażenie (XI.1.8a) opisuje falę płaską.
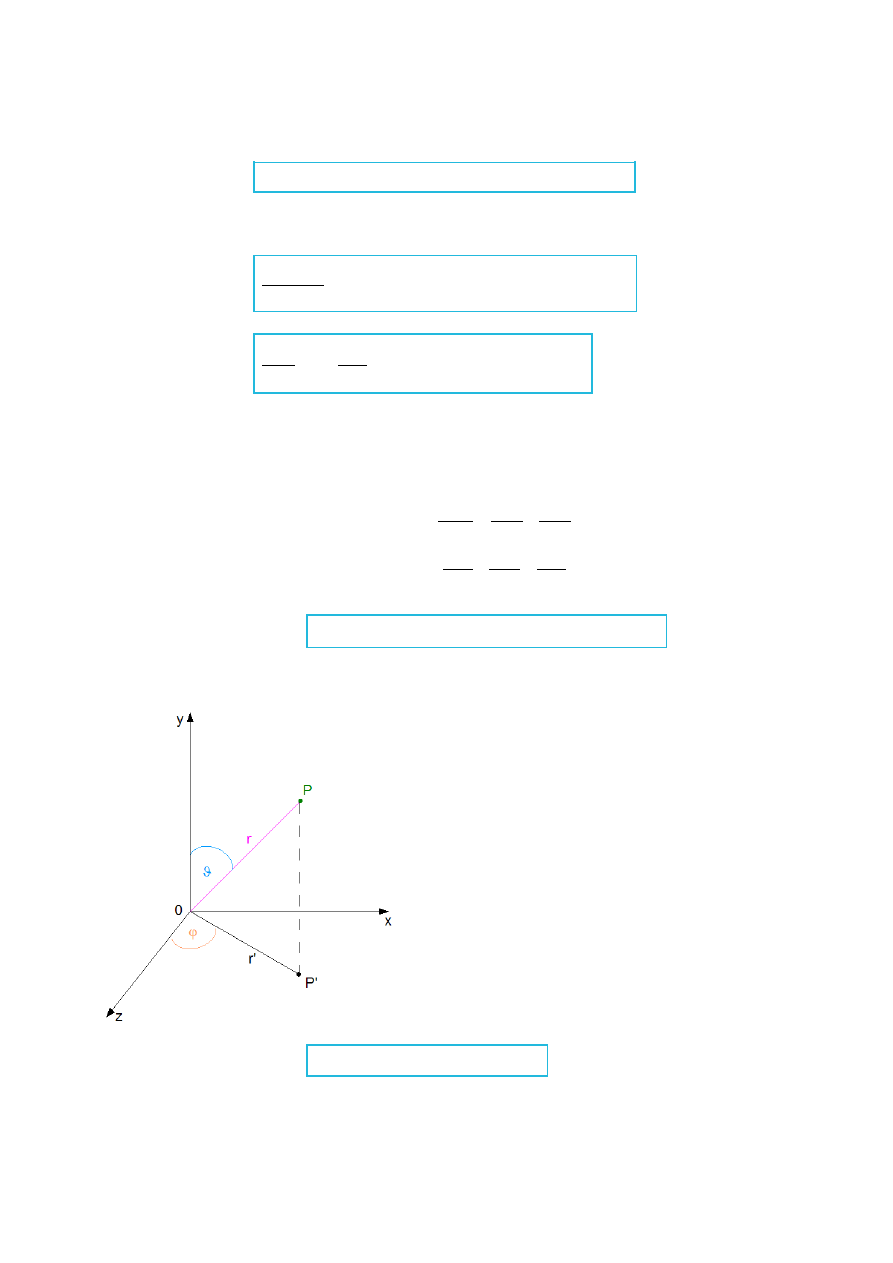
ϕ
– kąt azymutalny
ϑ
– kąt biegunowy
H r , , = Er , ,
(XI.1.9)
– 3 –

K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
H =− ℏ
2
2
[
1
r
2
∂
∂ r
r
2
∂
∂r
1
r
2
sin
2
∂
2
∂
2
1
r
2
sin
∂
∂
sin
∂
∂
]
−
Ze
2
r
(XI.1.10)
µ
jest to tzw. masa zredukowana i jest ona równa:
=
df
mM
m
M
Równanie (XI.1.9) rozwiązuje się metodą separacji zmiennych czyli zakładamy, że:
r , , = Rr
(XI.1.11)
R – funkcja radialna
Wykorzystujemy znajomość funkcji własnej
L
2
(patrz rozdział X.5.)
L
2
~ℏ
2
l
l1
Z równania (XI.1.10) oraz wykorzystując funkcję własną
L
2
otrzymujemy:
H = ℏ
2
2
[
−1
r
2
∂
∂ r
r
2
∂
∂r
1
r
2
L
2
]
−
Ze
2
r
(XI.1.12)
Po podstawieniu do równania (XI.1.12) wartości własnej operatora
L
2
{
ℏ
2
2
[
−1
r
2
∂
∂r
r
2
∂
∂ r
l
l 1ℏ
2
r
2
]
−
Ze
2
r
}
r , , = E r , ,
(XI.1.13)
Szukamy rozwiązań postaci:
r , , = RrY ,
(XI.1.14)
R
r – część radialna
Y
, – część kątowa
Z równań (XI.1.13) oraz (XI.1.14) otrzymujemy:
{
ℏ
2
2
[
−1
r
2
d
d r
r
2
d
d r
l
l1ℏ
2
r
2
]
−
Ze
2
r
}
R
r = ERr
(XI.1.15)
– 4 –
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
Równanie (XI.1.15) to równanie Laguerra
a) E ≥ 0, E jest ciągła
b) E < 0 – elektron związany – tworzy razem z jądrem atom.
{E
n
}: E
n
= −
nZ
2
e
4
2
ℏ
2
n
r
l 1
2
= −
nZ
2
e
4
2
ℏ
2
n
2
(XI.1.16)
Równanie (XI.1.16) to zbiór rozwiązań równania (XI.1.15) przy warunku b).
Z teorii Bohra – Sommerfelda:
E
~
1
n
2
n – główna liczba kwantowa
l = 0,1,....,n-1 – orbitalna liczba kwantowa
R
ln
r = Cx
l +1
e
−x
2
L
n + 1
2l +1
x
(XI.1.17)
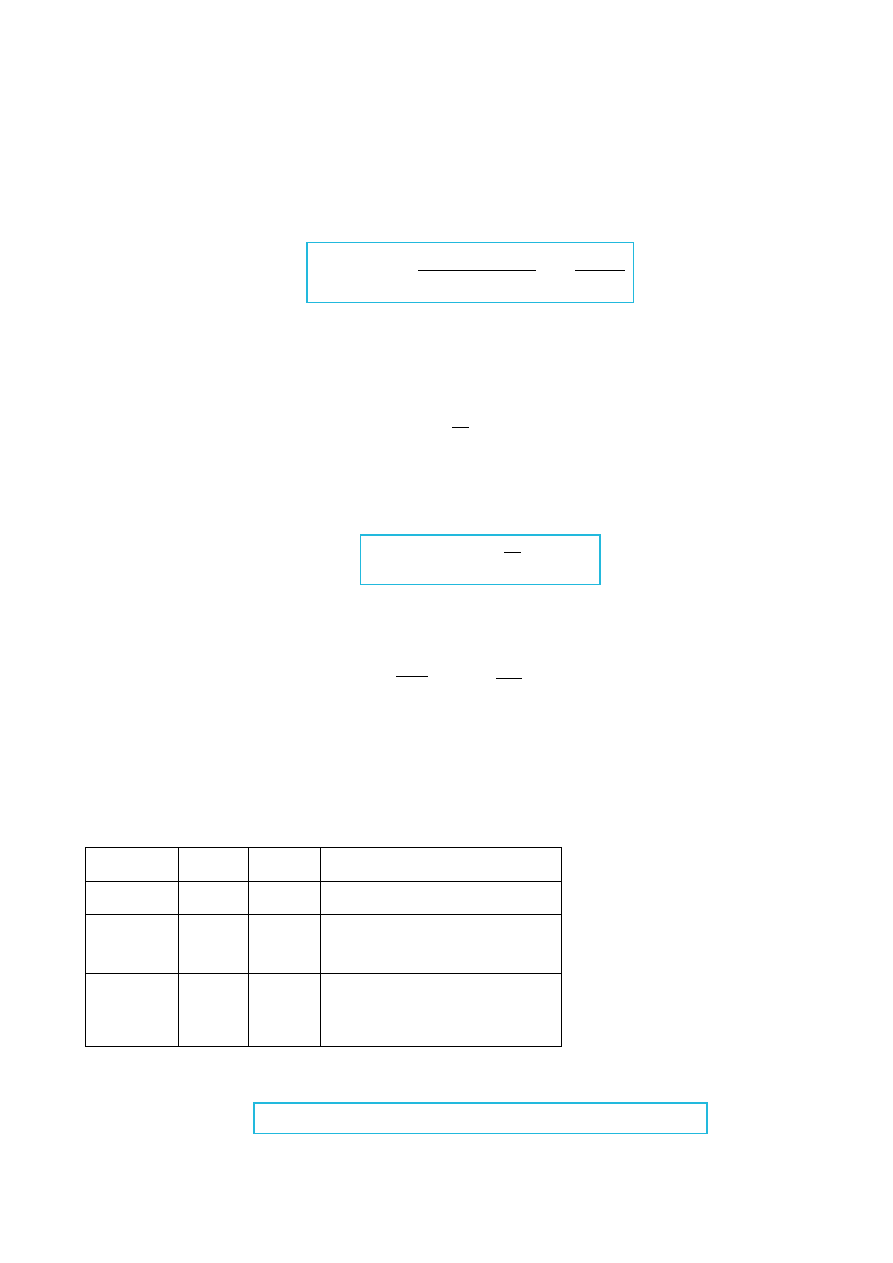
gdzie
L
n + 1
2l +1
x
jest wielomianem Lagguera.
x
=
2rZ
na
H
; a
H
=
ℏ
2
ne
2
Elektron
n
l
L
n +1
2l +1
x
1s
1
0
L
2
1
x =−1 !
na 1 orbicie
2s
2p
2
2
0
1
L
3
1
= 2x−4
L
3
3
= −3!
3s
3p
3d
3
3
3
0
1
2
L
4
1
= −3x
2
+ 18x
−18
24x
−96
−5 !
Tabela 1. Przykłady postaci wielomianu Laguerra dla kilku wartości n i l.
nlm
r , , = Y
lm
, R
nl
r =
m
lm
R
nl
r
(XI.1.18)
– 5 –
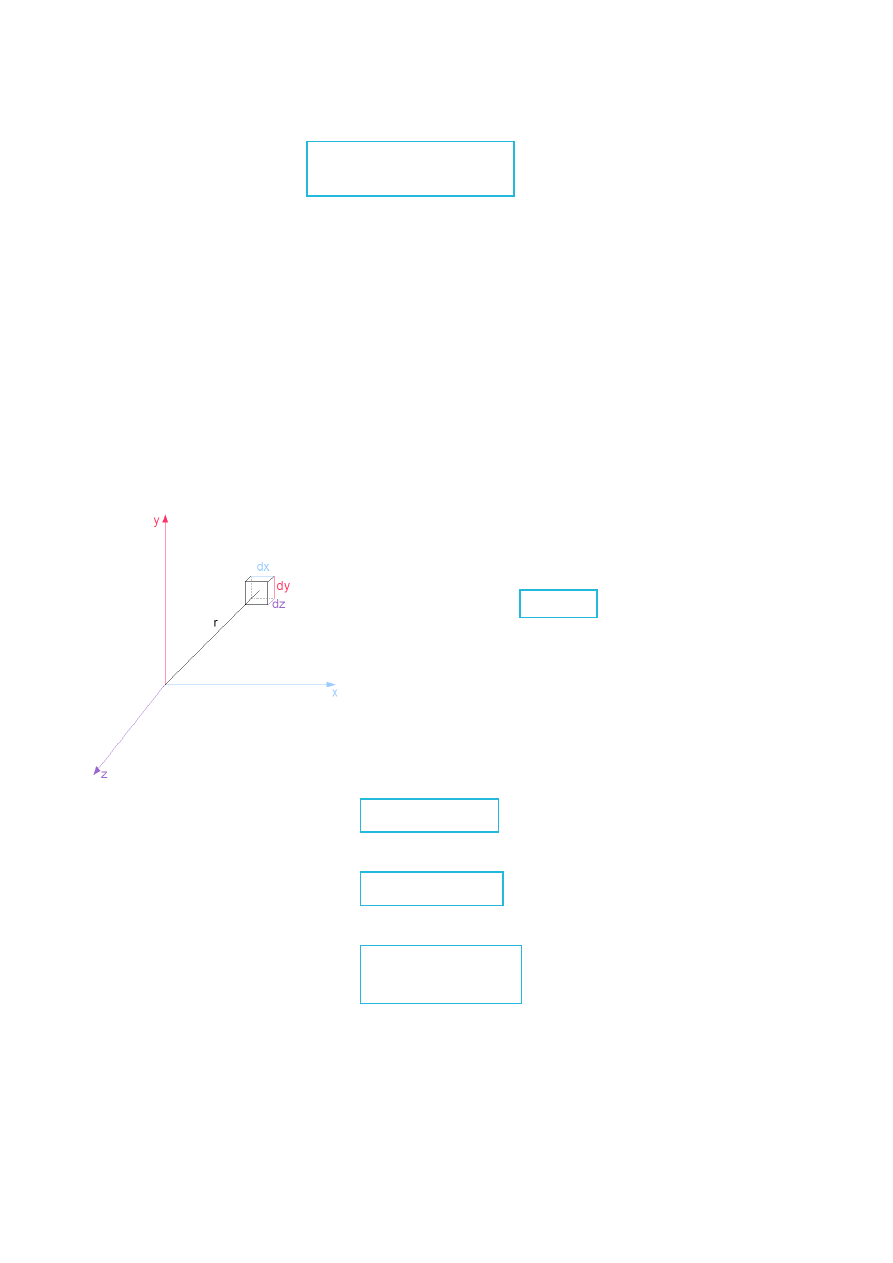
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
∀
n
E
n
∃
∑
l / 0
n
−1
2l +1 = n
2
funkcji własnych
(XI.1.19)
–
istnieje degeneracja stopnia n
2
.
Tylko elektronowi w stanie podstawowym (n = 1) odpowiada jedna funkcja własna – stan
elektronu jest niezdegenerowany. Na następnych orbitach stopień degeneracji rośnie.
Każdy stan atomu wodoropodobnego określony jest przez 3 wartości liczb całkowitych: n,
l, m.
XI.2. KWANTOWO – MECHANICZNY OBRAZ ATOMU (WG BORNA)
Prawdopodobieństwo znalezienia elektronu w objętości
dV:
* dV
(XI.2.1)
Przy czym funkcja
ψ
dana jest równaniem
(XI.1.18)
m
= Ae
i m
(XI.2.2)
m'
*
= Ae
- i m '
(XI.2.2a)
∫
0
2
m
m '
*
d
=
mm'
(XI.2.2b)
Z wyrażeń (XI.2.2b), (XI.2.2a) oraz (XI.2.2) otrzymujemy:
– 6 –
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
A
2
∫
0
2
e
i
m - m '
d
= A
2
Z warunku normalizacji:
A
=
1
2
(XI.2.3)
m
=
1
2
e
i m
(XI.2.3a)
lm
=
2l + 1l−|m |!
2
l + |m |!
sin
m
P
l
| m|
cos
(XI.2.4)
R
nl
r =
n−l−1!
[2n + 1!]
3
a
H
x
2+1
e
−x
2
L
n+ 1
2l+ 1
x
(XI.2.5)
Znormalizowana funkcja falowa atomu wodoropodobnego wyraża się wzorem:
r , , =
1
2
e
i m
⋅
2l + 1l−|m |!
2
l + |m|!
sin
m
P
l
| m|
cos ⋅
n−l−1!
[2 n +1!]
3
a
H
x
2 + 1
e
− x
2
L
n + 1
2l +1
x
Prawdopodobieństwo znalezienia elektronu w objętości dV:
* dV =
m
m
*
d
lm
lm
*
sin
d R
nl
R
nl
*
r
2
dr
(XI.2.6)
Gęstość prawdopodobieństwa:
* =
m
m
*
lm
lm
*
R
nl
R
nl
*
(XI.2.7)
A) Zależność
* od
m
m
*
=
1
2
=const
Prawdopodobieństwo wszędzie jest stałe – ma charakter izotropowy.
– 7 –
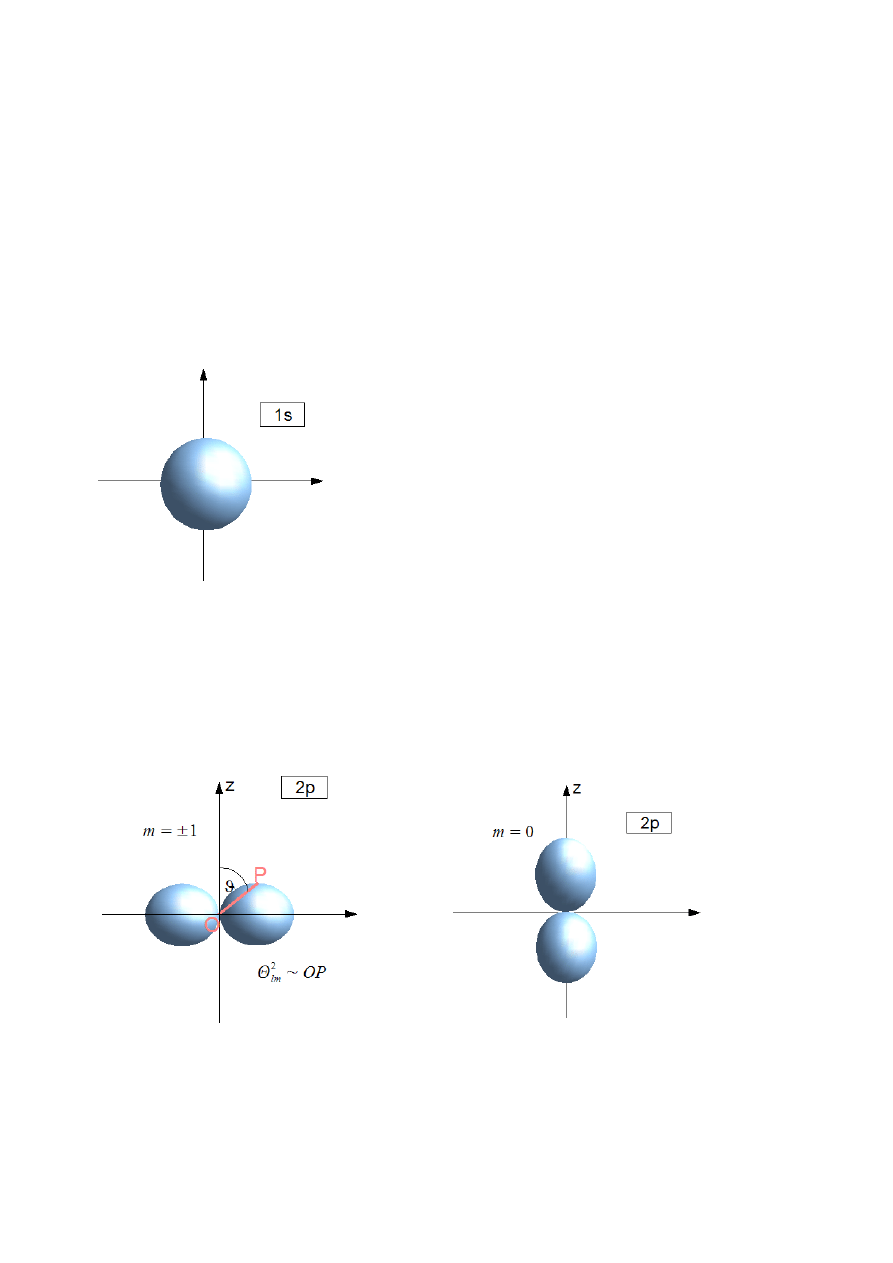
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
B) Zależność
* od
lm
lm
*
=
lm
*
Stan kwantowy dla danej trójki liczb kwantowych nazywa się orbitalem.
n
= 0 l = 0, m = 0
00
2
Rys.XI.2. Orbital typu s.
Orbital 1s – dla tych stanów rozkład gęstości jest sferycznie symetryczny.
n
= 1 l = 0, 1, m = −1, 0, 1
l = 1 – stan “p”
Rys.XI.2. Orbitale typu p.
OP – odcinek łączący początek układu z punktem P pod kątem
ϑ.
Rozkład gęstości jest typowo anizotropowy.
– 8 –
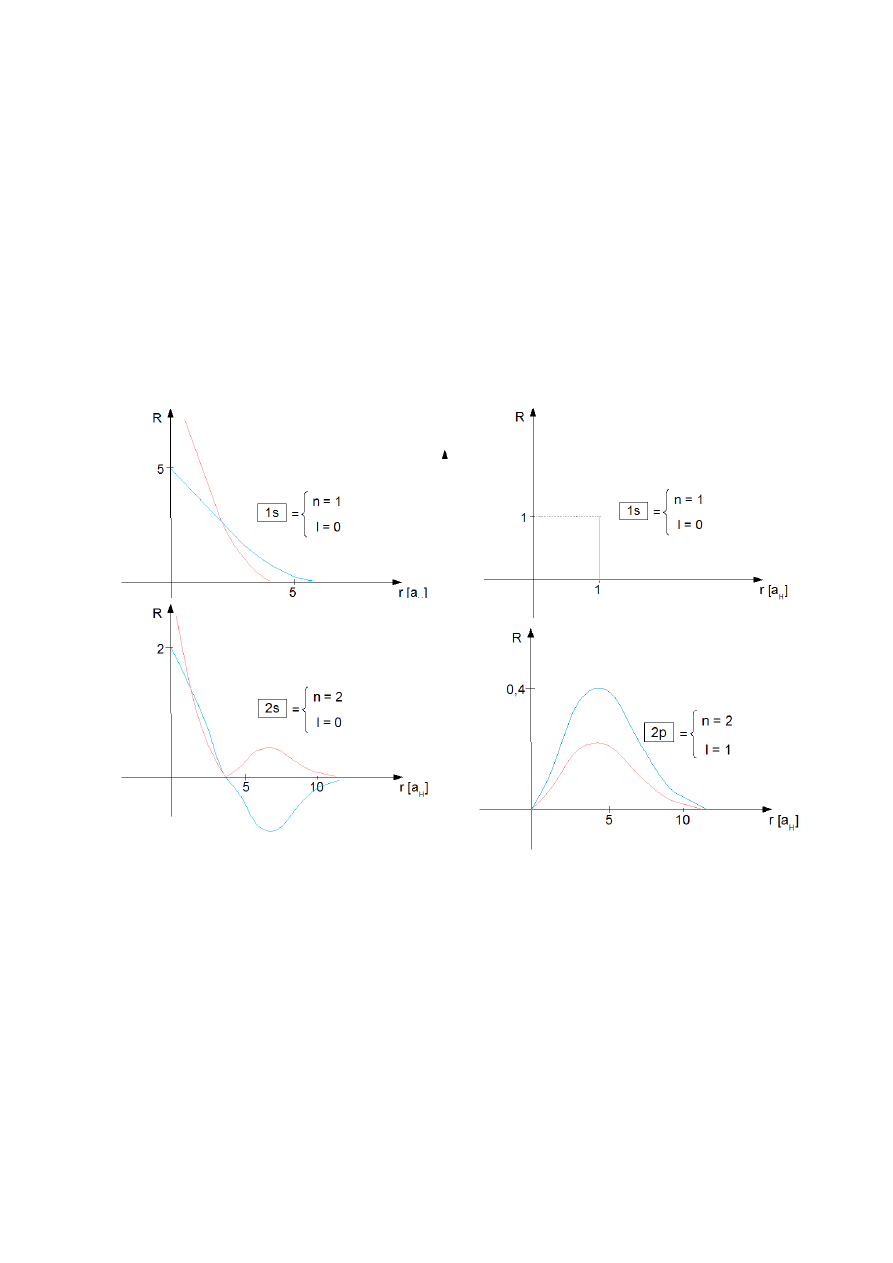
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
C) Zależność
r
:
r* r = R
nl
R *
nl
= R
nl
2
R
nl
– zależność samej funkcji falowej od r
R
nl
2
– gęstość prawdopodobieństwa
a)
b)
c)
d)
Rys.3. Zależność funkcji R od r. Czerwona linia – wykres gęstości prawdopodobieństwa, niebieska –
zależność funkcji falowej od r.
Mechanika kwantowa przewiduje możliwość penetracji jądra atomowego przez elektron –
pewne prawdopodobieństwo, że elektron znajduje się wewnątrz jądra.
Tylko elektrony typu s mają gęstość prawdopodobieństwa różną od zera w obszarze jądra
atomowego.
Funkcja falowa radialna stanu podstawowego (n = 1, l = 0, m = 0).
– 9 –
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
100
r = −
1
z
a
H
2
3
e
-
z
a
H
⋅r
(XI.2.8)
Indeks 100 oznacza trzy liczby kwantowe (n = 1, l = 0, m = 0)
100
100
*
=
100
2
r e
− Z
a
H
2r
(XI.2.9)
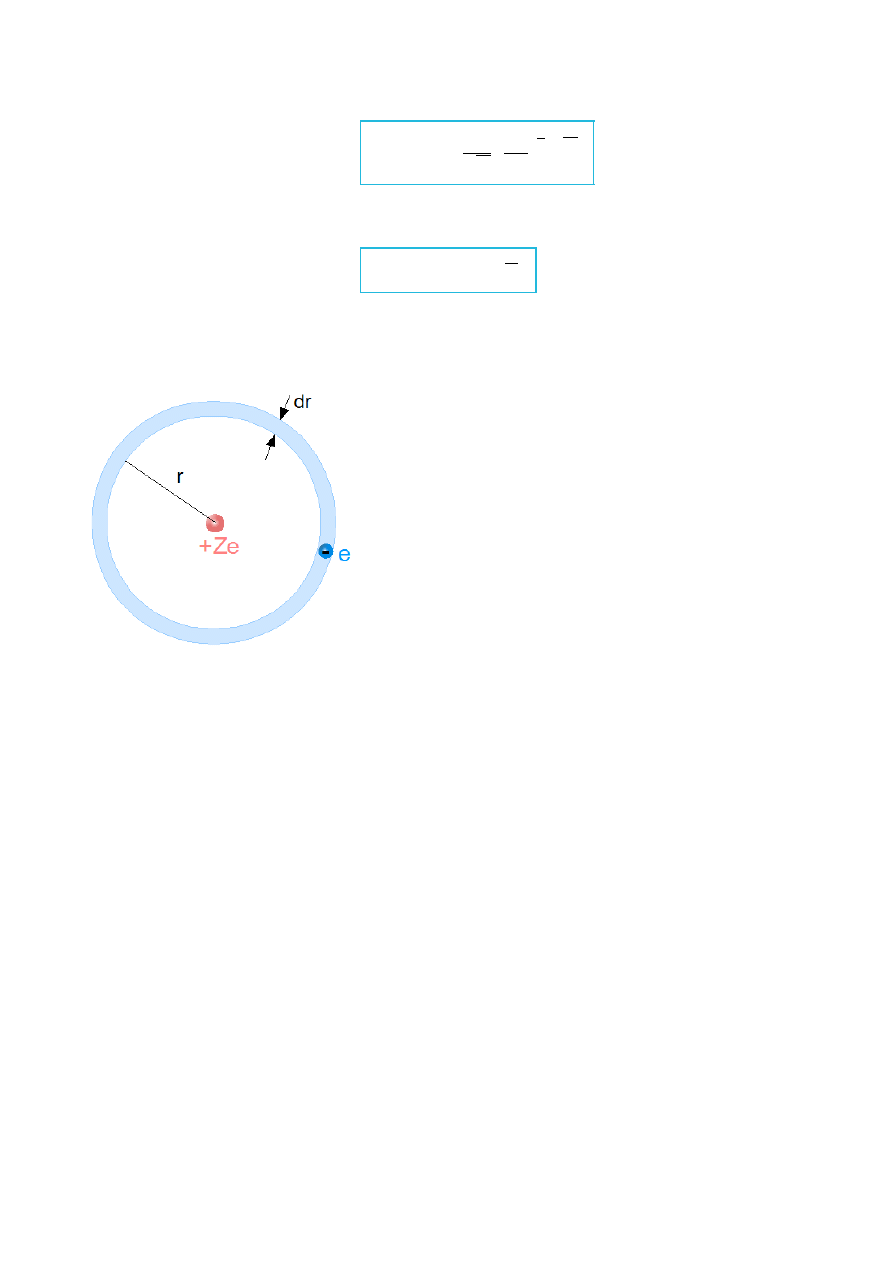
Inną wielkością, którą obrazuje się położenie elektronu w atomie jest częstość
przebywania elektronu w powłoce sferycznej o promieniu r i grubości dr (rys.XI.4):
= 4 r
2
dr R
2
rys.XI.4. Elektron w powłoce sferycznej.
Model orbitalny wprowadzony przez Bohra i Sommerfelda nie znajduje potwierdzenia w
fizyce kwantowej (kształty orbitali).
– 10 –
Wyszukiwarka
Podobne podstrony:
zarzadzanie portfelem inwestycyjnym j zarnowski ZPI dr J Zarnowski - mat obowiązkowy w zakresie str
12 Modele atomu
11 Modele chorob autoimmunizacyjnychid 12505 ppt
E2 11 modele zmiennych jakosciowych
rys, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 11 Poziomy energetyc
30, Modele budowy atomu
1 Budowa atomu model Bohra cw 11
Nr ćwiczenia 11, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 11 Pozio
Modele budowy atomu, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, Fizyka 2
poziomy energetyczne atomu wodoru, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Labo
aaa, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 11 Poziomy energetyc
30 Modele budowy atomu
11 Poziomy energetyczne atomu wodoru Sta�a Rydberga
modele budowy atomu(1)
więcej podobnych podstron