1
Ćwiczenie 2
Temat: Fizjologia bakterii
Demonstracja i omówienie:
1. Podłoża bakteriologiczne wykorzystywane w rutynowym badaniu mikrobiologicznym.
2. Posiew izolacyjny na podłoże stałe i posiew na podłoże płynne.
CZĘŚĆ PRAKTYCZNA
Zadanie 1.
Wykonanie posiewu izolacyjnego bakterii na podłożu stałym
Cel: Zapoznanie się z technikami izolacji drobnoustrojów w laboratoriach mikrobiologicznych
Wykonanie: w grupach 2-osobowych (dotyczy zadań 1A, 1B) i 6-osobowych (1C)
Posiew izolacyjny bakterii
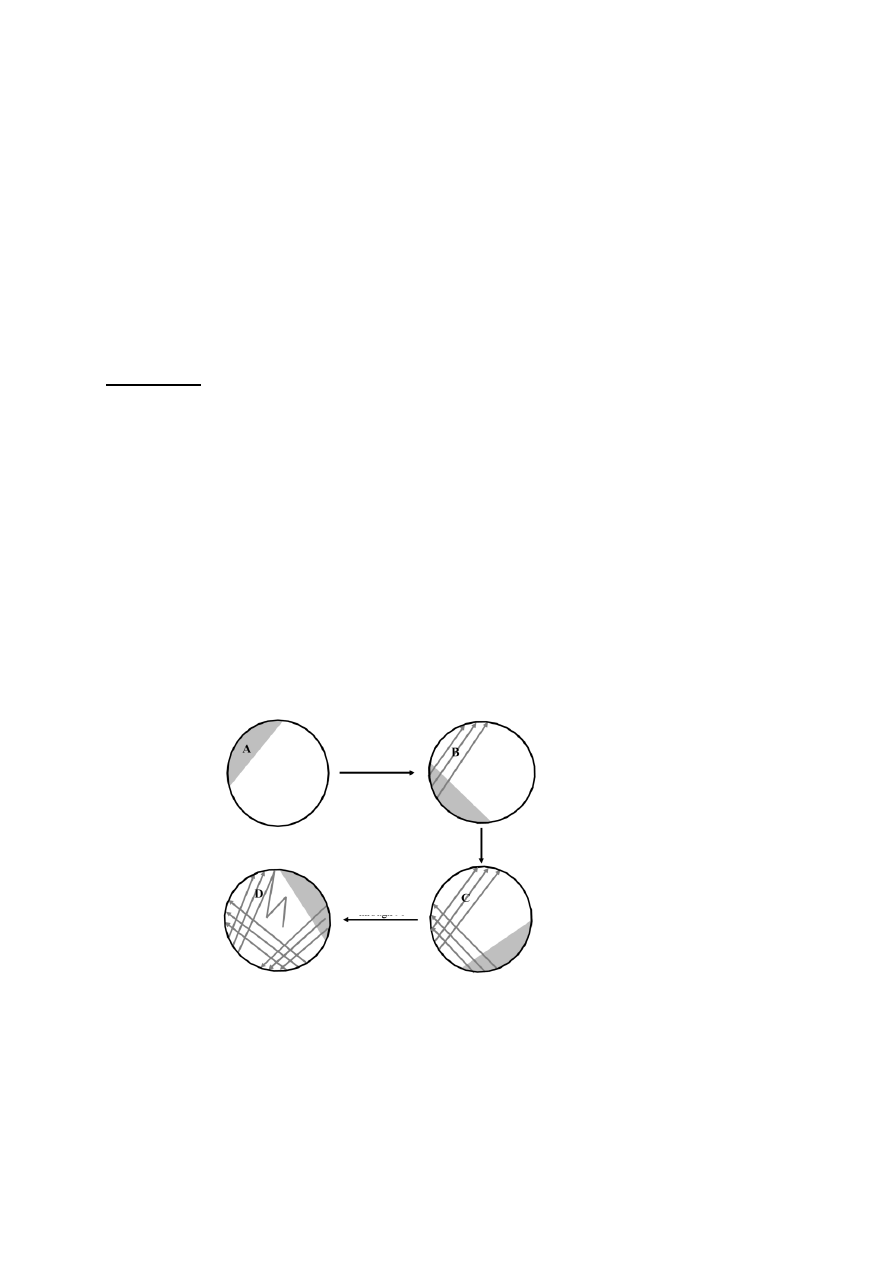
1) Pobrać jałową ezą bakterie (1 oczko ezy)
2) Nanosić bakterie na podłoże według załączonego schematu
Uwaga! W sektorach B, C i D wykonywać posiewy wyłącznie jałową, ostudzoną ezą!
3) Po wykonaniu zadania opalić ezę nad płomieniem palnika i odłożyć do statywu
Schemat:
Obróć płytkę o 90°
Obróć płytkę o 90°
Obróć płytkę o 90°
Opal ezę
Opal
ezę
2
1A. Cel: Badanie wymagań odżywczych bakterii
Wykonanie: w grupach 2-osobowych (każda grupa wykonuje posiew izolacyjny 1 hodowli
bakteryjnej)
Materiał:
24-48 godz. hodowle drobnoustrojów na podłożu krwawym (Streptococcus sp.,
Neisseriae sp., Staphylococcus sp., Corynebacterium sp., Escherichia sp., Bacillus sp.)
płytki z podłożem wzbogaconym (agar krwawy)
płytki z podłożem zwykłym (agar mięsny)
cieplarka na temp. 37°C
Badanie wymagań odżywczych bakterii
1) Wykonać posiew izolacyjny bakterii na podłoże zwykłe i podłoże wzbogacone
2) Płytki inkubować w cieplarce w 37°C przez 24-48 godzin
ODCZYTANIE WYNIKÓW NA NASTĘPNYCH ĆWICZENIACH!
3) Po inkubacji odczytać wynik:
porównać intensywność wzrostu bakterii na badanych podłożach
określić, która grupa drobnoustrojów ma większe wymagania odżywcze
Wyniki:
Tabela 1A
Bakterie
Wzrost
(- , +, ++, +++)
Interpretacja wyników
(drobnoustrój
wymagający/niewymagający)
podłoże
zwykłe
podłoże
wzbogacone
Streptococcus sp.
Neisseriae sp.
Staphylococcus sp.
Corynebacterium sp.
Escherichia sp.
Bacillus sp.
3
1B. Cel: Badanie wymagań tlenowych bakterii
Wykonanie: w grupach 2-osobowych (każda grupa otrzymuje 1 drobnoustrój)
Materiał:
24-48 godz. hodowle drobnoustrojów na agarze mięsnym: Pseudomonas sp., Escherichia
sp., Micrococcus sp., Serratia sp., Klebsiella sp., Enterococcus sp.
2 płytki z podłożem zwykłym (agar mięsny)
cieplarka na temp. 37°C
Badanie wymagań tlenowych bakterii
1) Wykonać posiew izolacyjny bakterii na 2 podłoża
2) Jedną płytkę inkubować w warunkach beztlenowych (anaerostat), drugą płytkę
inkubować w warunkach tlenowych.
3) Inkubować podłoża w 37°C przez 24-48 godzin
ODCZYTANIE WYNIKÓW NA NASTĘPNYCH ĆWICZENIACH!
4) Odczytać wynik po inkubacji i zapisać w tabeli 1B.
Wyniki:
Tabela 1B
Bakterie
Wzrost
(- , +)
Określić grupę
drobnoustrojów*
warunki
tlenowe
warunki
beztlenowe
Pseudomonas sp.
Escherichia sp.
Micrococcus sp.
Serratia sp.
Klebsiella sp.
Enterococcus sp.
*
bezwzględne tlenowce, bezwzględne beztlenowce, względne beztlenowce
4
1C. Cel: Różnicowanie i wstępna identyfikacja bakterii za pomocą podłoży wybiórczo-
różnicujących
Wykonanie: w grupach 6-osobowych (grupa wykonuje posiew 1 mieszaniny na 3 podłożach)
Materiał:
Mieszanina 2 rodzajów bakterii w fizjologicznym roztworze soli
Płytki z podłożem wzbogaconym (agar krwawy)
Płytki z podłożem wybiórczo-różnicującym (Mac Conkey’a)
Płytki z podłożem wybiórczo-różnicującym (Chapmana)
cieplarka na temp. 37°C
Różnicowanie i wstępna identyfikacja bakterii za pomocą podłoży
wybiórczo-różnicujących
1) Wykonać posiew izolacyjny mieszaniny bakteryjnej na podłoże wzbogacone
i 2 podłoża wybiórczo-różnicujące
2) Inkubować podłoża w 37°C przez 24-48 godzin
ODCZYTANIE WYNIKÓW NA NASTĘPNYCH ĆWICZENIACH!
3) Po inkubacji odczytać wynik i zapisać w tabeli 1C:
ocenić intensywność wzrostu każdego rodzaju bakterii na podłożu wzbogaconym
wykonać preparaty barwione metodą Grama: z obydwu rodzajów kolonii wyrosłych
na podłożu krwawym i z kolonii wyrosłych na podłożach wybiórczo-różnicujących
Wyniki:
Tabela 1C
Mieszanina
Podłoża / (wzrost: -, +, ++, +++)
Preparat Grama
Bakteria
Agar
krwawy
Mac
Conke’y*
Chapman’a**
Barwa
Kształt
A
1
2
B
1
2
*
barwa kolonii różowa lub barwa kolonii bez zmian
** barwa kolonii i podłoża żółta, podłoże bez zmian, z koloniami barwy białej
5
Zadanie 2
. Wykonanie posiewu bakterii na podłoże płynne
Cel: Zapoznanie się z technikami hodowli drobnoustrojów w laboratoriach mikrobiologicznych
Wykonanie: w grupach 2-osobowych (każda grupa posiewa 1 drobnoustrój na podłoże
płynne)
Materiał:
24-48 godz. hodowle drobnoustrojów (z zadania 1B)
podłoże płynne (bulion z glukozą)
cieplarka na temp. 37°C
Wykonanie posiewu bakterii na podłoże płynne
1) Pobrać jałową ezą bakterie (1oczko ezy)
2) Trzymając ezę w jednej ręce, drugą pobrać ze statywu probówkę z podłożem płynnym
3) Piątym palcem ręki w której trzymamy ezę, wyjąć korek z probówki
4) Delikatnie opalić wlot probówki nad płomieniem palnika
5) Wprowadzić bakterie do probówki z podłożem, delikatnie rozcierając zawartość ezy na
ściankach wnętrza probówki, tuż nad powierzchnią podłoża
6) Wymieszać podłoże, delikatnie opalić wlot probówki i po jej zamknięciu odstawić do
statywu
7) Ezę wyżarzyć nad płomieniem palnika i włożyć do statywu
8) Inkubować podłoże w 37°C przez 24-48 godzin
ODCZYTANIE WYNIKÓW NA NASTĘPNYCH ĆWICZENIACH!
9) Odczytać wynik i zapisać w tabeli 2.
Wyniki:
Tabela 2
Hodowla
Wzrost (+, -)
A
B
C
D
E
F

6
Zadanie 3.
Wykonanie preparatu mikroskopowego barwionego metodą Grama z hodowli na
podłożu stałym i obserwacja morfologii komórek
Cel: wstępna identyfikacja drobnoustroju
Wykonanie: w grupach 2-osobowych (każda grupa wykonuje 1 preparat)
Materiał:
24-48 godz. hodowle drobnoustrojów na podłożu krwawym (a-f): ziarniaki Gram (+); ziarniaki
Gram (-); pałeczki; maczugowce; laseczki; drożdżaki
odtłuszczone szkiełka podstawowe
jałowy roztwór fizjologiczny soli (0, 85% NaCl)
dermatograf (ołówek świecowy lub pisak wodoodporny)
zestaw barwników do barwienia metodą Grama
olejek immersyjny
mikroskop optyczny
Drobnoustroje, z których wykonujemy preparat mikroskopowy, pobieramy jałową ezą (drucik
z oczkiem wykonanym z platyny lub ze stopu platyno podobnego).
Jałowienie ezy przez wyżarzanie (opalenie) odbywa się przez włożenie drucika ezy do
wnętrza płomienia palnika na kilka sekund w celu doprowadzenia go do czerwoności, a
następnie chłodzenie (15-20 sekund). Czynności te wykonuje się przed i po każdym użyciu
ezy.
Przeniesienie hodowli z podłoża płynnego na szkiełko podstawowe obejmuje następujące
czynności:
włączyć palnik
wyjałowić ezę przez wyżarzenie, a następnie schłodzić
w drugiej ręce trzymać probówkę z hodowlą (wcześniej należy ją wymieszać)
piątym palcem ręki,w której trzymamy ezę, odciągnąć korek probówki
Nie należy kłaść korka na stole, ze względu na możliwość rozjałowienia!
opalić wylot probówki nad płomieniem palnika przez kilka sekund
ostrożnie pobrać hodowlę bakteryjną (oczko ezy)
opalić wylot probówki nad płomieniem przez kilka sekund
włożyć korek do probówki z hodowlą
odstawić probówkę z hodowlą do statywu
nanieść ezą pobraną hodowlę na szkiełko podstawowe

7
Wykonanie preparatu mikroskopowego barwionego metodą Grama
z hodowli polega na: - przygotowaniu rozmazu; - zabarwieniu rozmazu
Przygotowanie rozmazu z hodowli stałej
1) Umieścić na szkiełku podstawowym małą kroplę fizjologicznego roztworu soli (szkiełko
powinno być odtłuszczone)
2) Pobrać kolonie bakterii z podłoża za pomocą jałowej ezy i wykonać kolistymi ruchami rozmaz o
ø 10-20 mm (przy zbyt dużej ilości pobranych drobnoustrojów rozmaz jest za gruby; przy ich
zbyt małej liczbie - rozmaz jest za cienki)
3) Wysuszyć rozmaz w temperaturze pokojowej
4) Utrwalić rozmaz przez 3-krotne, wolne, przeprowadzenie szkiełka nad płomieniem palnika
Bezwzględnie unikać nadmiernego ogrzewania szkiełka!
5) Na odwrotnej stronie szkiełka, za pomocą dermatografu, oznaczyć miejsce naniesienia
drobnoustrojów (umożliwia wygodne określenie miejsca rozmazu) i zabarwić rozmaz.
Barwienie rozmazu metodą Grama
1) Położyć szkiełko z rozmazem na statywie nad zlewem
2) Nanieść na rozmaz kilka kropli barwnika - roztwór fioletu krystalicznego – tak, aby
oznaczony markerem obszar został w całości pokryty
Nie zalewać barwnikiem całego szkiełka – zbędne zużycie roztworu barwiącego!
3) Pozostawić barwnik na rozmazie przez 3 minuty
4) Usunąć barwnik do zlewu przechylając szkiełko w pozycję pionową
5) Spłukać delikatnie rozmaz cienkim strumieniem wody (z pojemnika oznaczonego H
2
O),
przechylając szkiełko w pozycję pionową i kierując strumień wody tuż nad rozmazem
Unikać spłukiwania wodą bezpośrednio miejsca naniesienia rozmazu, gdyż grozi to
wypłukaniem naniesionych drobnoustrojów!
6) Nanieść na rozmaz kilka kropli odczynnika - płyn Lugola – tak, aby oznaczony markerem
obszar został w całości pokryty
7) Pozostawić odczynnik na rozmazie przez 1 minutę
8) Usunąć odczynnik do zlewu przechylając szkiełko w pozycję pionową
9) Spłukać delikatnie rozmaz cienkim strumieniem wody (pojemnik oznaczony H
2
O),
przechylając szkiełko w pozycję pionową i kierując strumień wody tuż nad rozmazem
Unikać spłukiwania wodą bezpośrednio miejsca naniesienia rozmazu, gdyż grozi to
wypłukaniem naniesionych drobnoustrojów!
8
10) Nanieść na rozmaz kilka kropli odczynnika – alkohol - tak, aby oznaczony markerem
obszar został w całości pokryty
11) Pozostawić odczynnik na 30 sekund
12) Usunąć odczynnik do zlewu przechylając szkiełko w pozycję pionową
13) Spłukać delikatnie rozmaz cienkim strumieniem wody, przechylając szkiełko w pozycję
pionową i kierując strumień wody tuż nad rozmazem
Unikać spłukiwania wodą bezpośrednio miejsca naniesienia rozmazu, gdyż grozi to
wypłukaniem naniesionych drobnoustrojów!
14) Nanieść na rozmaz kilka kropli barwnika - fuksyna – tak, aby oznaczony markerem
obszar został w całości pokryty
15) Pozostawić barwnik na rozmazie przez 30 sekund
16) Usunąć barwnik do zlewu przechylając szkiełko w pozycję pionową
17) Spłukać delikatnie rozmaz cienkim strumieniem wody, przechylając szkiełko w pozycję
pionową i kierując strumień wody tuż nad rozmazem
18) Suszyć preparat w temperaturze pokojowej umieszczając szkiełko na bibule i opierając o
statyw w pozycji pionowej
19) Oglądać preparat w mikroskopie optycznym (obiektyw 100x), z użyciem olejku
immersyjnego.
Wyniki: zapisać w tabeli 3.
Tabela 3
Hodowla
Kształt
komórki
Barwliwość
Układ
Drobnoustrój
(wstępna identyfikacja)
A
B
C
D
E
F
Kształt: kulisty, cylindryczny, spiralny
Barwliwość w metodzie Grama: fioletowe komórki – Gram (+); różowe komórki – Gram (-)
Układ: dwoinki, pakiety, paciorki, grona, układ pisma klinowego
Drobnoustrój: ziarniaki Gram (+); ziarniaki Gram (-); pałeczki, maczugowce, laseczki; drożdżaki
Opis preparatu
W preparacie z hodowli …………. wykryto …………………………………………………………….

9
Zadanie 4.
Wykonanie preparatu mikroskopowego barwionego metodą Grama z hodowli na podłożu
płynnym i obserwacja morfologii komórek
Cel: wstępna identyfikacja drobnoustroju
Wykonanie: w grupach 2-osobowych (każda grupa wykonuje 1 preparat)
Materiał:
24 godz. hodowle drobnoustrojów na podłożu płynnym: ziarniaki Gram (+);
ziarniaki Gram (-); pałeczki; maczugowce; laseczki; drożdżaki
odtłuszczone szkiełka podstawowe
dermatograf (ołówek świecowy lub pisak wodoodporny)
zestaw barwników do barwienia metodą Grama
olejek immersyjny
mikroskop optyczny
Wykonanie preparatu mikroskopowego barwionego metodą Grama polega na
przygotowaniu rozmazu oraz jego zabarwieniu
Przygotowanie rozmazu z hodowli płynnej
1) Wymieszać hodowlę płynną przez kilka sekund
2) Pobrać 1-2 oczka płynnej hodowli drobnoustroju za pomocą jałowej ezy i umieścić na
szkiełku podstawowym wykonując kolistymi ruchami rozmaz o ø 10-20 mm
3) Rozmaz wysuszyć w temperaturze pokojowej
4) Utrwalić rozmaz przez 3-krotne, wolne przeprowadzenie szkiełka nad płomieniem palnika
Bezwzględnie unikać nadmiernego ogrzewania szkiełka!
5) Na odwrotnej stronie szkiełka oznaczyć miejsce naniesienia drobnoustrojów za pomocą
dermatografu (umożliwia wygodne określenie miejsca rozmazu) i zabarwić rozmaz.
Barwienie rozmazu metodą Grama – patrz: Zadanie 3
10
Wyniki: zapisać w tabeli 3.
Tabela 4
Hodowla
Kształt
komórki
Barwliwość
Układ
Drobnoustrój
(wstępna identyfikacja)
a
b
c
d
e
f
Kształt - kulisty, cylindryczny, spiralny
Barwliwość w metodzie Grama - fioletowe komórki – Gram (+); różowe komórki – Gram (-)
Układ - dwoinki, pakiety, paciorki, grona, układ pisma chińskiego
Drobnoustrój - ziarniaki Gram (+); ziarniaki Gram (-); pałeczki, maczugowce, laseczki; drożdżaki
Opis preparatu
W preparacie z hodowli …. …………… wykryto ……………………………………………………..
Wyszukiwarka
Podobne podstrony:
sciaga1-mikroby (podloza, farma 2 rok, mikrobiologia, fizjologia bakterii
Fizjologia bakterii ćwicz3
Podstawy morfologii i fizjologii bakterii Chorobotworczosc i systematyka bakterii Gram dodatnich
Fotosynteza bakteryjna, Fizjologia roślin
Probiotyki i fizjologiczna flora bakteryjna
Fizjologia i morfologia komórki bakteryjnej – przypomnienie materiału
FIZJOLOGICZNA FLORA BAKTERYJNA SKÓRY
DIAGNOSTYKA FIZJOLOGICZNA I 1
Ciąża fizjologiczna
Bakterie spiralne do druk
Aspekty fizjologiczne urazów 6
choroby wirus i bakter ukł odd Bo
fizjologia układu krążenia
11 U Fizjologia wysilkuid 12643 ppt
Ginekologia fizjologia kobiety i wczesnej ciÄ…ĹĽy I
więcej podobnych podstron