2012-02-24
1
Wykład 2
Stężenia. Reakcje w roztworach.
1
CHEMIA FIZYCZNA
Szkoła Główna Gospodarstwa Wiejskiego
Wydział Nauk o Żywności
Wykład 1.
Podstawy termodynamiki
dr inż. Bożena Parczewska-Plesnar
Katedra Chemii
WNoŻ, bud. 32, p. 2035
E-mail: bparczewska@wp.pl
Cel przedmiotu:
Opanowanie podstawowych metod eksperymentalnej chemii
fizycznej z opracowywaniem i interpretacją wyników pomiarów,
stosowaniem i właściwym przeliczaniem jednostek układu
Poznanie podstawowych teorii opisu zjawisk i właściwości
fizykochemicznych (w szczególności wybranych zagadnień
termodynamiki).
Pogłębienie wiadomości związanych ze strukturą materii,
właściwościami różnych stanów skupienia, równowag fazowych,
właściwości układów koloidowych.
Poznanie wybranych metod analizy instrumentalnej
(elektrochemicznych, optycznych i spektrofotometrycznych).
Wykład 1
Podstawy termodynamiki
2

2012-02-24
2
Wykład 1
Podstawy termodynamiki
3
Realizacja programu:
wykład: 7 x 2 godz.+1godz. = 15 godzin
ćwiczenia laboratoryjne: 5 x 3 godziny = 15 godzin.
Konsultacje:
Środa, pok. 2035 – godz. 13.15-15.00.
Podręcznik:
Bryłka J., Więckowska-Bryłka E., Stępniak S., Bortnowska-Bareła:
Eksperymentalna chemia fizyczna, Wyd. SGGW, Warszawa
2007, wyd. III zmienione.
Wykład 1
Podstawy termodynamiki
4
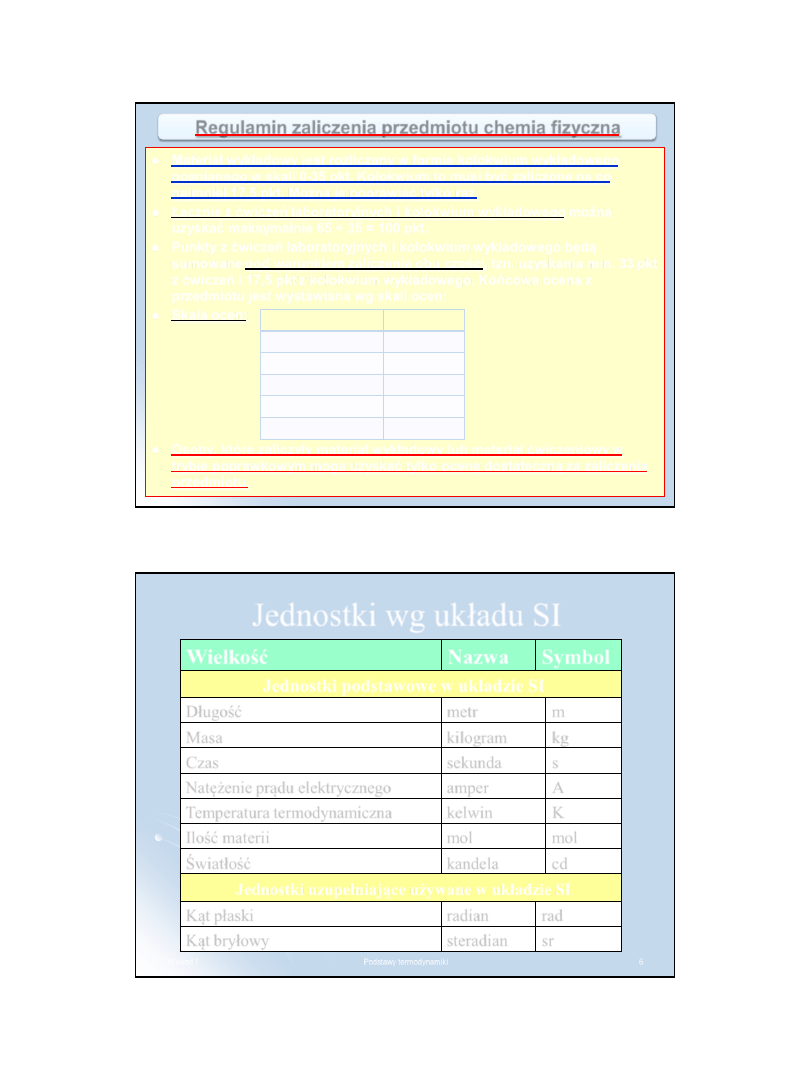
Regulamin zaliczenia przedmiotu chemia fizyczna
Zajęcia laboratoryjne - ćwiczenia w zespołach 2– lub 3– osobowych
zgodnie z harmonogramem.
Obowiązkowe są fartuchy laboratoryjne.
Każdy zespół ćwiczeniowy wykonuje 5 ćwiczeń. Na początku każdych zajęć
studenci piszą kolokwium złożone z 2 pytań. Co najmniej jedno z pytań jest
zawsze zadaniem. Każde pytanie oceniane jest w skali 0–5 punktów.
Z każdego ćwiczenia studenci przygotowują pisemne sprawozdanie w
formacie A4 (jedno na zespół) zawierające wszystkie wyniki pomiarów i
opracowanie tych wyników zgodne z opisem w podręczniku.
Liczba punktów z ćwiczeń laboratoryjnych jest sumą punktów uzyskanych
z:
5 kolokwiów (5 x 2 pytania x 5 punktów = 50 punktów) i 5 pisemnych
sprawozdań (5 x 3 punkty = 15 punktów) i wynosi maksymalnie 65 punktów.
Warunkiem koniecznym do zaliczenia ćwiczeń laboratoryjnych jest
wykonanie wszystkich pięciu ćwiczeń praktycznych (ewentualną
nieobecność trzeba odrobić) i uzyskanie minimum 51% czyli 33 pkt.
Studenci, którzy nie uzyskają 33 pkt, a mają wykonane i zaliczone wszystkie
ćwiczenia praktyczne, mogą pisać kolokwium wyjściowe z całości materiału
ćwiczeniowego po zakończeniu ćwiczeń. Kolokwium wyjściowe można
poprawiać tylko raz.
Zaliczenie przedmiotu wymaga uzyskania zaliczenia zarówno z
materiału wykładowego jak i zaliczenia ćwiczeń laboratoryjnych.
2012-02-24
3
Wykład 1
Podstawy termodynamiki
5
Materiał wykładowy jest rozliczany w formie kolokwium wykładowego
ocenianego w skali 0-
35 pkt. Kolokwium to musi być zaliczone na co
najmniej 17,5 pkt. Można je poprawiać tylko raz.
Łącznie z ćwiczeń laboratoryjnych i kolokwium wykładowego można
uzyskać maksymalnie 65 + 35 = 100 pkt.
Punkty z ćwiczeń laboratoryjnych i kolokwium wykładowego będą
sumowane
pod warunkiem zaliczenia obu części, tzn. uzyskania min. 33 pkt
z ćwiczeń i 17,5 pkt z kolokwium wykładowego. Końcowa ocena z
przedmiotu jest wystawiana wg skali ocen:
Skala ocen:
Osoby, które zaliczyły materiał wykładowy lub materiał ćwiczeniowy w
trybie poprawkowym mogą uzyskać tylko ocenę dostateczną za zaliczenie
przedmiotu.
Liczba punktów
Ocena
50,5
– 60 pkt
dst
60,5
– 70 pkt
dst plus
70,5
– 80 pkt
db
80,5
– 90 pkt
db plus
90,5
– 100 pkt
bdb
Regulamin zaliczenia przedmiotu chemia fizyczna
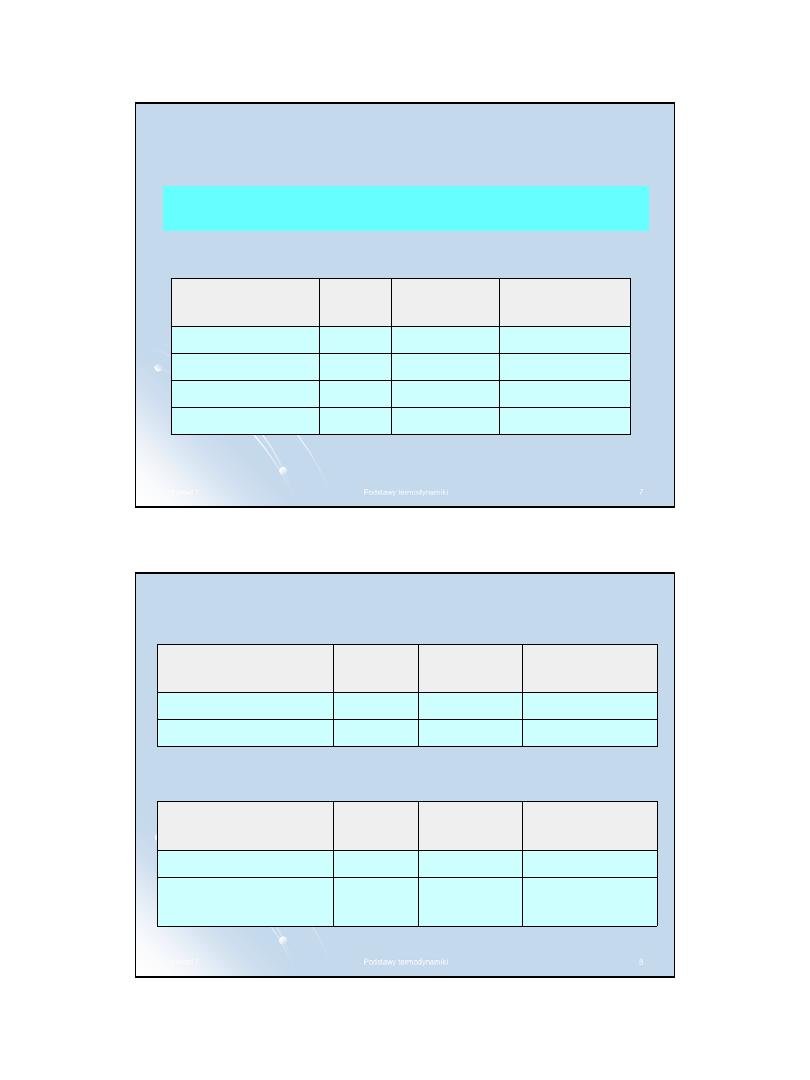
Jednostki wg układu SI
Wykład 1
Podstawy termodynamiki
6
Wielkość
Nazwa
Symbol
Jednostki podstawowe w układzie SI
Długość
metr
m
Masa
kilogram
kg
Czas
sekunda
s
Natężenie prądu elektrycznego
amper
A
Temperatura termodynamiczna
kelwin
K
Ilość materii
mol
mol
Światłość
kandela
cd
Jednostki uzupełniające używane w układzie SI
Kąt płaski
radian
rad
Kąt bryłowy
steradian
sr
2012-02-24
4
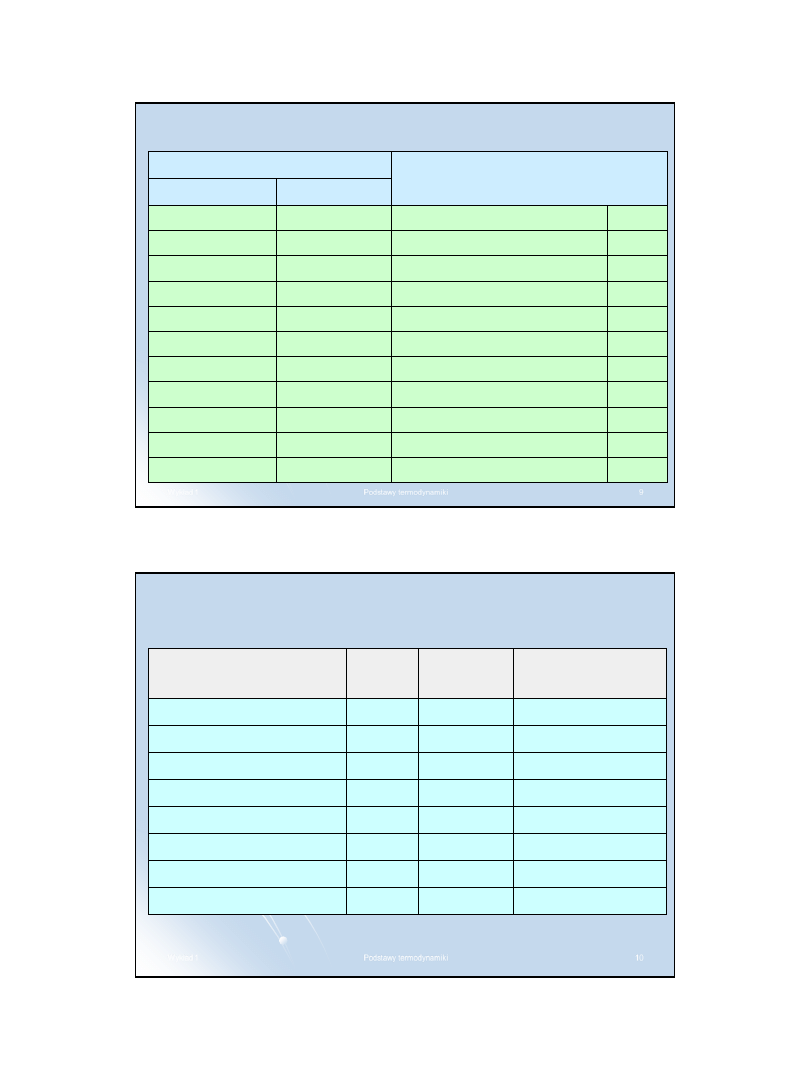
Jednostki pochodne układu SI
Jednostki pochodne - jednostki które można wyrazić
poprzez jednostki podstawowe i uzupełniające.
Wykład 1
Podstawy termodynamiki
7
Mechanika
wielkość
nazwa
oznaczenie
w jednostkach
podstawowych
siła
niuton
N
kg·m·s
-2
ciśnienie
paskal
Pa
kg·m
-1
·s
-2
energia, praca
dżul
J
kg·m
2
·s
-2
moc
wat
W
kg·m
2
·s
-3
Wykład 1
Podstawy termodynamiki
8
Optyka
wielkość
nazwa
oznaczenie
w jednostkach
podstawowych
strumień świetlny
lumen
lm
cd·sr
natężenie oświetlenia luks
lx
cd·sr·m
-2
Atomistyka
wielkość
nazwa
oznaczenie
w jednostkach
podstawowych
dawka pochłonięta
grej
Gy
m
2
·s
-2
aktywność ciała
promieniotwórczego
bekerel
Bq
s
-1
2012-02-24
5
Wykład 1
Podstawy termodynamiki
9
Jednostki wielokrotne i podwielokrotne
Przedrostki
Mnożnik
nazwy
oznaczenia
giga
G
1.000.000.000 =
10
9
mega
M
1.000.000 =
10
6
kilo
k
1.000 =
10
3
hekto
h
100 =
10
2
deka
da
10 =
10
1
decy
d
0,1 =
l0
-1
centy
c
0,01 =
10
-2
mili
m
0,001 =
10
-3
mikro
µ
0,000.001 =
10
-6
nano
n
0,000.000.001 =
10
-9
piko
p
0,000.000.000.001 =
10
-12
Wykład 1
Podstawy termodynamiki
10
Elektromagnetyzm
wielkość
nazwa oznaczenie
w jednostkach
podstawowych
ładunek elektryczny
kulomb
C
A·s
napięcie elektryczne
wolt
V
kg·m
2
·s
-3
·A
-1
pojemność elektryczna
farad
F
kg
-1
·m
-2
·s
4
·A
2
rezystancja
om
Ω
kg·m
2
·s
-3
·A
-2
przewodność elektryczna simens
S
kg
-1
·m
-2
·s
3
·A
2
strumień magnetyczny
weber
Wb
kg·m
2
·s
-2
·A
-1
indukcja magnetyczna
tesla
T
kg·s
-2
·A
-1
indukcyjność
henr
H
kg·m
2
·s
-2
·A
-2

2012-02-24
6
Wykład 1
Podstawy termodynamiki
11
• Jednostką podstawową długości jest metr [m].
Jednostką wielokrotną jest kilometr:
1 kilometr = 1 km = 1000 m = 10
3
m.
Jednostkami podwielokrotnymi są:
1 decymetr = 1 dm = 10
–1
m,
1 centymetr = 1 cm = 10
–2
m,
1 milimetr = 1 mm = 10
–3
m.
Długości fal promieniowania elektromagnetycznego oraz
wymiarów atomów i cząsteczek podaje się często w takich
jednostkach jak:
1 mikrometr = 1 µm = 10
–6
m,
1 nanometr = 1 nm = 10
–9
m,
oraz stosując jednostki nielegalne:
1 mikron = 1 µm = 10
–6
m
1 angstrem = 1Å = 10
–8
cm = 10
–10
m.
Przykłady:
Wykład 1
Podstawy termodynamiki
12
Zadanie1.
Wyraź 25 dm w:
a) metrach, b) centymetrach, c) milimetrach.
Rozwiązanie:
a) Ponieważ 1 dm = 10
–1
m
stąd: 25 dm = 25
·
1 dm = 25 ·10
–1
m = 2,5 m
b) Ponieważ 1 cm = 10
–2
m 1 m = 10
2
cm, a
1 dm = 10
–1
m = 10
-1
·
10
2
cm = 10
1
cm = 10 cm,
stąd: 25 dm = 25 · 10 cm= 250 cm
c) Ponieważ 1 mm = 10
–3
m
1 m = 10
3
mm, a
1 dm = 10
–1
m = 10
-1
·
10
3
mm = 10
2
mm,
stąd: 25 dm = 25 · 10
2
mm= 2500 mm

2012-02-24
7
Wykład 1
Podstawy termodynamiki
13
Zadanie2.
Wyraź objętość:
a) 30 dm
3
w m
3
,
b) 1500 cm
3
w m
3
i dm
3
.
Rozwiązanie:
a)
1 dm
3
= (1 dm)
3
=(10
–1
m)
3
= 10
-3
m
3
30 dm
3
= 30·10
–3
m
3
= 3,0·10
–2
m
3
b)
1 cm
3
= (1 cm)
3
= (10
-2
m)
6
= 10
–6
m
3
1500 cm
3
= 1500 ·10
–6
m
3
= 1,5·10
3
·
10
–6
m
3
=1,5
·
10
–3
m
3
1 cm
3
= (10
–1
dm)
3
= 10
–3
dm
3
1500 cm
3
= 1500 ·10
–3
dm
3
= 1,5·10
3
·10
–3
dm
3
= 1,5 dm
3
Opracowywanie i prezentacja wyników pomiarów
Sporządzając wykres ręcznie (na papierze
milimetrowym) dbamy o jak największą
dokładność właściwie dobierając skale na
osiach X i Y.
Wykreślając prostą lub krzywą
prezentującą wyznaczaną zależność, nigdy
nie rysujemy łamanej łączącej punkty
pomiarowe, tylko prostą lub gładką krzywą
najlepiej opisującą te punkty.
Korzystając z programu komputerowego
wykreślamy oprócz punktów pomiarowych
także linię trendu i polecamy wydruk jej
równania .
Wykład 1
Podstawy termodynamiki
14
Wyniki pomiarów powinny być zestawiane w formie odpowiednich tabel, a
ponadto obrazowane na wykresach (ręcznie lub za pomocą programów
komputerowych).
Należy stosować się do następujących zasad:
Obliczenia przeprowadzamy z największą dokładnością na jaką pozwalają
dane.
Nie wykonujemy zaokrągleń dopóki nie uzyskamy ostatecznego wyniku.
Właściwie określamy zmienną niezależną i zależną [y=f(x), x-zmienna
niezależna, y-zmienną zależna; to y zależy od x, a nie odwrotnie.

2012-02-24
8
Opracowywanie i prezentacja wyników pomiarów c.d.
Wykład 1
Podstawy termodynamiki
15
Szczególnie użyteczne są wykresy liniowe.
Linia prosta jest wykresem funkcji liniowej y (stąd jej nazwa) pewnego
argumentu x, którą można zapisać w postaci:
y = Ax + B
gdzie A i B są stałymi.
Określenie funkcji sprowadza się do określenia stałych A i B. Jeżeli znamy
pewne pary wartości x i y (są to wyniki pomiarów), to na ich podstawie
wykonujemy wykres, który następnie stanowi przedmiot opracowania.
Zaczynamy od tworzenia skali. Na osi poziomej (osi X) określamy skalę
zmiennej niezależnej (argumentu funkcji), na osi pionowej (Y) skalę
wartości funkcji.
Skale powinny być tak dobrane, aby obejmowały pełen zakres zmierzonych
wartości. Osie muszą być opisane przez podanie wielkości i jednostek.
Określamy wartości znaczników osi (uwaga: nie określamy na osiach
współrzędnych punktów pomiarowych, a jedynie definiujemy znaczniki).
Opracowywanie i prezentacja wyników pomiarów c.d.
Wykład 1
Podstawy termodynamiki
16
Mając tak przygotowaną powierzchnię w odpowiednich miejscach
wyraźnie zaznaczamy punkty pomiarowe. Następnie – o ile to możliwe –
rysujemy linię prostą w taki sposób, aby przechodziła ona pomiędzy
wszystkimi punktami pomiarowymi i zarazem tak, aby wszystkie punkty
były od tej prostej mniej więcej jednakowo i możliwie jak najmniej
oddalone.
Wyznaczenie funkcji wymaga określenia współczynników A i B prostej.
Współczynnik B możemy odczytać bezpośrednio z wykresu określając
wartość funkcji y dla argumentu x = 0. Czasem współczynnik B przyjmuje
wartość 0.
Na ogół bardziej interesujący jest współczynnik A, gdyż zawiera on w sobie
poszukiwaną wielkość. Parametr ten, zwany jest współczynnikiem
kierunkowym lub nachyleniem prostej.
2012-02-24
9
Opracowywanie i prezentacja wyników pomiarów c.d.
Wykład 1
Podstawy termodynamiki
17
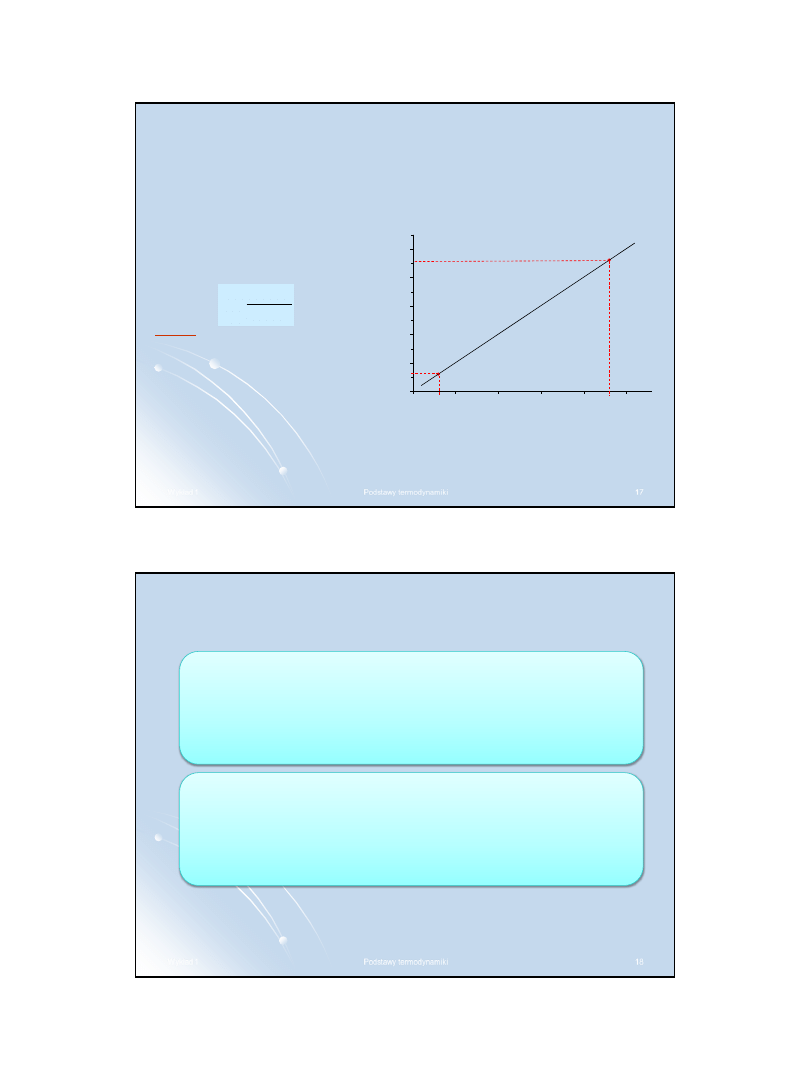
Aby określić współczynnik A obieramy dwa dowolne (nie całkiem) punkty
P
1
i P
2
leżące na prostej (najlepiej aby jeden był z początku, a drugi z końca
badanego przedziału) i określamy współrzędne (x
1
, y
1
) oraz (x
2
, y
2
) tych
punktów
Ponieważ dla każdej pary współrzędnych jest spełnione równanie prostej,
czyli:
y
1
= Ax
1
+ B
y
2
= Ax
2
+ B
stąd otrzymujemy:
Uwagi:
P
1
i P
2
są dowolnymi punktami
leżącymi na wykreślonej linii. W
żadnym wypadku nie mogą to być
punkty pomiarowe znajdujące się
obok wykreślonej prostej.
1
2
1
2
x
x
y
y
A
0
20
40
60
80
100
0
5
10
15
20
25
X
Y
P
1
P
2
x
1
x
2
y
2
y
1
Współczynnik kierunkowy A nie jest tangensem kąta i nie może być tak
nazywany. Tangens jest funkcją, której wartościami są bezwymiarowe liczby
rzeczywiste. Współczynnik kierunkowy z reguły ma określony wymiar
(jednostkę) i ma też określony sens fizyczny.
Wykład 1
Podstawy termodynamiki
18
Chemia fizyczna pozostaje w takiej relacji do
innych działów chemii jak filozofia do
wszystkich nauk.
Jej podstawowym celem jest powiązanie
różnych działów chemii; zatem może być
nazywana „filozofią chemii” (S.L. Bigelow,
1912)
2012-02-24
10
Wykład 1
Podstawy termodynamiki
19
Termodynamika
Termodynamika chemiczna zajmuje się
badaniem wymiany energii między układem a
otoczeniem podczas przemian
fizykochemicznych, przewidywaniem możliwości
samorzutnego przebiegu dowolnych przemian i
opisem układów, które w wyniku takich przemian
osiągnęły stan równowagi termodynamicznej.
Jest dziedziną nauki posługującą się opisem
makroskopowym, tzn. stosuje wielkości
makroskopowe (dające się zdefiniować bez
wprowadzania pojęcia atomu i cząsteczki), takie
jak temperatura, ciśnienie, skład chemiczny itp.
Otaczający nas Wszechświat zbudowany jest z
nieskończonej praktycznie liczby substancji.
Poszczególnym badaniom poddajemy tylko małą
jego część. Obiektem zainteresowań
termodynamiki jest układ.
Wykład 1
Podstawy termodynamiki
20
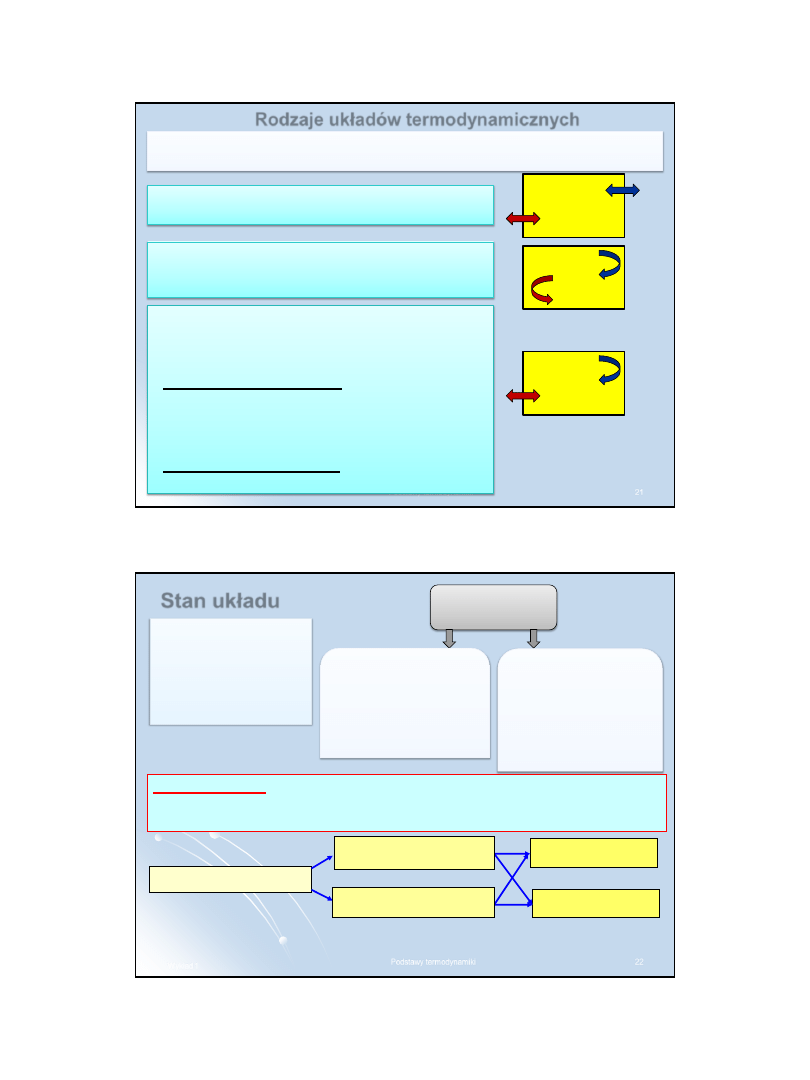
Układ termodynamiczny
Układem
nazywamy substancję lub zespół substancji poddanych
konkretnej obserwacji.
To, co znajduje się poza układem, nazywamy jego
otoczeniem
. Układ
może być oddzielony od otoczenia wyraźną granicą (np. ściankami
naczynia) lub granicą umowną.
Wiele układów jest tak zbudowanych, że można odróżnić
poszczególne ich części, zwane
fazami układu
. Fazą nazywamy część
układu oddzieloną wyraźną granicą - powierzchnią od pozostałej
części. Powierzchnia ta nosi nazwę
granicy faz
lub powierzchni
granicznej.
Układ
Otoczenie
Fazy
Granica
układu
Granica
faz
Właściwości w każdym punkcie
danej fazy są identyczne.
Właściwości elementów
leżących po różnych stronach
granicy faz są różne.
2012-02-24
11
Wykład 1
Podstawy termodynamiki
21
Rodzaje układów termodynamicznych
Z punktu widzenia wymiany materii (masy i energii) między układem a
otoczeniem układy dzielimy na trzy grupy:
Układ izolowany
- nie wymienia materii z
otoczeniem (ani na sposób masy ani na
sposób energii).
energia
masa
energia
masa
energia
masa
Układ zamknięty
- wymienia z otoczeniem
energię (na sposób ciepła, pracy lub kwantów
promieniowania) ale nie wymienia masy. Układ
zamknięty może być:
zamknięty adiabatycznie – nie wymienia
energii na sposób ciepła (układ jest
izolowany termicznie), ale może wymieniać
energię na skutek wykonania pracy (np. ruch
tłoka)
zamknięty diatermicznie – wymienia energię
na sposób ciepła jak i na sposób pracy.
Układ otwarty
-
wymienia z otoczeniem materię
zarówno na sposób masy jak i energii.
Wykład 1
Podstawy termodynamiki
22
Stan układu
Stanem układu
nazywamy jego
sytuację opisaną
zestawem
zmiennych, zwanych
parametrami stanu.
Parametry stanu
układu
Ekstensywne
-
Proporcjonalne do
ilości materii w
układzie:
• masa
• objętość
Intensywne
-
Niezależne od ilości
materii w układzie:
• temperatura
• ciśnienie
• ułamek molowy
Reguła Duhema
Stan termodynamiczny układu jest jednoznacznie określony jeżeli
znane są ilości każdego składnika oraz dodatkowo dwa parametry.
Układ może być:
jednofazowy
wielofazowy
jednoskładnikowy
wieloskładnikowy
Składnik
– substancja chemiczna (pierwiastek lub związek chemiczny)
niezależnie od swego stanu skupienia

2012-02-24
12
23
lód
woda
Przykłady:
Układ jednoskładnikowy
dwufazowy
Olej
(mieszanina
tłuszczów)
woda
Układ wieloskładnikowy
dwufazowy
nasycony
roztwór CuSO
4
wodzie
kryształy CuSO
4
Układ dwuskładnikowy
dwufazowy
Układ wieloskładnikowy
jednofazowy
24
Liczbę stopni swobody określa
Dla każdego układu można określić liczbę parametrów intensywnych,
które można niezależnie zmieniać nie powodując zmiany liczby faz
układu w stanie równowagi
– jest to
liczba stopni swobody z
.
Reguła faz Gibbsa
z = s - f +2
s
– liczba składników, f - liczba faz
Przykłady:
1) W układzie dwuskładnikowym składającym się z cieczy (roztwór) i
pozostającej z nim w równowadze pary (s=2, f=2) liczba stopni
swobody wynosi
z = 2 -2 +2 = 2.
Oznacza to, że możemy zmieniać w pewnym zakresie np. ciśnienie i
temperaturę i układ nadal będzie dwufazowy.
2) W układzie jednoskładnikowym składającym się z pozostających w
równowadze ciała stałego, cieczy i pary (s=1, f=3) liczba stopni
swobody wynosi
z = 1 -3 +2 = 0.
Nie możemy zmienić żadnego parametru. Jest tylko jedna
temperatura i ciśnienie, przy której występuje równowaga trzech faz
(punkt potrójny).

2012-02-24
13
Wykład 1
25
Prawo zachowania materii
Materia występuje w dwóch formach: masy i energii (w procesach
zachodzących w przyrodzie i w laboratoriach jedne postacie materii
przechodzą w inne, ale ilość materii nie zmienia się).
Prawo zachowania energii można zdefiniować w różny sposób, np.
energia układu izolowanego jest stała.
Prawo zachowania masy mówi, że sumaryczna masa substratów
wziętych do reakcji jest równa łącznej masie produktów z nich
otrzymanych
Wiadomo, że ani prawo zachowania masy ani prawo zachowania energii
nie są w pełni ścisłe (wobec E=m
.
c
2
), ale mogą być stosowane jako
oddzielne prawa w obliczeniach podczas przemian fizycznych i
chemicznych (z wyjątkiem przemian jądrowych).
Równoważność masy i energii można zapisać w postaci podanej przez
Einsteina:
E=m
.
c
2
W żadnym procesie materia nie powstaje z niczego ani nie ginie.
W chemii klasycznej (z pominięciem procesów jądrowych) obie formy
energii rozważa się niezależnie.
Właściwości funkcji stanu
:
wartość liczbowa funkcji stanu danego stanu ukłaadu jest
funkcją parametrów określających ten stan
mają określoną wartość liczbową opisującą dany stan
(niezależnie od drogi na jakiej ten stan osiągnięto)
zmiana wartości funkcji stanu zależy tylko od stanu końcowego
(B) i początkowego (A)
f = f
B
– f
A
wartości liczbowe funkcji stanu można dodawać i odejmować
różniczka funkcji stanu f = f(x,y) jest różniczką zupełną:
dy
dy
df
dx
dx
df
df
x
y
Wykład 1
Podstawy termodynamiki
26
Termodynamiczne funkcje stanu:
Energia wewnętrzna U
Entalpia H
Entropia S
Parametry stanu określają stan układu. Do opisu stanu układu, a w
szczególności przemian zachodzących w układzie, służą specjalne
do tego zdefiniowane funkcje, zwane funkcjami stanu.
Energia swobodna F
Entalpia swobodna G

2012-02-24
14
Wykład 1
Podstawy termodynamiki
27
Procesy termodynamiczne
Jest tylko jeden rodzaj energii, ale wiele dróg (sposobów)
przekazywania energii od układu do otoczenia lub odwrotnie.
Podział energii na energię chemiczną, cieplną, mechaniczną,
promieniowania elektromagnetycznego itd., należy traktować jako
podział na drogi (sposoby) przekazywania energii.
W termodynamice przez proces rozumiemy przemianę, podczas
której następuje zmiana parametrów stanu układu.
Często jeden z parametrów stanu nie zmienia się i w związku z tym
wyróżniamy procesy:
izotermiczne - gdy T=const,
izobaryczne - gdy p=const,
izochoryczne - gdy V=const,
adiabatyczne - gdy Q=0 (Q -
energia wymieniana na sposób ciepła
między układem a otoczeniem).
Możliwe jest jednoczesne wystąpienie stałości dwóch parametrów, np.
p i T, v i T czy p i V.
Wykład 1
Podstawy termodynamiki
28
Procesy termodynamiczne
Do opisu przemiany w termodynamice stosujemy funkcje stanu, czyli
funkcje, których wartości liczbowe są jednoznacznie określone przez
parametry stanu. Zmiana funkcji stanu w dowolnym procesie nie
zależy od drogi procesu, a tylko od początkowego i końcowego stanu
układu.
Drogą procesu (przemiany) nazywamy zespół stanów, podczas
których układ przechodzi od stanu początkowego do stanu
końcowego.
Wielkość fizyczna, za pomocą której obiektywnie charakteryzujemy
stan cieplny substancji nazywamy temperaturą. Podstawą do
pomiaru temperatury jest tzw.
zerowa zasada termodynamiki
.
Jeżeli układy A i B są w stanie równowagi termicznej z układem
C, to są one również w stanie równowagi termicznej względem
siebie.
E.A. Guggenheim, R. Fowler (1939)
Zasady termodynamiki
-
zwięzłe uogólnienia faktów doświadczalnych uznane
za aksjomaty; służą do definiowania funkcji stanu oraz określania związków
między nimi i parametrami mierzalnymi.
2012-02-24
15
Wykład 1
Podstawy termodynamiki
29
Energia wewnętrzna
Energia wewnętrzna określa całkowity zasób energii jakiegoś ciała. Z
punktu widzenia molekularnej struktury materii na energię wewnętrzną
składają się:
Energia wewnętrzna to funkcja stanu, którą oznaczamy
U [J] , [dla 1 mola substancji J
.
mol
-1
].
1)
energia wszelkich ruchów wykonywanych przez
cząsteczki i atomy-energia ruchu postępowego
(translacji), ich ruchów obrotowych (rotacji)
oraz ruchów drgających (oscylacji) wewnątrz
cząsteczek;
2)
energia oddziaływań pomiędzy elektronami,
pomiędzy jądrami atomowymi oraz pomiędzy
elektronami a jądrami;
3)
energia oddziaływań pomiędzy nukleonami w
jądrach atomowych.
Określenie bezwzględnej wartości U nie jest możliwe. Podaje się
wartości zmian tej funkcji termodynamicznej:
dU
– zmiana U w procesie elementarnym
U
– zmiana U w procesie skończonym przejścia ze stanu (p) do
stanu (k) dla wielkości mierzalnych
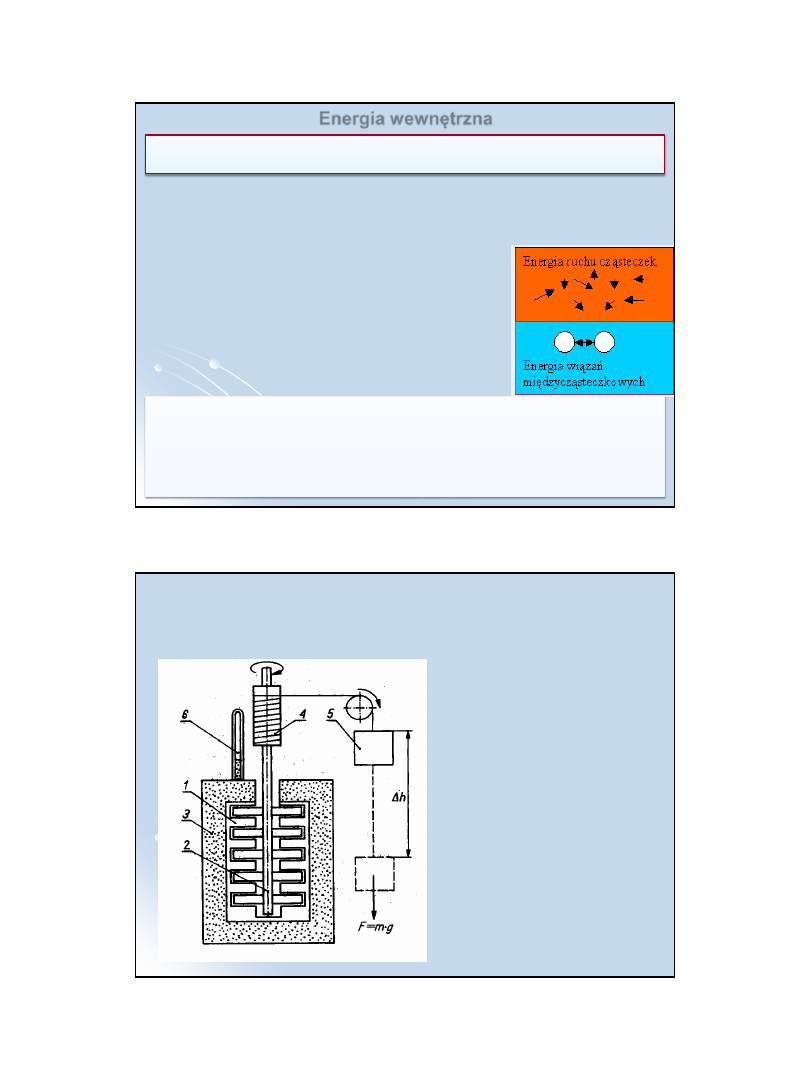
Doświadczenia J.P.Joule’a (1841 - 1850)
1
– naczynie
kalorymetryczne,
2
– mieszadło,
3
– izolacja cieplna,
4
– układ napędzający
mieszadło,
5
– ciężar wykonujący
pracę w polu
grawitacyjnym,
6
– termometr
Joule prowadził badania nad bezpośrednią zamianą energii
mechanicznej i elektrycznej na ciepło.
2012-02-24
16
31
Wnioski sformułowane na podstawie doświadczeń Joule’a
Określona praca wykonana na układzie adiabatycznym powoduje
identyczny wzrost jego temperatury niezależnie od sposobu jej
wykonania
Ponieważ taki sam efekt można osiągnąć dostarczając do układu
zamkniętego diatermicznie energię na sposób ciepła, to oba
sposoby wymiany energii są sobie równoważne.
Wymiana energii z otoczeniem:
Całkowita energia układu zamkniętego zmienia się na skutek
wymiany ciepła lub pracy z otoczeniem
U = Q + W
dU = Q
el
+ W
el
= Q
el
+ W
el,obj
+ W
el
Ogólny zasób energii jest niezmienny. Jeżeli zwiększa się zasób
energii wybranego układu, to wyłącznie kosztem zmniejszenia
zasobu energii otoczenia o dokładnie taką samą wartość.
W układzie izolowanym całkowita ilość energii pozostaje stała,
niezależna od przemian dokonujących się w układzie.
U = const dU = 0
U = 0
PIERWSZA ZASADA TERMODYNAMIKI
Wykład 1
Podstawy termodynamiki
32
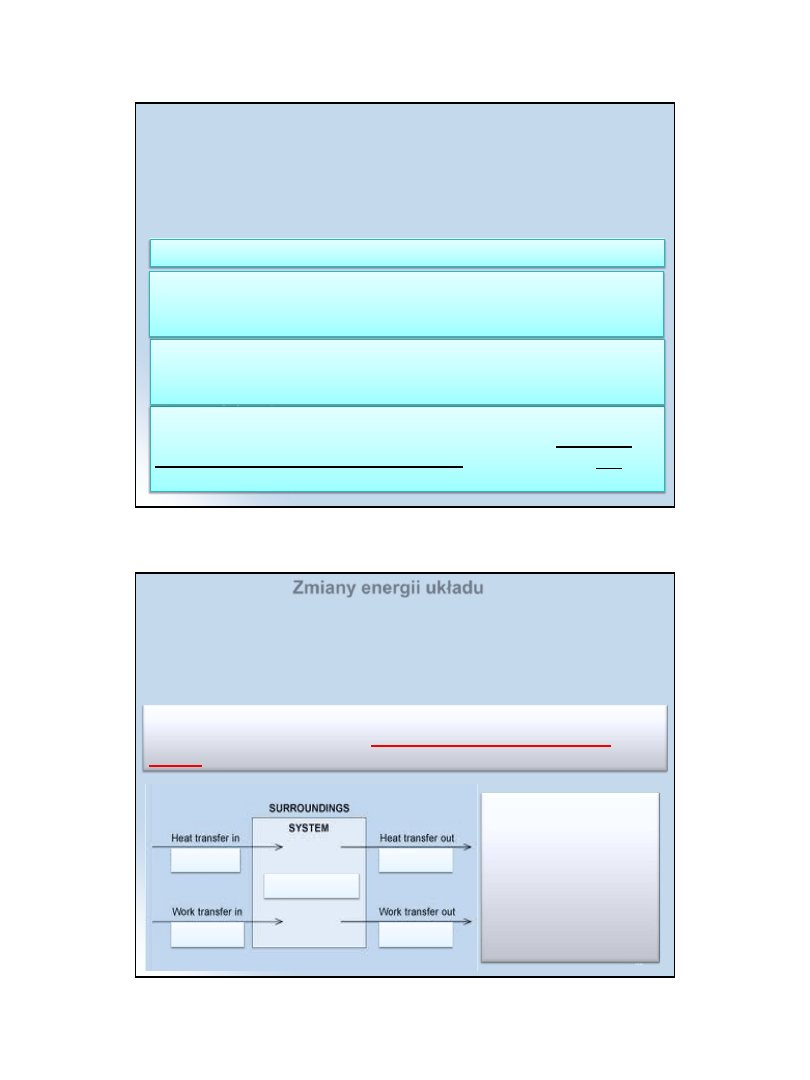
Zmiany energii układu
Pomimo że zmiana energii wewnętrznej
U zależy tylko od stanu
początkowego i końcowego danego układu, wymiana ciepła ani
wymiana pracy z otoczeniem takiej właściwości nie wykazują.
Od drogi nie zależy tylko suma obu wielkości, każda z nich z osobna
zmienia się zależnie od sposobu, w jaki zostaje przeprowadzona dana
przemiana.
Przyjęta obecnie konwencja znakowania efektów
energetycznych nosi nazwę znakowania z punktu widzenia
układu.
Wynika z niej, że
energia dostarczona
do układu (na sposób
ciepła lub pracy) ma
wartość dodatnią,
natomiast energia
przekazana przez
układ otoczeniu ma
znak ujemny.
U = Q +W
Q > 0
Q < 0
W > 0
W < 0
Wyszukiwarka
Podobne podstrony:
chf wykład 6, Studia, Chemia, fizyczna, wykłady
chf wykład 3, Studia, Chemia, fizyczna, wykłady
chf wykład 8, Studia, Chemia, fizyczna, wykłady
chf wykład 1, Studia, Chemia, fizyczna, wykłady
chf wykład 5, Studia, Chemia, fizyczna, wykłady
chf wykład 4, Studia, Chemia, fizyczna, wykłady
ChF Wyklad 6(1)
chf wykład 7, Studia, Chemia, fizyczna, wykłady
chf wykład 2, Studia, Chemia, fizyczna, wykłady
Wyklad 1p
chf wykład 6, Studia, Chemia, fizyczna, wykłady
Napęd Elektryczny wykład
wykład5
Psychologia wykład 1 Stres i radzenie sobie z nim zjazd B
Wykład 04
geriatria p pokarmowy wyklad materialy
ostre stany w alergologii wyklad 2003
WYKŁAD VII
więcej podobnych podstron