Ocena użytkowników:
/ 2
Słaby
Świetny
Wpisany przez kg
1. Moment Dipolowy
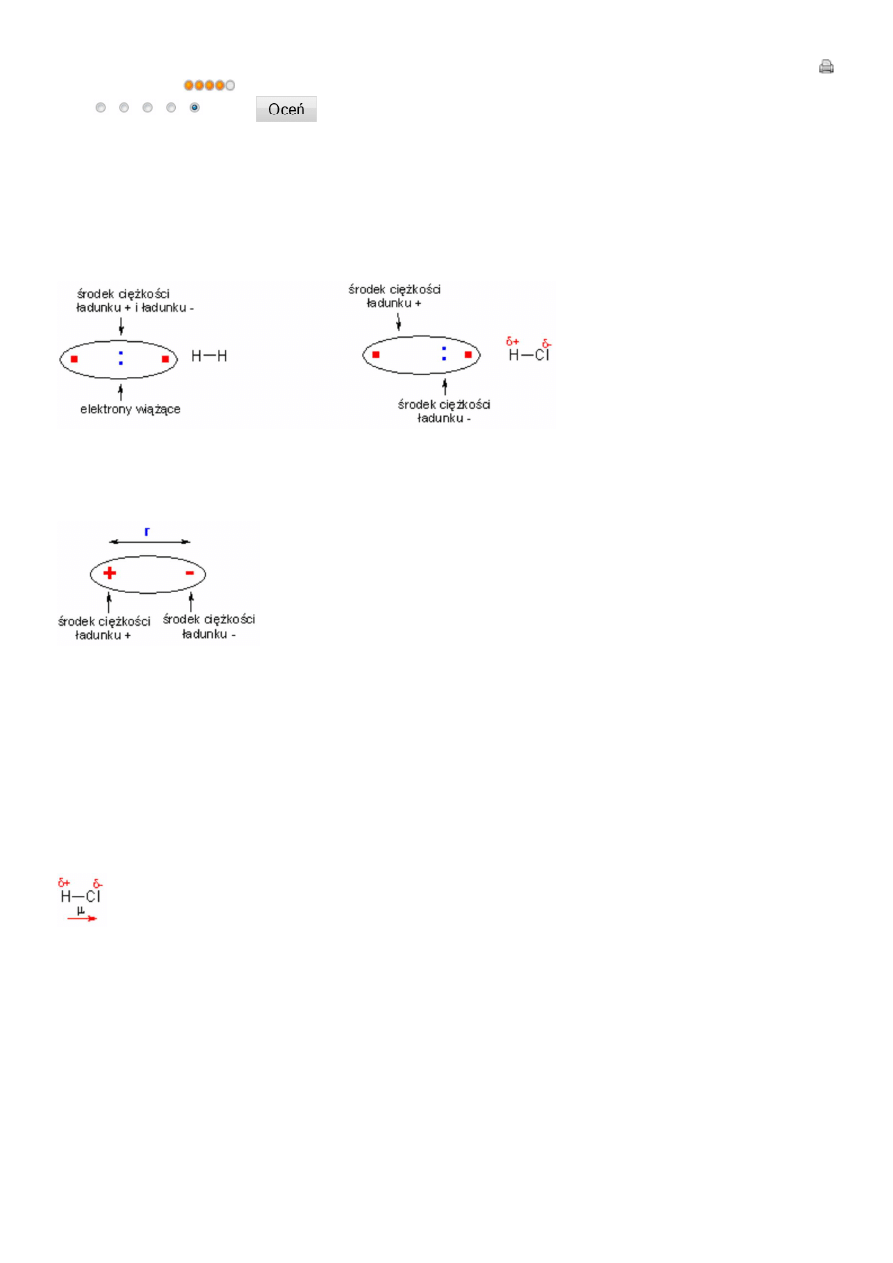
W cząsteczce homojądrowej (zbudowanej z dwóch identycznych atomów), każdy z atomów z jednakową siłą przyciąga elektrony
wiążące. Dzięki temu „środek ciężkości” elektronów pokrywa się ze „środkiem ciężkości” jąder atomowych. Inaczej przedstawia się
to w cząsteczkach heterojądrowych. W takich cząsteczkach jeden atom silniej przyciąga do siebie elektrony wiążące (ten bardziej
elektroujemny), dzięki czemu ma pewien cząstkowy nadmiar elektronów i uzyskuje cząstkowy ładunek ujemny (δ-). Drugi atom ma
cząstkowy niedobór elektronów i uzyskuje cząstkowy ładunek dodatni (δ+).
Cząsteczki w których środek ciężkości ładunku dodatniego nie pokrywa się ze środkiem ciężkości ładunku ujemnego nazywane są
cząsteczkami polarny mi. Cząsteczki takie, podobnie jak w fizyce, stanowią dipole elektryczne i posiadają moment dipolowy µ.
Wartość tego momentu dipolowego jest iloczynem ładunku e i odległośći pomiędzy „środkami ciężkości” ładunków r:
W układzie CGS ładunek elektronu (protonu) jest rzędu 10
-10
j.ES (jednostek elektrostatycznych, dokładnie 4,80
.
10
-10
j.ES).
Odległość pomiędzy atomami jest rzędu 10
-8
cm.
Moment dipolowy 10
-10
j.ES
.
10
-8
cm=10
-18
j.ES
.
cm nazywa się jednoską Debye’a (1 debaj) i oznacza D.
W układzie SI ładunek jednostkowy wynosic 1,602
.
10
-19
C, a odległość pomiędzy atomami (ładunkami) wyrażana jest w m. Dlatego
jednostką momentu dipolowego jest C
.
m (kulombometr). Pomiędzy kulombometrem a debajem zachodzi następująca zależność:
1D=3,33564
.
10
-30
Cm
1
.
10
-30
Cm=0,29979D
Moment dipolowy cząsteczki charakteryzowany jest nie tylko przez wartość, ale i kierunek oraz zwrot. Jest on więc wielkością
wektorową i oznacza się go strzałką skierowaną od dodatniego do ujemnego bieguna dipolu. W przypadku cząsteczki
dwuatomowej kierunek momentu dipolowego zbiega się z prostą przechodzącą przez środki atomów:
Wartość momentu dipolowego pozwala w prosty sposób oszacować w jakim stopniu wiązanie łączące dwa atomy jest wiązaniem
jonowym. Dla przykładu w chlorowodorze odległość między atomami wynosi 1,27
.
10
-8
cm. Gdyby chlorowodór składał się wyłącznie
z jonów wodorowych i chlorkowych (wiązanie H-Cl było w 100% jonowe), to moment dipolowy chlorowodoru powinien wynosić:
µ=4,8
.
10
-8
j.ES
.
1,27
.
10
-8
cm=6,09
.
10
-18
j.ES
.
cm=6,09D.
W rzeczywistości moment dipolowy chlorowodoru wynosi 1,08D. Możemy więc ułożyć proporcję:
6,09D to 100% wiązania jonowego,
1,08D to x% wiązania jonowego, czyli x=1,08D
.
100%/6,09D.
Skąd
x=17,7%
, co można przyjąć, że wiązanie w chlorowodorze jest tylko w około 18% wiązaniem jonowym.
W przypadku cząsteczek bardziej złożonych, zmierzony moment dipolowy cząsteczki jest sumą wektorową momentów
dipolowy ch wszystkich wiązań w cząsteczce (sumą wektorową cząstkowych momentów dipolowych pochodzących od wiązań).
Znając moment dipolowy cząsteczki i jej kształt można z rachunku wektorowego obliczyć momenty dipolowe wiązań. Dla wody
m=1,84D, kąt między wiązaniami H-O-H wynosi 104
o
, czyli:
Moment dipolowy
http://www.chemorganiczna.com/organiczna/kurs/16-moment-dipolowy...
1 z 4
2012-01-22 22:04
W podobny sposób obliczono momenty dipolowe dla następujących wiązań:
N-H
O-H
S-H
C-N
C-O
C-Cl
C-Br
C=O
1,3D
1,5D
0,7D
1,0D
1,2D
1,9D
1,8D
2,7D
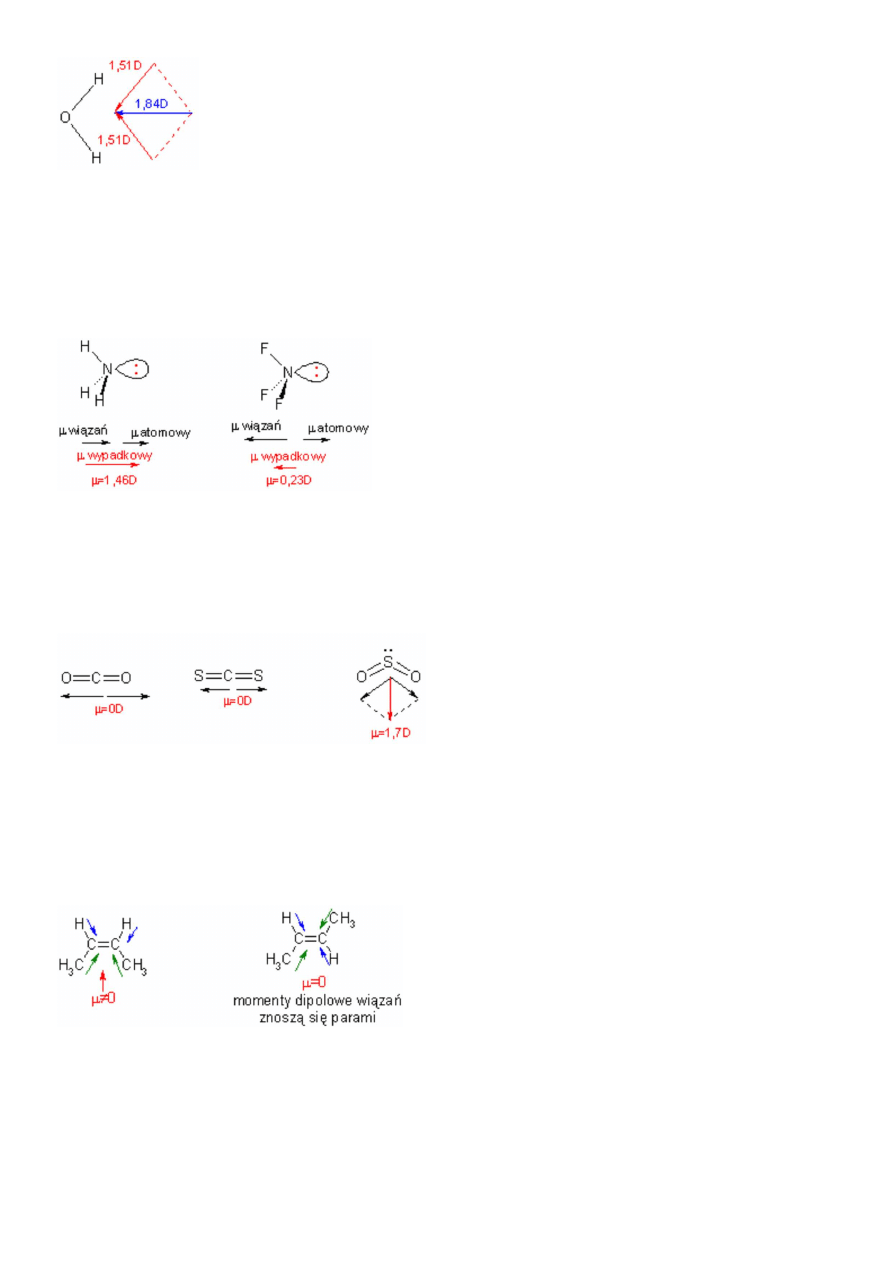
Jeżeli niesymetryczne rozmieszczenie elektronów wiążących odpowiedzialne jest za powstanie momentu dipolowego, to nie można
zapomnieć o elektronach niewiążących, które również wpływają na całkowity moment dipolowy. Cząstkowa składowa momentu
dipolowego pochodząca od wolnych par elektronowych nosi nazwę atomowego momentu dipolowego. Niejednokrotnie
składowa ta kompensuje momenty dipolowe wiązań do tego stopnia, że w fluorek azotu ma mniejszy moment dipolowy od
amoniaku, mimo że różnica elektroujemności między azotem a fluorem jest większa niż między azotem a wodorem.
W stabelaryzowanych wartościach momentów dipolowych wiązań jest już uwzględniona składowa momentu dipolowego
atomowego[1].
Ponieważ całkowity moment dipolowy jest sumą wektorową momentów wiązań, zależy on bardzo od symetrii cząsteczki. Cząsteczki
o jednakowym stosunku molowym składników: CO
2
, CS
2
i SO
2
mogą mieć różne momenty dipolowe. Tlenek węgla(IV) i siarczek
węgla(IV) są cząsteczkami liniowymi, składowe momentów dipolowych wiązań znoszą się. Tlenek siarki(IV) jest natomiast
cząsteczką płaską, w której kąt między wiązaniami O-S-O wynosi około 120
o
(hybrydyzacja sp
2
atomu siarki) i składowe
momentów dipolowych wiązań sumują się dając wypadkową różną od zera:
Czasami pomiar wartości momentu dipolowego pozwala wyciągnąć wnioski o kształcie cząsteczki np:
BeCl
2
µ=0D
H
2
S µ=1D
Oznacza to, że chlorek berylu jest cząsteczką liniową (momenty dipolowe wiązań znoszą się), a siarkowodór nie jest cząsteczką
liniową, ale jest cząsteczką płaską (musi być płaską ponieważ zbudowany jest z trzech atomów).
Dla FeCl
3
wartość m=1,27D wskazuje, że cząsteczka nie jest płaska.
Często wartość momentu dipolowego pozwala w łatwy sposób rozróżnić izomery geometryczne. Buten może istnieć w postaci
dwóch izomerów: cis-butenu i trans-butenu. Tylko cis-buten posiada m≠0:
Interesującą cząsteczką jest metan i jego pochodne. Oczywiście ze względu na symetrię jego moment dipolowy m=0D. Z oznaczeń
spektroskopowych wynika, że składowa momentu dipolowego wiązań C-H wynosi 0,3D. Wartość m=0 dla metanu oznacza, że
suma trzech wektorów podchodzących od momentów dipolowych trzech wiązań C-H równa jest co do wartości czwartej składowej,
lecz skierowana przeciwnie:
Moment dipolowy
http://www.chemorganiczna.com/organiczna/kurs/16-moment-dipolowy...
2 z 4
2012-01-22 22:04
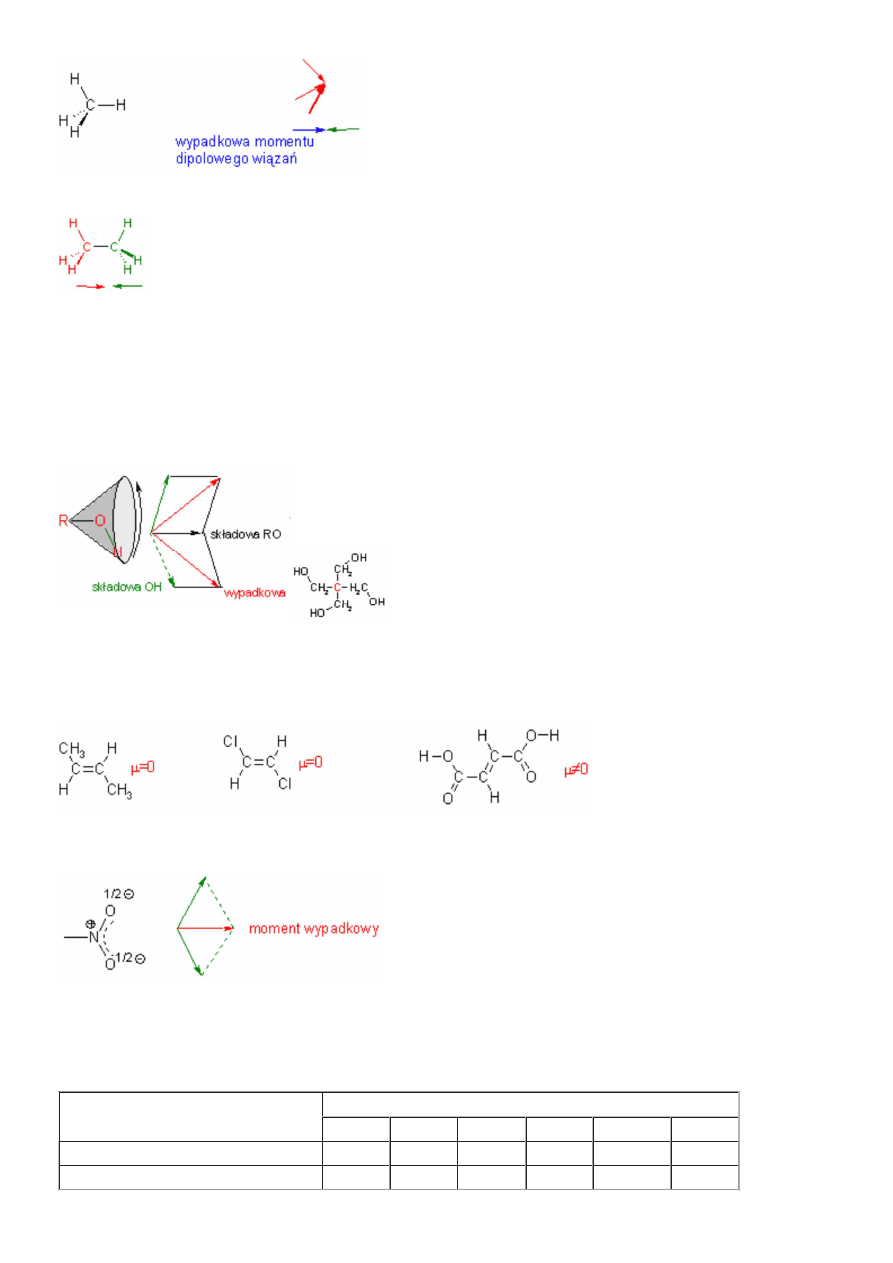
Czyli sama grupa CH
3
posiada moment dipolowy m=0,3D. Zastąpienie jednego atomu wodoru kolejną grupą CH
3
(przejście od
metanu do etanu) powoduje powstanie związku o momencie dipolowym również równym zero:
Oznacza to, że wszystkie węglowodory nasycone, bez względu na długość łańcucha (wszystkie mogą być wyprowadzone od
metanu) są niepolarne, posiadają moment dipolowy µ=0.
Jednakże nie zawsze symetrycznie podstawiony metan nie posiada momentu dipolowego. Zerowy moment dipolowy występuje
jedynie w tych pochodnych dla których kierunek wektora momentu dipolowego pokrywa się kierunkiem wiązania np. CH
4
, CCl
4
,
C(NO
2
)
4
.
Jeżeli kierunek wektora momentu dipolowego nie pokrywa się z kierunkiem wiązania (kierunek wektora momentu dipolowego
wiązania jest poprzeczny w stosunku do wiązania łączącego węgiel z grupą) momenty dipolowe wiązań nie zawsze się znoszą:
W przypadku grupy OH, grupa ta posiada rotację (wewnątrz zaznaczonego stożka) i
kierunek wektora m nie zawsze jest stały i nigdy nie pokrywa się z kierunkiem wiązania
R-OH.
Dlatego pentaerytrol , momo że posiada symetrię identyczną jak metan (zaznaczony atom
węgla znajduje się w środku tetraedru, a połączone z nim grupy w jego narożach), posiada
moment dipolowy różny od 0.
Pentaerytrol
Poprzeczny, wypadkowy moment dipolowy wiązań wykazują oprócz grupy hydroksylowej również grupy aminowa –NH
2
,
karboksylowa –COOH i pochodne tych grup (estrowa, amidowa, aminowa o różnej rzędowośći).
Poprzeczny moment dipolowy wiązania powoduje, że kwas trans-butendiowy (kwas fumarowy)w przeciwieństwie do trans-butenu
czy (E)-1,2-dichloroetenu posiada moment dipolowy:
Może wydawać się to dziwne, jednakże dla grupy nitrowej –NO
2
wypadkowy moment dipolowy wiązania pokrywa się z kierunkiem
wiązania tej grupy z atomem węgla. Jest to dobrze widoczne gdy grupę nitrową zapiszemy z rozłożonymi (zdelokalizowanymi)
ładunkami :
Dlatego w symetrycznie podstawionych związkach nitrowych wypadkowy moment dipolowy jest równy 0.
Mimo, że sumaryczny moment dipolowy jest sumą momentów dipolowych wiązań, w cząsteczkach bardziej złożonych od metanu
nie ma potrzeby rozpatrywania wszystkich cząstkowych momentów dipolowych, ponieważ w łańcuchu węglowodorowym
cząstkowe momenty wiązań kompensują się. Dodatkowo w szeregu homologicznym moment dipolowy jest praktycznie stały:
Momenty dipolowe w szeregu pochodnych alkanów R-X w fazie gazowej:
R
X
Cl
Br
OH
NO
2
CHO
CN
CH
3
-
1,86
1,78
1,69
3,54
2,69
3,94
CH
3
CH
2
-
2,02
2,02
1,69
3,70
2,73
4,04
Moment dipolowy
http://www.chemorganiczna.com/organiczna/kurs/16-moment-dipolowy...
3 z 4
2012-01-22 22:04

CH
3
CH
2
CH
2
-
2,03
2,04
1,64
3,72
2,72
4,05
CH
3
CH
2
CH
2
CH
2
-
2,04
2,04
1,63
4,04
Dane z podręcznika Chemia Organiczna Nanitescu
Zauważamy jedynie, że w każdym szeregu wartość momentu dipolowego dla CH
3
-X odbiega od wartości momentu dipolowego dla
pozostałych członów szeregu homologicznego. Jest to spowodowane tym, że dodatkowe podstawniki alkilowe poprzez efekt
indukcyjny pozwalają grupie X uzyskać większy ładunek ujemny, dodatkowo ładunkiem dodatnim obdzielonych jest więcej atomów
węgla i średnia odległość między tymi ładunkami dodatnim a ujemnym została zwiększona, powodując zgodnie ze wzorem µ=ql
wzrost wartości µ:
W szeregu CH
3
CH
2
X i CH
3
CH
2
CH
2
X wartość m nie zmienia się już, ponieważ efekt indukcyjny działa jedynie na krótkie odległości.
Warto w tym miejscu zapamiętać, że grupa alkilowa oddaje elektrony poprzez efekt indukcyjny, sama uzyskuje ładunek
dodatni. Mówimy że wykazuje ona efekt +I.
Grupa X natomiast w wyniku efektu indukcyjnego uzyskuje ładunek ujemny, wykazuje więc efekt –I.
Rozpatrując efekt indukcyjny (mezomeryczny) utożsamiamy się z rozpatrywaną grupą. Taki jaki ta grupa uzyskuje ładunek, taki
przypisujemy jej znak efektu indukcyjnego (mezomerycznego).
[1]Nie możemy o niej zapomnieć gdy szacujemy wielkość momentu dipolowego na podstawie elektroujemności składników
Moment dipolowy
http://www.chemorganiczna.com/organiczna/kurs/16-moment-dipolowy...
4 z 4
2012-01-22 22:04
Wyszukiwarka
Podobne podstrony:
ćw7 - Refrakcja i wyznaczanie momentu dipolowego, studia, chemia fizyczna
Refrakcja i wyznaczanie momentu dipolowego
(), materiały zaawansowane technologicznie L, Zagadnienia wyznaczanie momentu dipolowego substancji
Refrakcja i wyznaczanie momentu dipolowego, REFRAKCJA I WYZNACZANIE MOMENTU DIPOLOWEGO
moje momenty dipolowe sprawko4
3 WYZNACZANIE MOMENTU DIPOLOWEGO NITROBENZENU
moment dipolowy
REFRAKCJA I WYZNACZANIE MOMENTU DIPOLOWEGO, NAUKA, WIEDZA
sprawko z momentu dipolowego
sprawozdanie moment dipolowy, fizyczna, chemia fizyczna, Fizyczna, laborki
moje momenty dipolowe sprawko4poprawione
Moment dipolowy id 306932 Nieznany
moment dipolowy poprawa 03.12.11 bw, fizyczna, chemia fizyczna, Fizyczna, laborki
Moment dipolowy (toluen), Studia, Politechnika
Refrakcja i wyznaczanie momentu dipolowego
ćw7 - Refrakcja i wyznaczanie momentu dipolowego, studia, chemia fizyczna
moment dipolowy
więcej podobnych podstron