
Moment dipolowy wiązana μ
[Cm]
Asymetryczny rozkład ładunku wywołuje
powstanie momentu dipolowego elektrycznego –
iloczyn (wektorowy) ładunku i odległości na
jaką ten ładunek jest przesunięty.
μ = q · l (q – cząstkowy ładunek elektryczny
[C] ,
l odległość miedzy środkami ciężkości ładunków
elektrycznych [m]
Jednostką momentu dipolowego jest
kulombometr [Cm] oraz debaj (1D = 3,333·10
-
30
Cm
Moment dipolowy wiązania – miara przesunięcia
elektronów tworzących wiązanie chemiczne w
kierunku jądra pierwiastka bardziej
elektroujemnego w heterocząsteczkach.
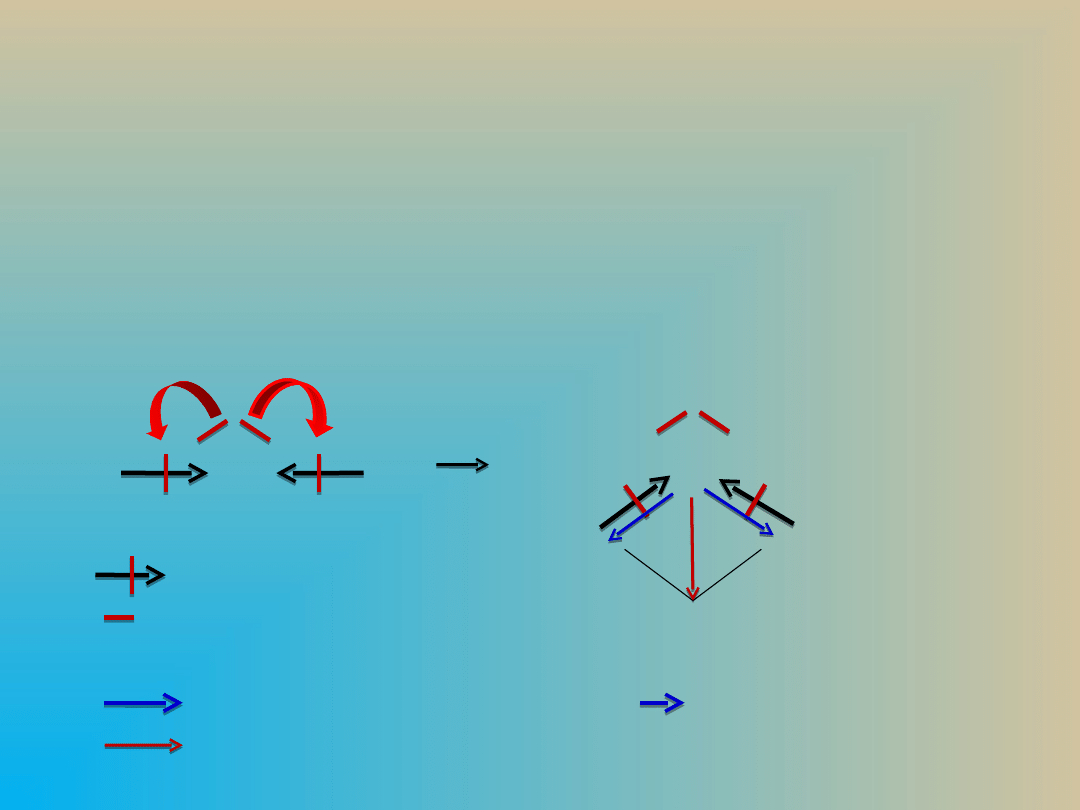
Moment dipolowy
cząsteczki μ
cz
Moment dipolowy cząsteczki –
suma wektorowa momentów
dipolowych poszczególnych wiązań.
:wiązanie kowalenc. polaryz.
:pary elektronowe niewiążące
δ+, δ- : cząstkowe ładunki elektryczne
: wektor momentu dipolowego (δ+ δ-)
: suma wektorów momentów dipolowych
O
δ-
δ+
H
H
δ+
O
δ-
H
δ
+
δ+
H
μ≠0
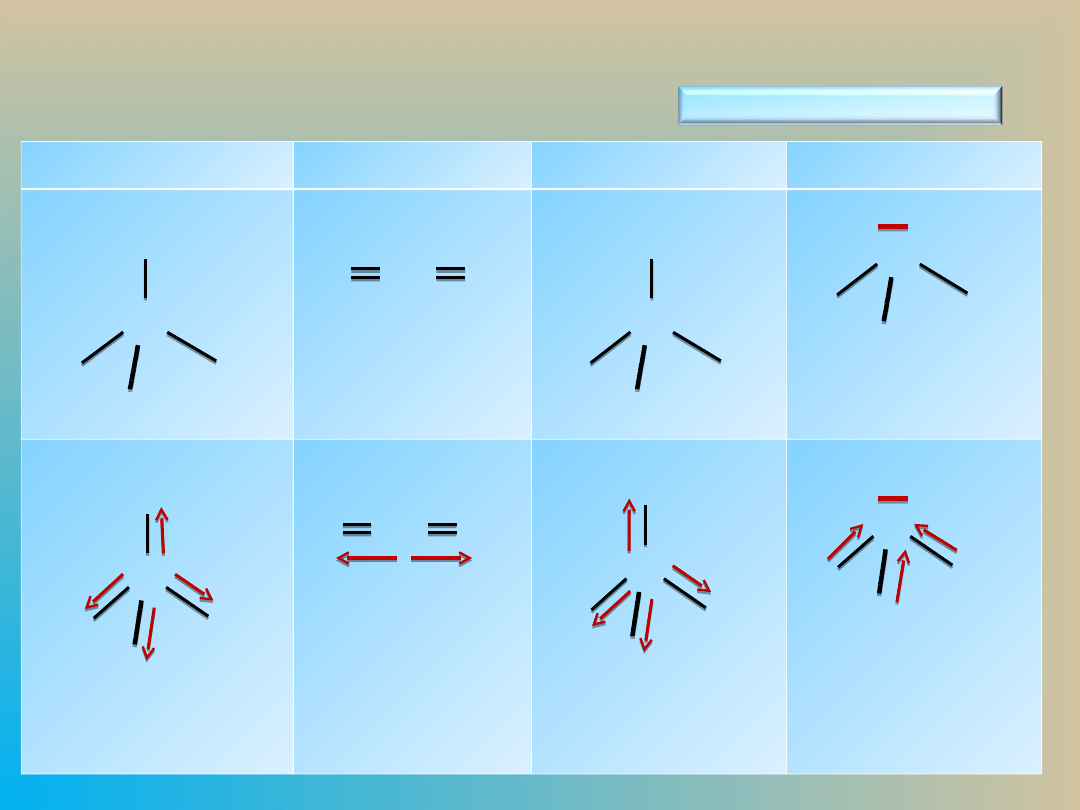
Sposób określania momentu dipolowego
wybranych cząsteczek
CCl
4
CO
2
CH
3
Cl
NH
3
μ = O
μ = O
μ ≠ O
μ ≠ O
C
δ+
Cl
δ
-
Cl
δ
-
Cl
δ
-
Cl
δ
-
C
Cl
Cl
C
l
Cl
C
δ+
H
δ
+
H
δ
+
H
δ
+
Cl
δ
-
C
H
H
H
Cl
N
δ-
H
δ
+
H
δ
+
H
δ
+
N
H
H
H
C
δ+
O
δ
-
O
δ
-
C
O
O

Cząsteczka polarna –
dipolowa
Moment dipolowy wiązania
nie jest równoznaczny z
momentem dipolowym cząsteczki:
Cząsteczki CO
2
, SO
3
, CH
4
, CCl
4
są apolarne
, chociaż
momenty dipolowe wiązań są różne od zera, jednak rozkład
ładunku elektrycznego jest symetryczny – momenty
dipolowe wiązań są przeciwnie skierowane i znoszą się.
Cząsteczki H
2
O, H
2
S
mają budowę kątową
– momenty
dipolowe wiązań nie znoszą się , cząsteczka ma
niesymetryczny rozkład ładunków elektrycznych
są
dipolami.
Cząsteczki dwuatomowe heterojądrowe
(
HF, HCl, HBr,
HI
) posiadają trwałe elektryczne momenty
dipolowe – są
dipolami
.
Cząsteczka NH
3
ma budową czworościanu, dzięki wolnej
parze elektronowej na atomie N rozkład ładunków
elektrycznych jest niesymetryczny a
suma momentów
dipolowych wiązań jest różna od zera
, a cząsteczka
jest
dipolem - cząsteczką polarną
.
Tu kliknij aby wrócić do
slajdu 1

Ważniejsze rodzaje hybrydyzacji
Hybrydyza
cja atomu
Figura geomet.
określająca
położ. orbitali
zhybrydyz.
Stan
podstawowy
i
wzbudzony
atomu
Orbitale biorące udział
w hybrydyzacji
Przykład
y drobin
Diagonaln
a
Linia prosta
Be:1s
2
2s
2
1s
2
2s
1
2p
1
C: 1s
2
2s
2
p
2
1s
2
2s
1
2p
3
sp
: 2 orbitale sp, kąt =
180
o
sp
: 2 orbitale sp +
2 orbitale 2p
BeH
2
HC ≡
CH,
HC ≡ N
Trygonalna Trójkąt
równoboczny
B:1s
2
2s
2
2p
1
1s
2
2s
1
2p
2
C: 1s
2
2s
2
p
2
1s
2
2s
1
2p
3
sp
2
: 3 orbitale sp
2
,
kąt = 120
o
sp
: 3 orbitale sp
2
+
orbitale 2p
BCl
3
H
2
C = O
Tetraedryc
zna
Tetraedr
(czworościan)
P:
1s
2
2s
2
2p
6
3s
2
3
p
3
N:
1s
2
2s
2
2p
3
O: 1s
2
2
s
2
2p
4
S:
1s
2
2s
2
2p
6
3s
2
3
p
4
C:1s
2
2
s
2
p
2
1s
2
2s
1
2p
3
Si:
1s
2
2s
2
2p
6
3s
2
3
p
2
1s
2
2s
2
2p
6
3s
1
3
p
3
sp
3
: 4 orbitale sp
3
w
tym 1 orbital
obsadzony jest parą e
-
,
ok.93
o
< kąt < 109
o
28`
jw.
sp
3
: 4 orbitale sp
3
w
tym 2 orbitale
obsadzone parami e
-
sp
3
: 4 orbitale sp
3
jw.
PCl
3
, PH
3
NH
3
H
2
O
H
2
S
CH
4
,
CCl
4
SiH
4

Ważniejsze rodzaje
hybrydyzacji - cd
Hybrydyza
cja atomu
Figura geomet.
określająca
położ. orbitali
zhybrydyz.
Stan
podstawowy
i
wzbudzony
atomu
Orbitale biorące udział
w hybrydyzacji i przykłady
drobin
Kwadratow
a
Kwadrat
może dot. at.
pierw. okresu
3
i kolejnych
sp
2
d
- wymieszanie 1 orbitalu s
oraz 2-ch orbitali p i 1 orbitalu
d, orbitale są skierowanie do
narożników kwadratu,
kąty = 90
o
Bipiramida
lna
Bipiramida
trygonalna
P:
1s
2
2s
2
2p
6
3s
2
3p
3
1s
2
2s
2
2p
6
3s
1
3p
3
d
1
S:1s
2
2s
2
2p
6
3s
2
3p
4
1s
2
2s
2
2p
6
3s
2
3p
4
3d
1
Cl:
1s
2
2s
2
3s
2
3p
5
1s
2
2s
2
3s
2
3p
4
3d
1
sp
3
d
– pięć orbitali
sp
3
d,
trzy
orbitale skierowane są do
narożników trójkąta
równobocznego kąty = 120
o
, 2
orbitale są ┴ do płaszczyzny w
której leżą trzy orbitale – (kąty =
90
o
),
PCl
5
sp
3
d
- jeden z 5-ciu orbitali
sp
3
d
obsadza para e
-
, SF
4
sp
3
d
- dwa z 5-ciu orbitali
sp
3
d
obsadzają pary e
-
,
ClF
3
Oktaedrycz
na
Ośmiościan
foremny –
bipiramida
tetragonalna
S:1s
2
2s
2
2p
6
3s
2
3p
4
1s
2
2s
2
2p
6
3s
1
3p
3
3d
2
I:
[Kr]4d
10
5s
2
5p
5
I[Kr]4d
10
5s
2
5p
3
5d
2
sp
3
d
2
– 6 orbitali skierowanych
do narożników ośmiościanu
foremnego, SF
6
sp
3
d
2
– 6 orbitali, jeden z 6
orbitali obsadzony jest parą e
-
,
IF
5
Bipiramida
lno-
pentagonal
na
Bipiramida
pentagonalna
I:
[Kr]4d
10
5s
2
5p
5
I[Kr]4d
10
5s
1
5p
3
5d
3
sp
3
d
3
–siedem orbitali
skierowanych do narożników
bipiramidy pentagonalnej,
IF
7
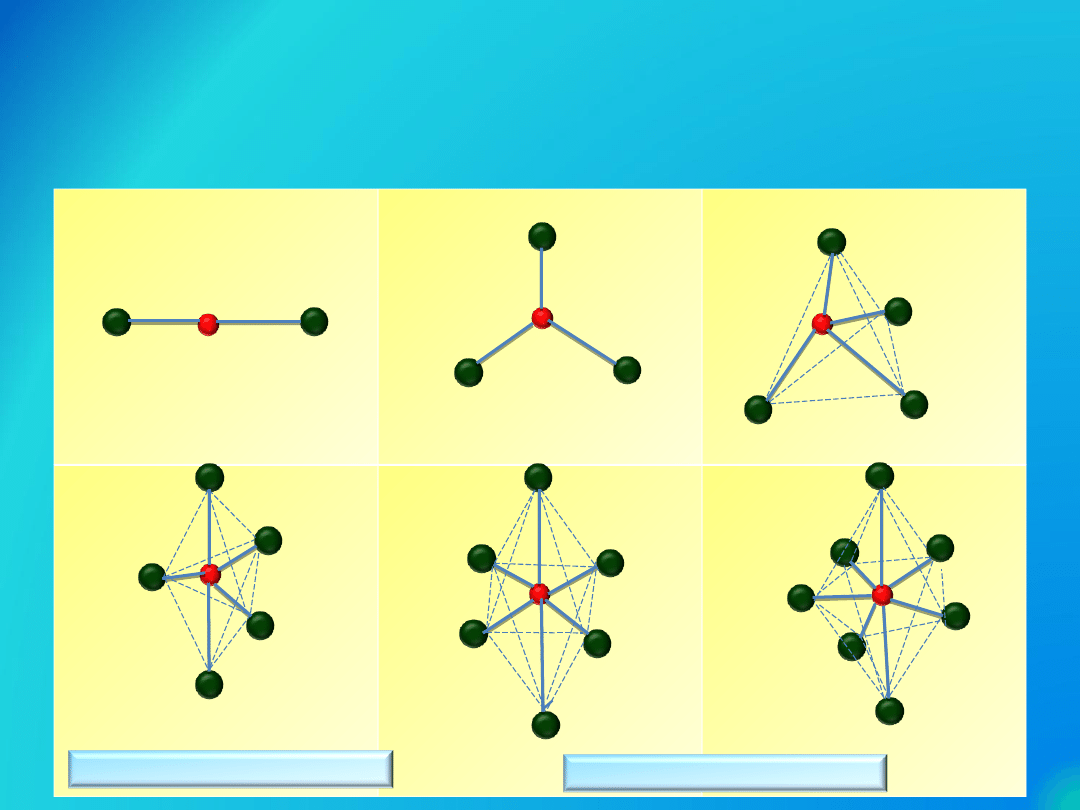
Przestrzenny rozkład wiązań
tworzonych przez orbitale
zhybrydyzowne
sp
sp
2
sp
3
sp
3
d
sp
3
d
2
sp
3
d
3
Tu kliknij aby wrócić do
slajdu 6
Tu kliknij aby wrócić do
slajdu 7
Document Outline
Wyszukiwarka
Podobne podstrony:
ćw7 - Refrakcja i wyznaczanie momentu dipolowego, studia, chemia fizyczna
Refrakcja i wyznaczanie momentu dipolowego
(), materiały zaawansowane technologicznie L, Zagadnienia wyznaczanie momentu dipolowego substancji
Refrakcja i wyznaczanie momentu dipolowego, REFRAKCJA I WYZNACZANIE MOMENTU DIPOLOWEGO
moje momenty dipolowe sprawko4
3 WYZNACZANIE MOMENTU DIPOLOWEGO NITROBENZENU
REFRAKCJA I WYZNACZANIE MOMENTU DIPOLOWEGO, NAUKA, WIEDZA
sprawko z momentu dipolowego
sprawozdanie moment dipolowy, fizyczna, chemia fizyczna, Fizyczna, laborki
Moment dipolowy
moje momenty dipolowe sprawko4poprawione
Moment dipolowy id 306932 Nieznany
moment dipolowy poprawa 03.12.11 bw, fizyczna, chemia fizyczna, Fizyczna, laborki
Moment dipolowy (toluen), Studia, Politechnika
Refrakcja i wyznaczanie momentu dipolowego
ćw7 - Refrakcja i wyznaczanie momentu dipolowego, studia, chemia fizyczna
moment dipolowy
więcej podobnych podstron
