
Miareczkowanie kompleksometryczne
polega na reakcji
tworzenia, rozpuszczalnych, słabo zdysocjowanych (trwałych) związków
,
p
y ,
y
j
y
(
y )
ą
kompleksowych. Dzieli się na:
miareczkowania chelatometryczne – miareczkowanie
k
l k
k ó
d
k
kompleksonometryczne w którym stosuje się do miareczkowania
związki organiczne zwane kompleksonami ( pochodne kwasów
aminopolikarboksylowych jak EDTA (sól disodowa kwasu
p
y
y
j
etylenodiaminotetraoctowego)
miareczkowania niechelatometryczne np. argentometryczne
i j kó
oznaczanie cyjanków
AgNO
3
+ 2CN
-
Ag(CN)
2
-
+ NO
3
-
Ag
+
+ Ag(CN)
2
-
2AgCN↓
w pkt równoważnikowym nadmiar AgNO3 wywołuje zmętnienie
merkurometryczne oznaczanie chlorków
Hg
2+
+ 2Cl
-
HgCl
Hg
2+
+ 2Cl
HgCl
2
nadmiar jonów Hg
2+
stwierdza się w reakcji z nitroprusydkiem sodu.

Schwarzenbach G. – twórca kompleksometrii chelatowej, chemik
szwajcarski, który badał właściwości kompleksotwórcze kwasów
aminopolikarboksylowych
zwanych
kompleksonami
stąd
nazwa
aminopolikarboksylowych
zwanych
kompleksonami,
stąd
nazwa
kompleksonometria
Kompleksony tworzą z metalami kompleksy chelatowe. Chelatometria jest
szerszym pojęciem niż komplesonometria. Ogólnie przyjął się termin
kompleksometria lub miareczkowanie komplesometryczne.
M t d
mi
k
ni
k mpl ks m t
n
m żn
n
ć
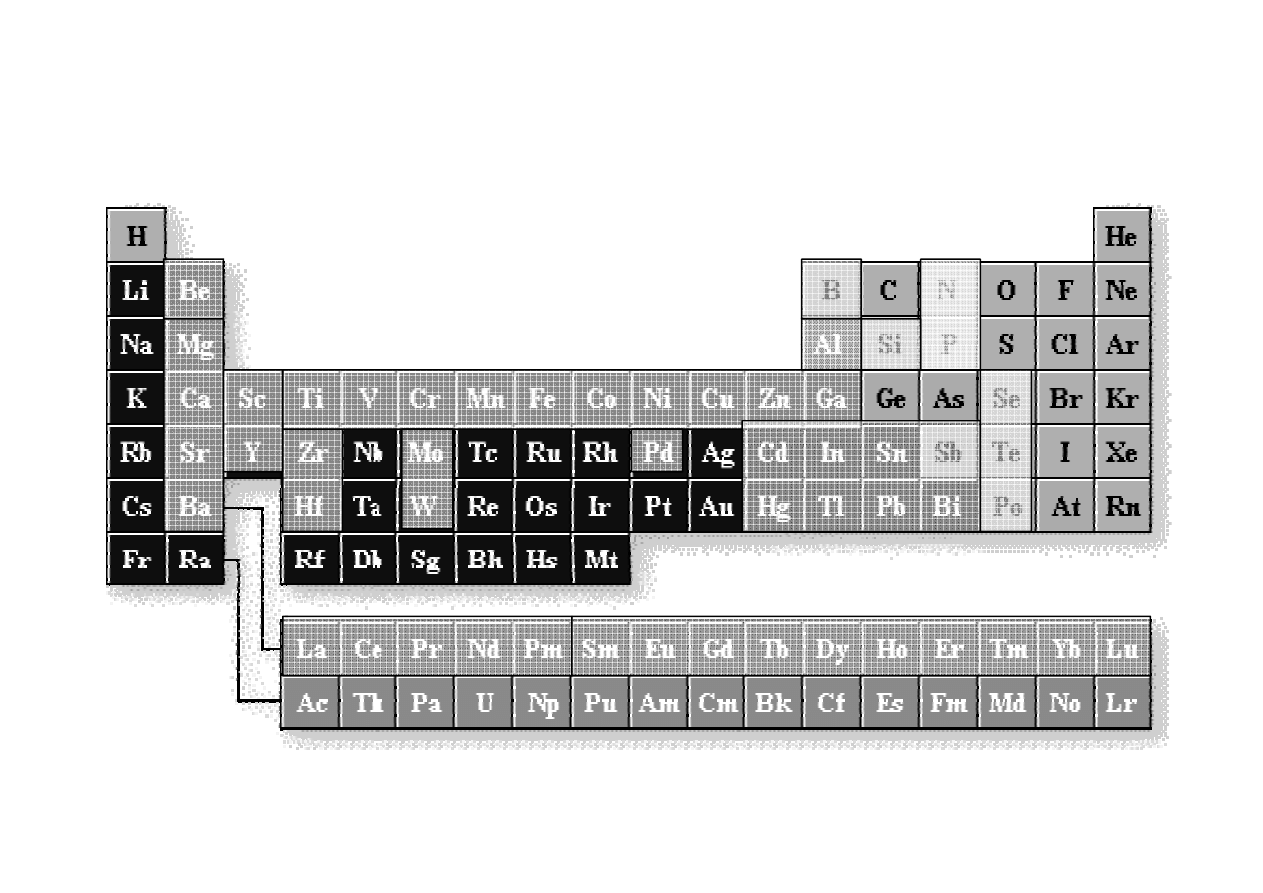
Metodą
miareczkowania
kompleksometrycznego
można
oznaczyć
kilkadziesiąt pierwiastków głównie metali. Bezpośrednio można oznaczyć
pierwiastki
zaznaczone
na
zielono,
pośrednio
zaznaczone
na
ń
pomarańczowo.
Pośrednio można oznaczyć kationy litowców, aniony fosforanowe jako
MgNH PO i miareczkowanie nadmiaru Mg
2+
SO
2-
wytrącając BaSO i
MgNH
4
PO
4
i miareczkowanie nadmiaru Mg
2
, SO
4
2
wytrącając BaSO
4
i
oznaczając nadmiar Ba
2+
. Komplesometrycznie można oznaczyć niemal
wszystkie pierwiastki z wyjątkiem gazów szlachetnych.
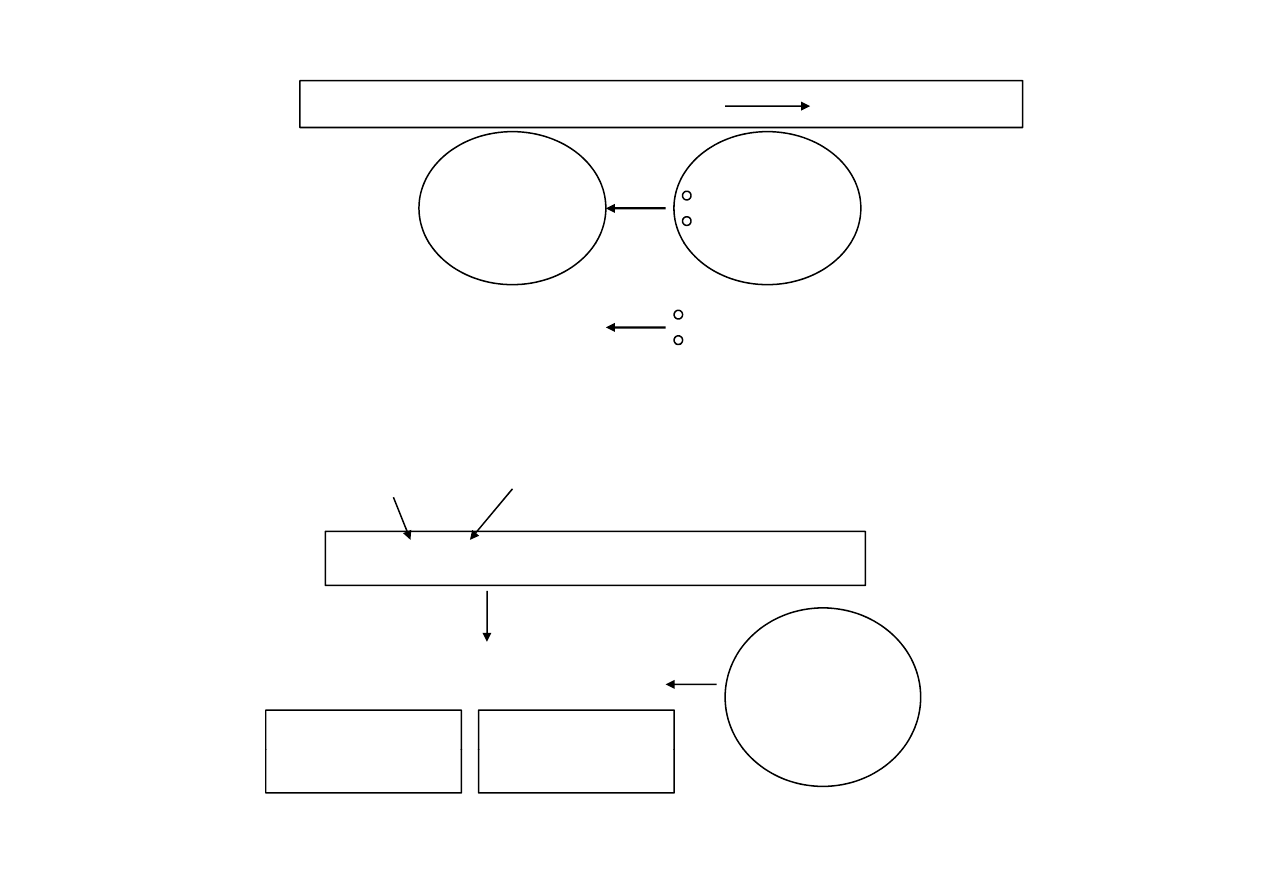
atom centralny + ligand
kompleks
akceptor
elektronu
donor
elektronu
M
L
M
L
wiązanie koordynacyjne
donorowo-akceptorowe
K [F (CN) ] ól k
l k
atom centralny
ligandy
K
4
[Fe(CN)
6
] sól kompleksowa
H
2
O
b d
4K
+
+ [Fe(CN)
6
]
4-
sfera
sfera
bardzo
trwały
kompleks
zewnętrzna
wewnętrzna
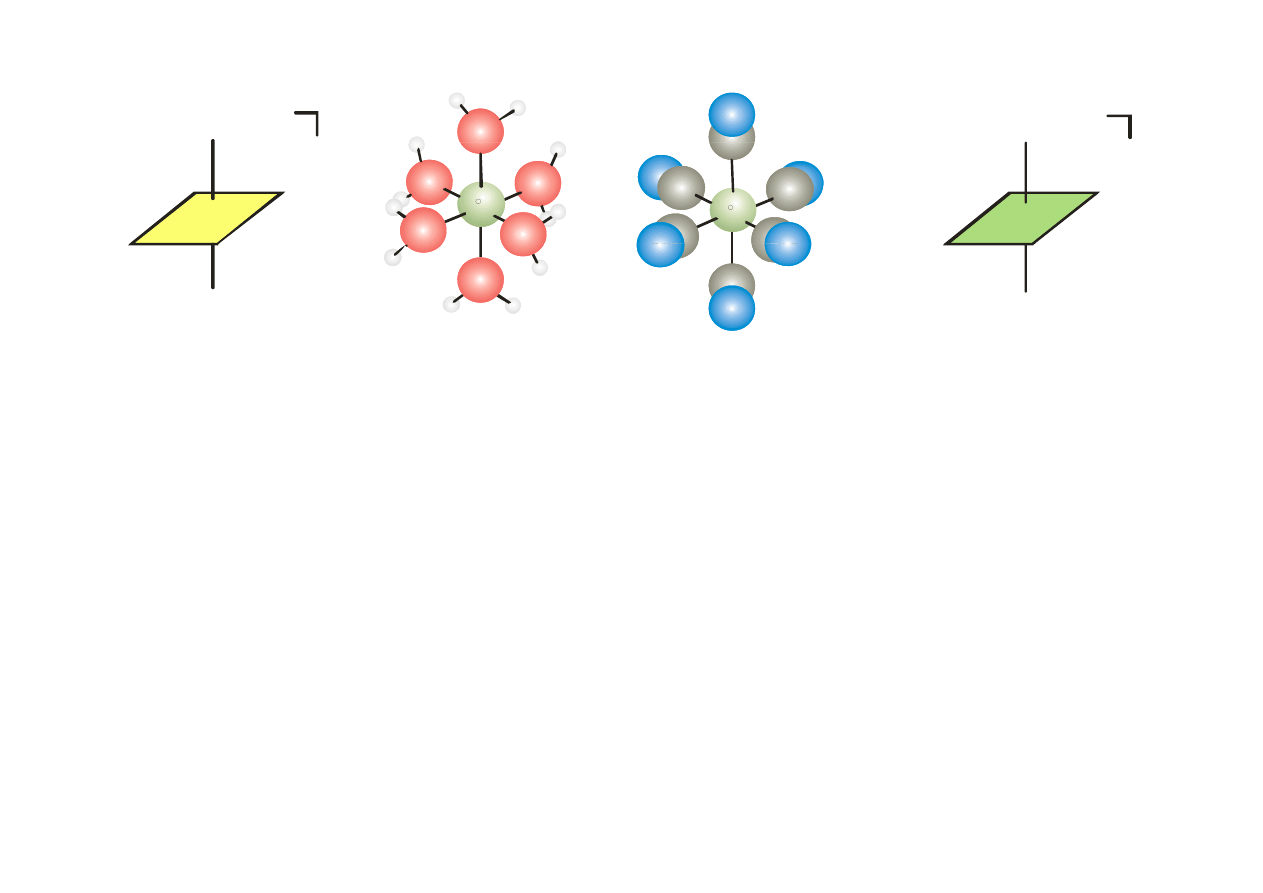
H O
2
2+
4-
CN
Fe
H O
H O
2
OH
OH
2
Fe
CN
NC
NC
H O
2
OH
2
H O
2
CN
CN
NC
[Fe(H
2
O)
6
]
2+
[Fe(CN)
6
]
4-
Atom centralny charakteryzuje liczba koordynacyjna –
liczba wiązań utworzonych przez jon centralny. Liczba par
elektronowych przyłączonych do atomu centralnego
elektronowych przyłączonych do atomu centralnego.
Maksymalna liczba koordynacji- największa liczba wiązań
k
d
j
h dl d
t
t l
koordynacyjnych dla danego atomu centralnego
Dla danych przykładów wynosi 6.
Liczba koordynacyjna dla różnych metali wynosi 2, 4, 6, 8, 9
a nawet 12
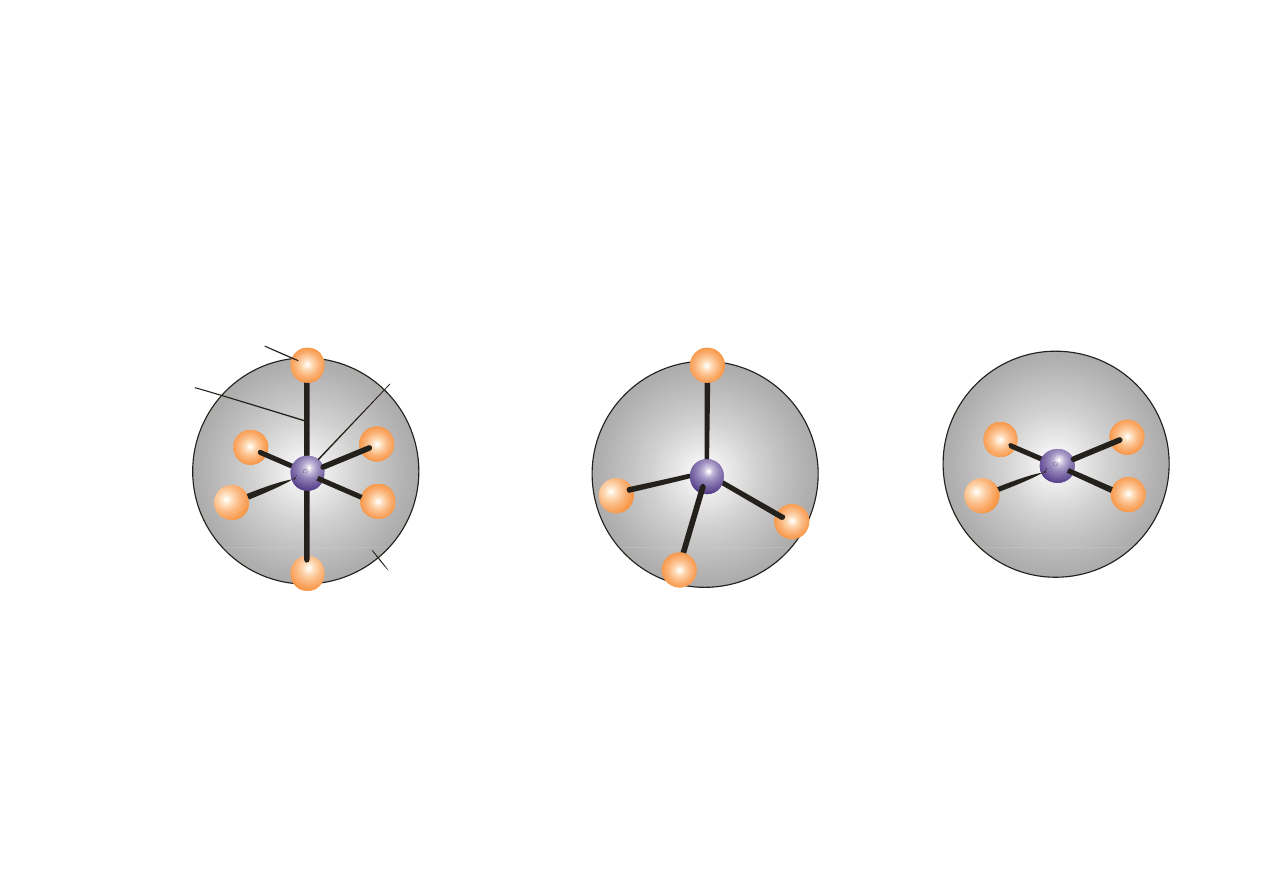
centraln
ligand
Kompleksy sześciokoordynacyjne
oktaedryczne
Kompleksy czterokoordynacyjne
tetraedryczne
płaskie kwadratowe
centralny
atom metalu
g
wiązanie
sfera
koordynacyjna

Ligandem może być anion lub obojętna cząsteczka Cl
-
, Br
-
, I
-
, SCN
-
, CN
-
,
H
2
O, NH
3
, cząsteczki organiczne nawet białka.
k d l
d
h d ć
k
( d
H )
W skład liganda mogą wchodzić grupy kwasowe (odszczepiajace H
+
) i grupy
koordynujące np.. funkcyjne hydroksylowa –OH, -karbonylowa C=O, -C=S, -
O-, -COO
-
,-NH
2
, =N-OH, =NH, -SH.
Ligand w zależności od swoich właściwości może zajmować jedno lub kilka
miejsc koordynacyjnych
2
miejsc koordynacyjnych.
Ligand jednofunkcyjny (prosty) – jedno miejsce, ligandy jednofunkcyjne
tworzą kompleksy homoligandowe (proste) np. [Cu(NH
3
)
4
]
2+
, [Fe(CN)
6
]
4+
,
ą
p
y
g
(p
) p [ (
3
)
4
] , [ (
)
6
] ,
[Ag(NH
3
)
2
]
+
. Jeżeli w kompleksie występują dwa ligandy to są to kompleksy
heteroligandowe (mieszane)
Li
d i l f k j
i l kl
bid
h l
2 l b i
j
Ligand wielofunkcyjny, wielokleszczowy, bidentny, chelatowy- 2 lub więcej
miejsc. Takie kompleksy z ligandami wielofunkcyjnymi mogą tworzyć
kompleksy chelatowe
W zależności od liczby atomów centralnych w cząsteczce kompleksy można
podzielić na:
• jednordzeniowe ML
n
jeden atom metalu
• wielordzeniowe M
m
L
n
wiecej niż jeden atom metalu
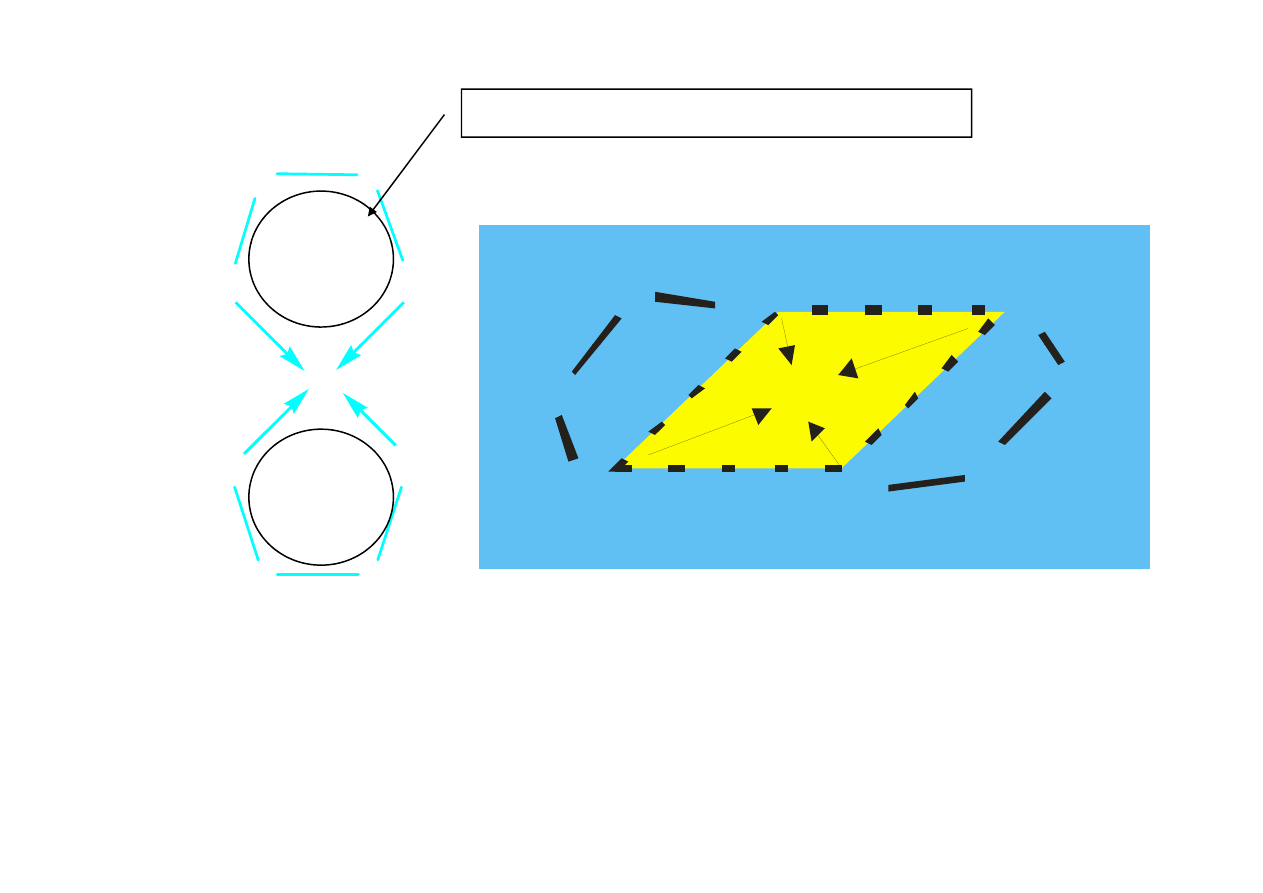
pierścień chelatowy 5-członowy
CH
2
H
2
C
H
H
chela -
z greckiego kleszcze
N
H
2
H
2
N
N
N
H C
2
H
2
H
2
Cu
Cu
CH
2
H C
2
N
H
2
H
2
N
CH
2
N
N
H
2
H
2
CH
2
H
2
C
H
2
H
2
Kompleks Cu(etylenodiamina)
2
Kompleksy chelatowe (pierścieniowe)- utworzone przez
p
y
(p
)
p
ligandy wielokleszczowe
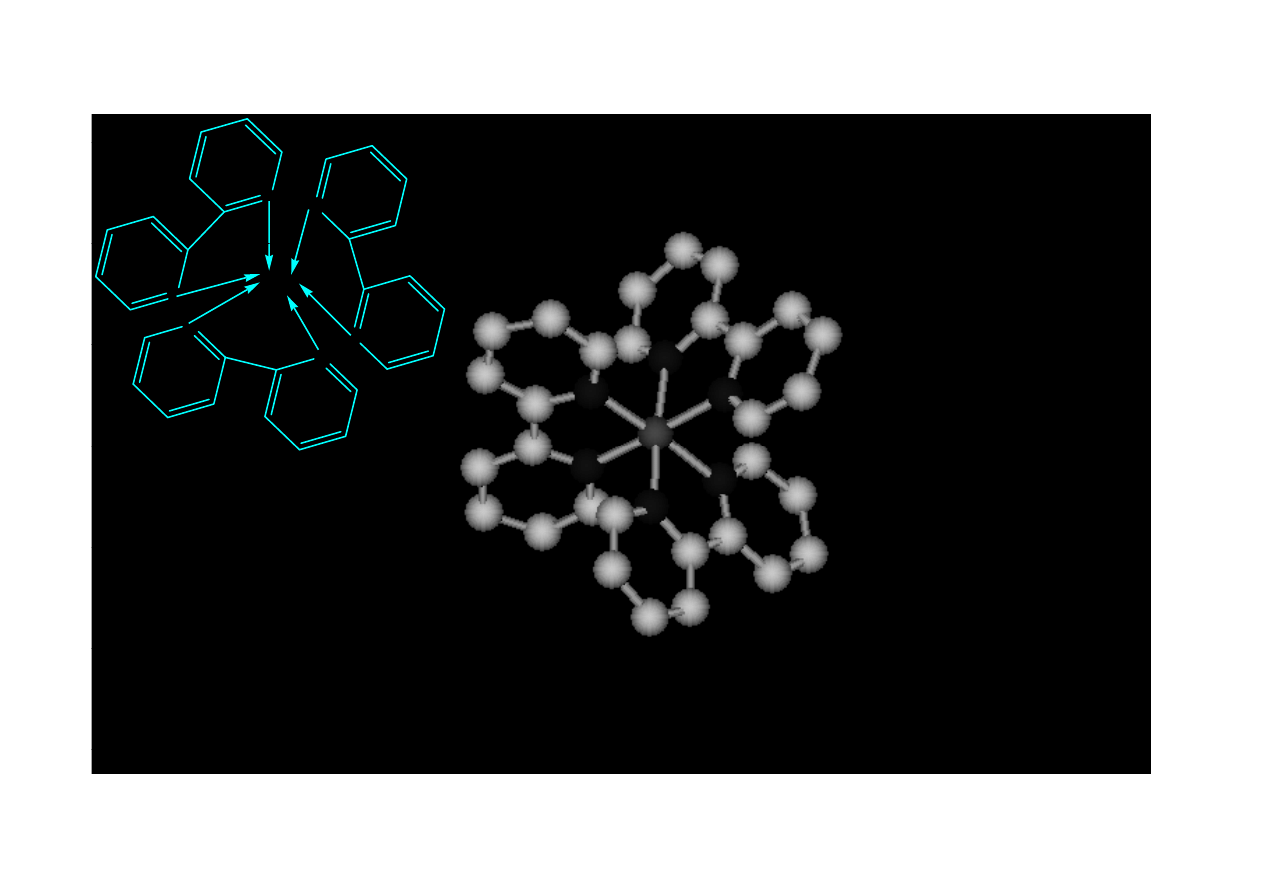
N
N
N
Fe
N
N
N
Fe - α,α ‘− dipirydyl
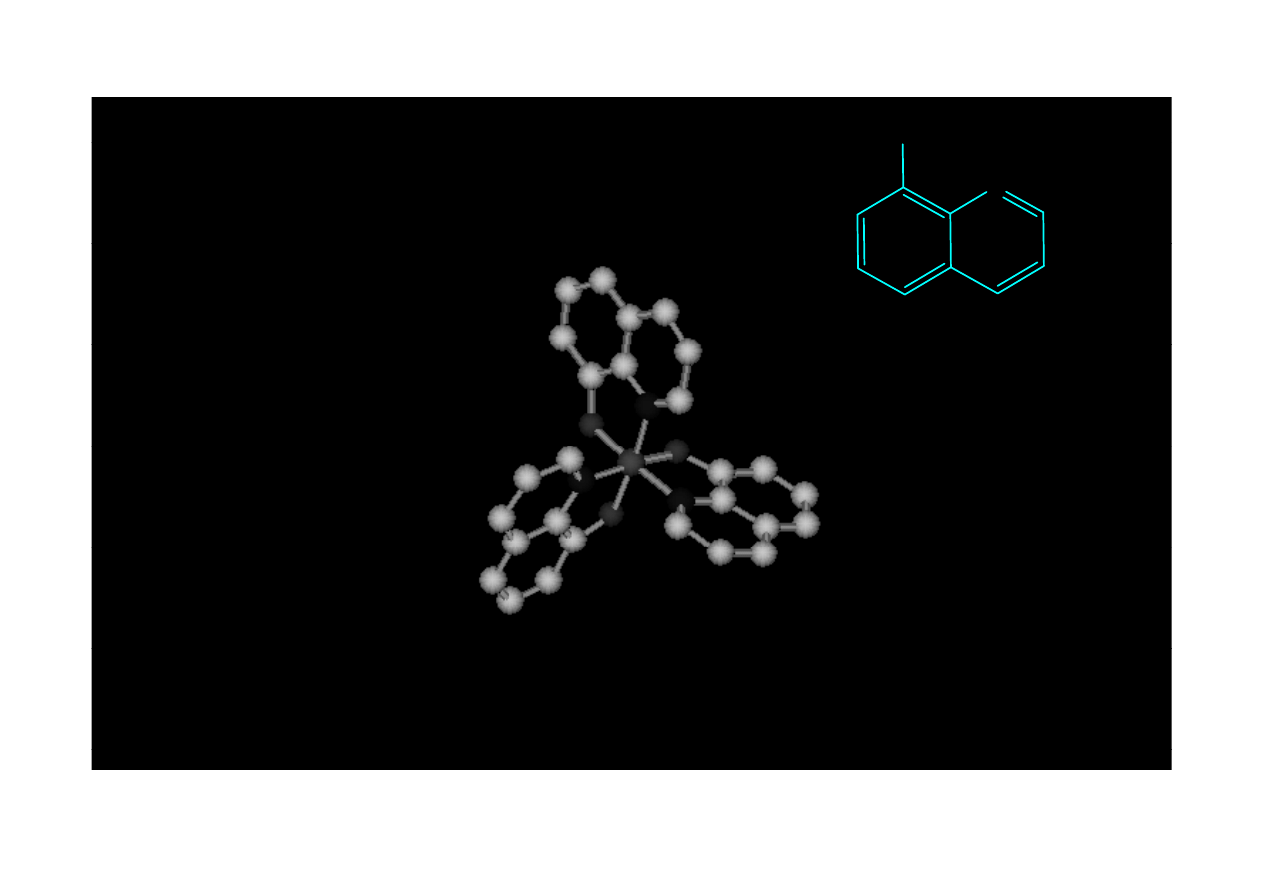
OH
8 hydroksychinolina
N
8-hydroksychinolina
Fe(8-hydchin)
3
Chelat wewnętrzny – ładunek kompleksu równy 0
Chelat wewnętrzny – ładunek kompleksu równy 0
Równowagę rekcje tworzenia kompleksów jonów metali możemy o opisać
stała równowagi nazywaną stała trwałości np..
Fe
3+
+ 6 CN
-
[Fe(CN) ]
3-
β
β
{[Fe(CN)
6
]
3-
}
1 10
42
Fe
3+
+ 6 CN
-
[Fe(CN)
6
]
3-
β =
[Fe
3+
] [CN
-
]
6
= 1 · 10
42
ól i dl
M L ML
β =
[ ML
n
]
ogólnie dla
M + nL ML
n
M + L ML
β
[ M ] [ L]
n
K
[ ML ]
ML + L ML
2
ML
2
+ L ML
3
K
1
=
[ M ] [ L ]
[ ML
2
]
ML
n-1
+ L ML
n
K
2
=
[ ML
2
]
[ ML ] [ L ]
[ ML
n
]
K
n
=
[ ML
n
]
[ ML
n-1
] [ L ]
K
1
·K
2
·K
3
··· ·K
n
= β

Kompleksy chelatowe są trwalsze niż kompleksy proste np.. Cu(II) z
etylenodiaminą jest trwalszy niż Cu(II) z amoniakiem. Zwiększenie
ety enod am ną jest trwa szy n ż
u( ) z amon a em. Zw ę szen e
trwałości w porównaniu z prostymi nazywamy efektem chelatowym. Wzrost
trwałości jest spowodowany większą zmianą entropii podczas tworzenia
kompleksu chelatowego i większą kowalentnością wiązania
kompleksu chelatowego i większą kowalentnością wiązania.
Za kompleksy trwałe uważa się kompleksy, które nie ulegają dysocjacji w
roztworze i charakteryzują się β>10
7
. Znajomość stałych trwałości
y j
ę β
j
y
umożliwia przewidywanie kierunku przebiegu reakcji ligandów i jonów
centralnych. Ligand tworzący kompleks trwalszy będzie wypierał z
kompleksu ligand tworzący słabszy kompleks.
kompleksu ligand tworzący słabszy kompleks.
[Ag(NH
3
)
2
]
2+
+ 2 CN
-
[Ag(CN)
2
]
-
+ 2 NH
3
l β [A (NH ) ]
2+
7 6
lg β [Ag(NH
3
)
2
]
2+
= 7.6
lg β [Ag(CN)
2
]
-
= 21.1
Nie wszystkie kompleksy sa zdolne do wymiany ligandów. Pod tym
względem wymiany ligandów dzielimy kompleksy na labilne i inertne
względem wymiany ligandów dzielimy kompleksy na labilne i inertne
(bierne)

Czynniki wpływające na trwałość kompleksów:
• wewnętrzne ( zależą od właściwości atomu centralnego i ligandów)
• zewnętrzne (zależą od warunków reakcji np.. ciśnienie i temperatura
Duży wpływ na trwałość, a nawet na istnienie jonu kompleksowego w
roztworze ma stężenie liganda i jonu metalu. W przypadku kompleksów
mało trwałych stosuje się duże nadmiar liganda
mało trwałych stosuje się duże nadmiar liganda.
Jeżeli w wyniku reakcji tworzą się jony H
+
to na trwałość wpływa pH.
Najtrwalsze kompleksy tworzą jony metali przejściowych
Najtrwalsze kompleksy tworzą jony metali przejściowych.
A z właściwości liganda duży wpływ na trwałość ma elektroujemność atomu
ligandowego, a także zdolność tworzenia kompleksów chelatowych.
g n w g ,
ż z
n
w z n
mp
w
wy .
Do miareczkowania kompleksometrycznego jako ligandów używa się
kompleksonów zdolnych do tworzenia z oznaczanymi jonami metali trwałych
kompleksów chelatowych:
K
l k
I
k
i
l
i
HOOC
Komplekson I
kwas nitrylotrioctowy
Komplekson II
( H
4
Y, EDTA)
N
HOOC
COOH
p
(
4
,
)
kwas etylenodiaminotetraoctowy
N
N
COOH
NaOOC
Komplekson III
( Na
2
H
2
Y, EDTA)
werenian disodowy sól disodowa
N
N
COONa
HOOC
COOH
werenian disodowy, sól disodowa
kwasu etylenodiaminotetraoctowego
K
l k
IV
HOOC
N
COOH
Komplekson IV
kwas 1,2-
diaminocykloheksano-N,N,N’,N’-
tetraoctowy (CDTA)
N
COOH
y (
)
N
COOH
COOH
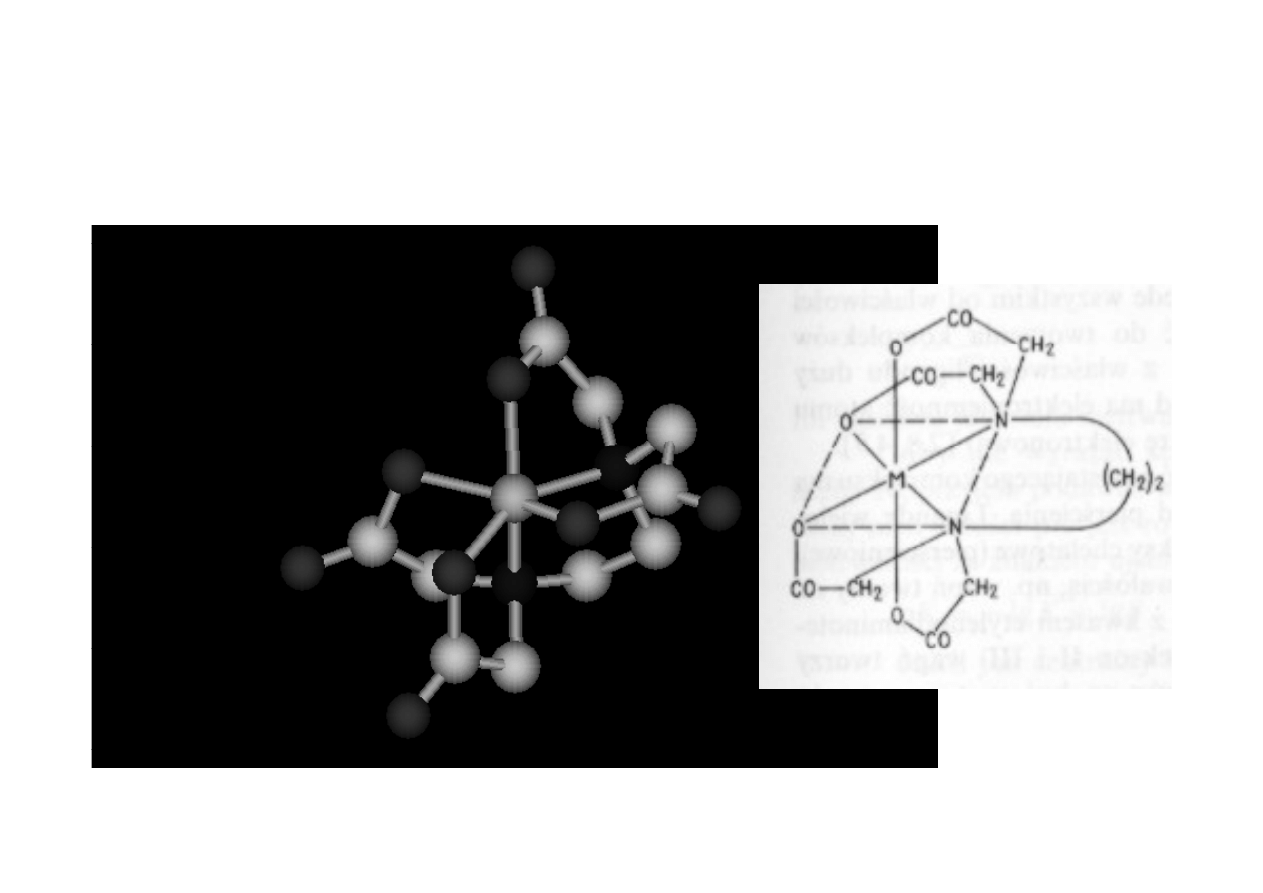
Kompleks metalu z EDTA
M:EDTA=1:1

Trwałość kompleksów z EDTA oprócz właściwości kationu zależy od pH.
Ringboom uszeregował kationy na krzywej przedstawiającej zależność pH
ng oom uszeregowa at ony na rzywej przedstaw ającej za eżność pH
(dla stężenia EDTA 1·10
-5
mol/l) od stałej trwałości
M
n+
+ H
2
Y
2-
MY
n-4
+ 2 H
+
Z krzywej wynika, że im większa jest stała trwałości, tym mniejsze jest
pH przy którym można oznaczać dany kation.
Oznaczanie z EDTA powinno
być wykonywane przy
krzywa Ringbooma
być wykonywane przy
określonym pH
Kationy
M
2+
- pH alkaliczne
Kationy
M
- pH alkaliczne
lub słabo kwaśne
M
3+
- pH 1-2
M
- pH 1-2
M
4+
- pH<1
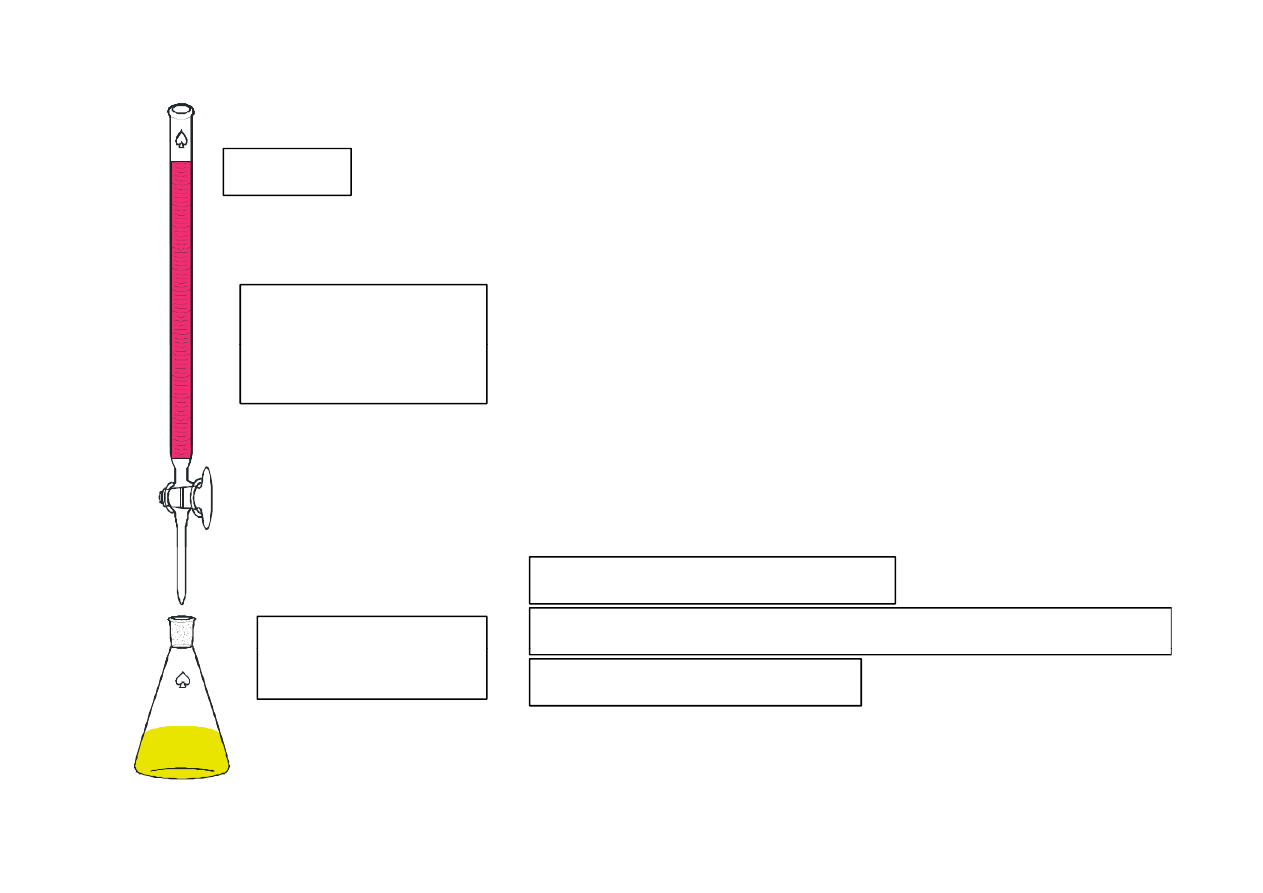
biureta
Roztwór
miareczkujący
miareczkujący
0.05 M EDTA
Kolba
roztwór miareczkowany
jon Zn
2+
+ wskaźnik (Czerń eriochromowa)
Kolba
Erlenmayera
j
bufor amonowy pH~11
zmiana barwy z czerwonej na niebieski
w punkcie równoważnikowym

Kompleksometryczne miareczkowanie roztworem EDTA roztworu jonu
metalu przebiega przy określonym pH co znaczy, że najczęściej
miareczkowanie prowadzi się dodając r-r odpowiedniego buforu.
Do miareczkowania stosuje 0.05 (0.01) M r-r EDTA. Masa molowa
N H Y 2H O 372 10 /m l
Na
2
H
2
Y·2H
2
O – 372.10 g/mol.
Jako wskaźniki stosuje się wskaźniki kompleksometryczne:
d k (
b
k
d
• redoks ( zmiana barwy nastepuje w wyniku zmiany potencjału, gdy jon
metalu
jest
związany
w
kompleks,
błękit
wariaminowy,
3,3’-
dimetylonaftadyna)
y
y
• metalowskaźniki ( dzielą się na 3 grupy):
I- bezbarwne, kwas salicylowy, sulfosalicylowy, tworzą barwne kompleksy z
I bezbarwne, kwas sal cylowy, sulfosal cylowy, tworzą barwne kompleksy z
kationem w zależności od pH;
II- reagują z kationem tworząc zmętnienie - kwas szczawiowy lub
zabarwione laki - galocyjanina;
III- metalochromowe najczęściej stosowane; kompleksują z metalem
tworząc kompleksy o różnych barwach w czasie miareczkowania EDTA
tworząc kompleksy o różnych barwach, w czasie miareczkowania EDTA
wypiera wskaźnik czemu towarzyszy zmiana zabarwienia roztworu.

ś
Miareczkowanie bezpośrednie
:
r-r kationu + wskaźnik + odpowiedni bufor miareczkowanie EDTA
Oznacza się Mg, Ca, Zn, Cd, Cu(II), Ni, Co, Sr, Ba, Mn(II), Al.,
Fe Ce Bi Zr Sc Ga In Hg Tl i lantanowce
Fe, Ce, Bi, Zr, Sc, Ga, In, Hg, Tl i lantanowce
Miareczkowanie odwrotne
dodaje się nadmiar EDTA który odmiareczkowuje się mianowanym
dodaje się nadmiar EDTA, który odmiareczkowuje się mianowanym
roztworem MgSO
4
lub ZnSO
4
. Stosuje się gdy EDTA zbyt wolno reaguje z
metalem lub metal tworzy zbyt silne kompleksy ze wskaźnikiem
Oznacza się Mn, Pb, Al, Hg, Tl, Co, Ni
Najczęściej używane wskaźniki metalochromowe to czerń eriochromowa,
mureksyd, kalces:
mureksyd, kalces
czerń eriochromowa T
pH 6.3
pH 11.5
H
2
F
-
HF
2-
F
3-
p
p
różowy
niebieski
pomarańczowy
SO
3
-
NO
2
reakcja ze wskaźnikiem
N
HO
OH
Mg
2+
+ HF
2-
MgF
-
+ H
+
winnoczerwony
N
N
miareczkowanie EDTA
MgF
-
+ H
2
Y
2-
MY
2-
+ HF
2-
+ H
+
MgF
H
2
Y
MY
HF
H
winnoczerwony
niebieski
bezbarwny
H 10 ż
ć M
2
Z
2
Cd
2
Al
3
M
2
i C
2
przy pH 10 można oznaczać Mg
2+
, Zn
2+
, Cd
2+
, Al
3+
, suma Mg
2+
i Ca
2+
pH 9
pH 11
Mureksyd
H
4
F
-
H
3
F
2-
H
2
F
3-
pH 9
pH 11
czerwono-
fioletowy
N
N
N
O
O
O
H
H
czerwono
fioletowy
fioletowy
N
N
N
+
H
4
N
-
O
O
O
H
H
Do oznaczania Ni
2+
, Co
2+
, Cu
2+
w roztworze amoniakalnym pH>11 i Ca w
alkalicznym pH>13
i bi k
alkalicznym pH>13
NiH
2
F
-
+ H
2
Y
2-
+ 2OH
-
NiY
2-
+ H
2
F
3-
+ H
2
O
żółt
niebiesko-
fioletowy
żółty
CaH
2
F
-
+ H
2
Y
2-
+ 2OH
-
CaY
2-
+ H
2
F
3-
+ H
2
O
czerwona
niebiesko-
fioletowy
Kalces
OH
N
N
OH
OH
HO
3
S
N
N
OH
COOH
HO
3
S
COOH
Do oznaczania wapnia obok magnezu pH 12-14. Zmiana barwy z czerwonej
na niebieską
Wyszukiwarka
Podobne podstrony:
anali srod chem anali4 id 59578 Nieznany (2)
anali srod chem anali1
anali srod chem anali3
anali srod chem anali6
Podst poj i pr chem id 366070 Nieznany
chem fiz 14 11 zad id 111352 Nieznany
analiza chem 2 id 59885 Nieznany (2)
cw rownowaznik subst chem id 12 Nieznany
Podst poj i pr chem id 366070 Nieznany
chem fiz 14 11 zad id 111352 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
więcej podobnych podstron