Miareczkowanie redoksometryczne
Podstawą metody jest rekcja utlenienia i redukcji. Reakcja utlenienia to
reakcja oddawania elektronów, redukcji reakcja przyłączania elektronów.
Ox
1
+ n
1
e
-
→
Red
1
Układ redoks to układ zawierający dwa jony w których ten sam pierwiastek
Układ redoks to układ zawierający dwa jony w których ten sam pierwiastek
ma różne stopni utlenienia np.. Fe
3+
, Fe
2+
, MnO
4
-
, Mn
2+
F
2+
F
3+
5
utlenienie
Fe
2+
→
Fe
3+
+ e
-
·5
MnO
4
-
+ 8 H
+
+ 5 e
-
→
Mn
2+
+ 4 H
2
O ·1
reduktor
utlenienie
redukcja
utleniacz
5 Fe
2+
+ MnO
4
-
+ 8 H
+
→ 5
Fe
3+
+ Mn
2+
+ 4 H
2
O
Układ redoks jest scharakteryzowany przez potencjał redoks, który ma
podstawowe
znaczenie
w
miareczkowaniu
redoksometrycznym.
podstawowe
znaczen e
w
m arecz owan u
redo sometrycznym.
Charakteryzuje on powinowactwo postaci utlenionej układu do elektronów.
Im wyższy potencjał tym silniejszym utleniaczem jest dany układ.
ó
Potencjał układu redoks jest opisany równaniem Nernsta:
Ox
o
a
l
RT
E
E
E
o
– potencjał standardowy
Red
Ox
o
a
ln
nF
E
E
+
=
R - stała gazowa
T - temperatura
n - ilość elektronów
F - stała Faradaya
V
1.52
E
o
/Mn
MnO
2
4
=
+
−
a - aktywność utleniacza i reduktora
V
0.77
E
o
/Fe
Fe
2
3
=
+
+
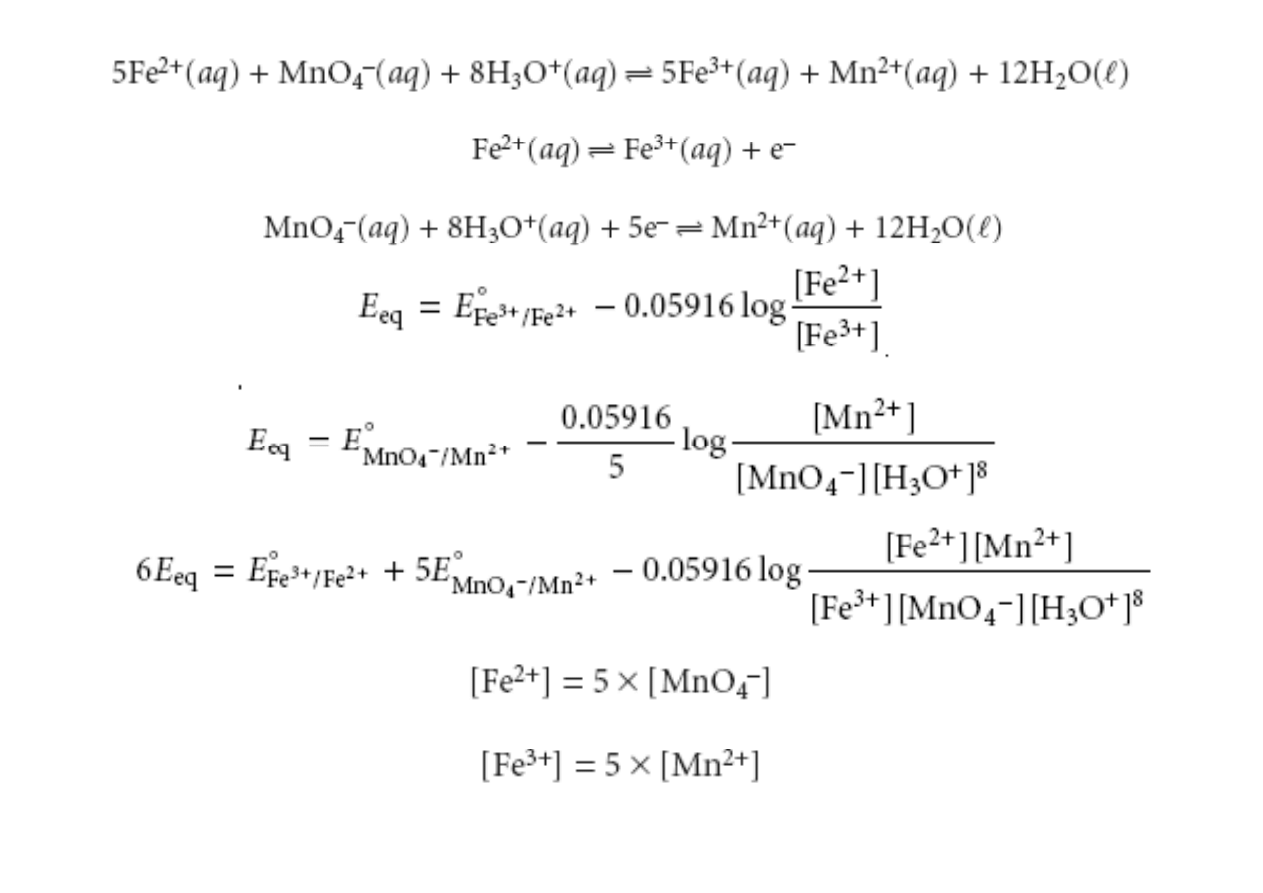
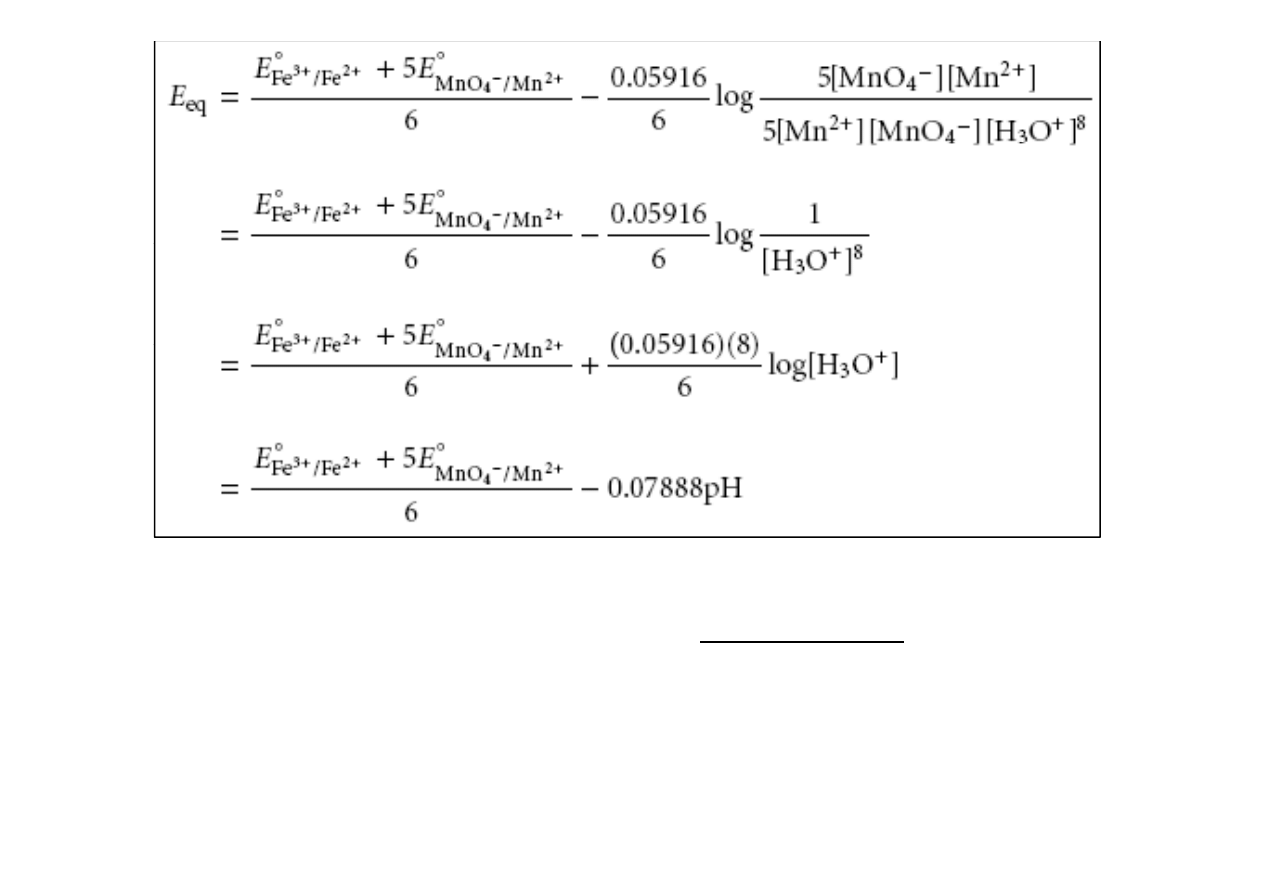
ogólnie dla równań:
Ox
1
+ n e
-
→
Red
1
E
eq
=
nE
o
1
+ mE
o
2
1
1
Ox
2
+ m e
-
→
Red
2
E
eq
m+n
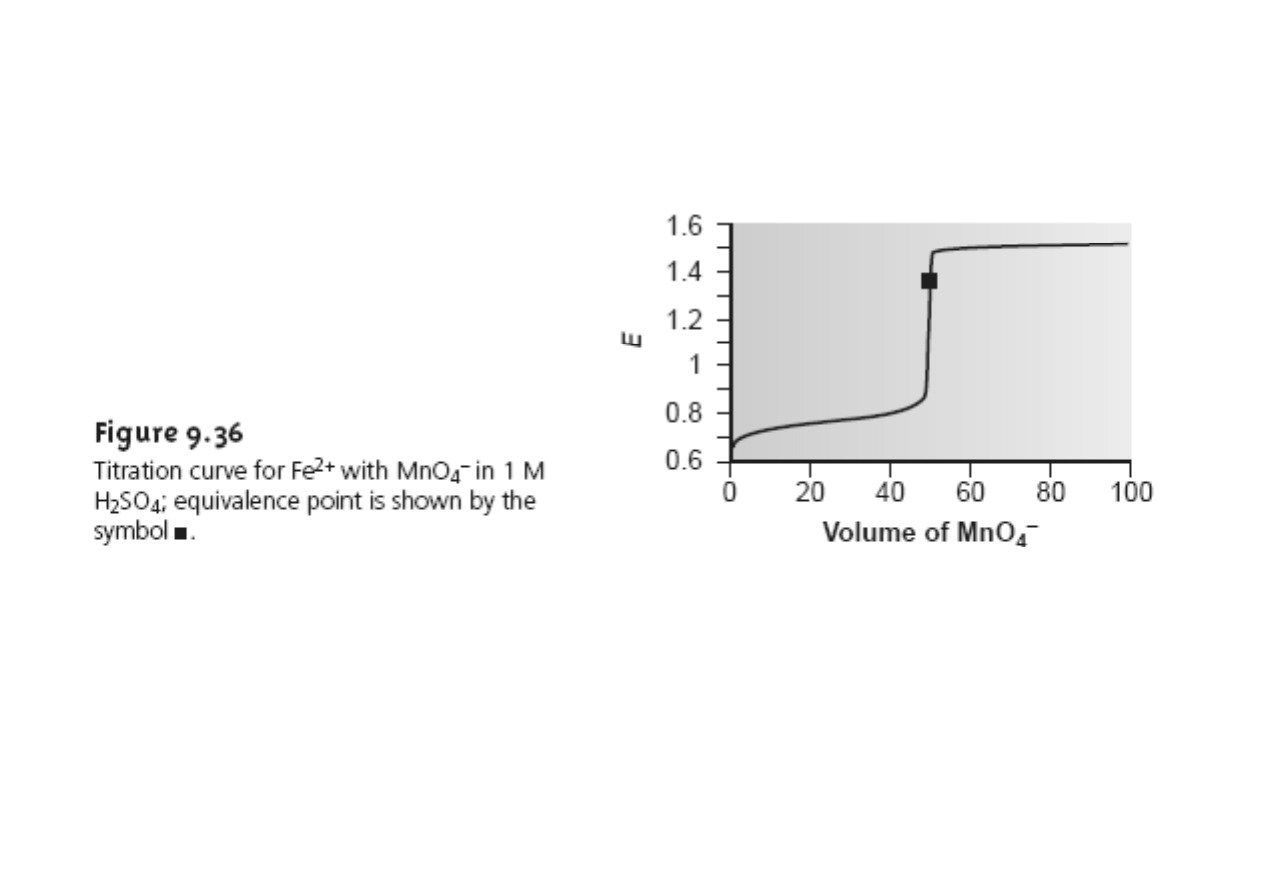
Wartość potencjału redoks dwóch układów decyduje o kierunku przebiegu
reakcji utlenienia-redukcji. Wartość dodatnia potencjału redoks wskazuje,
że reakcja w prawo ujemna w lewo
że reakcja w prawo, ujemna w lewo.
Potencjał układu redoks jest wyznaczany względem gazowej elektrody
wodorowej, której potencjał standardowy umownie wynosi E
o
= 0 V.
Normalna elektroda wodorowa jest to blaszka platynowa pokryta czernią
platynową omywana gazowym wodorem pod ciśnieniem 1 atm ( 1013 25 hPa)
platynową omywana gazowym wodorem pod ciśnieniem 1 atm ( 1013.25 hPa)
w 1 molowym roztworze kwasu o aktywności [H
+
]=1.
2
[H]
0 059
H
2
↔ 2 H ↔ 2 H
+
+ 2e
-
p
E
E
2
2
H
2
o
/H
2H
[H]
ln
2
0.059
+
=
+
Dodatnia wartość potencjału normalnego ukladu Ox/Red oznacza, że postać
utleniona układu Ox ma silniejsze własności utleniające niż jony wodorowe
l b
ć
d k
R d
b
d
d k
lub że postać zredukowana Red wywiera słabsze działanie redukujące niż
wodór elementarny.


Obliczenia w redoksometrii
W reoksometrii wygodne jest posługiwanie się stężeniem
normalnym, pamiętając, że równoważnik w redoksometrii to:
M
Eq =
M
cz
ilość elektronów wymienionych w rekcji
M
M
Eq
KMnO4
=
M
KMnO4
5
Eq
Fe
=
M
Fe
1
Wówczas
w
obliczeniach
nie
musimy
uwzględniać
współczynników stechiometrycznych reakcji. Przyjmujemy,
li b
ili
ó
ikó
b
ji
j
że liczba miligramorównoważników substancji oznaczanej
jest równa miligramorównoważników zużytego titranta.
1000
m
2
Fe
+
1000
Eq
c
v
c
v
2
2
2
4
4
Fe
e
Fe
Fe
MnO
MnO
⋅
=
⋅
=
⋅
+
+
+
−
−
Eq
c
v
2
M O
M O
⋅
⋅
[g]
1000
Eq
c
v
m
2
4
4
2
Fe
MnO
MnO
Fe
+
−
−
+
=

Wskaźnik redoks
K i i
k
i
b ć i d
ó
i
Koniec miareczkowania może być stwierdzony różnymi
sposobami:
• na koniec miareczkowania wskazuje zabarwienie roztworu
w wyniku dodania nadmiaru titranta np.. różowe
zabarwienie KMnO
zabarwienie KMnO
4
• odmiareczkowanie roztworu jodu – odbarwienie
d i l
j d
wydzielonego jodu
• w innych oznaczeniach wizualnych stosuje się wskaźniki
redoks.
Są to substancje tworzące układ redoks, których forma
ą
j
ą
,
y
utleniona i zredukowana może mieć inne zabarwienia.
Wskaźnik musi być dobrany do potencjału przy którym
Wskaźnik musi być dobrany do potencjału przy którym
następuje skok potencjału – skok miareczkowania.

Przegląd metod redoksometrycznych
Manganometria
g
Prowadzi się miareczkowanie roztworem KMnO
4
, który należy do
najsilniejszych utleniaczy. Jest to roztwór łatwo dostępny, zabarwiony na
k l
l
k ź k
kolor malinowy, nie wymaga stosowania wskaźnika.
Przebieg reakcji zależy od pH środowiska.
Może być stosowany do
oznaczania związków nieorganicznych i organicznych zarówno w środowisku
oznaczania związków nieorganicznych i organicznych zarówno w środowisku
kwaśnym jak i zasadowym. Gdy stężenie H
2
SO
4
jest większe od 0.05 M
zachodzi reakcja:
MnO
4
-
+ 8 H
+
+ 5 e
-
→
Mn
2+
+ 4 H
2
O
E
o
= 1.52 V
Reakcje można stosować do oznaczania:
Reakcje można stosować do oznaczania:
Fe
2+
, As
3+
, Sb
3+
, C
2
O
4
2-
, NO
2
-
, [Fe(CN)
6
]
4-
, H
2
O
2
, Na
2
O
2
, nadboranów,
nadwęglanów oraz do oznaczeń pośrednich polegających na redukcji
ęg
p
p
g ją y
j
nadmiarem FeSO
4
lub NaAsO
2
i odmiareczkowanie nadmiaru reduktora
roztworem KMnO
4
.

W roztworach słabo kwaśnych i alkalicznych jon MnO
4
-
redukuje się do Mn
4+
MnO
4
-
+ 4H
+
+ 3e
-
MnO
2
+ 2H
2
O E
o
= 1.67 V
Reakcja ta umożliwia oznaczenia substancji w środowisku obojetnym lub
słabo alkalicznym.
y
W tym środowisku oznacza się CN
-
utleniają się do cyjanianów, S
2-
, SO
3
2-
,
S
2
O
3
2-
do SO
4
2-
.
W środowisku silnie alkalicznym ( 1 M NaOH ) zachodzi redukcja MnO
4
-
do
Mn
6+
M O
M O
2
E
0 54 V
MnO
4
-
+ e
-
MnO
4
2-
E
o
= 0.54 V
W środowisku alkalicznym można oznaczyć:
• jodki obok bromków, które nie ulegają utlenieniu
• aldehyd mrówkowy utleniający się do węglanów
• fosforyny i podfosforyny utleniane do fosforanów
• oraz wiele substancji organicznych, które utleniają się do węglanów i
szczawianów

Miano roztworu KMnO
4
-
ustawia się na H
2
C
2
O
4
, Na
2
C
2
O
4
i As
2
O
3
2 MnO
4
-
+ 5 C
2
O
4
2-
+ 16 H
+
10 CO
2
+ 2 Mn
2+
+ 8 H
2
O
Oznaczanie żelaza
2 Fe
3+
+ Sn
2+
2 Fe
2+
+ Sn
4+
2 Fe
3
+ Sn
2
2 Fe
2
+ Sn
4
SnCl
2
+ HgCl
2
SnCl
4
+ Hg
2
Cl
2
5 F
2+
M O
8 H
+
5 F
3+
M
2+
4H O
5 Fe
2+
+ MnO
4
-
+ 8 H
+
→
5 Fe
3+
+ Mn
2+
+ 4H
2
O
Mieszaniana Zimmermana-Reinhardta ( MnSO
4
, H
3
PO
4
, H
2
SO
4
)
O
i
i
Oznaczenie wapnia
Ca
2+
+ C
2
O
4
2-
CaC
2
O
4
↓
CaC
2
O
4
+ H
2
SO
4
H
2
C
2
O
4
+ CaSO↓
2 MnO
4
-
+ 5 C
2
O
4
2-
+ 16 H
+
10 CO
2
+ 2 Mn
2+
+ 8 H
2
O
O
i
t ó
Oznaczenie azotynów
2 MnO
4
-
+ 5 NO
2
-
+ 6 H
+
2 Mn
2+
+ 5 NO
3
-
+ 3 H
2
O
nadmiar KMnO
4
, następnie KI i odmiareczkowuje się wydzielony jod
roztworem Na
2
S
2
O
3
Oznaczenie wody utlenionej
y
j
2 MnO
4
-
+ 5 H
2
O
2
+ 6 H
+
2 Mn
2+
+ 5 O
2
+ 8 H
2
O
Oznaczanie wandu
Oznaczanie wandu
5 VO
2+
+ MnO
4
-
+ 11 H
2
O
5 VO
4
3-
+ Mn
2+
+ 22 H
+
wanad utlenia się do wandynów nadmiarem KMnO następnie redukuje się
wanad utlenia się do wandynów nadmiarem KMnO
4
, następnie redukuje się
dwutlenkiem siarki nadmiar KMnO4 do Mn
2+
, a wanadyny do jonów
wanadylowych. Po usunięciu SO
2
strumieniem CO
2
prowadzi się
i
k
i
miareczkowanie
Oznaczanie chromu
6 Cr
3+
+ 3 ClO
4
-
+ 9 H
2
O 3
Cr
2
O
7
2-
+ 3 Cl
-
+ 18 H
+
dodaje się nadmiar Fe
2+
, który odmiareczkowuje się roztworem KMnO
4
Jodometria
Substancje oznacza się za pomocą miareczkowania mianowanym
Substancje oznacza się za pomocą miareczkowania mianowanym
roztworem jodu lub odmiareczkowuje się wydzielony jod.
Jodometria zajmuje szczególną pozycje wśród metod
Jodometria zajmuje szczególną pozycje wśród metod
miareczkowych co wynika z potncjału normalnego I
2
/2I
-
:
I + 2 e
-
2I
-
E
o
= 0 535 V
I
2
+ 2 e
-
2I
-
E
o
= 0.535 V
Można ją zaliczyć zarówno do metod oksydymetrycznych
( miareczkowanie roztworem jodu) jak i metod
reduktometrycznych ( miareczkowanie wydzielonego jodu,
najczęściej roztworem tiosiarczanu)

S bst
j
j d
t
i
ż d i lić d i
Substancje oznaczane jodometrycznie można podzielić na dwie
grupy:
1
b
k ó
h
l
d
1. Substancje, których potencjały utleniające są niższe od
potencjału układu I
2
/2I
-
, który wynosi 0.535 V.
Substancje te można bezpośrednio miareczkować
mianowanym roztworem jodu. Są to np.. S
2-
, SO
3
2-
, S
2
O
3
2-
,
As(III) Sn(II) i inn
As(III), Sn(II) i inne.
2. Substancje o potencjale wyższym od potencjału I
2
/2I
-
,
k ó l i j I d l
j d
W d i l
j d
il ś i
które utleniają I
-
do wolnego jodu. Wydzielony jod w ilości
równoważnej do ilości substancji oznaczanej
odmiareczkowuje się mianowanym roztworem Na S O
odmiareczkowuje się mianowanym roztworem Na
2
S
2
O
3
I
2
+ 2 S
2
O
3
2-
2 I
-
+ S
4
O
6
2-
Metodą pośrednią
( przez miareczkowanie tiosiarczanem
oznacza się liczne substancje utleniające np.. bromiany, jodany,
di h
i
h
i
d
i
hl
d l
k
dichromiany, chromiany, nadmanganiany, chlor, nadtlenek
wodoru, Cu(II), Fe(III)
Potencjał układu I
2
/2I
-
, nie zależy od stężenia jonów
wodorowych w zakresie do pH 9. W roztworze alkalicznym
potencjał ten maleje w wyniku reakcji
potencjał ten maleje w wyniku reakcji
I
2
+ 2OH
-
IO
-
+ I
-
+ H
2
O
utworzony podjodyn ulega szybko reakcji dysproporcjonacji
3 IO
-
IO
3
-
+ 2 I
-
3 IO
IO
3
+ 2 I
Reakcje te umożliwiają miareczkowanie jodem w środowisku
zasadowym Wskaźnikiem końca miareczkowania może być sam
zasadowym. Wskaźnikiem końca miareczkowania może być sam
jod, który wykazuje żółte lub brunatne zabarwienie. Do
wykrywania śladowych ilości jodu stosuje się wodną zawiesinę
wykrywania śladowych ilości jodu stosuje się wodną zawiesinę
skrobi, która z jodem tworzy garanatowe zabarwienie

Mianowany roztwór jodu
otrzymuje się przez rozpuszczenie jodu w roztworze KI, gdyż w wodzie
rozpuszcza się nieznacznie.
I
2
+ I
-
I
3
-
Reakcja jest odwracalna i nadmiar jodków przesuwa ją w prawo. Utworzenie
I
3
zmniejsza błędy wynikające z lotności jodu. Roztwory I
2
w KI
przechowuje się w ciemnym szkle ponieważ I
-
utleniają się do I Roztwór
przechowuje się w ciemnym szkle ponieważ I utleniają się do I
2
. Roztwór
jodu mianuje się na arszenik As
2
O
3
.
2 I
2
+ As
2
O
3
+ 2 H
2
O
As
2
O
5
+ HI
2 I
2
As
2
O
3
2 H
2
O
As
2
O
5
HI
Mianowany roztwór tiosiarczanu sodowego
2 S O
2
S O
2
2
E 0 17 V
2 S
2
O
3
2-
S
4
O
6
2-
+ 2 e
-
E
o
= 0.17 V
Odmiareczkowanie jodu prowadzi się w środowisku kwaśnym, ale w bardzo
kwaśnym środowisku kwas rozkłada jony S O
2-
z wydzieleniem siarki Miano
kwaśnym środowisku kwas rozkłada jony S
2
O
3
2
z wydzieleniem siarki. Miano
tiosiarczanu sodowego ustawia się na K
2
Cr
2
O
7
lub na mianowany roztwór
KMnO
4
Cr
2
O
7
2-
+ 6 I
-
+ 14 H
+
Cr
3+
+ 3 I
2
+ 7 H
2
O

Przykłady oznaczeń jodometrycznych
oznaczenie As
2
O
3
2 I
2
+ As
2
O
3
+ 2 H
2
O
As
2
O
5
+ HI
oznaczenie Cu
2 Cu
2+
+ 4I
-
2 CuI↓ + I
2
oznaczanie siarczków
oznaczanie siarczków
H
2
S + I
2
S + 2 H
+
+ 2 I
-
pośrednio można oznaczyć
wiele metali wytrącając je jako siarczki
oznaczenie cyny
Sn
2+
+ I
2
Sn
4+
+ 2 I
-
środowisko kwaśne
2
SnO
2
2-
+ I
2
+ H
2
O SnO
3
2-
+ 2 I
-
+ 2 H
+
środowisko alkaliczne
oznaczenie siarczynów
oznaczenie siarczynów
SO
3
2-
+ I
2
+ H
2
O SO
4
2-
+ 2 I
-
+ 2 H
+
oznacznie tiocyjanianów
oznacznie tiocyjanianów
SCN
-
+ 3 I
2
+ 4 H
2
O
6 I
-
+ HCN + SO
4
2-
+ 7 H
+
Substancje organiczne
aldehyd mrówkowy
HCHO + H
2
O + I
2
2 HI + HCOOH
fenol C
6
H
5
OH + 3 Br
2
C
6
H
2
Br
3
OH + 3 HBr
BrO
3
-
+ 5 Br
-
+ 6 H
+
3 Br
2
+ 3 H
2
O
3
2
2
brom oznacza się jodometrycznie
Br
2
+ 2 I
-
2 Br
-
+ I
2
Br
2
2 I
2 Br
I
2
Oznaczanie substancji o potencjale wyższym niż potencjał I
2
/2I
-
Fe(III)
2 Fe
3+
+ 2I
-
2 Fe
2+
+ I
Fe(III)
2 Fe
3+
+ 2I
2 Fe
2+
+ I
2
Pb i Ba
2 PbCrO
4
+ 2 H
+
Cr
2
O
7
2-
+ Pb
2+
+ H
2
O
C O
2
6 I
14 H
+
C
3+
3 I
7 H O
Cr
2
O
7
2-
+ 6 I
-
+ 14 H
+
Cr
3+
+ 3 I
2
+ 7 H
2
O
I
2
+ 2 S
2
O
3
2-
2 I
-
+ S
4
O
6
2-
H
2
O
2
H
2
O
2
+ 2 I
-
+ 2 H
+
I
2
+ 2 H
2
O
MnO
2
MnO
2
+ 4 HCl
MnCl
2
+ H
2
O + Cl
2
Cl
2
+ 2 I
-
2Cl
-
+ I
2
ClO
-
, Cl
2
ClO
-
+ 2 I
-
+ 2H
+
I
2
+ Cl
-
+ H
2
O
Cl
2
+ 2 I
-
2Cl
-
+ I
2
Bromianometria
stosuje się do miareczkowania roztwór bromianu potasu
BrO
3
-
+ 6 H
+
+ 6 e
-
Br
-
+ 3 H
2
O
·1 E
o
= 1.44 V
2 Br
-
Br
2
+ 2 e
-
BrO
3
-
+ 5 Br
-
+ 6 H
+
3Br
2
+ 3 H
2
O
·3
W oznaczeniach bromianometrycznych stosuje się sam bromian lub w
mieszaninie z bromkiem który w roztworze kwaśnym reaguje jak
mieszaninie z bromkiem, który w roztworze kwaśnym reaguje jak
równoważny roztworom bromu.
Bezpośrednio można oznaczyć Sn(II) Fe(II) Sb(III) As(III) Tl(I)
Bezpośrednio można oznaczyć Sn(II), Fe(II), Sb(III), As(III), Tl(I).
Stosuje się nieodwracalne wskaźniki redoks np.. oranż metylowy, czerwień
metylową. Metodą z zastosowaniem układu bromian –bromki można oznaczyć
wiele związków organicznych o charakterze fenoli np fenol anilinę kwas
wiele związków organicznych o charakterze fenoli np.. fenol, anilinę, kwas
sufanilowy. Substancje te po rozpuszczeniu zadaje się KBr i miareczkuje
bromianem w środowisku kwaśnym. Wydziela się brom
in statu nascendi
,
któ
dst i
t m
d
i ś i i b
m N dmi
b m
który podstawia atomy wodoru w pierścieniu benzenowym. Nadmiar bromu
oznacza się przez zadanie roztworem KI i odmiareczkowanie jodu
roztworem Na
2
S
2
O
3
.

Jodanometria
Stosuje się jodan potasowy. Podobnie jak w przypadku bromianometrii
k
k d d
d k k ó k ś
największe znaczenie ma układ jodan-jodek, który w kwaśnym roztworze
wywiazuje od razu jod, reagujacy tak samo jak zwykły roztwór jodu.
IO
-
+ 5 I
-
+ 6 H
+
3 I + 3 H O
E
o
= 1 19 V
IO
3
+ 5 I + 6 H
+
3 I
2
+ 3 H
2
O
E
o
= 1.19 V
Chromianometria
Stosuje się K Cr O w środowisku kwaśnym
Stosuje się K
2
Cr
2
O
7
w środowisku kwaśnym
Cr
2
O
7
2-
+ 14 H + 6H
+
2 Cr
3+
+ 7 H
2
O
E
o
= 1.36 V
Z l t j t t ż i tl i t
k j
j HCl j ż li j
Zaletą jest to, że nie utlenia on w temp. pokojowej HCl, jeżeli jego
stężenie nie jest większe od 1-2 mol/l. Jest to ważna własność ponieważ
HCl jest często używany do rozpuszczania stopów, rud i innych materiałów.
ó
2
ś
ó
Główne zastosowanie do oznaczania Fe
2+
w obecności jonów chlorkowych.
Cerometria
Stosuje się sole Ce(IV) jako Ce(ClO
4
) , CeCl
4
ale najczęściej siarczan
cerowo-amaonowy (NH
4
)
2
Ce(SO
4
)
3
· 2 H
2
O
C
4
C
3
E 1 44 H 0 il tl i
Ce
4+
+ e
-
Ce
3+
E
o
= 1.44 pH 0 silny utleniacz

Miareczkowanie reduktometryczne
Ferometria
Stosuje się sole żelaza Fe(II) najczęściej jako roztwór FeSO
4
lub soli
Mohra (NH
4
)
2
Fe(SO
4
)
2
· 6 H
2
O. Roztwory nie są trwałe bowiem łatwo
ulegają utlenieniu Ferometrię stosuje się do oznaczania silnych utleniaczy
ulegają utlenieniu. Ferometrię stosuje się do oznaczania silnych utleniaczy
jak Mn(VII), Ce(IV), Cr(VI) i V(V).
Tytanometria
Uż
i
i
Ti(III) l ż d il
h d kt ó
Używa się mianowany r-r Ti(III), należy do silnych reduktorów
Ti
3+
+ H
2
O
TiO
2+
+ 2 H
+
+ e
-
E
o
= 0.1 V
Tytanometrie można stosować do oznacznia utleniaczy soli Fe(III), Cr(VI),
NO
3
-
, ClO
3
-
, ClO
4
-
, S
2
O
8
2-
, nadboranów, soli metali ciężkich i szlachetnych, a
także organicznych soli nitrowych, nitrozowych, azowych
g
y
y ,
y ,
y
Sole Ti
3+
szybko utleniają się podczas przechowywania.
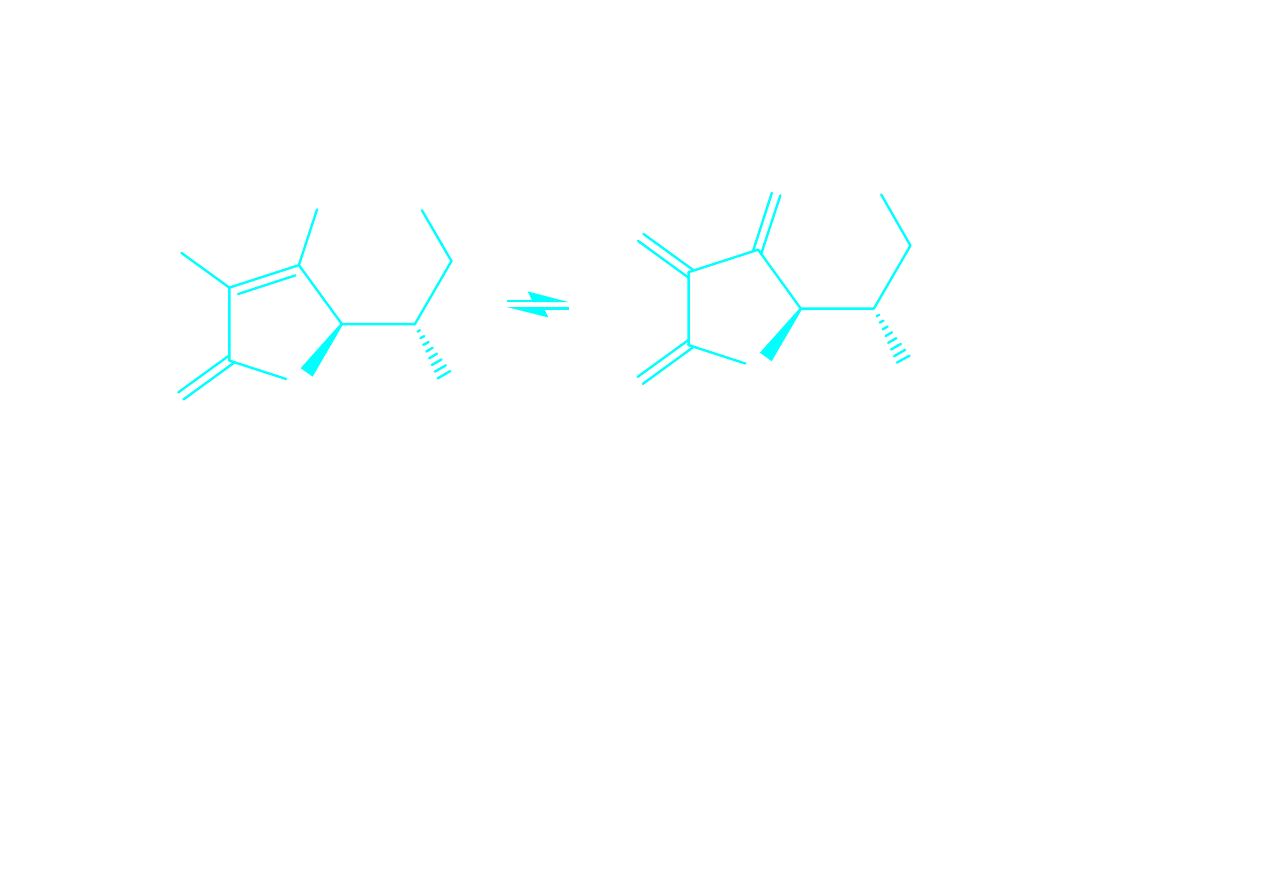
Askorbinometria
stosuje się roztwór witaminy C, który ma własności redukujące
OH
HO
HO
O
HO
O
HO
+ 2 H
+
+ 2 e
-
OH
O
O
OH
O
O
kwas askorbinowy
(postać zredukowana)
kwas dehydroaskorbinowy
(postać utleniona)
przy pH 7
E
o
= 0.19 V
przy pH 7
E 0.19 V
Tą metodą można oznaczyć I
2
, IO
3
-
, BrO
3
-
, NO
3
-
, MnO
4
-
, AsO
4
3-
,
Fe(CN)
6
3-
, Cu
2+
, Fe
3+
, Ce
4+
, Ag
+
, Hg
2+
i wiele związków organicznych. Można
(
)
6
g
g
g
y
oznaczyć żelazo w obecności azotanów, fosforanów, a nawet fluorków, które
przeszkadzają w innych metodach.

Wyszukiwarka
Podobne podstrony:
anali srod chem anali5 id 59579 Nieznany
anali srod chem anali1
anali srod chem anali3
anali srod chem anali6
Podst poj i pr chem id 366070 Nieznany
chem fiz 14 11 zad id 111352 Nieznany
analiza chem 2 id 59885 Nieznany (2)
cw rownowaznik subst chem id 12 Nieznany
Podst poj i pr chem id 366070 Nieznany
chem fiz 14 11 zad id 111352 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
więcej podobnych podstron