
Narkotyczne leki
przeciwbólowe
Opioidowe środki przeciwbólowe
Ból: definicja wg International Association for the
Study of Pain 1979r
Jest nieprzyjemnym doznaniem czuciowym i
emocjonalnym, związanym zarówno z
działaniem bodźca uszkadzającego lub
bodźca, którego działanie zagraża
wystąpieniem takiego uszkodzenia, jak i
spostrzeżeniem powstającym na podstawie
psychicznej interpretacji zachodzących
zjawisk, zmodyfikowanym przez
wcześniejsze doświadczenia i
psychosomatyczne uwarunkowania
Ból
Transdukcja szkodliwych bodźców
Komponenta kognitywna
Komponenta emocjonalna
Rola ostrzegawcza, ochronna
Rodzaje bólu: kryterium czasu
Ból ostry: < 3 m-ce
Ból przewlekły: > 3 m-ce
Ból przetrwały: dolegliwości bólowe
utrzymują się pomimo wygojenia tkanek
Ból ostry i ból przewlekły
Ból ostry
Ból przewlekły
Brak lub nieprawidłowo
prowadzone leczenie
przeciwbólowe powodują
utrzymywanie się bólu,
związane z narastaniem zmian
patofizjologicznych w OUN i
zjawiskiem neuroplastyczności
OUN
Rodzaje bólu
Receptorowy - nocyceptywny
Niereceptorowy:
Rodzaje bólu: kryterium – typ
bodźca
Fizjologiczny: pojawia się podczas
działania bodźca nocyceptywnego nie
powodującego uszkodzenia
tkanek
Kliniczny: z uszkodzeniem tkanek i
nadwrażliwością spowodowaną
zmianami wrażliwości pierwotnych
zakończeń czuciowych (obwodowa
sensytyzacja). Np. ból pooperacyjny
Ból receptorowy stanowi rodzaj
zmysłu
– czucie nocyceptywne pełni
rolę informacyjno – ostrzegawczą
Ból patologiczny
(niereceptorowy,
neuropatyczny)
jest objawem
choroby
Skutki bólu
Fizjologicznego:
Aktywacja motoneuronów
i odruchowy skurcz mm
szk.
Wzrost napięcia mm
Aktywacja współczulnych
neuronów
przedzwojowych
Klinicznego:
Powstanie nadwrażliwości
– sensytyzacja obwodowa i
ośrodkowa
Allodynia
Hiperalgezja
Bóle spontaniczne
Bóle rzutowane
RODZAJE BÓLU
Receptorowy Zapalny
Neuropatyczny
Anatomiczna klasyfikacja bólu (1)
Ból receptorowy
Terapia: NLPZ, znieczulenie powierzchniowe
Ból przewodowy (neuropatyczny)
Terapia: środki p/bólowe nieskuteczne; blokady
przewodzenia, neuroliza alkoholem, fenolem
Anatomiczna klasyfikacja bólu (2)
Ból ośrodkowy
– zmiany organiczne lub
czynnościowe w samym mózgu
Terapia: AED, psychotropowe, psychoterapia
Pojęcia związane z bólem
¾
Hiperalgezja
- nadwrażliwość na ból, przeczulica
nadmierne odczuwanie bólu wywołane bodźcem
o umiarkowanej sile; wzrost odpowiedzi na
stymulację
¾
Hipoalgezja
– zmniejszone odczuwanie bólu
¾
Allodynia
- ból wywołany przez bodziec
fizjologiczny; obniżenie progu bólowego
¾
Anestezja
– zniesienie czucia, w tym czucia
bólu
¾
Nocycepcja
- proces przewodzenia impulsów od
miejsca działania do CNS
¾
Analgezja
– zniesienie czucia bólu
Ból przewlekły - patogeneza
Nie jest przedłużoną wersją bólu ostrego
,
gdyż dochodzi w nim do
zjawisk pamięci
w
drogach przewodzenia, co powoduje
nadwrażliwość na bodźce bólowe
Głównym mediatorem bólu przewlekłego są
EAA, działające poprzez receptory NMDA i
AMPA
Nocycepcja
Jest to proces powstawania odczucia
bólowego.
Jednocześnie jest to jedynie fizjologiczny
proces powstawania bólu; klinicznym
wykładnikiem nocycepcji jest cierpienie.
W procesie tym wyróżniamy:
Transdukcję
Przewodzenie (transmisję)
Modulację
Percepcję
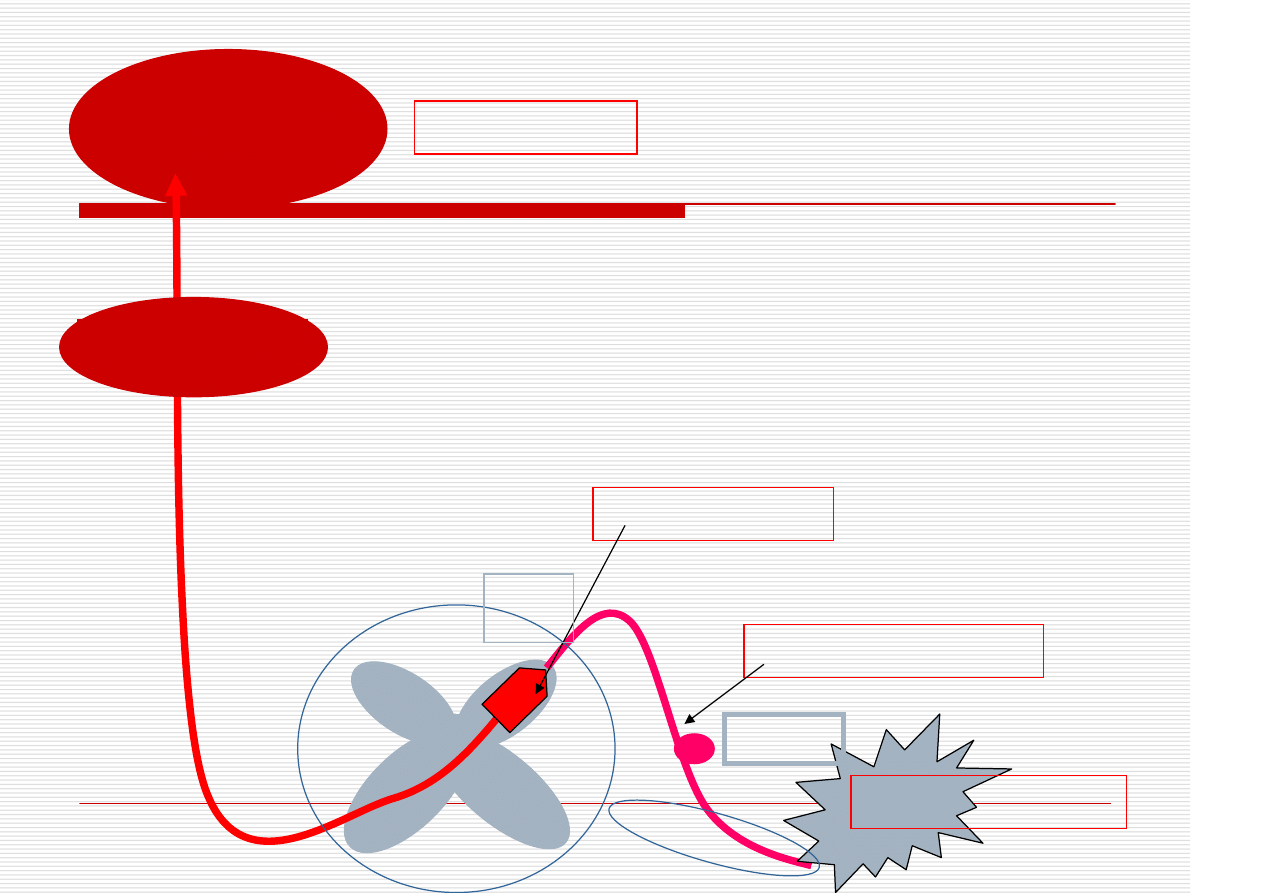
TRANSDUKCJA
PRZEWODZENIE
MODULACJA
PERCEPCJA
RT
WZGÓRZE
KORA
MÓZGOWA
ZRT
Transdukcja bodźca bólowego
Zamiana energii działającego bodźca
(mechanicznego, termicznego,
chemicznego) na impuls
bioelektryczny przewodzony
włóknami nerwowymi
W obwodowych zakończeniach
neuronu I (nocyceptorowego) - w
nocyceptorach na włóknach C i Aδ
Nocyceptor - definicja
Pierwotny neuron czuciowy, aktywowany przez
bodźce uszkadzające tkanki
Posiada określone, charakterystyczne cechy:
próg wrażliwości
Wiele typów:
Mechanoreceptory
Chemoreceptory
Termoreceptory
Mechaniczno-termiczne receptory
Receptory polimodalne reagujące na bodźce
mechaniczne, termiczne i chemiczne
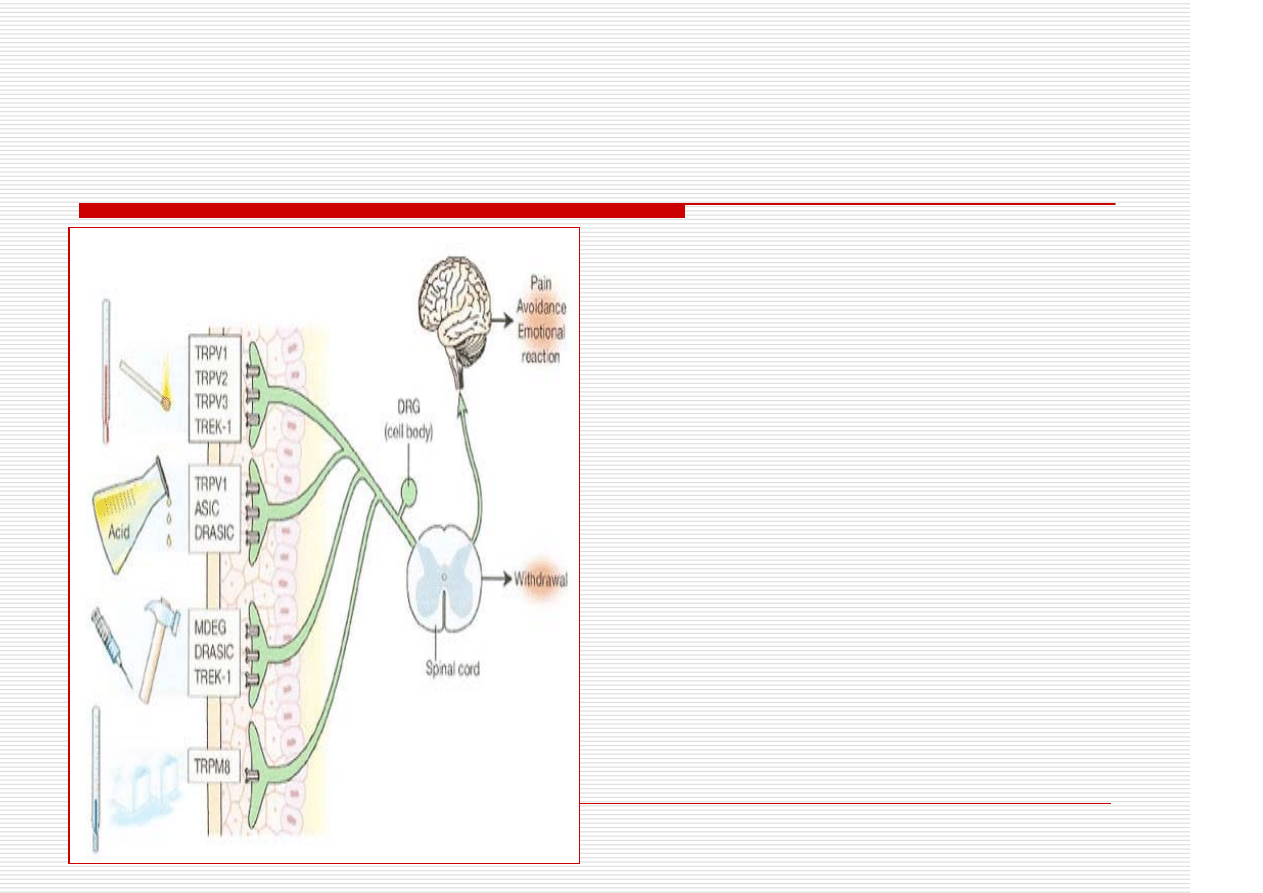
Detekcja bodźców szkodliwych
Ciepło:
TRPV1, 2, 3
(włókna C i Aδ)
Zimno:
kanały TRPM8,
ANKTM1 = TRPA1
(włókna C i Aδ)
Czynniki mechaniczne:
niektóre kanały sodowe,
ASIC2 = BNC1, ASIC3
(Acid sensing ion
channels), receptory P2Y
(włókna C i Aδ)
Czynniki chemiczne:
kwasy - TRPV1, ASIC
(włókna C)
Drogi przewodzenia bólu
Ciało I neuronu: w zwoju rdzeniowym
Ciało II neuronu: rogi tylne RK.
Wypustki przechodzą na 2gą stronę i
tworzą drogę rdzeniowo-wzgórzową
Wzgórze: III neuron (jądra: brzuszne
tylnio-boczne i tylnio-przyśrodkowe).
Jego wypustki osiągają pień mózgu
Pień mózgu: PAG i TS
W RK oprócz tego jest
wielosynaptyczny układ wstępujący-
dodatkowa droga bólowa
Włókna typu C
Grubsze niż włókna A i wolniejsze, wrażliwe na
uszkodzenie
Brak mieliny- powolne przewodzenie bólu- 0.5-
2m/s
Przybliżona lokalizacja bólu, ból tępy !!!
Receptory opioidowe, TRPV
Część wrażliwa silnie na HA- bodźce świądowe
Większość stanowi polimodalne nocyceptory
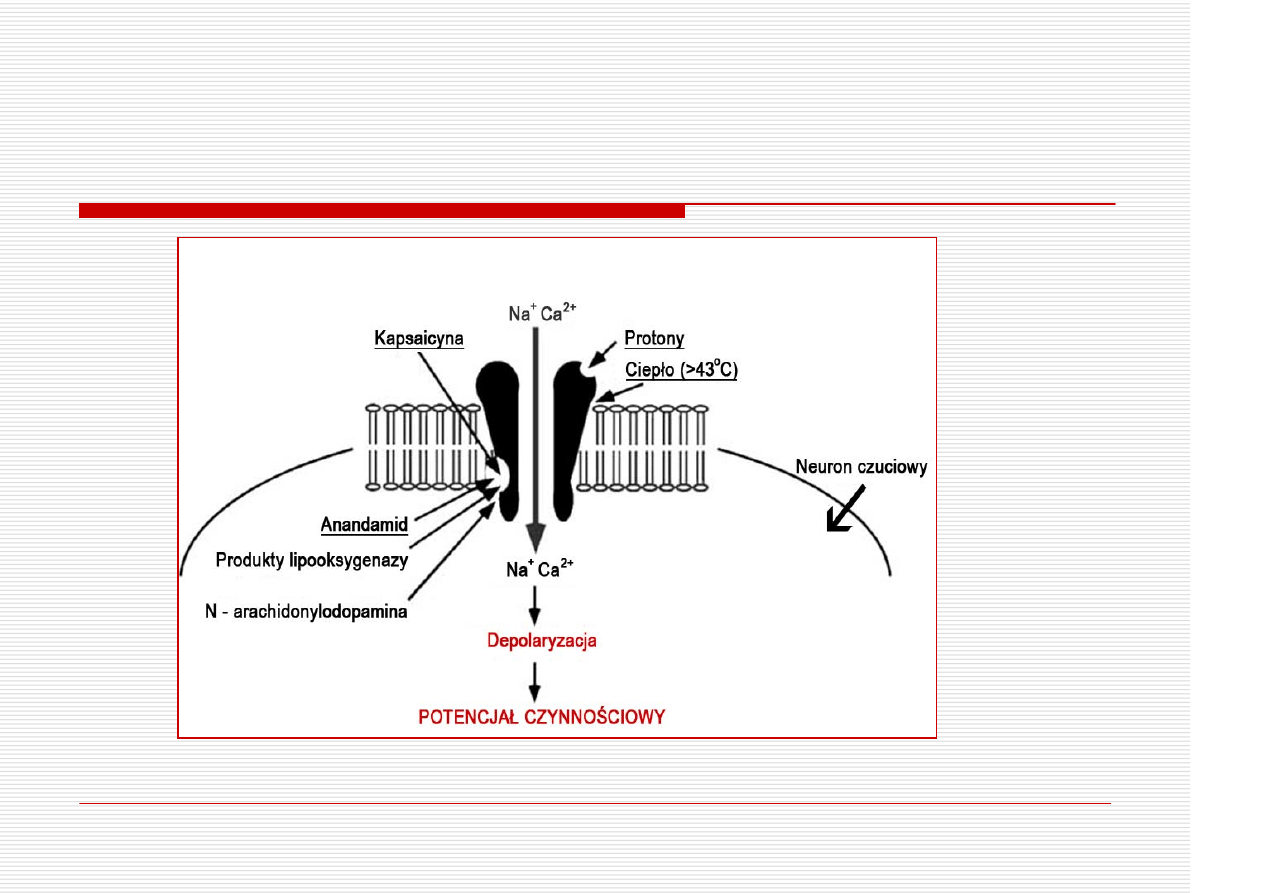
Włókna C: receptory TRPV1
Wanilloidowy, kapsaicynowy rec.
Kanał jonowy dla Ca2+ i Na+
Włókna C i Aδ
Też: jądro pasma samotnego, area
postrema, podwzgórze, PAG, kora,
móżdżek, , skóra, rogówka, układ
moczowy, glej i mastocyty
TRPV1
Włókna Aδ
Cienkie, zmielinizowane
Precyzyjna lokalizacja bólu
Ból ostry o ścisłej lokalizacji
Szybkie przewodzenie impulsów
Brak receptorów opioidowych
Włókna o różnej reaktywności
termicznej
Zapalenie neurogenne
Bezpośredni uraz tkanek: wzrost poziomu potasu
oraz uwolnienie prozapalnych mediatorów
(bradykinina, histamina, prostanoidy, cytokiny, SP,
ATP, jony wodorowe, serotonina, NGF), powodują
one uwrażliwienie receptorów
(sensytyzację
obwodową)
i odpowiadają za wytworzenie
informacji bólowej przesyłanej do OUN
Aktywowane nocyceptory
mogą uwalniać
rozmaite substancje z zakończeń obwodowych (SP,
ATP, CGRP), ułatwiając w ten sposób
uwalnianie
prozapalnych czynników z sąsiednich
komórek nieneuronalnych
(mastocytów,
neutrofili) i tkanki naczyniowej

Sensytyzacja obwodowa
Jest odpowiedzią ustroju na
bezpośredni uraz tkanek
Jest procesem uwrażliwiania
nocyceptorów przez:
SP
NA
„błędne koło bólowe”
„zapalenie neurogenne”
Ból
Głównym neuroprzekaźnikiem
pobudzającym w nocyceptorach jest
glutaminian
Transmisja bólu:
neuroprzekaźniki
Aminokwasy pobudzające
Substancja P i neurokinina A
CGRP (calcitonin gene-related
peptide)
Somatostatyna pochodząca ze
zwojow rdzeniowych
VIP (wazoaktywny peptyd jelitowy)
Galanina
NPY
Reakcja na ból
Psychiczna
Ruchowa (ucieczka, przykurcz mm – obrona
mięśniowa)
Wegetatywna z udziałem podwzgórza
Wewnątrzwydzielnicza (oś LPPN)
Zstępujące układy antynocyceptywne
(ZUA)
Kora zakrętu obręczy
Substancja szara okołowodociągowa (PAG) w
śródmózgowiu
Substancja szara okołokomorowa w podwzgórzu
Boczne i grzbietowo-boczne części mostu
zawierające neurony noradrenergiczne
Brzuszno-dogłowowa część rdzenia przedłużonego
(RVM), zawierajaca neurony serotoninergiczne,
zlokalizowane zwłaszcza w jądrze wielkim szwu
Czynnościowo układy antynocyceptywne
tworzą:
Endogenny system opioidowy
System noradrenergiczny - receptory
alfa-2
Układ cholinergiczny
Układ serotoninergiczny
Układ GABA-ergiczny
Układ endokannabinoidowy
Układ purynergiczny i receptory
adenozynowe
κ
Percepcja bólu
Układ limbiczny i kora mózgowa
Rola poznawcza
Ocena bólu
Reakcje afektywne, emocjonalne na ból
Kształtowanie modeli zachowań
związanych z przeżytym bólem
Ból nowotworowy
– jest to ból przewlekły ciągły, nasilający się w
miarę rozwoju choroby
– o złożonej patofizjologii i zróżnicowanej
reakcji na leczenie
– u 80% chorych występuje kilka rodzajów
bólu jednocześnie (Twycross R.G.)
– u większości chorych obecne bóle
przebijające, występujące spontanicznie lub
w trakcie ważnych czynności (przyjmowanie
pokarmu, poruszanie się)
– często jednocześnie obecne inne dokuczliwe
objawy np. duszność
– chory o pogarszającym się stanie ogólnym
Ból: GABA
Transmisja GABA-ergiczna podlega regulacji
glutaminianergicznej
Kwas glutaminowy poprzez presynaptyczne
jono- i metabotropowe receptory może zarówno
potencjalizować, jak i hamować uwalnianie
GABA
Uwalnianie GABA jest możliwe dzięki interakcji
kwasu glutaminowego z receptorami NMDA i
kainianowymi zlokalizowanymi na
zakończeniach GABA-ergicznych
GABA - nocycepcja: poziom
rdzeniowy
Hamujący nt; GABA-A i GABA-B
Interneurony DH-RK: duże stężenie
GABA w miejscach, gdzie kończą się
pierwotne zakończenia nocyceptywne
GABA: krytyczna komponenta „bariery
bólowej” (‘pain gate’)- rola w
zachowaniu równowagi m/układami
pobudzającymi i hamującymi
Spadek GABA w RK to najczęstsze
zjawisko towarzyszące uszkodzeniu
RK i nerwów obwodowych; ból
lekooporny
baklofen,
midazolam
Teoria bramki kontrolnej
- Melzack
i Wall (Gate-Control-Theory,
1965)
W OUN muszą istnieć mechanizmy zdolne
zmienić lub nawet stłumić informację
nocyceptywną w trakcie jej przepływu od
obwodu do ośrodków odpowiedzialnych za
świadomość odbierania bodźców bólowych
Musi istnieć „coś” co selekcjonuje, moduluje
lub wyhamowuje ogrom informacji
nocyceptywnej docierającej do organizmu
GABA- teoria bramkowania
Uwalniany z nocyceptywnych zakończeń
aferentnych kwas glutaminowy stymuluje
uwalnianie GABA z interneuronów RT, co
skutkuje zahamowaniem uwalniania
glutaminianu i SP poprzez mechanizmy
hamowania presynaptycznego
Zjawisko to stanowi najlepiej
udokumentowany mechanizm
antynocyceptywnego działania GABA
Leki GABA-ergiczne w leczeniu bólu
Gabapentanoidy: GBP, PGB
Baklofen
Retigabina
Topiramat
Tiagabina
Wigabatryna
VPA
BZD
Układ endokannabinoidowy (EKS)
Receptory kannabinoidowe: CB1 i CB2;
receptory „sieroce” : GPR55, GPR119
Ich endogenne ligandy- endokannabinoidy
Białka niezbędne do ich syntezy i
inaktywacji
Ligandy EKS:
Lipidowe mediatory, pochodne AA, obecne w
mózgu, osoczu i tkankach obwodowych:
Anandamid (N-arachidonyloetanolamid,
AEA)
2-arachidonyloglicerol (2-AG)
Eter 2-arachidonyloglicerolowy (2-AGE,
noladyna)
O-arachidonyloetanolamina (wirhodamina)
N-arachidonylodopamina (NADA)
Rola fizjologiczna EKS
Obwodowa modulacja układu immunologicznego
Wpływ na łożysko naczyniowe
Wpływ na układ rozrodczy
Wpływ na motorykę żołądkowo-jelitową (hamowanie)
Kontrola metabolizmu
Regulacja procesów percepcji- wpływ na nocycepcję i
procesy widzenia w siatkówce
Kontrola reakcji emocjonalnych (wpływ hamujący na
uwalnianie glutaminianu i CRF; efekt anksjolityczny
wzmożonej transmisji kannabinoidowej w hipokampie) i
rola w uzależnieniach (leki, alkohol) oraz pobudzający
wpływ na pobieranie pokarmów i leków
EKS: mechanizmy nocycepcji
Kannabinoidy: ośrodkowe działanie
p/bólowe o sile zbliżonej do opioidów
Rola CB1 i CB2 (analgezja) i GPR55 (efekt
pronocyceptywny)
Hamowanie reakcji bólowej u zwierząt
indukowanej temperaturą, czynnikami
chemicznymi i mechanicznymi
Rdzeniowe CB1- analgezja poprzez
hamowanie uwalniania Glu

Noradrenergiczny mechanizm analgezji
Większość neuronów NA w CNS
wykazuje aktywność hamującą
przewodzenie bodźca
Wykorzystywane w celu potencjalizacji
analgezji opioidowej
KLONIDYNA
Cholinergiczne mechanizmy analgezji
Działanie ośrodkowe i obwodowe
Pobudzenie receptorów M: hamowanie
uwalniania nt pronocyceptywnych
IAChE: p/bólowo w bólach talamicznych
Epibatydyna: siła działania 200x> od
morfiny (receptor N)
Serotoninergiczne mechanizmy analgezji
Neurony 5HT oddające projekcje do RT
hamują neurony dróg rdzeniowo-
wzgórzowych postsynaptycznie, a
presynaptycznie hamują uwalnianie SP i
CGRP z ośrodkowych zakończeń
aferentnych
Aktywują interneurony GABAergiczne w RT
Klinicznie wykorzystywany jest potencjał
LPD, które są m.in. ATG NMDA
Adenozyna i receptory purynergiczne
Receptory:
P1- metabotropowe receptory dla
adenozyny
A1
A2A
A2B
A3
P2- dla ATP i ADP, UTP, UDP
P2x – bramkowane ligandem kanały jonowe
(receptory jonotropowe; 7 podtypów)
P2Y- receptory związane z białkiem G (8
podtypów: P2Y1, 2, 4, 6, 11,12, 13, 14)
ATP
Rola w przenoszeniu sygnału bólowego
Wiązanie się z receptorami P2X3 i P2X2/3;
związane jest to z kauzalgią, migreną,
bólem w obrębie miednicy i bólem
nowotworowym
Rola ATP w ostrym bólu zapalnym,
trzewnym i neuropatycznym
Inicjacja przekazywania impulsu przez
szlaki czuciowe do CNS
Antagoniści VDCC w terapii bólu
Gabapentyna
Felbamat
Lamotrygina
Fenytoina
Karbamazepina i okskarbazepina
Zonisamid
Pregabalina
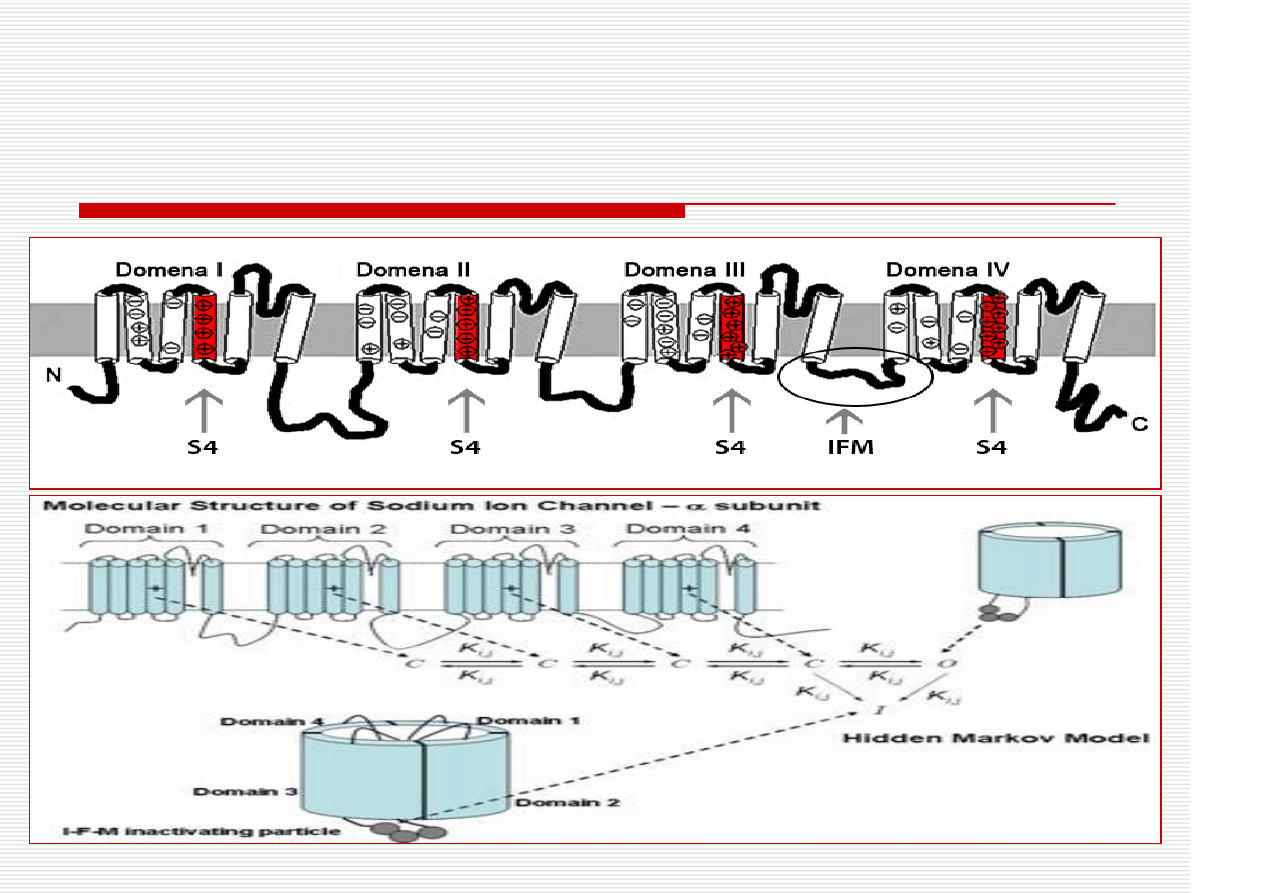
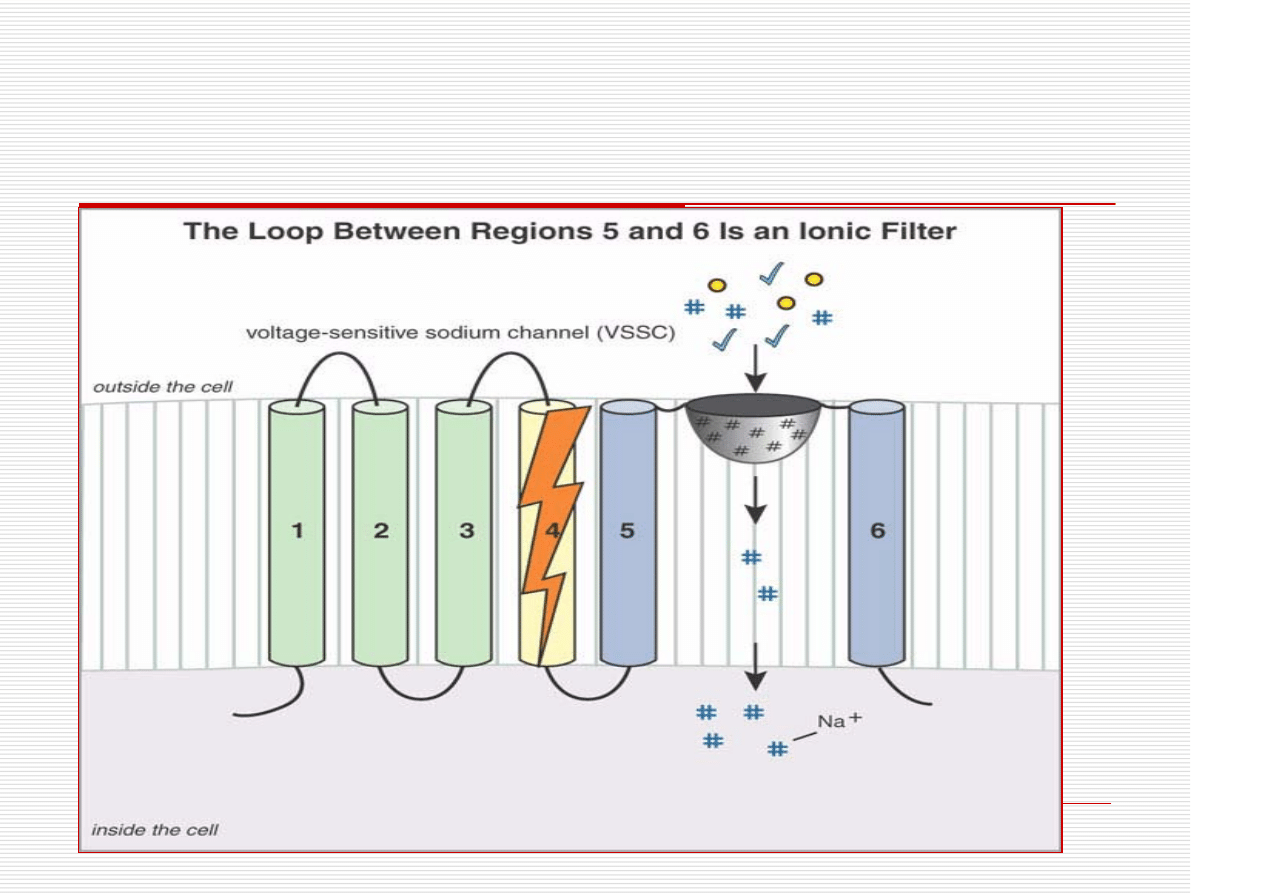
VSSC
VSSC: budowa domeny
Kanały sodowe: ból
Lokalne anestetyki
Halotan
Selektywne działanie p/bólowe dotyczy
leków wpływających na kanały sodowe
obecne na zakończeniach aferentnych
małej średnicy (kanały Nav1.8 i 1.9)
Cztery izoformy kanałów sodowych- Nav1.3,
1.7, 1.8 oraz1.9 mogą stanowić potencjalny
cel dla nowych leków przeciwbólowych
Nieselektywne
działanie

Endogenne peptydy opioidowe
Enkefaliny
Endorfiny
Dynorfiny
Powstają ze swoistych prekursorów
Wspólna sekwencja aa na końcu
aminowym- motyw opioidowy:
Tyr-Gly-Gly-Phe- (Met lub Leu)
β-endorfina to główny EPO
Presynaptyczne hamowanie uwalniania pronocyceptywnych nt lub
hiperpolaryzacja postsynaptycznych neuronów CNS

Receptory opioidowe - metabotropowe
μ (OP3, MOP, MOR, mu)
δ (OP1, DOP, DOR, delta)
κ (OP2, KOP, KOR, kappa)
N/OFQ (OP4, NOP, ORL1, receptor
“sierocy”)

Pobudzenie receptora
μ (OP3)
Analgezja
Depresja oddechu
Zwężenie źrenicy
Euforia
Zahamowanie perystaltyki
Uzależnienie, aktywacja mezolimbicznego
układu dopaminergicznego prowadzącą do
zależności psychicznej (pobudzenie ukł.
nagrody)
Podtypy rec. μ1 i μ2
Pobudzenie receptora
δ (OP1)
Analgezja
Uzależnienie
Potęgowanie zależności wywołanej pobudzeniem
rec. μ
Pobudzenie mezolimbicznego układu
dopaminergicznego, uczucie satysfakcji
Depresja oddechu
Podtypy: δ1 oraz δ2

Pobudzenie receptora
κ (OP2)
Zwężenie źrenicy
Sedacja
Dysforia, działanie psychozomimetyczne,
Analgezja
Nie powoduje uzależnienia, jako jedyny,
wręcz zmniejsza fizyczną i psychiczną
zależność, prawdopodobnie na skutek dużej
ilości tych rec. u pacjentów nowotworowych,
nie dochodzi u nich do tak silnej zależności
Podtypy: κ1, κ2, κ3

Mechanizm ośrodkowego działania
opioidów
Opioidy działają na część presynaptyczną I
synapsy, zmieniają przepuszczalność dla jonów K+
i Ca2+, co powoduje zmniejszenie uwalniania
neuroprzekaźników (tachykinin, EAA i peptydów) z
zakończeń nerwowych
Działanie postsynaptyczne – opioidy powodują
hiperpolaryzację neuronów RT RK, zwalniając
przewodzenie (w komórkach projekcyjnych)
Działają na sprzężenie 2 układów neuronów
hamujących: GABA-ergicznych i enkefalinowych w
rdzeniu kręgowym
Hamowanie przekaźnictwa nocyceptywnego w
rdzeniu kręgowym
Hamowanie percepcji bólu na poziomie wzgórza
Wpływ opioidów na układ
immunologiczny
Efekt supresyjny i stymulujący poprzez
receptory zlokalizowane na komórkach UI
Wpływ na proliferację komórek UI
Wpływ na syntezę cytokin
Wpływ na receptory opioidowe osi LPPN
Depresyjny wpływ MOR i jej metabolitów na
aktywność komórek NK i limf. T cytotoks.,
limf. B; hamowanie prezentacji antygenu,
fagocytozy. Osłabienie UI
Podział narkotycznych leków
przeciwbólowych
1. Leki agonistyczne
, zwane „czystymi agonistami”, lekiem
modelowym jest morfina.
2. Leki agonistyczne o słabych właściwościach
antagonistycznych-
np. pentazocyna. Wykorzystuje się
właściwości agonistyczne tej grupy.
3. Leki antagonistyczne o słabych właściwościach
agonistycznych
np. nalorfina. Wykorzystuje się ich
właściwości antagonistyczne – znoszą one działanie
leków 1 grupy (czystych agonistów), natomiast nie
znoszą objawów przedawkowania leków 2 grupy.
4. Leki antagonistyczne,
„czyści antagoniści”, nie mają
działania przeciwbólowego, znoszą one działanie leków 1
i 2 grupy.
W leczeniu bólu nowotworowego
znajdują zastosowanie niemal
wyłącznie opioidy o czystym działaniu
agonistycznym (wyjątek: BUPR)
Morfina - standard w terapii silnego bólu
nowotworowego (III st. DA)
Zmienne wchłanianie z ppok, metabolizm
wątrobowy do:
M-6-G: analgezja, nudności, wymioty, depresja
oddechowa, sedacja
M-3-G: neurotoksyczność i hiperalgezja (ból
paradoksalny po podaniu opioidów)
Ból nowotworowy: dlaczego boli?
Inwazyjny charakter nowotworu –
zniszczenie tkanek, w których są R bólowe i
drogi przewodzenia bólu
Dodatkowo ból z wyniszczenia i ↓aktywności
pacjenta
Powikłanie poleczeniu cytostatykami
(VINKR) i operacji (ból jatrogenny)
U >> chorych występuje więcej niż jeden
rodzaj bólu
Cechy bólu nowotworowego
Jest to ból przewlekły ciągły, nasilający się w
miarę rozwoju choroby
O złożonej patofizjologii i zróżnicowanej reakcji
na leczenie
U 80% chorych występuje kilka rodzajów bólu
jednocześnie
U większości chorych obecne bóle przebijające,
występujące spontanicznie lub w trakcie ważnych
czynności (przyjmowanie pokarmu, poruszanie
się)
Często jednocześnie obecne inne dokuczliwe
objawy np. duszność
Chory o pogarszającym się stanie ogólnym
Chory przebywa w domu
Zasady leczenia bólu nowotworowego
Podawanie leków drogą doustną,
W regularnych odstępach czasu,
Według trzystopniowej drabiny
analgetycznej, w skojarzeniu z lekami
wspomagającymi,
W dawkach dobranych indywidualnie,
Konieczność szczegółowej oceny bólu i
monitorowania leczenia.
Morfina: działanie ośrodkowe
Działanie przeciwbólowe, proporcjonalnie do dawki
Działanie uspokajające – senność, utrudnienie
koncentracji
Zmiany nastroju:
Dysforia, po pierwszorazowym podaniu, nie
pojawia się u osób cierpiących
Euforia – po wielokrotnym podaniu pozajelitowym,
nie występuje po podaniu doustnym, co
wykorzystuje się w terapii uzależnień
Działanie wymiotne – po pierwszym podaniu
występują nudności i wymioty. Po kilkakrotnym
podaniu następuje zahamowanie ośrodka
wymiotnego
Morfina: działania ośrodkowe
Depresja czynności oddechowej
Działanie przeciwkaszlowe,
depresyjny wpływ na ośrodek kaszlu
Wpływ na wydzielanie dokrewne:
↑ ADH → ↓ wydalania moczu
↓FSH, LH, TSH
Działanie hipotermiczne
Obniżenie progu drgawkowego (duże
dawki)
Zwężenie źrenic – na to działanie nie
rozwija się tolerancja
Morfina: działania obwodowe
Wzrost napięcia mięśni gładkich, z wyjątkiem mięśni
naczyń. Działanie spastyczne, skurcz toniczny,
ustanie perystaltyki:
Wydłużenie czasu przebywania treści
pokarmowej w żołądku
Zaparcia spastyczne
Wzrost ciśnienia w drogach żółciowych – nie
wolno morfiny stosować w kolkach
Skurcz zwieracza pęcherza i mm
moczowodów – utrudnienie
wydalania moczu
Uwalnianie histaminy
Hamowanie czynności skurczowej macicy. Dochodzi
do wydłużenia porodu i depresji oddechu u
noworodków

Leczenie bólu opornego na opioidy
Farmakoterapia wg zaleceń WHO pozwala
opanować ból u ok. 85-90% chorych. U
pozostałych osób cierpiących ból nie
ustępuje pomimo stosowania coraz
wyższych dawek opioidu, przy których
pojawiają się DN
Jest to:
• Ból o niskiej wrażliwości na OP
•Ból oporny
•Ból trudny (intractable pain)
Bóle przebijające
Każdy chory musi być zaopatrzony w
roztwór szybko działającej morfiny, do
stosowania w razie wystąpienia bólów
przebijających
Leczenie bólu opornego na OP
Zamiana MOR na inny, silny OP
Podawanie OP dożylnie systemem PCA
Patient - Controlled
Analgesia
Leczenie bólu opornego na OP
Analgezja zewnątrzoponowa, podpajęczynówkowa
Cel: zmniejszenie dawki MOR, zmniejszenie ilości jej
metabolitów (brak ef. I przejścia); dołączenie do OP
bupiwakainy
Ketamina w dawkach subanestetycznych –
długotrwale we wzrastających dawkach
Przełamanie zjawiska oporności i tolerancji na OP-
hamowanie sensytyzacji ośrodkowej !!!!
Doustnie, podskórnie, czasem doodbytniczo
Z midazolamem
Paliatywne zabiegi chir. (neuroliza)
Najcięższe przypadki bólu – kontrolowana sedacja
– dołączenie do stosowanych analgetyków
midazolamu w ciągłym wlewie sc lub iv.
Jak zwiększyć skuteczność leczenia
analgetykami opioidowymi?
Ból kostny i neuropatyczny to bóle trudne do
uśmierzenia – ich leczenie wymaga dołączenia do
OP koanalgetyków (= adjuwantów
analgetycznych):
W b. neuropat.: LPD, AED, LA, ketaminy
W b. kostnym: NLPZ, GKS, bisfosfoniany
Rotacja opioidowa (80% skuteczności)
Zmiana drogi podania z doustnej lub TTS na
dożylną, epiduralną lub dokanałową
Dożylne podanie siarczanu magnezu
Anestezjologiczne metody leczenia bólu
Kodeina (II stopień drabiny analg.)
Metylowa pochodna MOR
Metabolizowana do MOR (CYP2D6) i jej
metabolitów; ma też odrębne metabolity
(aktywny analgetycznie KOD-6-G)
Efekt analgetyczny KOD =1/10 MOR
Czas analgezji: 4-6 godz.

Metadon
AG receptora μ
Ma wyższe od morfiny powinowactwo do rec.δ
Jest antagonistą rec. NMDA
Hamuje wychwyt zwrotny 5-HT i NA w CNS
Lepiej od morfiny wchłania się z przewodu pokarmowego;
wysoce lipofilny, mniejsze ryzyko zaparć, wymiotów i
nudności
Może być stosowany u pacjentów, którym morfina nie
zapewnia wystarczającej analgezji lub którzy nie tolerują
morfiny
Czas analgezji: 6-12 godz.
Wielokrotne podanie – ryzyko kumulacji
Liczne interakcje:
CYP3A4, 2D6, 1A2, 2B6
Stosowany jest również do leczenia uzależnień.
Metadon
W rotacji opioidowej
Przy nasilonych DN innych OP
Przy mało efektywnej analgezji
Syrop
Podawany pozajelitowo (niedostępny w PL)
lub u chorego z czynnikami ryzyka –
konieczne EKG i monitorowanie poziomu
K+, Ca2+ i Mg2+
(ryzyko wydłużenia QT i
arytmii komorowych)
Fentanyl
Wykazuje silne powinowactwo do rec.μ, jest
bardzo lipofilny, przenika przez skórę i
szybko przechodzi do CNS
Posiada bardzo silne działanie
przeciwbólowe (100x silniejszy od morfiny)
Wykazuje mniejsze działania obwodowe:
m.in. nie powoduje uwalniania histaminy,
nie wpływa na ciśnienie tętnicze krwi
W dużych dawkach może wywoływać
sztywność mięśniową, także mięśni
międzyżebrowych, dlatego przy
zastosowaniu fentanylu w anestezjologii
wymagane jest użycie leków zwiotczających
Fentanyl
Stosowany w neuroleptanalgezji w połączeniu z
droperidolem (THALAMONAL)
Stosowany w anestezjologii – podany i.v. powoduje
utratę świadomości po 45 s
Posiada działanie wagomimetyczne, może powodować
bradykardię, niekiedy hipotensję, zmniejsza opór
naczyniowy
W postaci plastrów (transdermal fentanyl, TF)
stosowany u pacjentów z nowotworami, z bólem o
stałym nasileniu (DUROGESIC TTS), zmienianych co 72
godziny, u chorych źle znoszacych morfinę, z
trudnościami w połykaniu, wygodniejszy, poprawa
jakości życia
Podczas leczenia TF w bólu przebijającym opioid krótko
działający
Petydyna (Dolargan)
Działa słabiej przeciwbólowo od morfiny, działanie
rozpoczyna się szybciej i trwa krócej. W
odróżnieniu od morfiny:
Słabiej kurczy m. gładkie, może być stosowana w
kolkach żółciowych i nerkowych
Nie wpływa hamująco na czynność skurczową
macicy, nie przedłuża porodu, słabiej przechodzi
przez łożysko, może jednak powodować depresję
oddechową noworodka. Ostrożnie stosować w
analgezji porodowej!
Nie zwęża źrenic
Petydyna
Nie należy stosować petydyny w leczeniu
bólów nowotworowych ponieważ:
Nie zapewnia odpowiedniej kontroli bólu,
działa 2-3h
Podawana jest i.m., dyskomfort pacjenta
Metabolizuje się do norpetydyny, która
jest drgawkotwórcza i neurotoksyczna a u
osób długo otrzymujących petydynę
kumuluje się

Leki ago-antagonistyczne
Właściwości agonistyczne tych leków ujawniają
się o ile stosowane są jako jedyne opioidy. W
skojarzeniu z czystym agonistą powodują objawy
odstawienne
Właściwości antagonistyczne tych leków
powodują że działanie przeciwbólowe ulega
samoograniczeniu, występuje efekt pułapowy
Ryzyko wystąpienia zależności po tych lekach
jest mniejsze niż po czystych agonistach
Pentazocyna (Fortral)
Wywołuje objawy psychozomimetyczne,
omamy niepokój, dysforia (agonista rec
σ)
Nie zwęża źrenicy
Objawy przedawkowania znosi wyłącznie
nalokson
Ze wzgl. na słabe działanie przeciwbólowe
i dysforię nie należy jej stosować w bólach
przewlekłych, w tym nowotworowych
Znosi działanie przeciwbólowe morfiny!
Nie łączyć z czystymi agonistami – zespół
odstawienny
Buprenorfina
AG częściowy μ i ATG κ, co daje
pułapowy efekt analgezji
Działa silnie przeciwbólowo (III stopień drabiny)
Siła działania 100x> MOR doustnej
Aktywny metabolit (CYP3A4): norbuprenorfina
Nie wywołuje euforii, ani objawów
psychozomimetycznych, mniejszy potencjał uzależniajacy
od morfiny
Rzadko depresja oddechowa
Mała dostępność p.o. – podaje się ją podjęzykowo
(BUNONDOL), donosowo, transdermalnie (TRANSTEC)
Stosowana w bólach pooperacyjnych i nowotworowych
Można stosować zamiast rru MOR sl BUP w bólu
przebijającym
Próby leczenia uzależnień – znosi euforyzujące działanie
pozajelitowo podanej morfiny i nie dopuszcza do
wystąpienia objawów abstynencyjnych
Buprenorfina
Wykazuje działanie antyhiperalgetyczne
Jak metadon może być stosowana w bólu
neuropatycznym
Tramadol
Silne ośrodkowe działanie przeciwbólowe leku
wynika z 2 mech. działania:
Jest agonistą rec μ (związek i jego metabolit:
(+)M1, który ma 200x większe powinowactwo).
Przemianę TRAM do (+)M1 katalizuje CYP2D6 –
interakcje z SSRI!!!
Stymuluje noradrenergiczny i serotoninergiczny
zstępujący układ antynocyceptywny, hamuje
wychwyt zwrotny 5-HT i NA
Tramadol
Zastosowanie: bóle o umiarkowanym nasileniu,
samodzielnie lub z analgetykami
nieopioidowymi
Î
Premedykacja
Î
Analgezja
Î
Położnictwo
Î
Bóle pooperacyjne
Î
Bóle nowotworowe
UWAGA: Stosowany łącznie z IMAO lub
SSRI może wywołać
zespół
serotoninowy (CYP2D6)
Leki antagonistyczne o słabych
właściwościach agonistycznych
NALORFINA, LEWALORFAN
Wykorzystuje się ich właściwości antagonistyczne; podane
iv znoszą:
Depresję oddechu wywołaną morfiną i jej pochodnymi,
ale ponieważ antagoniści działają krócej niż morfina
należy podawać je kilkakrotnie w celu uniknięcia
REMORFINIZACJI
Depresję oddechu u noworodków, których matki
otrzymywały petydynę podczas porodu
Nie antagonizują depresji oddechu wywołanej
pentazocyną!!!
Znoszą nudności i wymioty wywołane przez opioidy i
apomorfinę
Pogłębiają depresję oddechu wywołaną barbituranami
lub etanolem
Pełni antagoniści - NALOKSON
Znosi objawy przedawkowania opioidów; depresję
oddechu, zwężenie źrenic, działanie przeciwbólowe,
stosowany w zatruciu, przedawkowaiu opioidów
Odwracanie działania opiodów użytych podczas
znieczulenia ogólnego
Odwracanie depresji oddychania u noworodka
wskutek podania opioidu rodzącej
Nie powoduje dysforii
Nie pogłębia depresji oddechu wywołanej przez inne
leki, znosi toksyczne działanie etanolu
Nie wchłania się z przewodu pokarmowego
Podany samodzielnie nie wykazuje istotnego
działania farmakologicznego
Stosowany w zwalczaniu zależności morfinowej –
dodawany do preparatów metadonu
Metylonaltrekson (Relistor)
ATG receptora μ
Leczenie zaparć po OP
Zastrzyki podskórne
Jako bromek
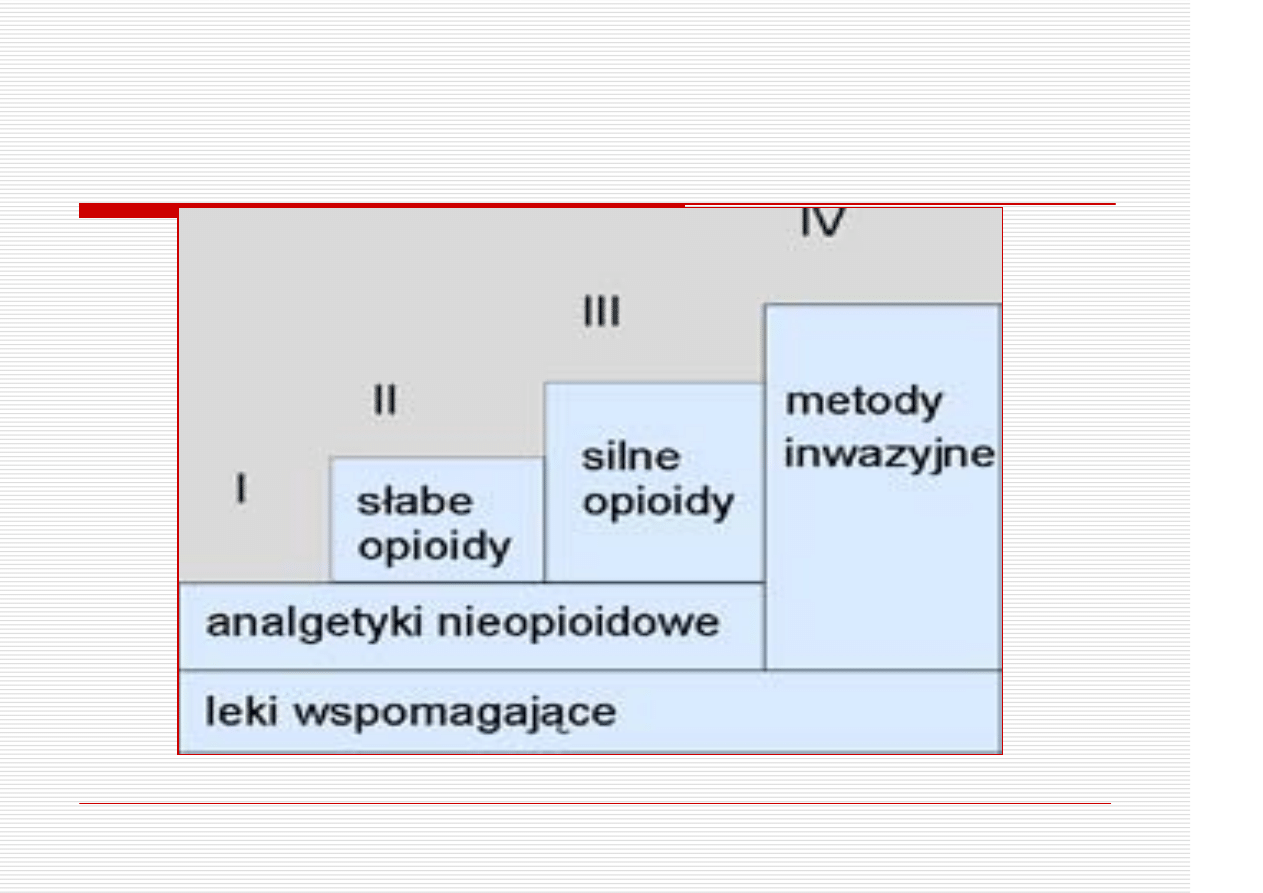
Drabina analgetyczna wg WHO (1986)
Ocena stopnia natężenia bólu
Skala VAS (skala wzrokowo-analogowa,
Visual Analogue Scale)

Drabina analgetyczna
I stopień – NLPZ, paracetamol
II stopień – jw., + dodaje się słaby
opioid; tramadol, kodeina, dionina
III stopień – silny opioid + NLPZ
IV stopień – metody inwazyjne
Leczenie bólu nowotworowego jest z reguły
polipragmatyczne i obejmuje szeroki wachlarz terapii
uzależniony od rodzaju bólu
W bólach o niższej skuteczności typowych
analgetyków stosuje się koanalgetyki oraz
metody niefarmakologiczne leczenia
Adiuwany analgetyczne to zróżnicowana
grupa leków, które oddziałują na procesy
nocycepcji głównie poprzez:
Aktywowanie NA i 5HT układu zstępującego
hamowania bólu
Stabilizację błony komórkowej
Zmniejszenie uwrażliwienia nocyceptorów

Leczenie bólu
Spazmolityki (Scopolan), opioidy
Bóle trzewne kolkowe
Opioid + LPD (AMITR, VENL,
MIANS)+AED (KLON, VPA, CBZ, GBP)+
LPA (stabilizujący błonę komórkową),
baklofen, w wybranych przypadkach -
klonidyna z.o. lub ketamina
Bóle neuropatyczne
Steroidy, opioidy, blokady i neurolizy
nerwów, radioterapia przy przerzutach
do kręgosłupa
Bóle z ucisku na nerw
Baklofen, midazolam, diazepam
Bóle mięśniowe
Leki hamujące odruch kaszlu, blokada
nerwów międzyżebrowych
Ból przy oddychaniu i kaszlu spowodowany
przerzutami do żeber
NLPZ, opioidy, bisfosfoniany, steroidy,
teleradioterapia, radioterapia
izotopowa, zabiegi ortopedyczne
(zespolenie złamanej kości itd.),
zaopatrzenie ortopedyczne,
znieczulenie zewnątrzoponowe z
zastosowaniem bupiwakainy i w
wybranych przypadkach opioidu
Bóle kostne
KOANALGETYKI = adjuwanty
analgetyczne
Leki przeciwdepresyjne
Stosowane w bólach neuropatycznych
opornych na opioidy
Potęgują działanie analgetyczne opioidów
TLPD lub SSRI pobudzają system
antynocyceptywny, podnoszą nastrój i próg
bólowy (zwykle stos. amitryptylina)
Działanie analgetyczne może również
wynikać z hamującego wpływu na rec.
NMDA, zablokowania kanałów sodowych
oraz efektu sympatykolitycznego TLPD
Skuteczne również wenlafaksyna i
nefazodon
KOANALGETYKI
Leki przeciwdrgawkowe
Hamują samoistne wyładowania w uszkodzonych
włóknach nerwowych poprzez wpływ na kanały
sodowe, zmniejszenie ośrodkowego uwalniania
aminokwasów pobudzających lub działanie GABA-
mimetyczne
Wskazaniem są bóle neuropatyczne i fantomowe
PHT, CBZ, OXCBZ, LTG, TPM, VPA, GBP
Benzodiazepiny
Nie działają przeciwbólowo, ale wspomagają
leczenie bólu spowodowanego wzmożonym
napięciem mięśni
Zmniejszają niepokój
KOANALGETYKI
Leki miejscowo znieczulajace
Stosowane w bólach neuropatycznych
Hamują aktywność obwodowych włókien nerwowych
(lidokaina, meksyletyna p.o.)
Glikokortykosteroidy
Przeciwzapalne - hamują syntezę PG, które
uwrażliwiają nocyceptory
Zmniejszają obrzęki, ucisk, naciekanie nerwów lub
rdzenia przez guza
Stosowane w bólach torebek narządów, bólach
kostnych, zwiększonym ciśnieniu
wewnątrzczaszkowym
KOANALGETYKI
Bisfosfoniany i kalcytonina
Hamują resorpcję kości, zwalczają
hiperkalcemię nowotworową, zmniejszają
ból
Stosowane
w:
Bólach spowodowanych przerzutami
nowotworowymi do kości
Naciekach białaczkowych
Spazmolityki
Bóle trzewne, kolki
KOANALGETYKI
Klonidyna
Agonista presynaptycznego rec α
2
– nasila
analgezję opioidową
Antagoniści rec. NMDA
Pobudzenie rec. NMDA przez uwalniane w
nadmiarze EAA jest odpowiedzialne za
nasilanie doznań bólowych, jego przewlekły
charakter, nadwrażliwość i sensytyzację
Stosowani antagoniści rec. NMDA: ketamina,
memantyna
Przewlekły ból neuropatyczny, zniesienie
allodynii i hiperalgezji
Inwazyjne metody leczenia bólu
U wybranych chorych, u których nie uzyskuje się
zadowalającego efektu farmakoterapii, należy
rozważyć zastosowanie metody
anestezjologicznej, takiej jak:
Zn. zewnątrzoponowe,
Zn. podpajęczynówkowe
Neurolizy nerwów i splotów nerwowych
Metody inwazyjne leczenia bólu u chorych z
chorobą nowotworową znajdują zastosowanie u
nie więcej niż 2-4% chorych.
INNE ZASTOSOWANIA OPIOIDÓW
Działanie przeciwkaszlowe
Kodeina
Dekstrometorfan
Działanie przeciwbiegunkowe
Loperamid
Difenoksylat
INNE ZASTOSOWANIA OPIOIDÓW
Zawał serca
Podaje
się morfinę i.v.
INNE ZASTOSOWANIA OPIOIDÓW
OP w leczeniu bólu nienowotworowego
Obecnie stosowanie OP jest standardem
leczenia p/bólowego
Ryzyko uzależnienia (zachowanie
kompulsywne) gdy są stosowane jako
analgetyki jest niskie
Depresja oddechowa jest zjawiskiem
przemijającym i jest antagonizowana
przez ból; występuje wyłącznie u
pacjentów wcześniej nie zażywających OP
Brak DN typowych dla NLPZ i interakcji z
lekami hipotensyjnymi
Polskie Towarzystwo Badania Bólu – wskazania do
podawania OP w leczeniu przewlekłego bólu
nienowotworowego
Stały ból
Trwa > 3 miesiące
Siła > 5pkt. W skali VAS
Dotychczas stosowane metody
farmakologiczne nieskuteczne
Dotychczas stosowane metody
farmakologiczne dają DN
Leczenie skojarzone nie daje db wyników
Brak innych możliwości leczenia
Ból rujnuje życie chorego
Przeciwwskazania do stosowania OP u
pacjentów z bólem przewlekłym
Choroba alkoholowa
Wcześniejsze okresy uzależnienia
Choroby psychiczne
Metody anestezjologiczne oraz
chirurgiczne leczenia bólu
Blokady
Neurolizy
Termolezja, Kriolezja
Stymulacja rdzenia kręgowego
Zabiegi operacyjne rekonstrukcyjne
Zabiegi neurodestrukcyjne
Wyszukiwarka
Podobne podstrony:
Narkotyczne leki przeciwbolowe Nieznany (2)
Narkotyczne leki przeciwbólowe, Farmacja, III rok farmacji, Chemia leków
32 Narkotyczne leki przeciwbólowe
Narkotyczne leki przeciwbólowe, farmacja, Farmakologia
Farmakologia - Wykład 5 cz.2 - Narkotyczne leki przeciwbólowe, Farmakologia
Histamina i leki przeciwhistami Nieznany
Farmakologia - Wykład 5 cz.2 - Narkotyczne leki przeciwb ólowe, Farmakologia
Narkotyczne leki przeciwbólowe Cz I Charakterystyka ogó
narkotyczne leki przeciwbolowe- cwiczenia uzupelnienie, Narkotyczne leki przeciwbólowe- uzupełnienie
narkotyczne leki przeciwbolowe, farma
Narkotyczne leki przeciwbólowe-tabela
Narkotyczne leki przeciwbólowe
Narkotyczne leki przeciwbólowe, ❒ DOKUMENTY, ▣ TECHNIK FARMACEUTYCZNY, • Farmakologia
Niesteroidowe leki przeciwzapal Nieznany
Opioidy- giełda zebrana, Farmacja, Farmakologia(1), Narkotyczne leki przeciwbólowe
Leki przeciwbĂłlowe, Farmacja, Farmakologia(1), Narkotyczne leki przeciwbólowe
więcej podobnych podstron