1
AMINOKWASY
zwi
ą
zki dwufunkcyjne;
w naturze > 500, kodowane – ok. 20
→
100 000 ró
ż
nych białek
Inne podziały:
•
Ze wzgl
ę
du na pozycj
ę
grupy aminowej (
αααα
-,
ββββ
-,
γγγγ
-….aminokwasy)
NH
2
-CHR-(CH
2
)
x
-COOH x = 0,1,2…; rz
ę
dowo
ść
gr. aminowej;
•
glikogenne (przetwarzane w glukoz
ę
lub glikogen w przypadku niedoboru
w
ę
glowodanów: Gly, Ala, Ser, Thr, Val, Asp, Glu, Arg, His, Met, Pro), ketogenne (keton
ko
ń
cowym produktem przemiany np. Leu)
•
Alifatyczne, aromatyczne, heterocykliczne…
•
Oboj
ę
tne, kwasowe, zasadowe
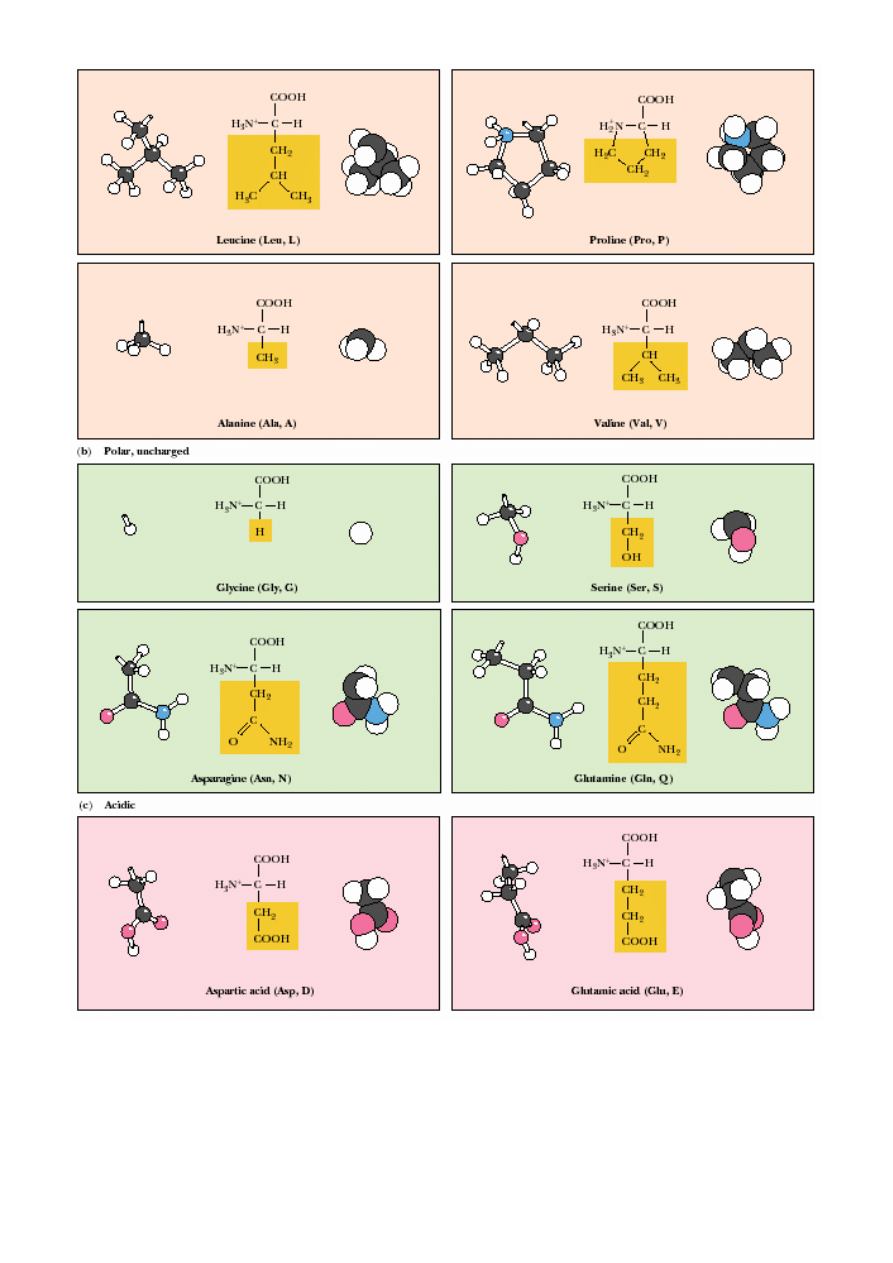
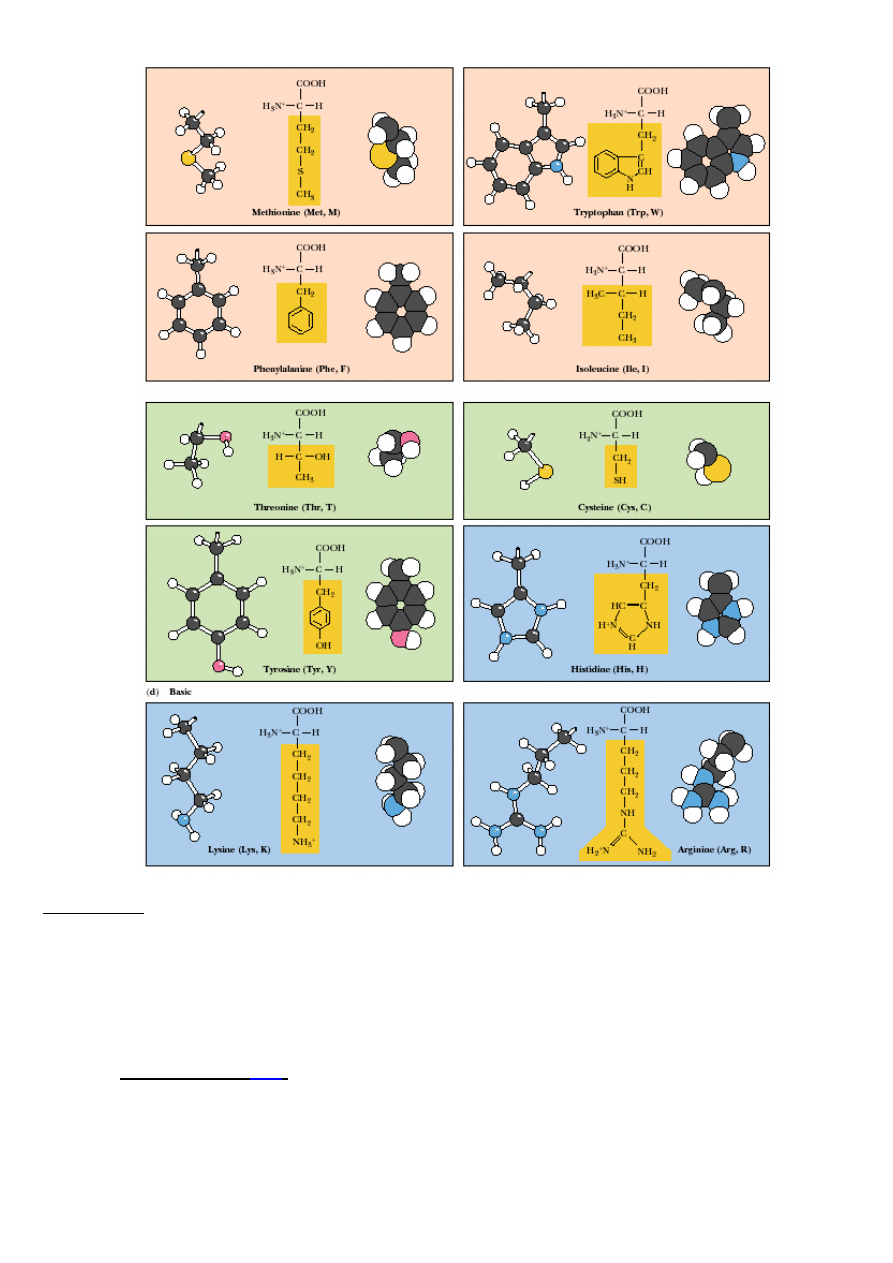
AMINOKWASY KODOWANE:
a/ niepolarne, hydrofobowe (łososiowy); b/ polarne nienaładowane (zielony); c/ kwasowe (ró
ż
);
d/ zasadowe (niebieski)
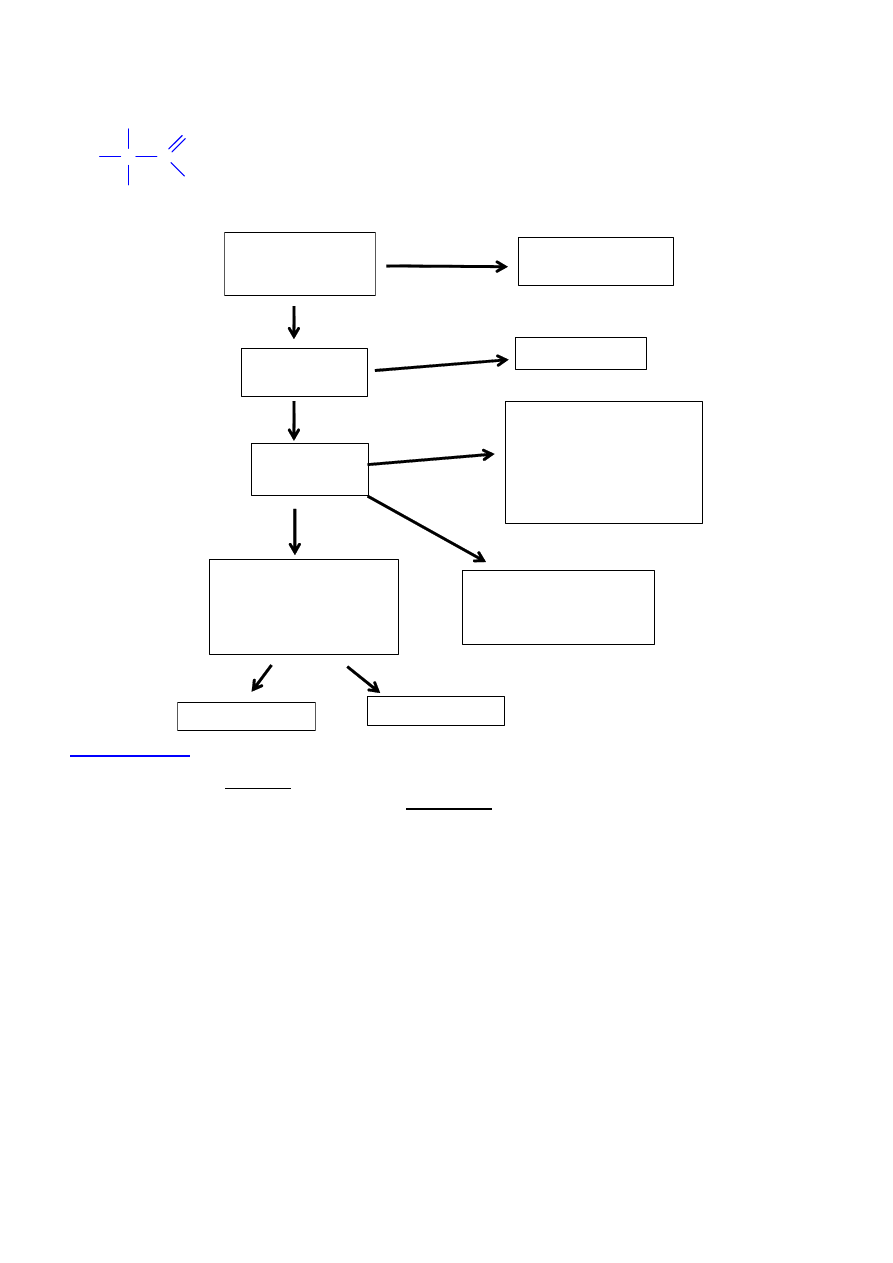
AMINOKWASY
NATURALNE
kilkaset
SYNTETYCZNE
(NIENATURALNE)
BIAŁKOWE
(kilkadziesi
ą
t)
NIEBIAŁKOWE
PIERWSZORZ
Ę
DOWE
(kodowane, 20 lub 21)
substraty w syntezie
rybosomalnej
DRUGORZ
Ę
DOWE
wynik postrybosomalnej
modyfikacji
TRZECIORZ
Ę
DOWE
modyfikacje
postrybosomalne z
niepeptydowymi
wi
ą
zaniami
kowalencyjnymi
ENDOGENNE
EGZOGENNE
C
O
OH
C
NH
2
R
H
aminokwas
α−
2
3
Aminokwasy:
- niepolarne, hydrofobowe, np.:
Leu
,
Ile,
Pro,
Val
, Ala,
Trp
,
Phe
,
Met
…
- polarne, nienaładowane, np.: Gly, Ser, Asn, Cys,
Thr
, Tyr…
- kwa
ś
ne, np.: Asp, Glu;
- zasadowe, np.:
Arg
,
Lys
,
His
.
20 Aaa kodowanych,
8 Aaa
niezb
ę
dnych
(nie syntezowanych przez dojrzałego człowieka)
21 Aaa – selenocysteina (
Sec
) NH
2
-CH-COOH
1986 r.
|
CH
2
-Se
rekodowanie kodonu terminalnego UGA; Sec bardziej nukleofilowa vs Cys
→
enzymy

4
22 Aaa – L-pyrrolysine
B. Hao, W. Gong, T.K.Ferguson, C.M. James, J.A. Krzycki, M.K. Chan, A new UAG-encoded residue
in the structure of a mathanogen methyltransferase, Science 2002, 296, 1462
N
N
H
OH
O
O
NH
2
X
X = OH, NH
2
,CH
3
“Stop codon” UAG enzymatycznie reprogramowany do syntezy “pyrrolysine”. Nieoczekiwana
ró
ż
norodno
ść
⇒
nowe enzymy o znaczeniu przemysłowym.?
Hydroliza białek
→
24 Aaa (dawniej - 22 Aaa) (kodowane + Cys-Cys + Hyp)
2R
SH
[O]
[H]
R
-S-S-
R
Nomenklatura i symbolika:
-
nazwa zwi
ą
zana z: pierwsz
ą
izolacj
ą
[
ź
ródłem - Asp (łac. – asparagus), Cys (gr. – cystis –
p
ę
cherz], sposobem wyodr
ę
bniania (Arg – w post. soli Ag, Trp – prod. degr. trypsyn
ą
),
podobie
ń
stwem do innych zwi
ą
zków (Val – od kw. walerianowego)
-
z wyj
ą
tkiem Trp, przyrostek
–ina lub –yna
-
reszty
(H
2
N-CHR-CO-) przyrostek
–ylo
[glutamylo- (Glu-), aspartylo-, glutaminylo- (Gln-),
asparaginylo-]
-
skróty trzyliterowe, konfiguracja w
ę
gla
α
zawarta w symbolu (L-alanina = Ala, A –
jednoliterowy skrót biochemiczny)
COOH
H
R
H
2
N
COOH
H
CH
2
OH
HO
L-aminokwas
aldehyd L-glicerynowy
(S)-2,3-dihydroksypropanal
-
allo
-L-izoleucyna – aIle,
hydroksy
lizyna –
Hy
l,
allo
-L-
hydroksy
prolina -
aHy
p
-
nor
walina –
N
va
-
grupa aminowa – A (kw.
α
-aminomasłowy – Abu,
α
-aminoadypinowy Aad)
dwie grupy aminowe – D (
α
,
γ
-diaminomasłowy – Dbu)
poło
ż
enia w pozycjach
α
i
ω
nie s
ą
uwzgl
ę
dniane w nazwie, inne tak (
β
-Ala)
N-metylowalina – MeVal
WŁA
Ś
CIWO
Ś
CI CHEMICZNE
Aminokwasy s
ą
zwi
ą
zkami amfoterycznymi, tworz
ą
sole obojnacze.
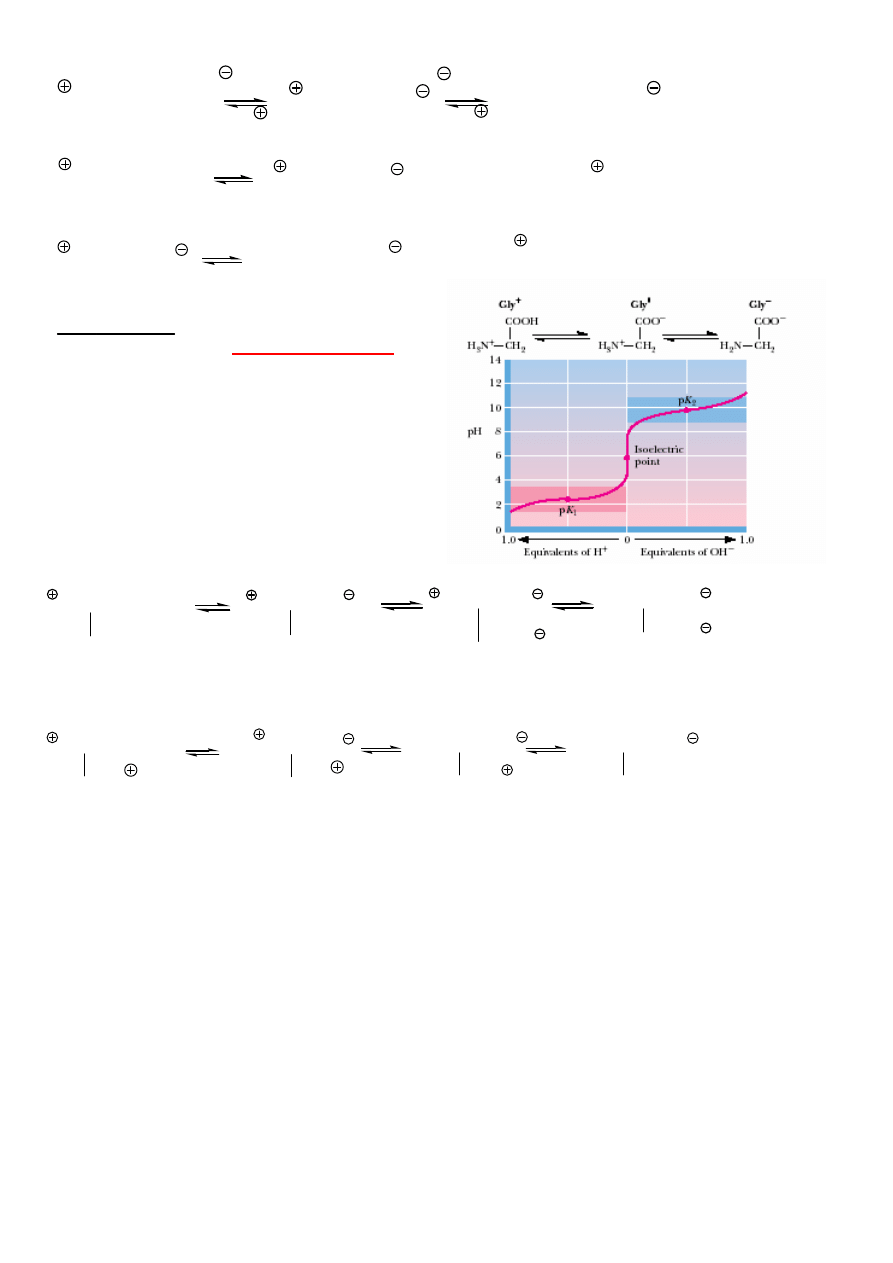
5
NH
3
-CHR-COOH
NH
3
-CHR-COO
NH
2
-CHR-COO
OH
OH
H
H
NH
3
-CH
2
-COOH
NH
3
-CH
2
-COO
pK
a,1
= 2.4 (wplyw NH
3
)
K
a,1
NH
3
-CH
2
-COO
NH
2
-CH
2
-COO
pK
a,2
= 9.8 (NH
3
, a nie COOH)
K
a,2
punkt izoelektryczny
max. st
ęż
enie jonu obojnaczego (minimalny
ładunek)
Gly - pI = ½ (2.4 + 9.8) = 6.1
CH
2
COOH
NH
3
-CH-COOH
CH
2
COOH
NH
3
-CH-COO
CH
2
COO
NH
3
-CH-COO
pK
1
1.9
pK
2
CH
2
COO
NH
2
-CH-COO
pK
3
3.7
9.6
pI
= ½ (1.9 + 3.7) = 2.8 (Asp)
(CH
2
)
4
NH
3
NH
3
-CH-COOH
(CH
2
)
4
NH
3
H
3
N-CH-COO
(CH
2
)
4
NH
3
NH
2
-CH-COO
pK
1
2.2
pK
2
(CH
2
)
4
NH
2
NH
2
-CH-COO
pK
3
9.0
10.5
pI
= ½ (9.0 + 10.5) = 9.7 (Lys)
Ż
RÓDŁA AMINOKWASÓW
1. Hydrolizaty białkowe
2. Metody mikrobiologiczne
3. Metody enzymatyczne
•
rozdział racemicznych pochodnych Aaa
•
synteza asymetryczna
4. Metody syntetyczne
→
produkty achiralne/produkty chiralne
pK
a,1
+ pK
a,2
2
= pI
6
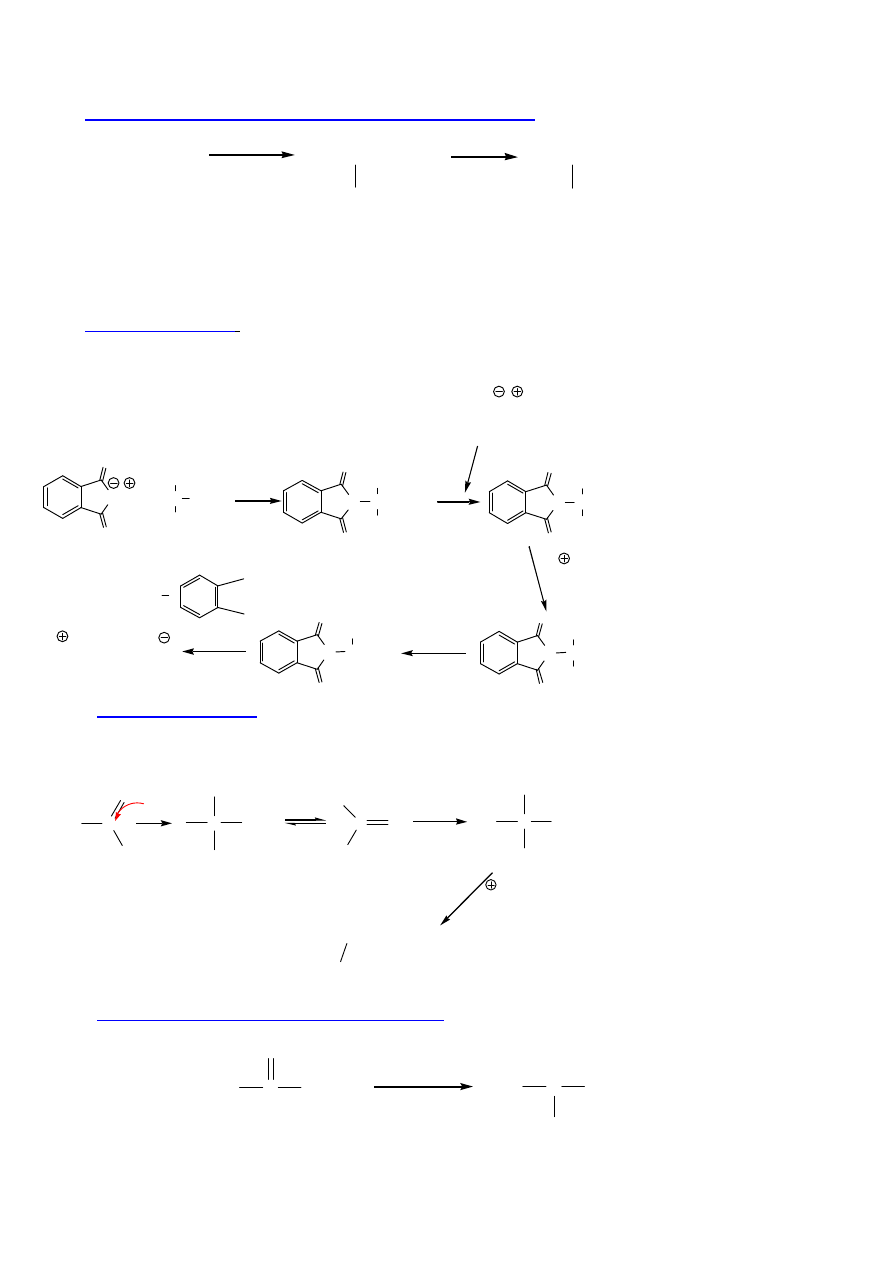
SYNTEZA
1. Bromowanie i aminowanie kwasów karboksylowych
CH
3
CH
2
COOH
Br
2
PBr
3
CH
3
CHCOOH
Br
CH
3
CHCOOH
NH
2
NH
3,
H
2
O
(R,S)-Ala, 56%
80%
Małe zastosowanie, zwykle niskie wydajno
ś
ci.
2. Synteza Gabriela
(z ftalimidku potasu)
Alkilowanie anionu ftalimidowego (1,2-benzenodikarboksylowego). Czynnik alkiluj
ą
cy – produkt
bromowania malonianu dietylowego.
N K
O
O
+
HC
COOC
2
H
5
COOC
2
H
5
Br
N
O
O
CH
COOC
2
H
5
COOC
2
H
5
N
O
O
CR
COOC
2
H
5
COOC
2
H
5
1. EtO Na, EtOH
2. RX
H, T
N
O
O
CR
COOH
COOH
-CO
2
N
O
O
CHR
COOH
COOH
COOH
NH
3
-CHR-COO
ester imidomalonowy
3. Synteza Strecker’a
Działanie amoniakiem i cyjanowodorem na aldehydy.
R
C
O
H
C
OH
NH
2
H
R
C
NH
R
H
R
C
NH
2
CN
H
NH
3
-H
2
O
HCN
H, H
2
O, T
R-HC-COOH
NH
2
aminonitryl
4. Redukcyjne aminowanie
αααα
-oksokwasów
(laboratoryjny analog biosyntezy)
H
3
C
C
O
COOH
NH
3
NaBH
4
H
3
C
H
C
COOH
NH
2
R,S-Ala
kwas
αααα−−−−
oksopropanowy
(pirogronowy)
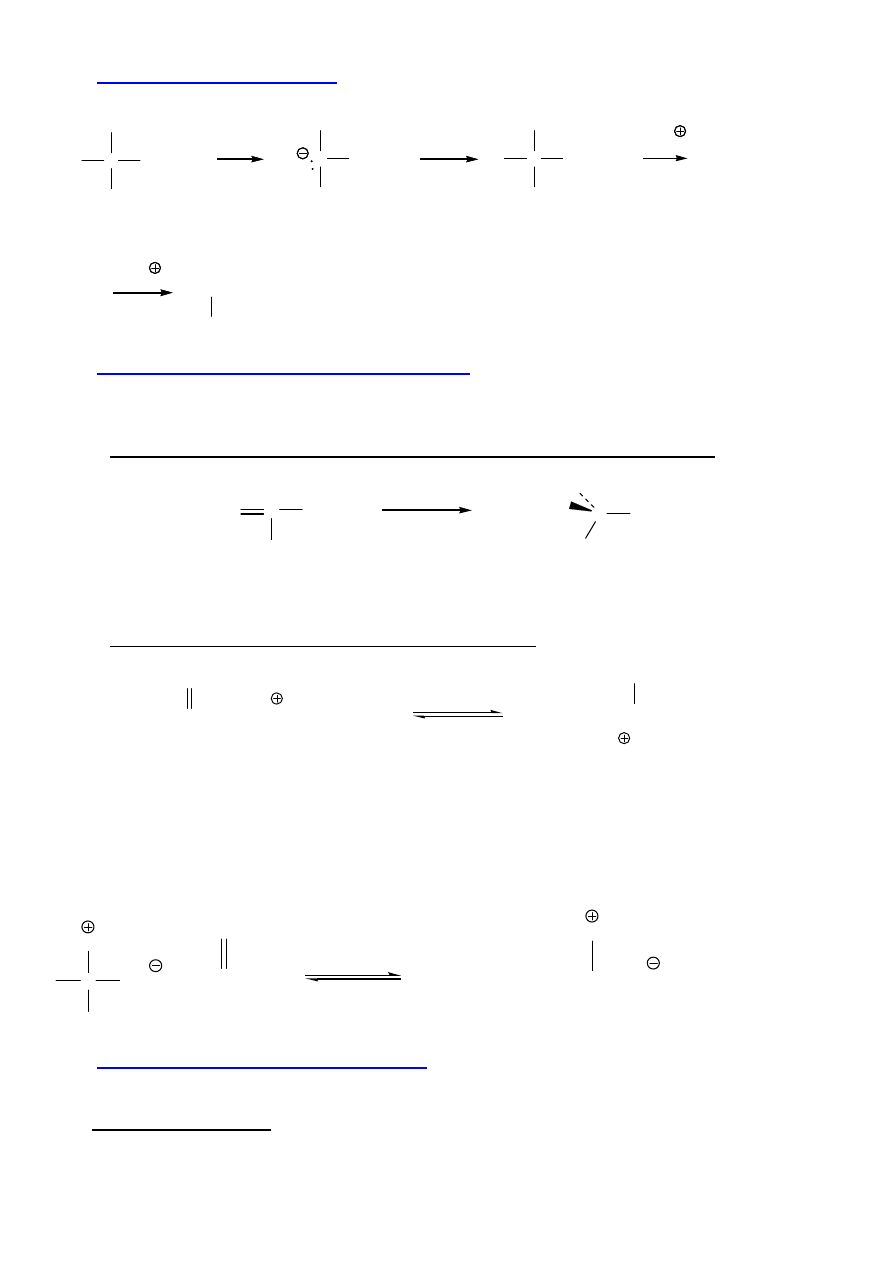
7
5. Synteza amidomalonianowa
Najbardziej uniwersalna.
C
COOEt
COOEt
NH-CO-CH
3
C
COOEt
COOEt
NH-CO-CH
3
R
R-X
S
N
2
EtONa
C
COOEt
COOEt
NH-CO-CH
3
H
H
3
O
H
3
O
+ CO
2
+ 2EtOH + CH
3
COOH
C
COOEt
COOEt
NH-CO-CH
3
C
COOEt
COOEt
NH-CO-CH
3
R
R-X
S
N
2
EtONa
C
COOEt
COOEt
NH-CO-CH
3
H
H
3
O
H
3
O
R-CH-COOH
NH
2
+ CO
2
+ 2EtOH + CH
3
COOH
6. Syntezy enancjoselektywne (asymetryczne)
Np.:
A.
U
ż
ycie chiralnych katalizatorów otrzymanych na bazie metali przej
ś
ciowych:
H
2
C
C
COOH
NHCOCH
3
C
COOH
H
3
COCHN
H
3
C
H
chiralny kompleks Rh
H
2
kwas 2-acetyloaminopropenowy
B.
Biosynteza – redukcyjne aminowanie
α
-oksokwasów:
HOOCCH
2
CH
2
CCOOH
O
kwas
αααα−−−−
ketoglutarowy
(
α
αα
α−−−−
oksoglutarowy)
+ NH
4
+ NADPH
dehydrogenaza
glutaminianowa
HOOCCH
2
CH
2
CHCOOH
NH
2
+ NADP + H
2
O
L-Glu
Escherichia coli – synteza wszystkich kodowanych; człowiek – prócz 9 egzogennych
L-Glu (prekursor)
→
Gln, Pro, Arg
Wi
ę
kszo
ść
Aaa – grupa
α
-aminowa
←
Glu
H
C
R
NH
3
COO
+ R'CCOOH
O
transaminaza
R'CHCOO
NH
3
RCOCOOH +
7. Rozdział racemicznych aminokwasów:
A.
za pomoca deacylaz:
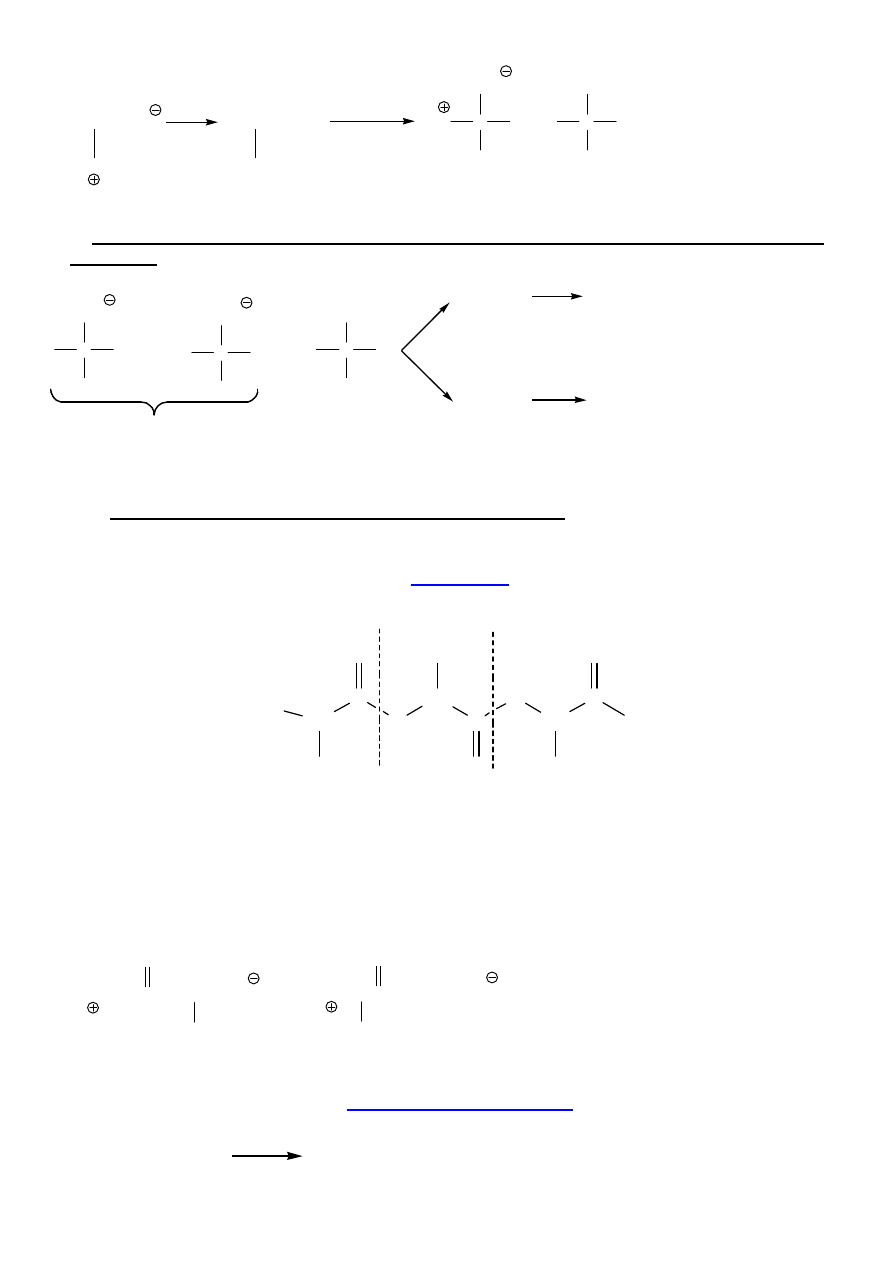
8
NH
3
NHCOCH
3
Ac
2
O
deacylaza
H
3
N
C
R
H
COO
H
C
R
NHAc
COOH
+ CH
3
COOH
+
R-CH-COOH
R-CH-COO
B.
z u
ż
yciem chiralnych amin - (-)-chinina, (-)-strychnina, (-)brucyna lub kwasu (+) lub (-)
winowego
H
C
R
NH
3
COO
H
3
N
C
R
H
COO
Ph
C
R
H
NH
2
racemiczny Aaa
(R)-1-fenyloetyloamina
+
sól S,R
sól R,R
R-Aaa
S-Aaa
C.
HPLC z chiralnymi fazami stacjonarnymi (HPLC-CSP)
PEPTYDY
CH
C
N
H
CH
C
H
N
CH
C
OH
O
O
O
R"
R'
R
H
2
N
C-koniec
N-koniec
Aaa
1
Aaa
3
Aaa
2
Ła
ń
cuch główny, ła
ń
cuchy boczne (R, R’, R”)
Dipeptyd, tripeptyd…
Sekwencja Aaa w ła
ń
cuchu peptydowym:
H
3
N-H
2
C-C-NH-CH-COO
O
CH
3
H
3
N-HC-C-NH-CH
2
-COO
O
CH
3
Gly-Ala
Ala-Gly
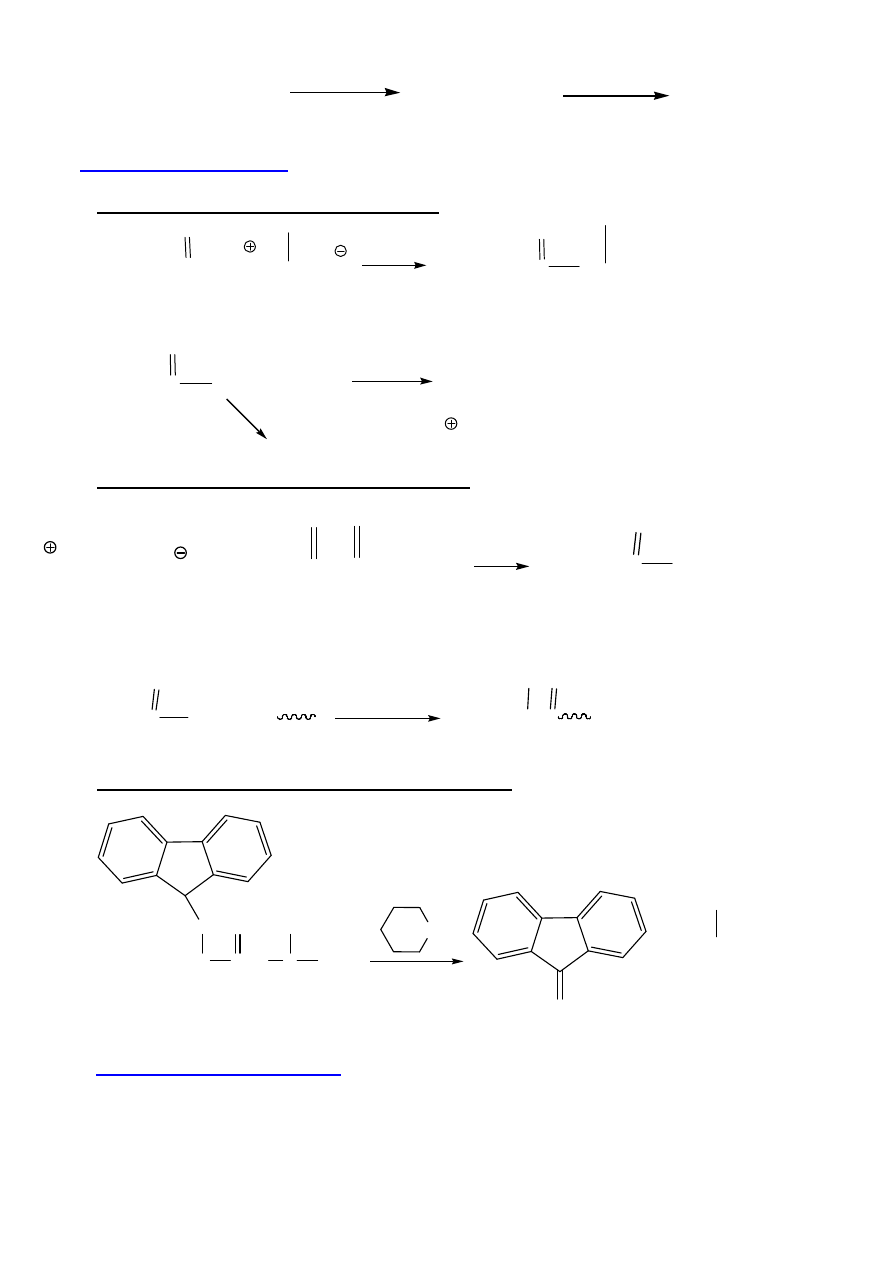
SYNTEZA W ROZTWORZE
Gly + Ala
- H
2
O
∆
Gly-Gly + Ala-Gly +
Gly-Ala
+ Gly-Gly-Ala....
9
P
1
Gly + AlaOP
2
aktywacja
P
1
Gly-AlaOP
2
HGly-AlaOH
I. Osłona grupy aminowej (gł. grupy uretanowe):
A. Grupa benzyloksykarbonylowa (Z, Cbz):
C
6
H
5
CH
2
-O-C-Cl
O
+ NH
3
CHCOO
CH
3
NaOH
-NaCl
-HOH
C
6
H
5
CH
2
-O-C
O
CH
3
NHCHCOOH
chloromrówczan benzylu
(Z-Cl)
Z-Ala
C
6
H
5
CH
2
-O-C
O
NHCH
2
RCO--
H
2,
Pd
C
6
H
5
CH
3
+ CO
2
+ NH
2
-CHRCO-
C
6
H
5
CH
2
Br + CO
2
+ NH
3
-CHR-CO
-
HBr
B. Grupa tert-butoksykarbonylowa (Boc, BOC)
NH
3
-CHR-COO
+ (CH
3
)
3
CO-C-O- C-O-C(CH
3
)
3
O
O
diw
ę
glan tert-butylowy
B
-CO
2
-(CH
3
)
3
COH
(CH
3
)
3
COC
O
NHCHRCOOH
(Boc
2
O)
Zdejmowanie:
(CH
3
)
3
COC
O
NHCHRCO
HCl lub CF
3
COOH
H
3
NCHC
R O
+ CO
2
+ CH
2
=C(CH
3
)
2
C. Grupa fluorenylo-9-metoksykarbonylowa (Fmoc)
CH
2
O
CNH
O
C
H
R
COOH
NH
CH
2
x C
5
H
11
N
+ NH
2
-CH-COOH
R
Fmoc-Aaa
II. Osłona grupy karboksylowej: estry benzylowe, tert-butylowe, metylowe…
OBzl – H
2
/Pd
OtBu – TFA
OMe – NaOH
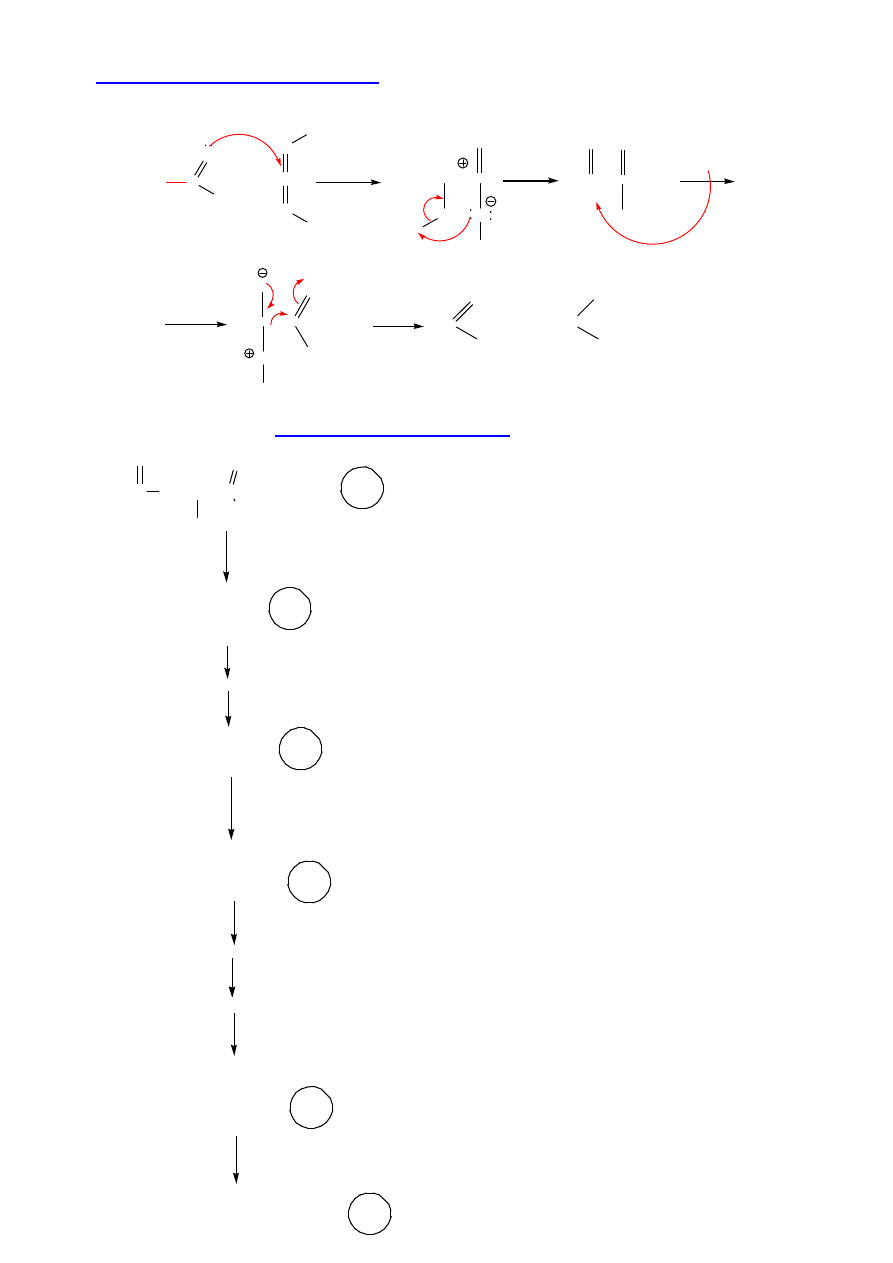
10
III. Aktywacja grupy karboksylowej:
Dicykloheksylokarbodiimid DCC, C
6
H
11
N=C=N-C
6
H
11
R
C
O
OH
N
C
N
C
6
H
11
C
6
H
11
+
R-C=O-C
N-C
6
H
11
N
C
6
H
11
O
H
R-C-O-C
NC
6
H
11
NHC
6
H
11
R"-NH
2
O
R-C-O-C
O
NH
2
NC
6
H
11
NHC
6
H
11
R'
R-C
O
NH-R'
+ O=C
NHC
6
H
11
NHC
6
H
11
DCU
Synteza na no
ś
niku stałym (Merrifield’a)
R. Bruce Merrifield – nN 1984 r.
Automatyczne syntezatory peptydów – 1 Aaa – ok. 1 h
Synteza rybonukleazy (124 Aaa) – 369 reakcji,
12 000 zautomatyzowanych kroków;
η
= 17%
(1 etap> 99%)
Biosynteza – 150 Aaa w okre
ś
lonej sekwencji 1 min (!)
(CH
3
)
3
C-O-C
O
NH-CH-C
O
OH
R
+ Cl-CH
2
- R
B
Boc-Aaa
1
R
-CH
2
-
TFA
R
3
N
NH
2
-Aaa
1
R
-CH
2
-
Boc-Aaa
2
OH
R
Boc-Aaa
2
-Aaa
1
-CH
2
-
TFA
Et
3
N
Boc-Aaa
3
OH
R
Boc-Aaa
3
-Aaa
2
-Aaa
1
-CH
2
-
HF
Aaa
3
-Aaa
2
-Aaa
1
-OH
+ F-CH
2
-
R
DCC
DCC
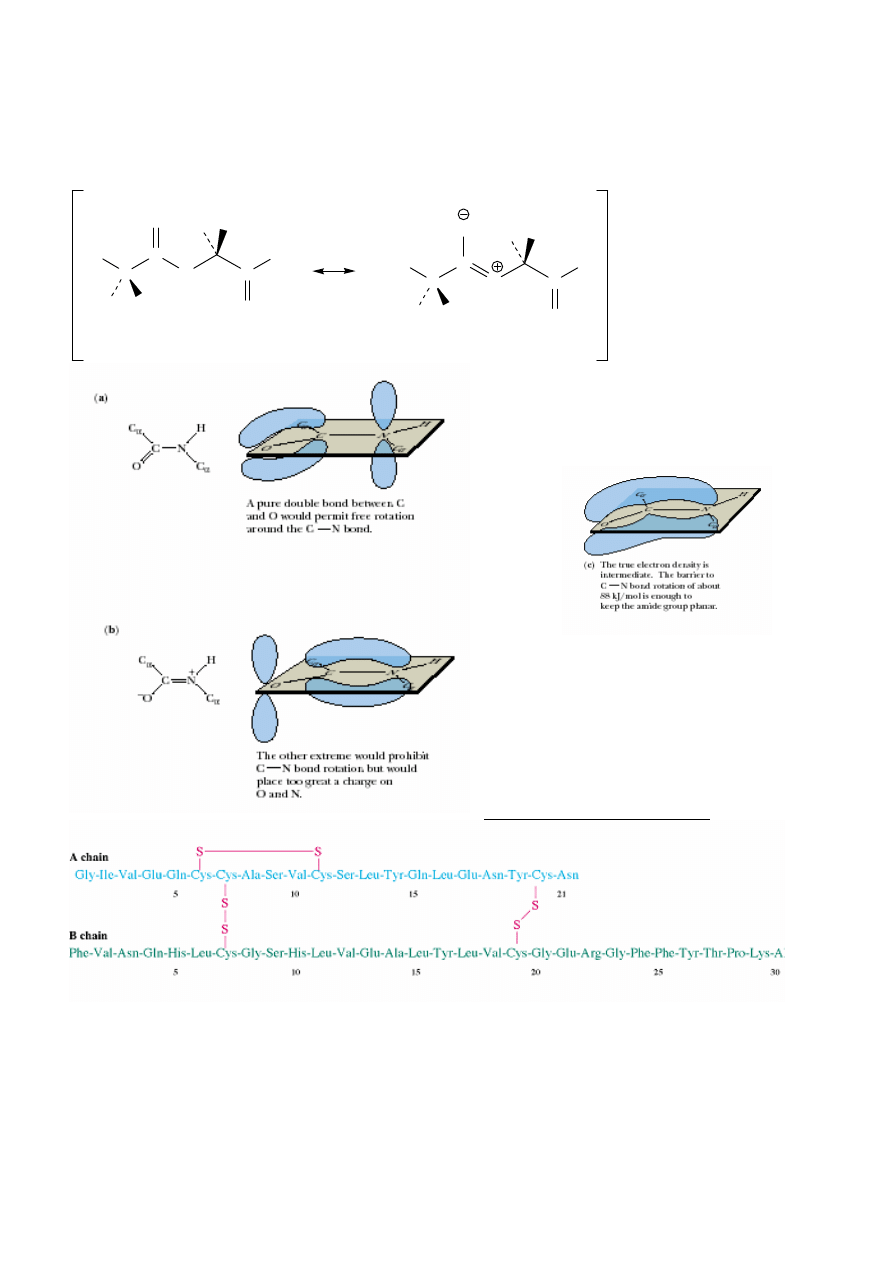
11
STRUKTURA POLIPEPTYDÓW /BIAŁEK
Sekwencja Aaa w ła
ń
cuchu peptydowym –
1° struktura peptydu/białka
Płaski układ wi
ą
zania peptydowego/amidowego:
C
C
O
N
H
HN
C
NH
O
R
H
H
R
C
C
O
N
H
HN
C
NH
O
R
H
H R
Sekwencja insuliny wołowej:
Kiedy
ś
– trzustka zabitych zwierz
ą
t; teraz – bakterie z genami ludzkiej insuliny.
Aspartam - Asp-Phe-OCH
3
Glutation -
γ
-Glu-Cys-Cys
Płasko
ść
wi
ą
zania amidowego, konfiguracja cis, oddziaływania mi
ę
dzy ła
ń
cuchami bocznymi
⇒
konfiguracja
trans
Minimalizowanie oddziaływa
ń
sterycznych i maksymalizowanie elektrostatycznych, dyspersyjnych
i wodorowych
⇒
⇒
⇒
⇒
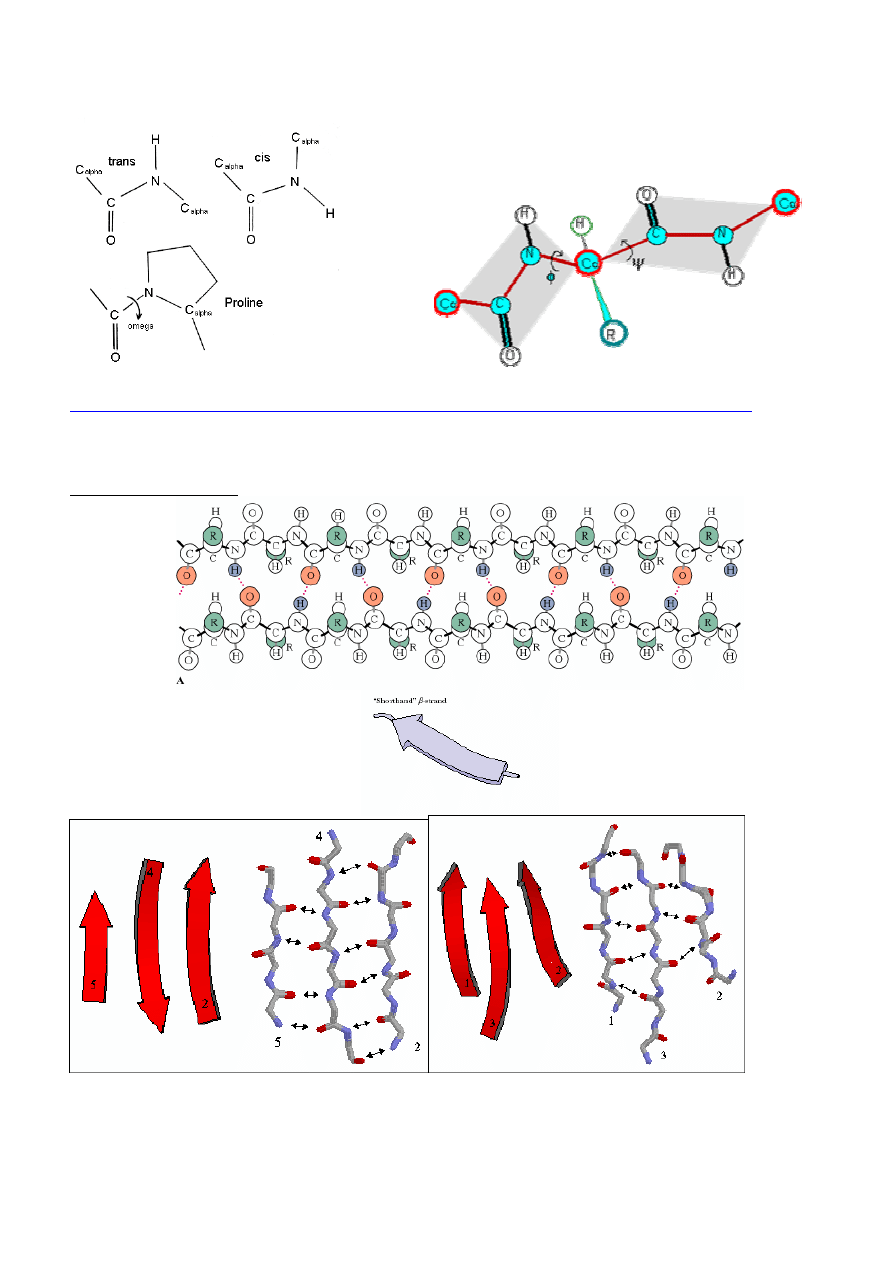
12
2° Struktura peptydu/białka –
lokalna konformacja ła
ń
cucha peptydowego
Charakterystyczne typy kształtu ła
ń
cucha polipeptydowego
wynikaj
ą
ce z oddziaływania niedaleko le
żą
cych reszt Aaa
←
X-ray, 2D-NMR
ββββ
-Kartki (harmonijka
β
, pofałdowany arkusz
β
,
β
-sheet) – równoległa i antyrównoległa
(np. fibroina jedwabiu)
Wi
ą
zania wodorowe mi
ę
dzy dwoma ła
ń
cuchami peptydowymi.
Równoległa
β
-kartka:
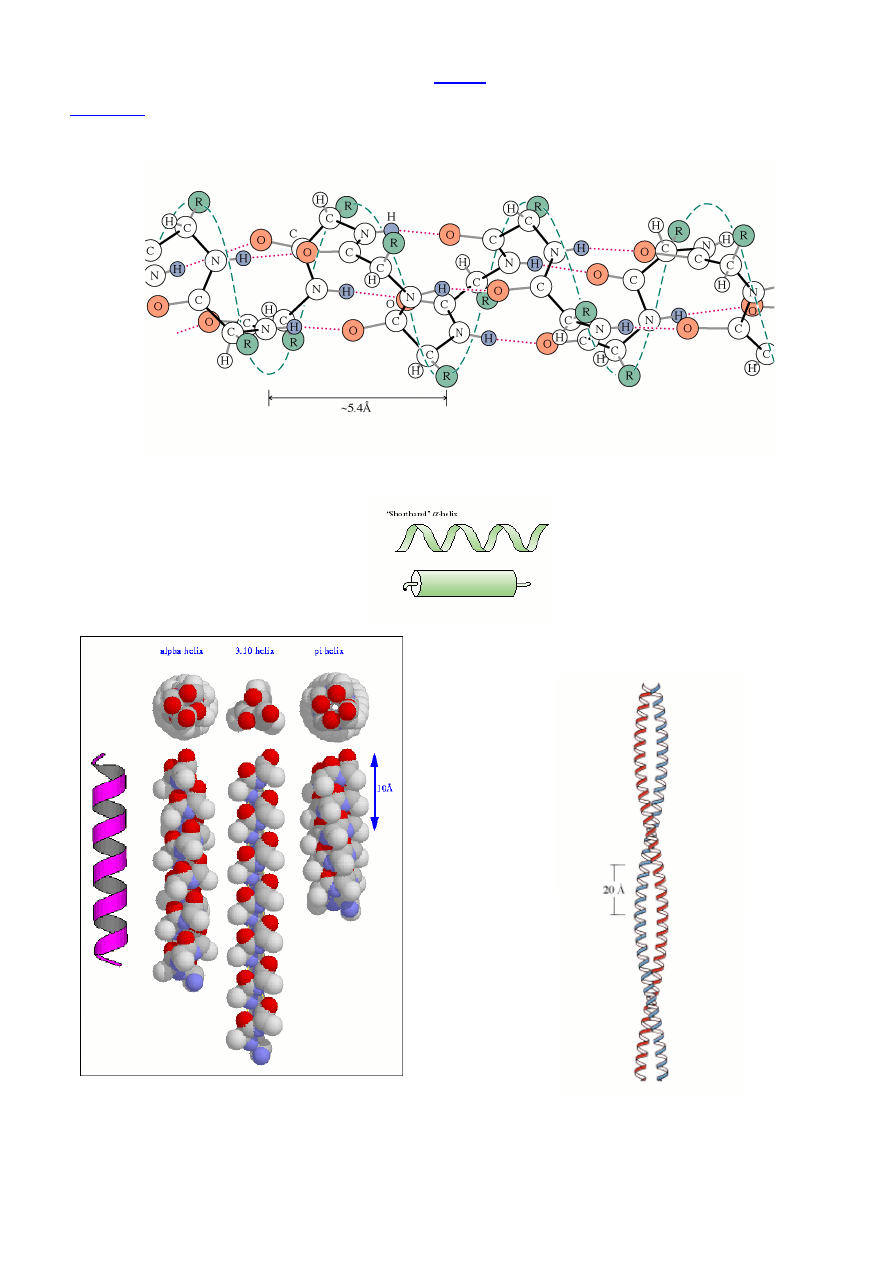
13
Helisy
αααα
-Helisa,
helisa
3,6
13
, (np. keratyna włosów) - wewn
ą
trzcz
ą
steczkowe w.wodorowe mi
ę
dzy C=O
reszty n i NH (n+4); s = 5.4
Ẩ
)
superhelisa
Lokalizacja reszt w globularnych białkach:

14
1. Reszty z niepolarnymi ła
ń
cuchami bocznymi (Val,Leu, Ile, Phe…) – wewn
ą
trz białka,
ograniczony kontakt z wodnym
ś
rodowiskiem;
2. Ła
ń
cuchy boczne reszt polarnych (Arg, Lys, Glu, Asp) – zwykle na powierzchni;
3. Nienaładowane polarne ła
ń
cuchy boczne (Ser, Thr, Trp, Tyr, Asn) – cz
ę
sto na powierzchni,
ale tak
ż
e, zwi
ą
zane wodorowo - wewn
ą
trz cz
ą
steczki.
Konformacja statystycznego kł
ę
bka.
3° Struktura peptydu/białka –
struktura trójwymiarowa wynikaj
ą
ca z dalszego fałdowania
ła
ń
cucha polipeptydowego.
Białka globularne (np. mioglobina, hemoglobina) – wi
ę
ksze fałdowanie (ekspozycja grup
hydrofilowych do
ś
rodowiska); odpowiedzialne za transport chemiczny i kataliz
ę
.
Białka fibrylarne
(np. miozyna – mi
ęś
nie, fibryna – skrzepy krwi,
α
-keratyna - włosy) –
„superhelisa”
Trzeciorz
ę
dowa struktura enzymów, białek transportuj
ą
cych – miejsce aktywne
Białka: fibrylarne, globularne, membranowe
4° Struktura białka -
sposób w jaki kilka ła
ń
cuchów polipeptydowych (podjednostki; domeny) ł
ą
czy
si
ę
w agregat.
Denaturacja – zniszczenie 3° struktury białka (
→
precypitacja, zniszczenie aktywno
ś
ci
katalitycznej…)
15
Okre
ś
lanie struktury 1° (sekwencjonowanie)
I.
Oczyszczanie polipeptydów:
1. Dializa;
2. Chromatografia s
ą
czenia molekularnego (gel-filtration chromatography);
3. Chromatografia jonowymienna;
4. Elektroforeza (> 1000 białek w 1 eksperymencie!);
5. Chromatografia powinowactwa (affinity chromatography).
II.
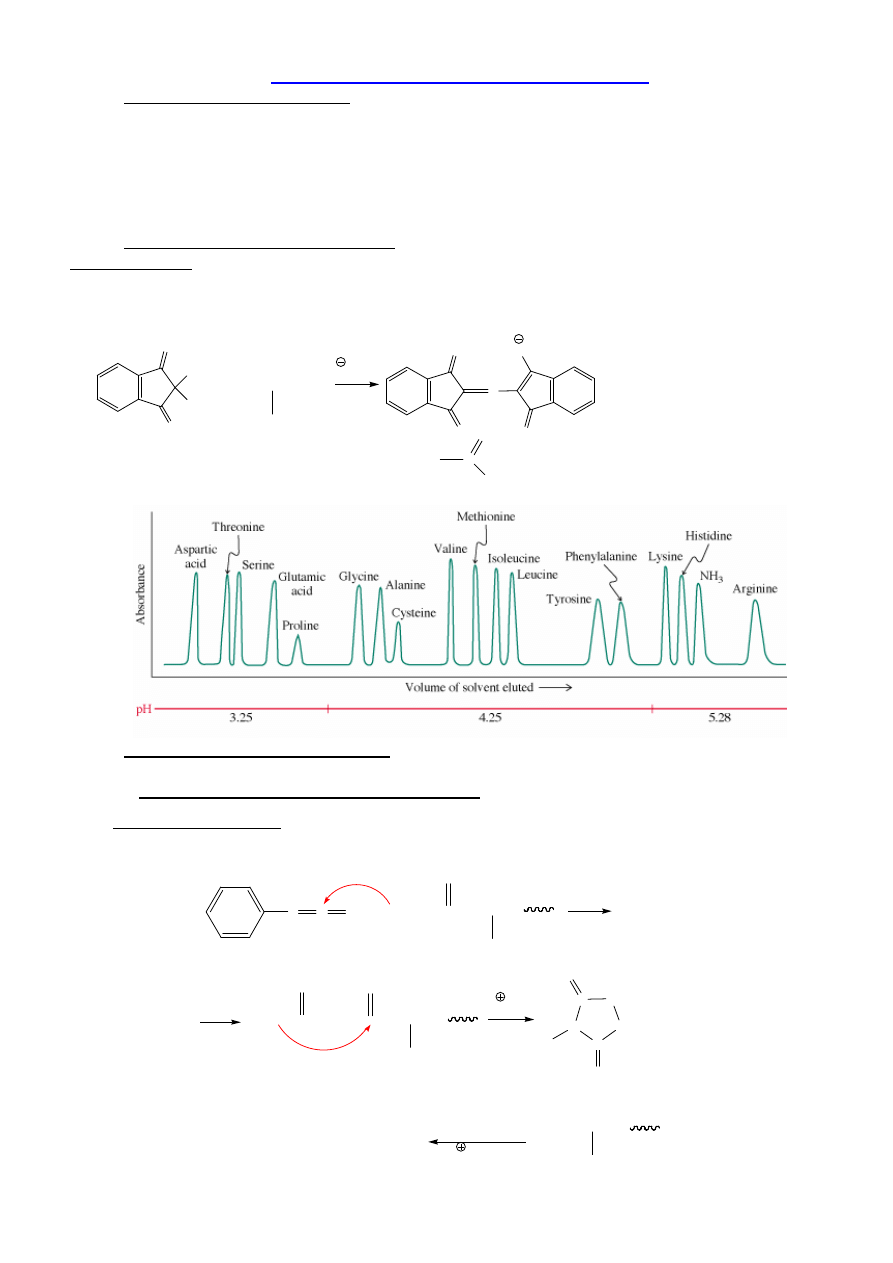
Badanie składu aminokwasowego: analizator aminokwasów lub MS
Analizator Aaa
a/ hydroliza (6 N HCl, 110 °C, 24 h);
b/ analiza aminokwasowa – kolumna z naładowanym ujemnie no
ś
nikiem, wymywanie
buforami, po elucji – reakcja z ninhydryn
ą
.
O
O
OH
OH
+ NH
2
CHCOOH
R
O
O
O
O
N
OH
H
2
O
+ R
C
O
H
+ CO
2
Absorbancja = f(t):
III.
Sekwencjonowanie tradycyjne:
a/ Ustalanie aminokwasu N-terminalnego:
Degradacja Edman’a:
Odczynnik Edmana = tiocyjanian fenylu
N
C
S
+ NH
2
-CH
2
-C-NH-CH-CO
O
CH(CH
3
)
2
Ph-NH-C-NH-CH
2
-C-NH-CH-CO
S
CH(CH
3
)
2
O
H, H
2
O
C
N
C
CH
2
NH
O
S
Ph
+
+ NH
2
-CH-CO
CH(CH
3
)
2
N-fenylotiohydantoina glicyny
PTH(Gly)
1. PhN=C=S
2. H, H
2
O
PTH(Val) + skrócony peptyd
16
Sekwenatory automatyczne - zwykle do 50 Aaa (nagromadzanie produktów ubocznych)
→
oznaczanie sekwencji w segmentach, inna hydroliza – oznaczenie uło
ż
enia segmentów.
Trypsyna – hydroliza przy COOH Lys, His
Chymotrypsyna – po Phe, Trp, Tyr
b/ Sekwencjonowanie z u
ż
yciem rekombinacyjnej technologii DNA
c/ Oznaczanie reszty C-ko
ń
cowej:
Inkubacja polipeptydu z karboksypeptydaz
ą
. Badania pojawiaj
ą
cego si
ę
Aaa. Peptyd z
nowym C-ko
ń
cem – dalsza degradacja.
Karboksypeptydaza A (trzustka wołowa) – prócz Pro, Arg, Lys
Karboksypeptydaza B (trzustka wieprzowa) – tylko gdy C-terminalna Arg lub Lys
Karboksypeptydaza A + B – wszystkie prócz Pro
Karboksypeptydaza C (li
ś
cie cytrusów) – wszystkie
Karboksypeptydaza Y (dro
ż
d
ż
e) – wszystkie
Strategia sekwencjonowania białek:
1. Gdy kilka ła
ń
cuchów polipeptydowych – rozdział (ekstremalne pH, 8M mocznik,
chlorowodorek guanidyny…).
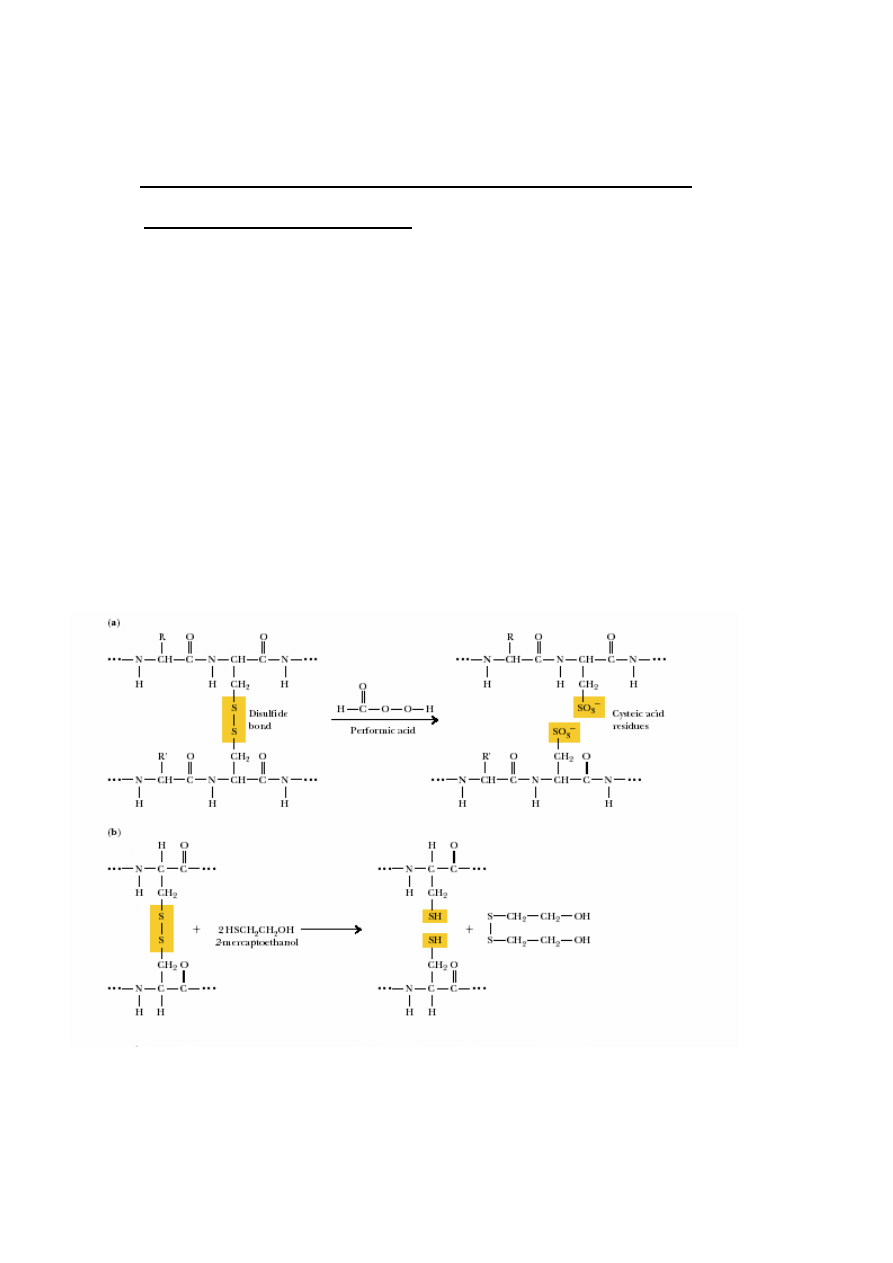
2. Rozerwanie mostków disiarczkowych:
Gdy S-S mi
ę
dzyła
ń
cuchowe 2
→
1
modyfikacje reaktywnego SH:
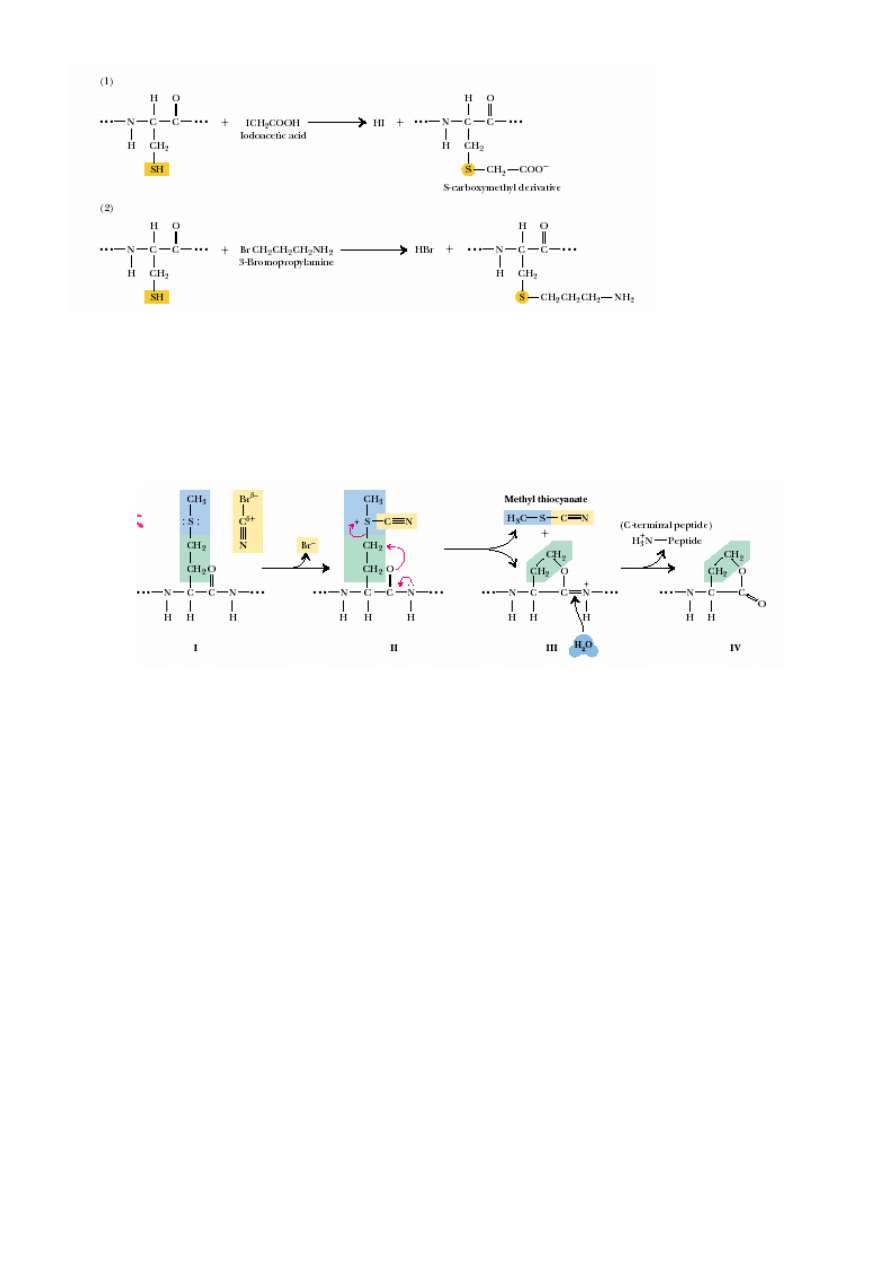
17
3. Ustalanie składu aminokwasowego.
4. Identyfikacja reszty C- i N-ko
ń
cowej (karboksypeptydazy, degradacja Edmana).
5. Hydroliza na mniejsze fragmenty, ustalanie ich sekwencji (trypsyna – po Arg, Lys,
chymotrypsyna – po aromatycznych Aaa, bromocyjan – po Met…).
lakton homoseryny
CNBr w 70% HCOOH
niestabilny w wodzie
produkt posredni
6. P-kt 5 powtórzony po innej proteolizie, generowanie nakładaj
ą
cych si
ę
fragmentów.
7. Rekonstruowanie sekwencji na podstawie nakładaj
ą
cych si
ę
fragmentów/
determinacja sekwencji na podstawie MS.
8. Lokalizacja mostków S-S.
Wyszukiwarka
Podobne podstrony:
aminokwasy[1] id 59122 Nieznany (2)
Aminokwasy 6 id 59098 Nieznany
aminokwasy 8 id 59102 Nieznany
aminokwasy 2 id 59089 Nieznany (2)
aminokwasy[1] id 59122 Nieznany (2)
6 Aminokwasy i bialka id 43565 Nieznany
Aminokwasy egzogenne id 59124 Nieznany (2)
Aminokwasy i bialka id 59127 Nieznany (2)
aminokwasy i peptydy id 59133 Nieznany
AMINOKWASY teoria id 59145 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
więcej podobnych podstron