
Zakażenia szpitalne –
Zakażenia szpitalne –
intensywna terapia
intensywna terapia
mgr Izabela Sałacińska

„Pierwszy wymóg, jaki musi spełniać
szpital, to nie pogorszyć choroby, z
którą pacjent został przyjęty”
Florence Nightingale

Zakażenie szpitalne rozwija się w czasie
pobytu chorego w szpitalu lub po jego
opuszczeniu.
Do zakażeń szpitalnych należą również
zakażenia personelu. Coraz częściej dochodzi
do zakażenia personelu wirusem wzw typu C
i B (wirusy są przenoszone przez
nieodpowiednio wyjawiony sprzęt medyczny
oraz niezadowalający reżim sanitarno –
higieniczny).

Źródłami zakażeń są:
- chorzy z chorobami zakaźnymi i
inwazyjnymi
- nosiciele chorób zakaźnych
- środowiska wilgotne
- osoby odwiedzające pacjentów

DROGI ZAKAŻENIA:
•
Droga kontaktowa:
- personel medyczny
- pacjenci
- insekty
- sprzęt medyczny
- sprzęt higieniczny
- narzędzia i aparatura medyczna
- preparaty dezynfekcyjne
- mydło i ręczniki wielokrotnego użytku
•
Droga krwi:
- zakażony materiał biologiczny
- krew i jej preparaty, zakażone płyny infuzyjne i leki, niesterylne
narzędzia chirurgiczne

•
Droga pokarmowa:
- naczynia stołowe, sztućce, zakażona
woda, pokarm zakażony florą
bakteryjną
•
Droga powietrzna:
- kurz, kropelki wydzielin z dróg
oddechowych pacjenta, zakażone
powietrze

Postęp w medycynie, najbardziej widoczny na
OIT, poprzez inwazyjność postępowania:
sztuczna wentylacja, dializoterapia czy
żywienie dojelitowe, wskazuje, iż zakażenia
dotyczą najczęściej tego oddziału. Objawia
się to w postaci zapalenia płuc (4-ktronie
częściej niż na innych oddziałach) oraz
zakażenia krwi. Coraz szersze wskazania do
operacji u ludzi starszych z cukrzycą, rozległą
miażdżycą i obniżoną odpornością sprzyja
zakażeniom w okresie pooperacyjnym.

Czynniki ryzyka na OIT:
- cewnik w żyle centralnej
- mechaniczna wentylacja
- długi pobyt w oddziale
- uraz przy przyjęciu
Ryzyko śmierci wzrasta:
- wiek powyżej 60 lat
- uszkodzenie narządowe przy przyjęciu
- zapalenie płuc
- kliniczne objawy zakażenia
- choroba nowotworowa

Badania z 1992 roju przeprowadzone w
Europie Zachodniej na 1417 oddziałach
intensywnej terapii, w grupie 10 000
wskazały że: zarejestrowano zakażenie
u 45% pacjentów; z tego 47% dotyczyło
układu oddechowego, 18% układu
moczowego, 19% krwi, 12% rany.
Aż 62% pacjentów otrzymywało
antybiotyki, w tym 51% przynajmniej
dwa antybiotyki.

Z aktualnych badań Grupy ds. Sepsy
Polskiego Towarzystwa Anestezjologii i
Intensywnej Terapii wynika:
- u 47% zakażonych pierwszym
miejscem była jama brzuszna
- u 28% układ oddechowy
- u 10% krew
- u 5% rana

Problemem charakterystycznym dla
zakażeń szpitalnych jest rozwój bakterii
i grzybów oraz ich oporność na
antybiotykoterapie. Przyczyną jest m.
in. nadużywanie antybiotyków, nie tylko
w medycynie ludzkiej ale również w
weterynarii, przemyśle kosmetycznym i
ochronie roślin.

Bakterie; podobnie jak ludzie; mają aspiracje
aby: gdziekolwiek żyć, mieć wystarczającą
ilość pożywienia, szansę rozmnażania,
możliwość uniknięcia naturalnych wrogów
oraz kłopotliwych sąsiadów.
Łatwe przemieszczanie się ludności w związku z
taniejącymi biletami lotniczymi, misje
wojskowe, strefa euro, to przyczyny
przywlekania wielu chorób wywołanych przez
wirusy: Ebola, Manta, żółtej febry, wirus grypy
i SARS.

Wirus Ebola
Wirus Ebola

Gorączka krwotoczna Ebola – choroba zakaźna o
wysokiej śmiertelności zaliczana do wirusowych
gorączek krwotocznych. Czynnikiem
etiologicznym gorączki krwotocznej jest wirus
Ebola, należący RNA - wirusów z rodziny
Filoviridae, blisko spokrewniony z wirusem
Marburg. Choroba wywoływana jest u ludzi
przez 3 z 4 znanych biotypów wirusa - są nimi:
- Ebola - Zaire,
- Ebola - Sudan
- Ebola - Ivory Coast (Cote d'Ivoire).
Jedynym podtypem nie wywołującym zakażenia u
ludzi jest Ebola - Reston (chorobotwórczy u
małp).

Większość przypadków kończy się śmiercią z wykrwawienia.
Naturalnym rezerwuarem są prawdopodobnie gryzonie i
małpy Saba. Najczęściej występuje w krajach
tropikalnych. Zarażenie następuje po bezpośrednim
kontakcie z chorym, chociaż choroba może także
przenosić się innymi drogami. Okres choroby trwa do ok.
2 tygodni (najszybszy przypadek śmierci nastąpił po 4
dniach), przy czym śmiertelność waha się w granicach 60
- 90%.
Pierwsze objawy gorączki krwotocznej przypominają objawy
grypy - wysoka temperatura, bóle mięśni, biegunka. W
miarę postępu chory zaczyna wymiotować, odczuwać
bóle brzucha, klatki piersiowej oraz głowy, pojawia się
wysypka. W szczytowej fazie choroby może dojść do
obfitych krwawień z jam ciała oraz krwotoków
wewnętrznych. Niejednokrotnie chory może nawet w tym
czasie tracić przytomność i kontakt z otoczeniem a nawet
doznawać zaburzeń psychicznych.

Jedyny znany szczep, który przenosi się drogą
powietrzną - Ebola Reston - nie jest szkodliwy
dla człowieka.
Na terenie Afryki centralnej w czasie ostatniego
pięćdziesięciolecia zanotowano
prawdopodobnie sześć epidemii wywołanych
różnymi szczepami, w których zmarło około
750 osób na 1000 zainfekowanych. Przyczyny
epidemii leżały głównie w obyczajach ludności
i bardzo niskim standardzie służby zdrowia w
krajach afrykańskich - używano wielokrotnie
tych samych igieł i strzykawek, brak było
podstawowych środków medycznych i
przeszkolenia personelu.

Rozpoznanie:
- dodatni wynik biopsji skóry;
- wykrycie kwasu nukleinowego wirusa Ebola;
- dodatnie badanie serologiczne, które może
wystąpić późno w przebiegu choroby.
Leczenie: leczenie przyczynowe nie jest znane.
Stosuje się leczenie objawowe i
podtrzymujące, polegające na utrzymywaniu
równowagi kwasowo-zasadowej i wodno-
elektrolitowej.
Trwają prace nad opracowaniem szczepionki.

Zdolności namnażania bakterii
zmniejszają się w środowisku suchym i
zimnym, zwiększają w wilgotnym i
ciepłym. Dotyczy to głównie pałeczek
G-ujemnych Pseudomonas i
Acinetobacter. Najczęściej kolonizują
zlewy, nawilżacze, miski, baseny oraz
pojemniki na mydło.
Śmiertelność w OIT rośnie wprost
proporcjonalnie do liczby zakażeń.

Długość pobytu chorego w szpitalu jest
czynnikiem istotnie wpływającym na ryzyko
rozwoju zakażenia. Po tygodniu pobytu na
OIT około 80% chorych ulega kolonizacji florą
bakteryjną charakterystyczną dla danego
oddziału. Zakażenie może nastąpić przy
udziale flory endogennej znajdującej się w
organizmie pacjenta (przewód pokarmowy) i
egzogennej przenoszonej głównie za
pośrednictwem rąk personelu i sprzętu lub
bezpośrednio na linii pacjent – pacjent.

Bardzo ważnym ogniwem w kierunku
zwalczania zakażeń szpitalnych jest
czynnik ludzki – personel szpitalny.
- mycie rąk
- zdejmowanie biżuterii, zegarków
Ręce powinny być myte i odkażane przed
i po każdym kontakcie z chorym, po
każdej wykonywanej czynności, po
ściągnięciu rękawiczek ochronnych.

Rękawiczki jednorazowego użytku są w 85%
- 99% wykonane z lateksu naturalnego.
Nadwrażliwość na białko znajdujące się w
lateksie, szacuje się na 1% ludności na
świecie, wśród personelu medycznego w
Polsce: 16% - 18% pielęgniarek i 6%
chirurgów. Nadwrażliwość może przybierać
różne formy: od odczynów skórnych po
reakcje alergiczne o charakterze wstrząsu.

Fartuchy jako ubranie ochronne powinno
być noszone przez wszystkich
pracowników służby zdrowia. Fartuchy
powinny być używane wszędzie tam
gdzie ubranie może mieć kontakt z
krwią oraz wydzielinami i wydalinami
pacjenta. Na OIT powinno używać się
nowego fartucha jednorazowego
podczas pracy przy każdym chorym.

Inne czynniki:
- maski twarzowe
- dekontaminacja sprzętu medycznego
(dezynfekcja i sterylizacja)
Cewnikowanie pęcherza moczowego

Zakażenie cewnika wprowadzanego do żył
centralnych jest bardzo poważnym
powikłaniem w postaci bakteriemii. Składa
się na to wiele przyczyn a szczególnie sposób
obchodzenia się z cewnikiem. Ponad 50%
zakażeń jest spowodowanych
nieprzestrzeganiem ogólnych zasad aseptyki
podczas wykonywania czynności związanych
z podawaniem leków i podłączeniem
kroplówek do otworów kraników tworzących
linię dożylną.

Duże znacznie ma zachowanie prawidłowych
zasad aseptyki podczas wprowadzania
cewnika, zasady nie powinny się różnić od
standardów przyjętych dla
przeprowadzanych operacji. Ze względu na
stan pacjentów na oddziałach OIT większość
takich zabiegów jest wykonywana na łóżku
chorego co wymaga postępowania jeszcze
bardziej aseptycznego (obłożenie pola
serwetami jałowymi)

Podczas obsługiwania centralnej linii dożylnej
trzeba przestrzegać zasad aseptyki, należy
przed podłączeniem strzykawki lub kroplówki
zdezynfekować spirytusem w sprayu otwory
kranika. Dodatkowo jedno wejście w
cewnikach wielokanałowych powinno być
zarezerwowane na żywienie dożylne.
Opatrunki o ile nie są zmoczone lub zabrudzone
krwią należy zmieniać co drugi dzień,
dodatkowo dezynfekując okolicę wejścia
cewnika w skórę.

Cewnik centralny należy wymieniać w
sytuacji gdy:
- istnieje stan zapalny lub ropa w okolicy
wkłucia
- cewnik został założony w warunkach nie
zapewniających aseptyki
- pacjent gorączkujący (nie ma innej przyczyny
gorączki poza cewnikiem)
Zawsze obowiązuje pobranie krwi do badania
bakteriologicznego – krwi z żyły obwodowej,
krwi pobranej z cewnika, końcówki cewnika i
ropy z miejsca wkłucia.

Zakażenia bakteriami G -
Zakażenia bakteriami G -
dodatnimi
dodatnimi
Gronkowce są najczęstszym czynnikiem
etiologicznym zarówno zakażeń szpitalnych i
poza szpitalnych.
Trzy szczepy najczęściej występujące na
OIT to:
- gronkowiec złocisty – Staphylococcus aureus
- koagulazo – ujemny zwany też naskórnym –
Staphylococcus epidermidis
- hemolizujący – Staphylococcus haemoliticus

Spośród 16 gatunków gronkowców związanych z
człowiekiem, gronkowiec złocisty jest najbardziej
złośliwy. Elementy odpowiedzialne za zjadliwość tej
bakterii to białka powierzchniowe ułatwiające
kolonizację.
Gronkowiec koagulazo – ujemny charakteryzuje się
mniejszą złośliwością, ponieważ przez wiele lat był
stałym elementem ludzkiej skóry; posiada nadzwyczajne
zdolności do kolonizacji, szczególnie materiałów
sztucznych wprowadzanych do organizmu.
Częstość zakażeń:
- 0,5% przy protezowaniu stawów biodrowych
- 3% stawy kolanowe
- 1 – 4% sztuczne zastawki serca
- 4 – 6% rozruszników serca
- 0,1% soczewki oka
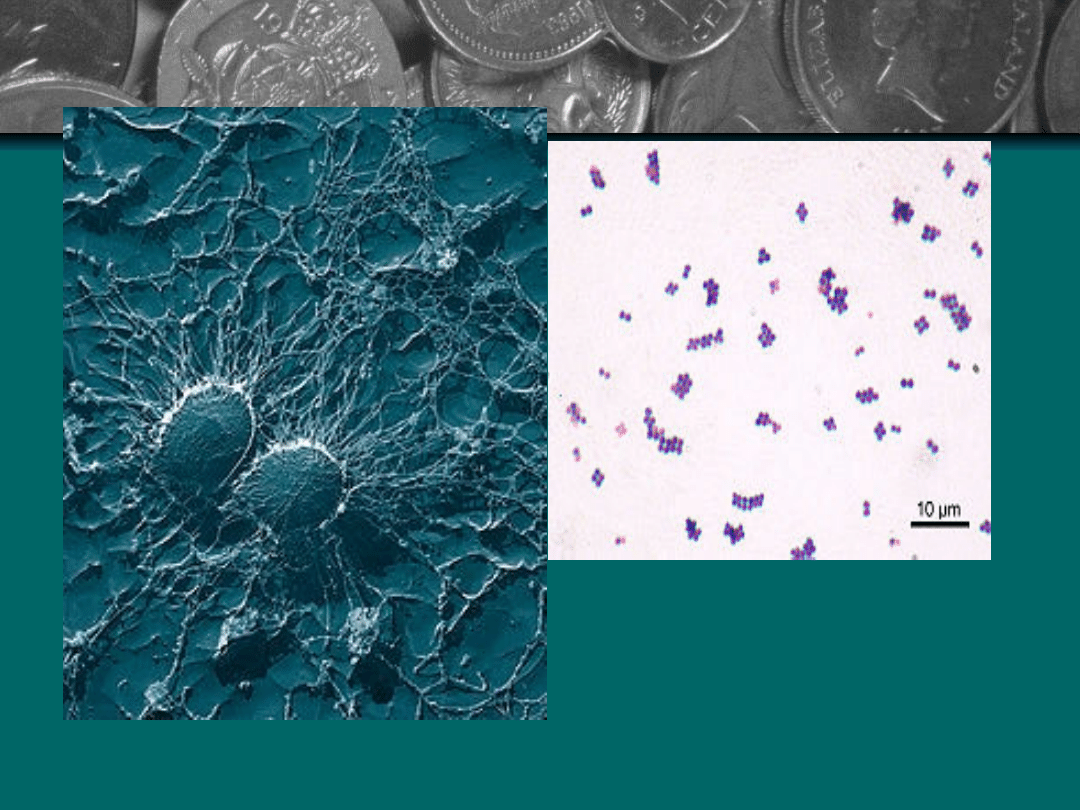

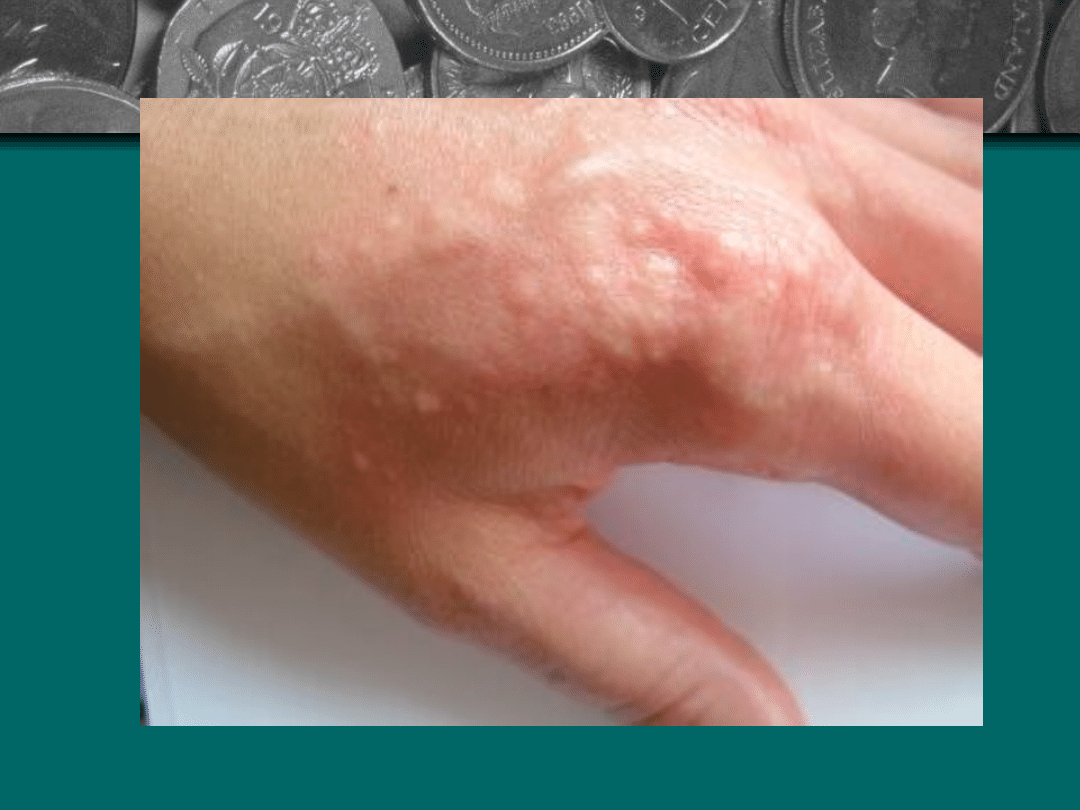
MRSA
MRSA
Szczep MRSA wykryto w 1961 r. w Wielkiej Brytanii. Nie
dlatego, że tam właśnie się pojawił po raz pierwszy, a
raczej, że po raz pierwszy się nim zainteresowano.
Masowe zakażenie gronkowcem może wywołać
śmiertelną sepsę (posocznicę). Pomimo drakońskich
metod walki z chorobami szpitalnymi, odnotowuje się
coraz więcej zakażeń właśnie szczepem MRSA.
Amerykańskie Centrum Kontroli Chorób (CDC –
Center for Disease Control) ocenia, że w samych
Stanach Zjednoczonych liczba szpitalnych zakażeń
MRSA podwoiła się w latach 1999–2005. Ostatni
raport z października ubiegłego roku donosi, że w
2005 r. szczep MRSA wywołał ponad 94 tys. zakażeń,
powodując prawie 19 tys. zgonów, a więc więcej niż
AIDS. Podobne tendencje obserwuje się też w innych
wysoko rozwiniętych krajach świata. Pojawiają się już
szczepy wywodzące się z MRSA, które odporne są
nawet na najsilniejszy znany antybiotyk –
wankomycynę – i jego zmodyfikowaną formę o
przedłużonym działaniu – teicoplanin.

MRSA (ang. methicyllin-resistant
Staphylococcus aureus), gronkowiec złocisty
oporny na metycylinę – lekooporne szczepy
gronkowca będące częstą przyczyną zakażeń
wewnątrzszpitalnych oraz stanowiące poważny
problem finansowy dla służby zdrowia.
Wykształcony przez drobnoustroje typ oporności
oznacza brak wrażliwości na wszystkie
antybiotyki z grupy beta-laktamów – w tym
penicyliny, cefalosporyny, monobaktamy czy
karbapenemy. Szczepy MRSA są jedynymi
bakteriami Gram-dodatnimi, na które nie
działają karbapenemy.

• Gronkowiec złocisty to Gram-dodatnia
bakteria występująca w powietrzu, glebie -
co oznacza ze stale się z nią stykamy. U
człowieka i zwierząt występuje na skórze,
gruczołach łojowych i potnych, mieszkach
włosowych oraz na wszystkich błonach
śluzowych które stykają się z otoczeniem
tzn.: oczy, usta, nos, gardło, przewód
pokarmowy, a także narządy płciowe.
• Gronkowiec złocisty (Staphylococcus ureus)
wywołuje ropne zapalenie skóry, śluzówek,
tkanki łącznej oraz kości w postaci różnego
rodzaju czyraków, ropni itp. W przypadku
przedostania się do krwioobiegu może
uszkodzić i wywołać ogniska zapalne
organów wewnętrznych.

Sposoby zakażenia Gronkowcem złocistym:
• drogą kropelkową
• przez kontakt pośredni
• przez przedmioty codziennego użytku
Ryzyko zakażenia Gronkowcem złocistym wzrasta
w przypadku:
• przerwania ciągłości tkanek (otarcia, zadrapania,
skaleczenia)
• obecności ciała obcego w tkankach
• współistniejących chorób, takich jak: nowotwory (np.
białaczka), marskość wątroby, cukrzyca i inne
choroby metaboliczne, stosowanie terapii
immunosupresyjnej lub przeciwnowotworowej,
• inne niedobory odporności.

Paciorkowce
Rozróżnia się 4 grupy paciorkowców A, B,
C, G, paciorkowce zieleniejące oraz
wyodrębnioną grupę D zwaną
Enterococcus i dwoinkę zapalenia płuc
czyli pneumokoka – Streptococcus
pneumoniae.

1. Paciorkowce z grupy B, C i G
- paciorkowce z grupy B są odpowiedzialne za
zakażenia noworodkowe, ponieważ u 20 –
25% kobiet w ciąży kolonizują one drogi
rodne, ale zakażenie może być wynikiem
infekcji szpitalnej, przenoszonej przez
personel; kobietom szczególnie narażonym
na przeniesienie zakażenia na dziecko podaje
się profilaktycznie antybiotyk w czasie
porodu.
- paciorkowce z grupy C i G wywołują zapalenie
gardła, skóry oraz dróg rodnych.

2. Enterokoki
Przez wiele lat były uznawane za
fizjologiczną florę kolonizującą wiele
obszarów ludzkiego ciała (pęcherzyk
żółciowy, pochwa, jelito grube).
Spośród 16 gatunków dwa z nich:
Enterococcus faecalis i Enterococcus
faecium, izolowane są z zakażonych
tkanek u ludzi.

Pneumokoki
Zakażenia pneumokokowe dotyczą zapalenia płuc,
zapalenia opon mózgowych, w 20% przypadków są
powikłane bakteriemią. Wielokierunkowy sposób
nabierania oporności na peniciline, cefalosporyny i
makrolidy stanowi bardzo istotny problem
terapeutyczny. Pierwszy oporny na peniciline
pneumokok został zidentyfikowany w 1967 roku, od
tego momentu liczna pneumokoków opornych na
peniciline wzrasta osiągając w :
- Azji 80%
- Francja 40%
- Hiszpania 26%
- Polska 14%
- najmniej kraje skandynawskie

Diagnostyka mikrobiologiczna polega na
pobraniu materiału do hodowli z
jałowych miejsc – krew, płyn z opłucnej,
płyn mózgowo – rdzeniowy i badaniu
preparatu bezpośrednio pobranego z
drzewa oskrzelowego, plwociny albo
płynu mózgowo – rdzeniowego oraz
wykrywaniu przy pomocy antygenów
przeciwciał pneumokokowych.

Meningokoki
Neisseria meningitidis to G-ujemna dwoinka
zapalenia opon mózgowo – rdzeniowych.
Wyłącznym rezerwuarem jest człowiek, liczba
bezobjawowych nosicieli waha się od 2 – 25%;
wzrasta w okresie zimowym. Miejscem
kolonizacji jest nosogardło. Nosicielstwo tylko w
niewielkim odsetku prowadzi do zachorowania
(1/1000 – 5000 nosicieli). Najwięcej
zachorowań obserwuje się u dzieci, szczególnie
poniżej 1 r. ż. i w przedziale wiekowym 15 – 24
lata. Związane jest to ze stylem życia , w
którym przenoszenie bakterii drogą kropelkową
jest ułatwione.

Meningokoki charakteryzują się bardzo
dużą zjadliwością – skutkiem jest
aktywacja kaskady zapalnej czyli
aktywacja układu krzepnięcia z zespołem
wykrzepiania wewnątrznaczyniowego i
charakterystycznymi objawami
zatorowości w drobnych naczyniach.
Efektem tego jest martwica tkanek w
wielu narządach, objawiająca się na
zewnątrz plamistą martwiczą wysypką.

Diagnostyka mikrobiologiczna:
- płyn mózgowo – rdzeniowy (badanie pod
mikroskopem, posiew oraz badanie osadu)
- wymaz z jamy nosowo – gardłowej
- pobranie materiału z wybroczyn na skórze
- krew na posiew
- badanie post mortem do 5 godz. od
momentu zgonu

Zakażenia wywołane przez
Zakażenia wywołane przez
bakterie G-ujemne
bakterie G-ujemne
1. Pałeczka ropy błękitnej – Pseudomonas
aeruginosa. Należy do grupy pałeczek nie
fermentujących, o bardzo małych
wymaganiach odżywczych, szeroko
rozpowszechniona w środowiskach
wilgotnych. Bakteria typowo szpitalna o
rozwiniętych cechach inwazyjności i
zdolności do kolonizacji, która wzrasta wraz z
długością pobytu w szpitalu – w ciągu 7 dni
kolonizacji ulega 23%, po 14 dniach aż 60%.
Źródłem zakażenia może zlew, nawilżacz,
ssak oraz środek dezynfekcyjny zawierający
chlorheksydynę.

2. Acinetobacter baumanii są szeroko
rozpowszechnione w przyrodzie. Występują w
ziemi, wodzie, produktach spożywczych oraz
w wielu miejscach na skórze (gdzie panuje
wilgoć). Czynnikami zwiększającymi ryzyko
zakażenia są: osłabienie odporności,
oparzenia oraz podeszły wiek. Na oddziałach
IT najczęstsze zakażenia dotyczą płuc i
bakteriemii, obciążonych dużą
śmiertelnością,

Bakterie beztlenowe
Bakterie beztlenowe
Można je podzielić na wytwarzające i nie
wytwarzające zarodniki. Do pierwszej grupy
zalicza się bakterie z rodzaju Clostridium,
odpowiedzialne za infekcję związaną z
wytwarzaniem toksyn:
- Clostridium botulinum – odpowiedzialne za
zatrucia jadem kiełbasianym
- Clostridium tetani – tężec
- Clostridium diffcile – przyczyna
rzekomobłoniastego zapalenia jelita grubego

Do grupy nie wytwarzającej przetrwalników należą G-
ujemne pałeczki (Fusobacterium), G-dodatnie
pałeczki (Lactobacillus).
Bakterie beztlenowe zostały odkryte przez Pasteura
(1861 r.) Bakterie te dominują nad bakteriami
tlenowymi w proporcjach:
- w jelicie grubym – 1:1000
- w pochwie – 1:100
- w jamie ustnej i górnych drogach oddechowych –
1:10
Równowaga ta zapewnia prawidłowe funkcjonowanie
ekosystemu człowieka, zabezpieczając przed
kolonizacją bakterii patogennych, co jest
szczególnie widoczne w obrębie przewodu
pokarmowego.

Spadek odporności, niedotlenienie tkanek,
cukrzyca czy perforacje w obrębie
przewodu pokarmowego są przyczyną
rozwoju zakażeń wywoływanych przez te
bakterie. Stanowią one istotny udział w
zakażeniach jamy ustnej (zakażenia
okołozębowe), jamy brzusznej, miednicy,
w ropniach zlokalizowanych w OUN, w
zapaleniach skóry i tkanki podskórnej.

Pojedyncza bakteria beztlenowa rzadko
wywołuje zakażenie, natomiast przy
współudziale innych bakterii
beztlenowych (a przede wszystkim
bakterii tlenowych) stają się one
przyczyną zakażeń.

Pałeczka Jadu Kiełbasianego
Beztlenowa bakteria, powodująca zatrucie pokarmowe. Jad
kiełbasiany, czyli toksyna botulinowa, jest wytwarzany
poza organizmem ludzkim, w zanieczyszczonych
produktach spożywczych. Botulina to najsilniejsza
toksyna bakteryjna. Wpływa ona układ nerwowy,
uszkadzając przewodzenie bodźców w synapsie
nerwowo-mięśniowej. Clostridium botulinum rozwija się
w hermetycznie zamkniętych konserwach mięsnych,
rybnych, jarzynowych i owocowych, w konserwach
domowych, przeterminowanych lub niewłaściwie
przechowywanych. Bakteria powoduje bombaż konserw i
puszki z zakażonymi produktami są zazwyczaj rozdęte.
Po otwarciu produkt pachnie zjełczałym tłuszczem.
Gotowanie w wysokich temperaturach powoduje
rozłożenie toksyny. Po zjedzeniu zakażonego produktu
jad zostaje wchłonięty do ustroju z przewodu
pokarmowego.

Clostridium botulinum występująca
naturalnie np. w miodzie, w niezwykle
rzadkich przypadkach powoduje u
niemowląt ciężką chorobę, tzw.
botulizm dziecięcy - rozwój choroby jest
spowodowany nie skutkiem działania
botuliny, ale namnażaniem się bakterii
w organizmie. Nie należy więc dawać
miodu dzieciom poniżej 1 roku życia.

Okres inkubacji może trwać od kilku godzin do
kilkunastu dni i zależy od dawki spożytej
toksyny. Chory jest osłabiony, zmęczony,
cierpi na zawroty głowy i suchość w ustach.
Po kilku godzinach zaczyna widzieć
podwójnie i cierpi na światłowstręt, zez
zbieżny, opadanie powiek, rozszerzenie
źrenic. Z powodu braku śliny chory nie może
połykać i mówi cicho. Z powodu upośledzenia
perystaltyki jelit brzuch jest wzdęty i chory
cierpi na ciężkie zaparcia oraz na
zaburzenia w oddawaniu moczu.

Narasta osłabienie mięśni, głównie
szyjnych i oddechowych. W ciężkich
przypadkach dochodzi do śmierci z
powodu: niewydolności oddechowej,
zachłystowego zapalenia płuc,
zatrzymania akcji serca (ok. 10%-20%
przypadków). Śmierć jest spowodowana
porażeniem ośrodka oddechowego i
nagłym zatrzymaniem krążenia krwi.

Leczenie: tylko w szpitalu, bardzo często
kończące się śmiercią. Leczenie powinno być
rozpoczęte jak najszybciej, natychmiast po
spożyciu zakażonego pokarmu. Aby usunąć
toksynę, należy sprowokować wymioty,
wypłukać żołądek, zrobić lewatywę oraz podać
surowicę antytoksyczną, aby zneutralizować
truciznę jeszcze we krwi. Chorzy, którzy wyjdą
z zatrucia jadem kiełbasianym, zdrowieją
bardzo wolno, szczególnie jeśli chodzi o
zaburzenia wzroku i osłabienia mięśni.

Gruźlica
Ważnym wydarzeniem było odkrycie przez
Roberta Kocha prątków gruźlicy w 1882 roku.
Za klasyczną postać bakterii wywołujących
gruźlicę u ludzi uważa się prątki należące do
kompleksu Mycobacterium tuberculosis.
Gruźlica jest jedną z najstarszych chorób
zakaźnych, której udokumentowane początki
sięgają okresu ponad 35 000 lat wstecz i
uważana jest za największego pojedynczego
zabójcę. Obecnie na świecie notuje się coraz
większą liczbę zachorowań, szczególnie na
gruźlicę lekooporną.

Szacuje się, że 1/3 światowej populacji jest zakażona
prątkami gruźlicy, a WHO przewiduje że w roku
2020 około miliarda ludzi ulegnie zakażeniu, z
czego 150 milionów umrze. 95% zgonów z powodu
gruźlicy dotyczy krajów rozwijających się.
Przyczyny:
- źle przygotowane programy zwalczania gruźlicy
- nieudolna realizacja nawet najlepszych programów
- brak środków finansowych
- nie przestrzeganie przez chorych reżimów
przyjmowania leków
- migracja ludzi, szczególnie z krajów biednych do
bogatych

Czynnikiem bardzo obciążającym, jeżeli
chodzi o zapadalność na gruźlicę jest HIV.
Z raportu WHO, opublikowanego w 2007
roku wynika, że największa liczba
zakażeń HIV u osób chorych na gruźlicę
jest w Portugalii i Hiszpanii – 16% i 19%.
W Hiszpanii, Portugalii, Estonii, Łotwie i
Litwie jest największy procent (15 – 23%)
chorych na gruźlicę wysokooporną czyli
nie reagującą na rifampicynę i izoniazyd.

Klasyczne leczenie gruźlicy polega na
łącznym podaniu 4 leków:
- izoniazydu
- rifampicyny
- pyrazinamidu
- etambutolu lub streptomycyny

Bardzo ważne jest wczesne rozpoznanie gruźlicy.
Na podstawie ogólnego badania lekarskiego
można podejrzewać gruźlicę u osób skarżących
się na zmęczenie, nocne poty, stany
podgorączkowe, spadek masy ciała i
utrzymujący się przez 2 – 3 tygodnie kaszel.
Następnym etapem są badania obrazowe –
RTG klatki piersiowej w dwóch projekcjach, o
ile istnieją wskazania również TK. Diagnostyka
bakteriologiczna polega na ocenie pod
mikroskopem preparatów barwionych z
plwociny zbieranej przez 3 kolejne dni oraz
popłuczyn żołądkowych, moczu oraz płynu
mózgowo – rdzeniowego.

Ptasia grypa
Jest to wysoce zaraźliwa choroba wywołana
przez wirusy grupy A. Wirusy typu AH5N1,
które zarażają człowieka, są wyłącznie
pochodzenia ptasiego. Głównym obszarem,
który stanowi rezerwuar wirusa są Chiny i
południowo – wschodnia Azja, gdzie hoduje
się bardzo dużą ilość drobiu stłoczonego
razem z ludźmi na niewielkich obszarach, w
prymitywnych warunkach, bez zachowania
należytych standardów epidemiologicznych
podczas obróbki drobiu do celów
spożywczych.

Jedynym skutecznym sposobem zahamowania
epidemii jest wybijanie całych stad
zakażonego ptactwa. Ogniska zachorowań
wśród ludzi, które obejmowały co najmniej 2
zachorowania, odnotowano w 10 krajach.
Największe z tych ognisk obejmowało 8 osób,
w 90% były to osoby spokrewnione, co może
sugerować podatność genetyczną na
zakażenie. Do grudnia 2007 roku na świecie
zachorowało 314 osób, z czego 61% zmarło.

Główną drogą przenoszenia zakażenia jest
bezpośredni kontakt z zakażonym lub
martwym ptactwem podczas oskubywania,
uboju lub przygotowywania do spożycia. Inny
sposób zakażenia to kontakt z przedmiotami
zanieczyszczonymi kurzym nawozem,
inhalacja pyłu zawierającego wirus,
spożywanie produktów skażonych oraz kąpiel
w zbiornikach wodnych zanieczyszczonych
odchodami płynów.
Wszystkie wydzieliny i wydaliny osób chorych
są potencjalnym źródłem zakażenia. Okres
inkubacji nie przekracza 7 dni, ale może być
krótszy czyli 2 – 5 dni.

Główny proces patologiczny przebiega w płucach pod
postacią wirusowego zapalenia, często o
piorunującym przebiegu z pełnoobjawowym
zespołem ARDS. Replikacja może również
przebiegać w górnych drogach oddechowych, w
przewodzie pokarmowym, jak również – jako
czynnik ogólnego zakażenia – we krwi i płynie
mózgowo – rdzeniowym. Odpowiedzią organizmu
na zakażenie jest uruchomienie uogólnionej reakcji
zapalnej. Ciężkie zapalenie płuc rozwija się średnio
w ciągu 4 dni, a zgon następuje w czasie 4 – 10 dni.
Dominują objawy niewydolności oddechowej
charakterystycznej dla zespołu ARDS i DIC. Inne
objawy: nudności, wymioty, biegunka, bóle brzucha
i w obrębie klatki piersiowej oraz krwotoki.

SARS
Przyczyną ciężkiej niewydolności oddechowej
są koronawirusy, o specyficznej budowie;
źródło ich pochodzenia jest nieznane.
Pierwsze zachorowanie zanotowano w Hong-
Kongu w 2003 roku, wówczas epidemia
objęła Chiny wywołując 5163 zachorowania a
następnie rozprzestrzeniła się w 23 krajach.
Całkowita liczba zachorowań wyniosła 7864,
w tym 643 osoby zmarły.

Okres prodromalny przypomina objawy grypy w
fazie zakażenia charakteryzującej się suchym
kaszlem, dusznością i hipoksemią. Po 6 – 8
dniach u 80 – 90% chorych następuje samoistna
poprawa. 20 – 30% pacjentów wymaga
intensywnej terapii, w tym 76 – 85% wentylacji
mechanicznej.
SARS wywołał na całym świecie chaos
organizacyjny, który po części wynikał z
zamykania OIT z powodu kwarantanny oraz
trudności we wzajemnym porozumiewaniu się
szpitali i organizacjami rządowymi
odpowiedzialnymi za ochronę zdrowia.
Uwidoczniły się również wtedy braki środków
finansowych i braki personelu pielęgniarskiego.

Inwazyjne zakażenia grzybicze
Stanowią poważny i rosnący problem
oddziałów intensywnej terapii o profilu
chirurgiczno – internistycznym z
dominującą rolą gatunku Candida.
Zakażenia Candida stanowią obecnie
czwartą lub piątą przyczynę zakażeń
krwi.

Czynniki, które sprzyjają że zakażenia
grzybicze występują głównie w OIT:
•
inwazyjność postępowania
•
stan ogólny leczonych pacjentów,
prowadzący do obniżenia odporności
•
stosowanie w leczeniu zakażeń bakteryjnych
szerokiej gamy antybiotyków, które prowadzą
do zaburzeń fizjologicznych równowagi
ułatwiając patologiczne namnażanie się
grzybów.
•
żywienie parenteralne drogą centralnych
naczyń żylnych

Niecharakterystyczne objawy kliniczne i trudna
diagnostyka laboratoryjna powodują późne
postawienie rozpoznania, a tym samym
opóźnienie leczenia, co skutkuje wysoką
śmiertelnością przewyższającą śmiertelność
wynikającą z zakażenia bakteryjnego.
Najbardziej obiektywną metodą potwierdzającą
rozpoznanie jest diagnostyka oparta o
badanie mikroskopowe pobranego do analizy
materiału tkankowego. Hodowla grzyba na
specjalnym podłożu Sabouranda potwierdza
rozpoznanie. Należy również przeprowadzić
badanie dna oka.

Szpitalne zapalenie płuc (HAP)
Jest to podstawowy problem terapeutyczny na
oddziałach IT na całym świecie. Zapalenie
płuc dzieli się na:
- postać wczesną, która rozwija się w ciągu
pierwszych 3 dni pobytu w szpitalu; lepsze
rokowanie
- postać późna, która rozwija się po 5 dniach
pobytu wywołaną przez wielooporne szczepy
bakterii; gorsze rokowanie

Czynniki zmniejszające ryzyko rozwoju HAP i VAP:
Unikanie intubacji gdy tylko to jest możliwe i
zastępowanie wentylacji mechanicznej poprzez
wentylację nieinwazyjną z zastosowaniem maski;
szczególnie u osób z przewlekłą obturacyjną chorobą
płuc
Skrócenie czasu wentylacji mechanicznej do
niezbędnego okresu poprzez ścisłą kontrolę nad
sedacją
Unikanie intubacji przez nos oraz wprowadzania
sondy do żywienia
Używanie rurek dotchawiczych i tracheostomijnych z
możliwością odsysania z okolicy ponad głośnią.

Właściwe podejście do obsługi układu obiegowego rur
łączących respirator z pacjentem
Otwarty / zamknięty układ odsysania z dróg
oddechowych
Wentylowani pacjenci powinni zawsze pozostawać w
pozycji z głową uniesioną pod kątem 45 stopni
Działania prowadzące do zmniejszenia kolonizacji w
nosogardzieli i jelitach
Profilaktyczne zastosowanie antybiotyków
Przetaczanie krwi
Właściwa aseptyka w pielęgnacji rurki intubacyjnej i
tracheostomijnej
Podanie soli fizjologicznej do rurki dotchawiczej przed
czynnością odsysania wydzieliny z drzewa oskrzelowego

Nowe rozwiązania technologiczne rurek
dotchawiczych i tracheostomijnych
•
Hi – Lo – rurka posiada duży kanał w
części grzbietowej do odsysania z okolicy
podgłośniowej; ma niestety kilka wad:
- masywna
- kanał do odsysania sprawia że jest
sztywna
- odsysanie powoduje przyssanie do portu
błony śluzowej co utrudnia odsysanie
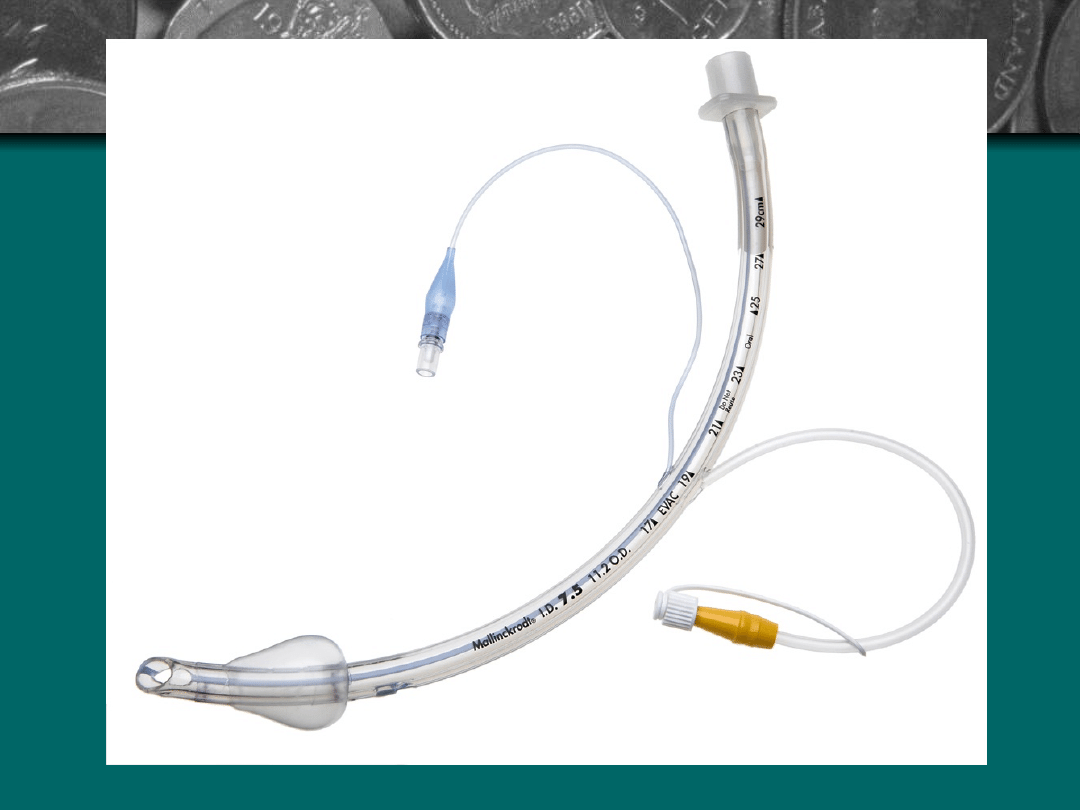

•
Rurki HVLP – rurki z mankietem
niskociśnieniowym produkowane są od
40 lat. Konstrukcja mankietu z coraz
cieńszego tworzywa powoduje, że
nieszczelności pomiędzy mankietem i
tchawicą są coraz mniejsze, dzięki
temu zmniejsza się przez to zaciekanie
tchawicy


•
Lo Trach System – składa się z rurki
dotchawiczej lub tracheostomijnej z
trzema kanałami do odsysania
wydzieliny z okolicy podgłośniowej.
Umożliwia to delikatne odsysanie
standardową strzykawką oraz
systemem automatycznej kontroli
ciśnienia w mankiecie.

Diagnostyka
Klasyczne objawy zapalenia płuc:
- nowe lub poszerzające się zmiany
radiologiczne płuc
- minimum 2 z 3 objawów dodatkowych:
temperatura powyżej 38 C, leukocytoza
lub leukopenia, obecność ropnej
wydzieliny w drzewie oskrzelowym.

Leczenie
Terapia antybiotykami powinna być wdrożona
w ciągu 4 godzin, zwierać szerokospektralny
antybiotyk w maksymalnej dawce.
Antybiotyk powinien być z innej grupy niż
ten, którym pacjent był uprzednio leczony,
charakteryzować się bardzo dobrą lub dobrą
penetracją do płuc. Głównymi antybiotykami,
które spełniają większość wymagań to
karbapenemy.

Zakażenia związane z
Zakażenia związane z
kaniulacją dużych naczyń
kaniulacją dużych naczyń
żylnych
żylnych
- podstawowy zabieg wykonywany na
OIT
- obecność kaniuli w żyle centralnej jest
czynnikiem odpowiedzialnym za 90%
zakażeń krwi
- 1/20 pacjentów doznaje zakażenia krwi
- czynniki ryzyka: wiek powyżej 60 lat,
płeć męska, alkoholizm, cukrzyca,
choroby nowotworowe i dializa.

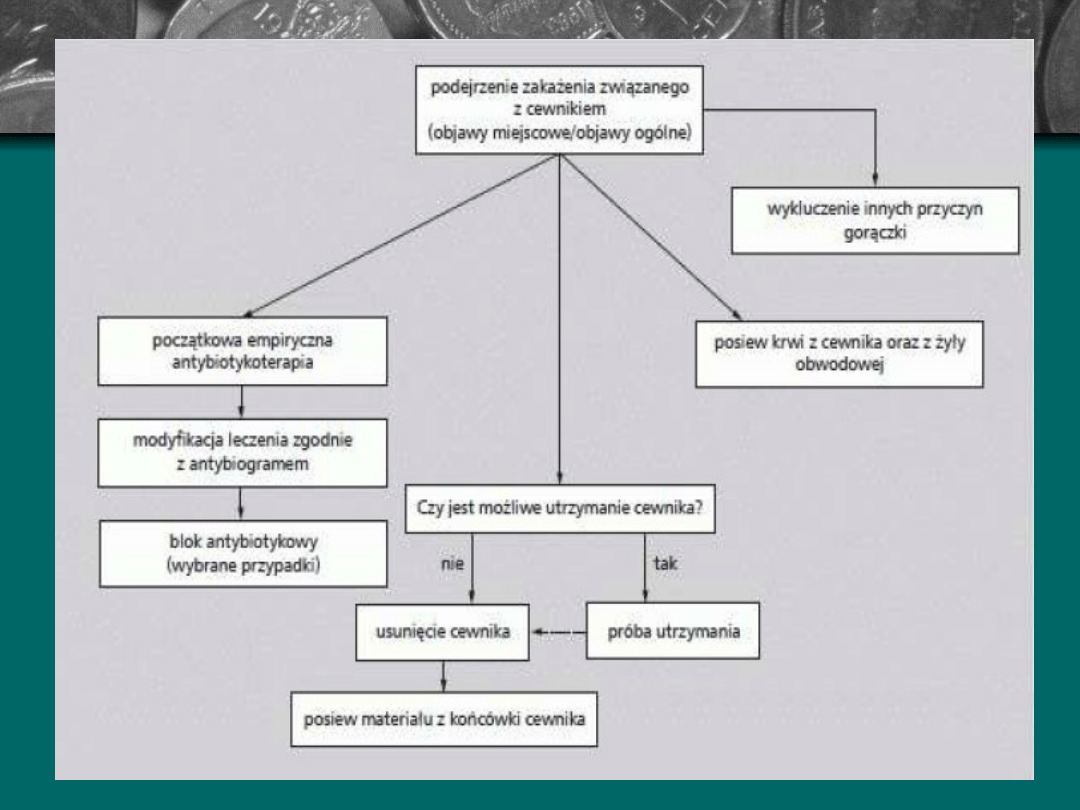
Niejednolita interpretacja pojęcia „zakażenie cewnika”
sprawia iż przyjmuje się następującą definicję (wg
Rybickiego):
- kolonizacja lub zakażenie cewnika – pozytywna hodowla bakterii
z części cewnika
- lokalne zakażenie – zaczerwienie, stan ropny w okolicy wkłucia
- kliniczne podejrzenie zakażenia cewnika – infekcja w miejscu
wkłucia, gorączka nie uzasadniona innymi przyczynami,
obecność cewnika z żyle powyżej 3 dni, dodatni posiew krwi
wobec obecności innego źródła zakażenia, normalizacja
temperatury po usunięciu cewnika
- bakteriemia zależna od cewnika – objawy zakażenia, którego
źródła nie można zlokalizować poza cewnikiem lub dodatni
posiew krwi w połączeniu z miejscowym zakażeniem miejsca
wkłucia, krew do badania musi być pobrana z żyły poza żyłą
centralną; bakteriemie rozpoznajemy łącząc objawy
pozytywnych posiewów tego samego patogenu wyizolowanego
z krwi pobranej przez cewnik, z części cewnika i z krwi
pobranej z osobnej żyły.

Decydującym czynnikiem związanym z
możliwością zakażenia cewnika jest czas
pobytu kaniuli z żyle:
- obecność cewnika do 3 dni – ryzyko 0%
- od 3 – 7 dni – ryzyko 3 – 5%
- powyżej 7 dni – ryzyko 5 – 10%
Do zakażenia dochodzi drogą
zewnątrzcewnikową przez migrację bakterii ze
skóry i dotyczy to przede wszystkim okresu
wczesnego. W pierwszym okresie ma miejsce
kolonizacja, głównie gronkowcami, z czego u
20% pacjentów dochodzi do zakażenia (dużą
rolę odgrywa tu również stan układu
odpornościowego)

Droga wewnątrzcewnikowa jest główną drogą
zakażeń kaniul długo utrzymywanych.
Zakażenie rozprzestrzenia się głównie poprzez
zanieczyszczenie złącz, kraników; a nie
obejmuje linii centralnej. Po 3 dniach połowa
złączy musi być skolonizowana. Są to
zakażenia jatrogenne, w których udział
personelu odgrywa ważną rolę. Nabiera to
szczególnego znaczenia, jeśli przez cewnik
prowadzi się żywienie dożylne, ponieważ
mieszaniny alimentacyjne stanowią pożywkę
dla bakterii. Zarówno do żywienia
pozajelitowego jak i przetaczania krwi i
preparatów krwiopochodnych powinna być
zarezerwowana osobna linia cewnika.

Zakażenia krwiopochodne i poprzez
zanieczyszczone płyny są rzadkie.
Istotnym czynnikiem, który zwiększa
ryzyko rozwoju zakażenia jest zakrzep
tworzący się na końcu cewnika lub
obejmujący znaczny obszar w żyle.
Zjawisko to towarzyszy 37 – 67%
przypadków kaniulacji żył centralnych,
ale tylko 0,5% manifestuje się w sposób
kliniczny (bez badania USG).

Najpewniejszym sposobem zapobiegania zakażeń
odcewnikowych jest przestrzeganie zasad
aseptyki i antyseptyki zarówno podczas
zakładania wkłucia centralnego i w późniejszej
opiece nad cewnikiem. Podczas zakładania
cewnika należy stworzyć warunki przybliżone
do panujących na sali operacyjnej:
- dokładne i szerokie obłożenie pola
operacyjnego
- sterylny ubiór
- dokładne umycie pola operacyjnego
- opatrunek z gazy, zmieniany co 48 godzin lub
częściej
- przemywanie okolicy wkłucia spirytusem

Cewnik należy wymienić gdy:
- istnieje podejrzenie zakażenia ogólnego
związanego z zakażeniem cewnika,
szczególnie gdy jest to podejrzenie infekcji
grzybiczej poprzez lokalizację w nowym
miejscu
- źródło zakażenia jest inne niż odcewnikowe –
wymienia się cewnik na nowy w tym samym
miejscu używając prowadnicy
- cewnik zakładany w sytuacji nagłej, bez
zachowania właściwego poziomu aseptyki i
antyseptyki; upoważnia to do wymiany
cewnika po prowadnicy w ciągu 24 godzin.


Posiew krwi
Posiew krwi
Wskazania do posiewu krwi
1. Podejrzenie bakteriemii lub fungemii (odcewnikowej, gorączka u
pacjentów z neutropenią i inne)
2. Podejrzenie zapalenia wsierdzia
3. Gorączka o nieznanej przyczynie
4. Posocznica
5. Jako badanie pomocnicze w diagnostyce:
- szpitalnego i pozaszpitalnego zapalenia płuc (do 50% przebiega z
bakteriemią);
- zapalenia opon mózgowo-rdzeniowych i ropni mózgu (40%
przypadków przebiega z obecnością bakterii we krwi);
- zakażenia układu moczowo-płciowego
- zakażenia miejsca operowanego;
- zakażenia w obrębie jamy brzusznej, zapalenia dróg żółciowych;
- głębokich, ropnych zmian skórnych;
- powikłań po ropnym zapaleniu ucha środkowego i zatok
przynosowych

Posiew krwi
Posiew krwi
POTRZEBNY SPRZĘT:
1.
Rękawiczki jednorazowe i jałowe
2.
System do zamkniętego pobierania krwi na posiew (np.
Vacutainer, Blood Collection Sets)
3.
Opaska uciskowa
4.
Środek dezynfekujący: 70% alkohol (alkohol izopropylowy,
etanol), 2% roztwór jodu lub środek zawierający 2% powidon
jodu
5.
Gaziki i plastry
6.
Odpowiednie podłoża - ogrzane do temperatury 37°C,
podpisane imieniem i nazwiskiem pacjenta (z zaznaczoną
datą pobrania próbki krwi)
7.
Starannie wypełnione skierowanie (imię i nazwisko pacjenta,
wiek, rozpoznanie, oddział, podawane antybiotyki, data i
godzina pobrania krwi)

Posiew krwi
Posiew krwi

Posiew krwi
Posiew krwi

Posiew krwi
Posiew krwi
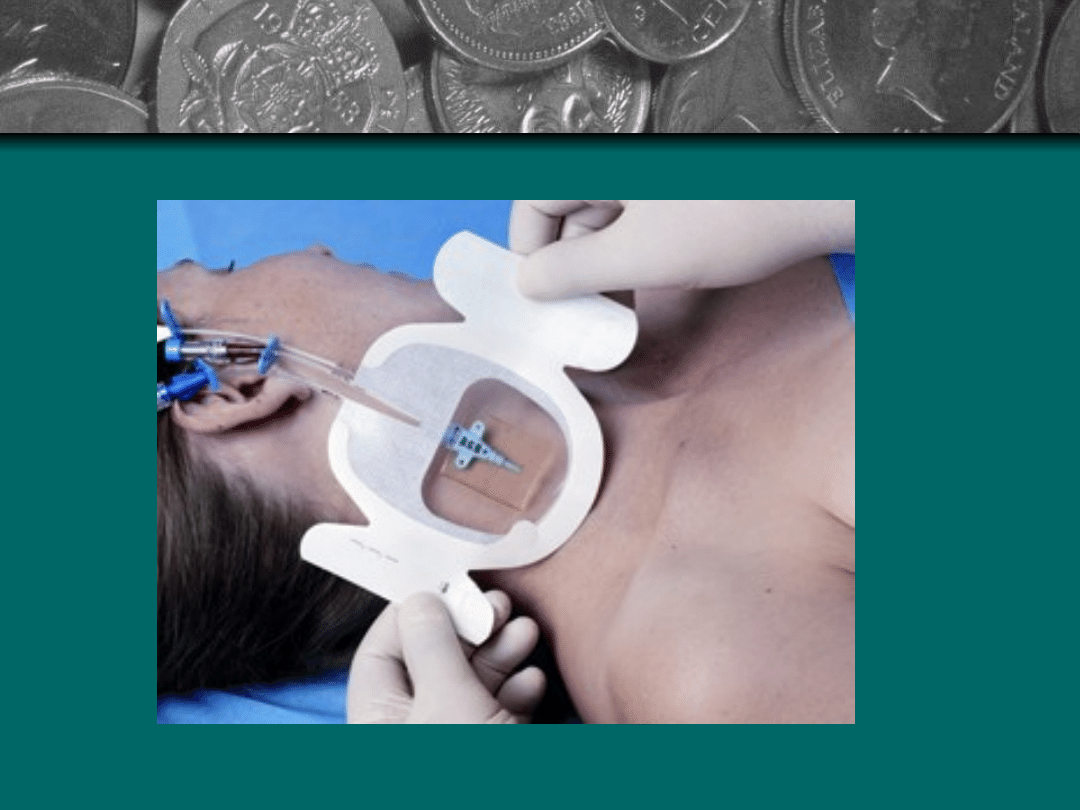
Technika wykonania zabiegu:
Skontrolowanie oprawnego wypełnienia skierowania
na badanie: imię i nazwisko, wiek, rodzaj materiału,
data i godzina pobrania próbki, miejsce pobrania
Ocena wyglądu podłoża i ogrzanie do temperatury
37C
Higienicznie umycie rąk
Wybranie odpowiedniej żyły
Nałożenie odzieży ochronnej
Zaciśnięcie opaski uciskowej

Posiew krwi
Posiew krwi
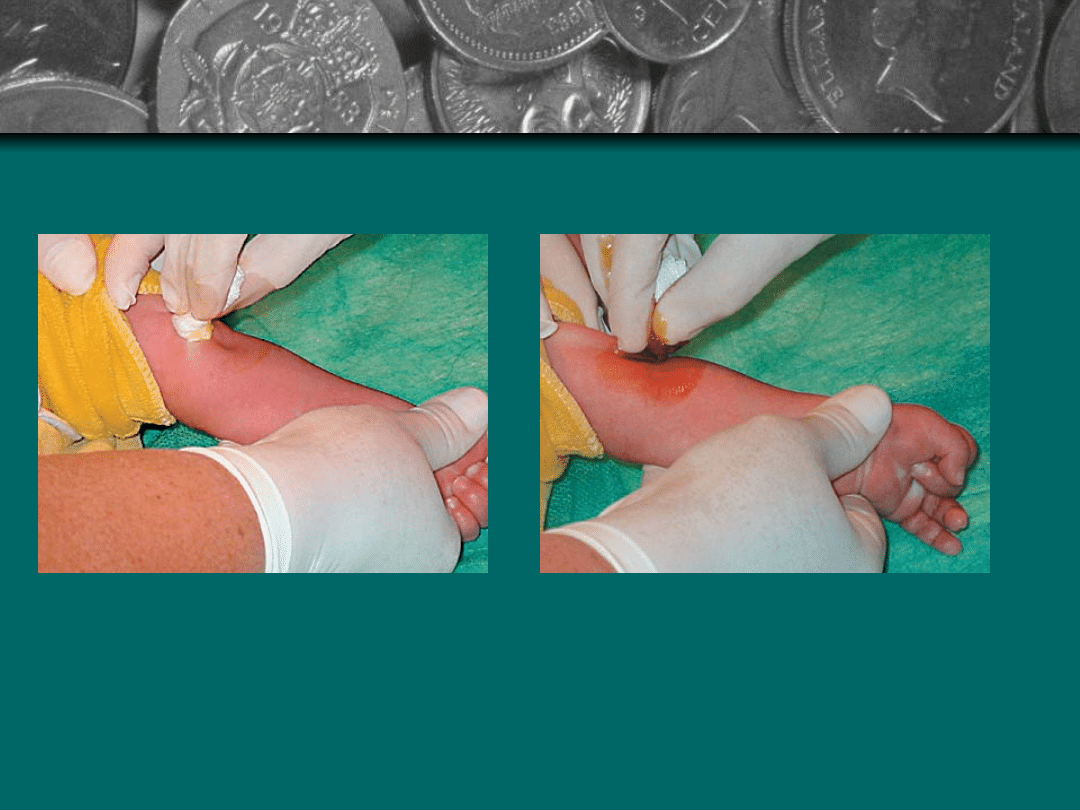
Wykonanie trzykrotnej dezynfekcji skóry
(każdorazowo odczekanie do wyschnięcia)
miejsca wkłucia ruchem kolistym od żyły
na zewnątrz
Jałowym gazikiem nasączonym 70%
roztworem alkoholu
Jałowym gazikiem nasączonym roztworem
jodyny
Jałowym gazikiem nasączonym 70%
roztworem alkoholu
Posiew krwi
Posiew krwi

Posiew krwi
Posiew krwi
Odkażenie gumowego korka butelki z podłożem
jałowym, gazikiem nasączonym roztworem 70%
alkoholu, kolejno jałowym gazikiem
nasączonym roztworem jodyny – gazik
zostawiamy na korku do czasu jego nakłucia
Nakłucie żyły i pobranie krwi – standardowo 5
ml
Wstrzyknięcie pobranej krwi do butelki z
podłożem (najpierw podłoże beztlenowe)
Założenie opatrunku
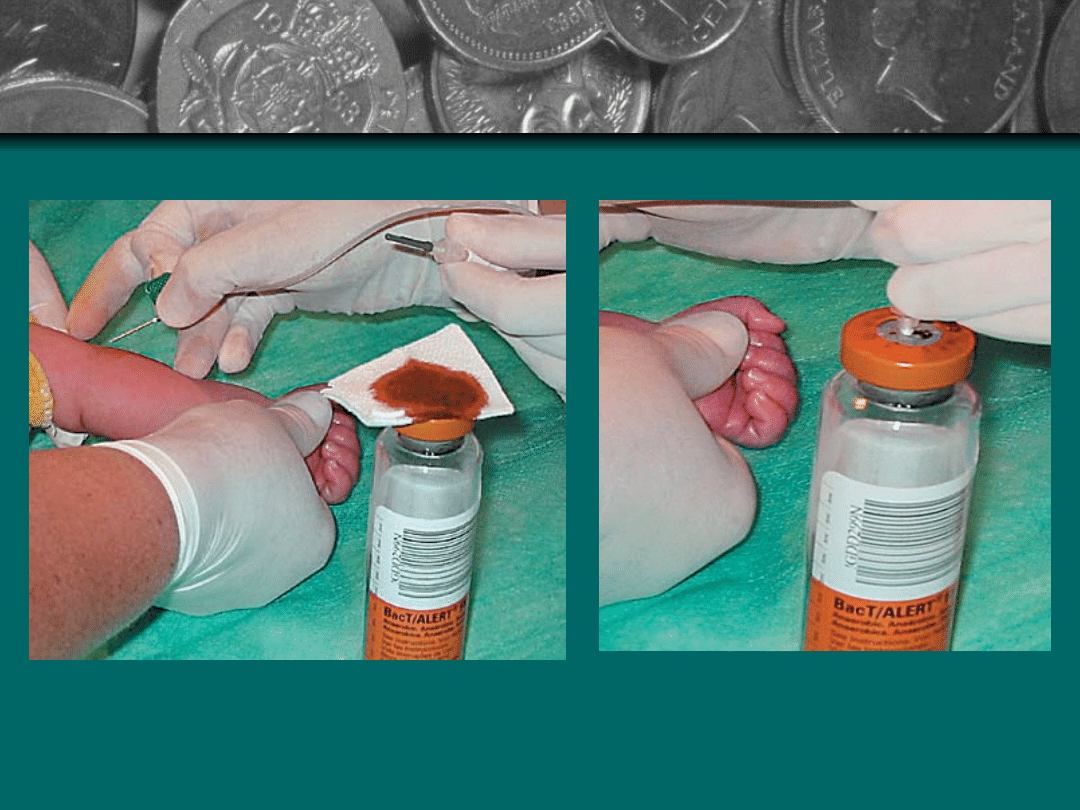
Posiew krwi
Posiew krwi

Posiew krwi
Posiew krwi
Ponowne odkażenie korka butelki z
podłożem, jałowym gazikiem
nasączonym 70% roztworem alkoholu
Odnotowanie wykonania zabiegu w
karcie
Jak najszybsze dostarczenie materiału
do laboratorium
Uporządkowanie sprzętu i higieniczne
umycie rąk

Posiew krwi
Posiew krwi
Najczęściej popełniane błędy podczas
pobierania krwi na posiew:
1. Zbyt mała objętość krwi
2. Niedostateczna liczba próbek
3. Badanie wykonane po wdrożeniu terapii
przeciwbakteryjnej
4. Pobranie krwi przez cewnik naczyniowy
wykorzystywany w innym celu
5. Niewłaściwe przygotowanie skóry pacjenta
6. Przechowywanie próbek krwi w niewłaściwej
temperaturze

Zakażenia dróg
Zakażenia dróg
moczowych
moczowych
Zakażenia układu moczowego stanowią
w USA 40% wszystkich zakażeń
szpitalnych i są podobne we wszystkich
grupach wiekowych. 90% z tych
zakażeń jest spowodowanych przez
cewnik założony do pęcherza
moczowego. Elementem najczęściej
wprowadzanym do dróg moczowych
jest cewnik Foleya (1927 r.)

Samo wprowadzenie cewnika do pęcherza
moczowego u pacjenta, łączy się z 2 – 6,5%
możliwością spowodowania infekcji. Czas
pozostawania cewnika w pęcherzu jest
bardzo istotnym czynnikiem w powstawaniu
zakażeń.
- od 1 do 7 dni – okres krótki
- od 7 do 30 dni – okres średni
- powyżej 30 dni – okres długi
W ciągu pierwszych 10 dni liczna zakażeń
wynosi 2 - 16%. Po upływie 30 dni zakażenie
dotyczy prawie wszystkich pacjentów

Działania zmniejszające liczbę zakażeń:
•
Rozsądne wskazania do założenia cewnika
•
Używanie jedynie szczelnych systemów odpływu moczu,
które posiadają zastawkę zapobiegającą jego cofaniu
•
Bezwzględne przestrzeganie zasad aseptyki:
sterylny zestaw + dokładne umycie cewki moczowej
środkiem antyseptycznym
nie zanieczyszczać cewnika z systemem drenażowym
podczas jego rozłączania
ręce personelu
•
Utrzymywanie w czystości okolicy odbytu i krocza
•
Opracowanie standardów postępowania

Odleżyny
Odleżyny
Powstanie zmian o typie odleżyn zależy od osobniczej tolerancji
ucisku, który zaburza przepływ przez drobne naczynia,
skutkiem czego rozwijają się odleżyny jako efekt niedotlenienia
tkanek. Tolerancja ucisku zależy od:
- masy ciała
- wieku
- stanu nawodnienia
- poziomu białka
- czynników stresowych
- temperatury
- obkurczania naczyń
- reaktywność pacjenta na ból
- brak zgłaszania dolegliwości
Liczba odleżyn maleje wraz ze wzrostem liczby pracujących
pielęgniarek.

Pacjenci na OIT są szczególnie narażeni
na powstawanie odleżyn ze względu
na:
- ciężkość schorzenia podstawowego
- niedożywienie
- zaburzenia perfuzji obwodowej
- zaburzenia natlenienia tkanek

Prewencja polega na zmianie pozycji co 2 - 3
godziny (pacjenci z niedowładem co 30
minut). Najlepszą pozycją jest przechylenie na
jedną lub drugą stronę ciała pod kątem 30
stopni z zabezpieczeniem przy użyciu
poduszek, dodatkowo używa się materacy p /
odleżynowych (40%→8%)
Zakażenie odleżyn stwarza poważne
zagrożenie, nie tylko z powodu bólu jak i
również ze względu na ostateczny wynik
leczenia.

Leczenie odleżyn ułatwiają specjalne
opatrunki, które poprzez oddziaływanie
na ranę umożliwiają jej oczyszczanie i
poprawiają proces gojenia i epitelizacji.
Hydrożele i alginiany zapewniają
wilgotne środowisko rany, wchłaniają
wydzielinę, bakterie i martwicze
fragmenty tkanek. Szczególne
właściwości wchłaniania wydzielin z
rany mają hydrokoloidy.

Rodzaje opatrunków
•
Hydrokoloidy – Granuflex, Hydrocoll – to
nieprzepuszczalne dla wody, aktywne
opatrunki w postaci płytek lub pasty,
powinne być zmieniane w zależności od
potrzeb co 1 – 7 dni. Stosowane są do
leczenia odleżyn od II do IV stopnia z
umiarkowanym lub dużym wysiękiem.
•
Opatrunki hydrofiber – Aquacel – są
zbudowane z karboksymetylocelulozy
sodowej, głównego składnika opatrunków
hydrokoloidowych; dają dobre efekty przy
leczeniu ran skolonizowanych przez bakterie
i ran zagrożonych rozwojem infekcji.

•
Hydrożele – Aquagel, Hydrosorb –
pozwalają na niezakłócony rozrost i migracje
komórek; stosowane są głównie do leczenia
płaskich lub o niewielkiej głębokości odleżyn
II, III i IV stopnia. Wymienia się je co 3 dni,
przepłukując ranę 0,9% roztworem NaCl.
•
Półprzepuszczalne błony poliuretanowe
– Opsite, Tegaderm – to cienkie, elastyczne
błony, dobrze przylegające do rany, nie mają
właściwości wchłaniających. Ich
przeźroczysta powierzchnia pozwala na
obserwację rany i procesu gojenia.

•
Opatrunki poliuretanowe – Allevyn,
Lyofoam – mają postać pianki, płytek lub
gąbki; posiadają właściwości pochłaniające,
izolacyjne i oczyszczające. Można je stosować
przy leczeniu odleżyn II, III i IV stopnia z dużym
wysiękiem, na ranie utrzymuje się je 1 – 5 dni.
•
Dekstranomery – Acudex, Cebrisan –
zbudowane są z małych ziarenek
polisacharydów, które w kontakcie z wysiękiem
formują żel. Dają dobre efekty przy leczeniu
dużych, głębokich i zainfekowanych ran (IV i V
stopień); działają skutecznie od 24 do 48
godzin.

•
Opatrunki alginianowe – Kaltostat,
Fibracol – są otrzymywane z glonów morskich.
Mają duże właściwości pochłaniające dlatego
wymagają rzadszej wymiany, nie wywołują
objawów nietolerancji i alergii. Stosowane są
głównie do leczenia płaskich i czystych odleżyn
od II do IV stopnia; nie powinny być stosowane
na odleżyny suche lub z objawami zakażenia.
•
Opatrunki złożone – Aquacel Ag – służą
głównie do leczenia ran zakażonych. Mocowane
są za pomocą gazy i bandaży na ranie,
wykazują aktywność przeciwbakteryjną przez
około 14 dni.
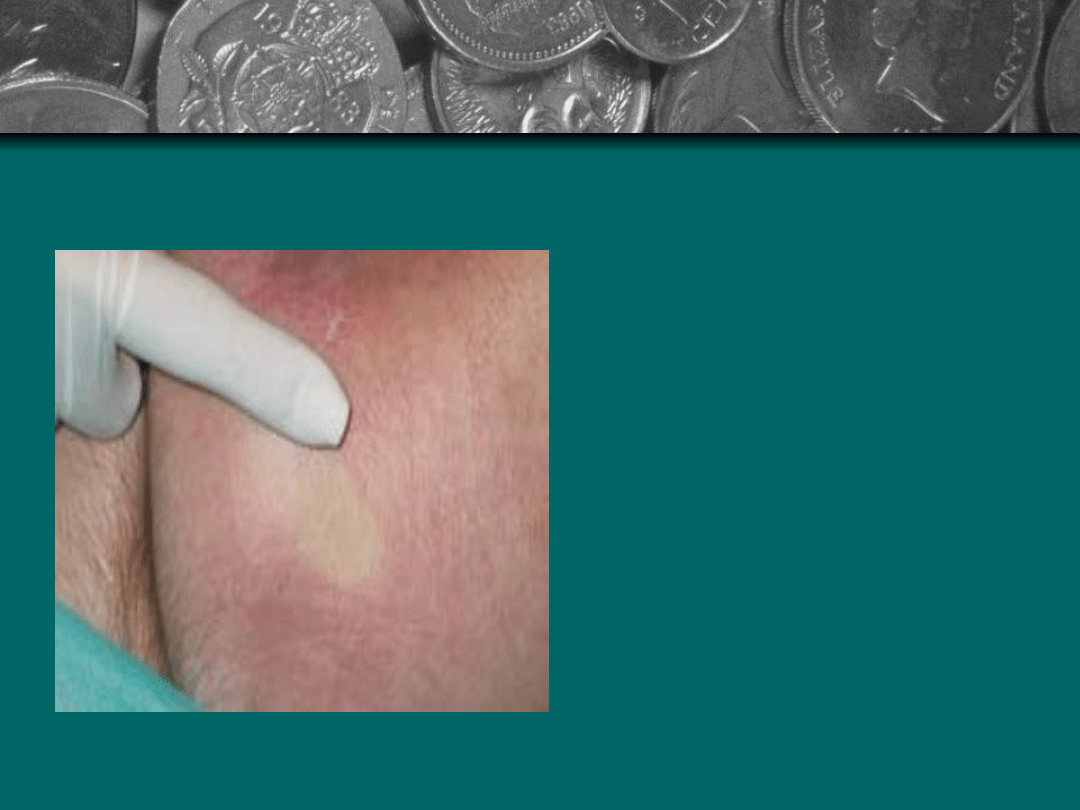
Stopnie zmian
Stopnie zmian
odleżynowych:
odleżynowych:
Klasyfikacja według
Klasyfikacja według
Torrance'a
Torrance'a
Stopień I - Blednące
zaczerwienienie -
reaktywne
przekrwienie i
zaczerwienienie,
odwracalne. Lekki
ucisk palcem
powoduje zbledniecie
zaczerwienienia, co
wskazuje na to, ze
mikrokrążenie jest
jeszcze
nieuszkodzone.
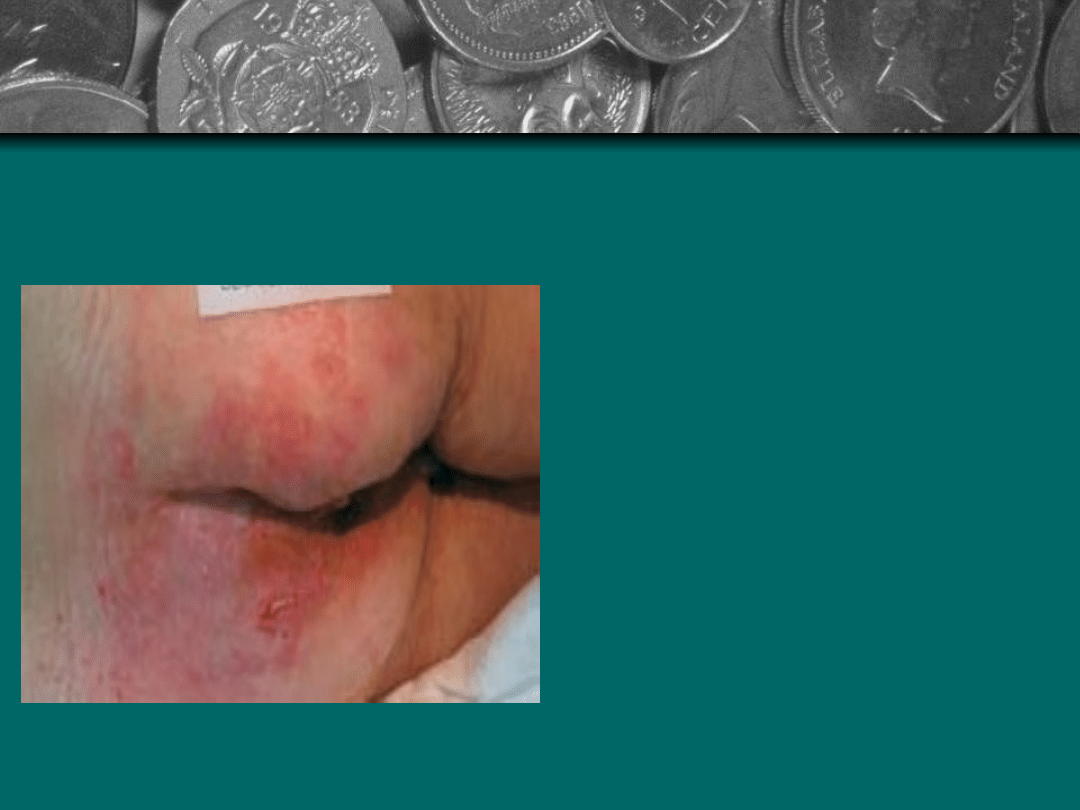
Stopień II: Nieblednace
zaczerwienienie -
rumień utrzymuje się po
zniesieniu ucisku.
Spowodowane jest
uszkodzeniem
mikrokrążenia,
zapaleniem i obrzękiem
tkanek. Może pojawić
się powierzchniowy
obrzęk, uszkodzenia
naskórka i pęcherze.
Zwykle towarzyszy
temu ból.
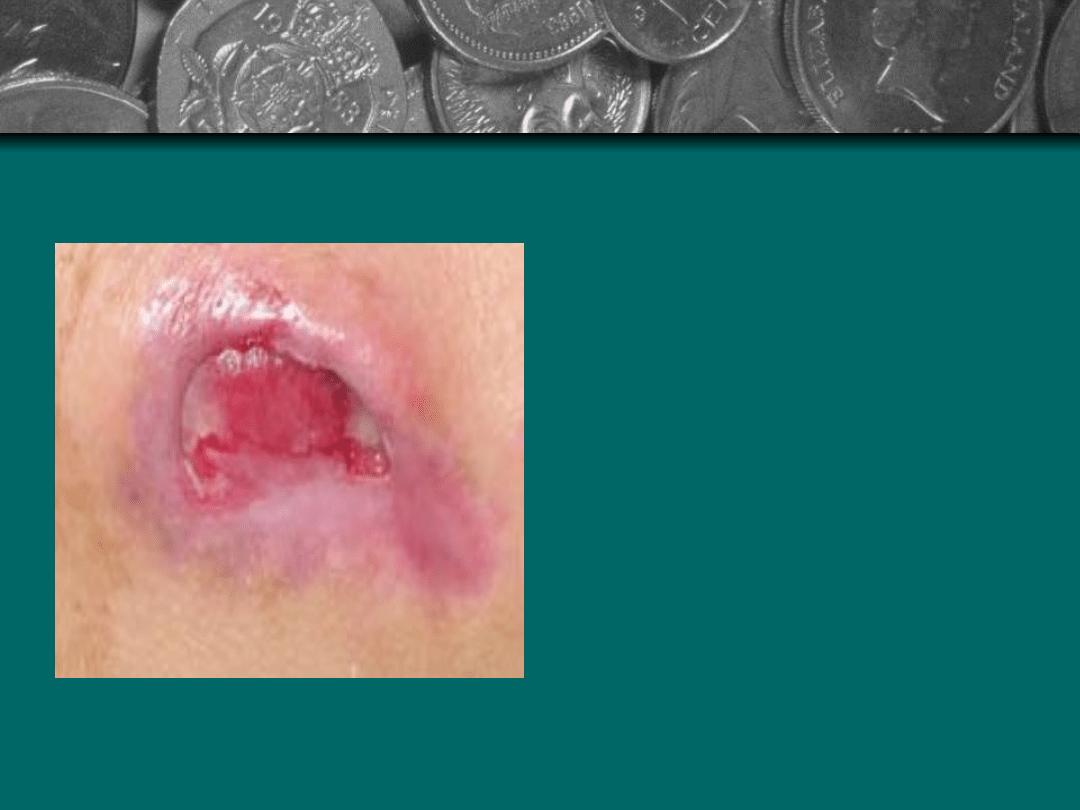
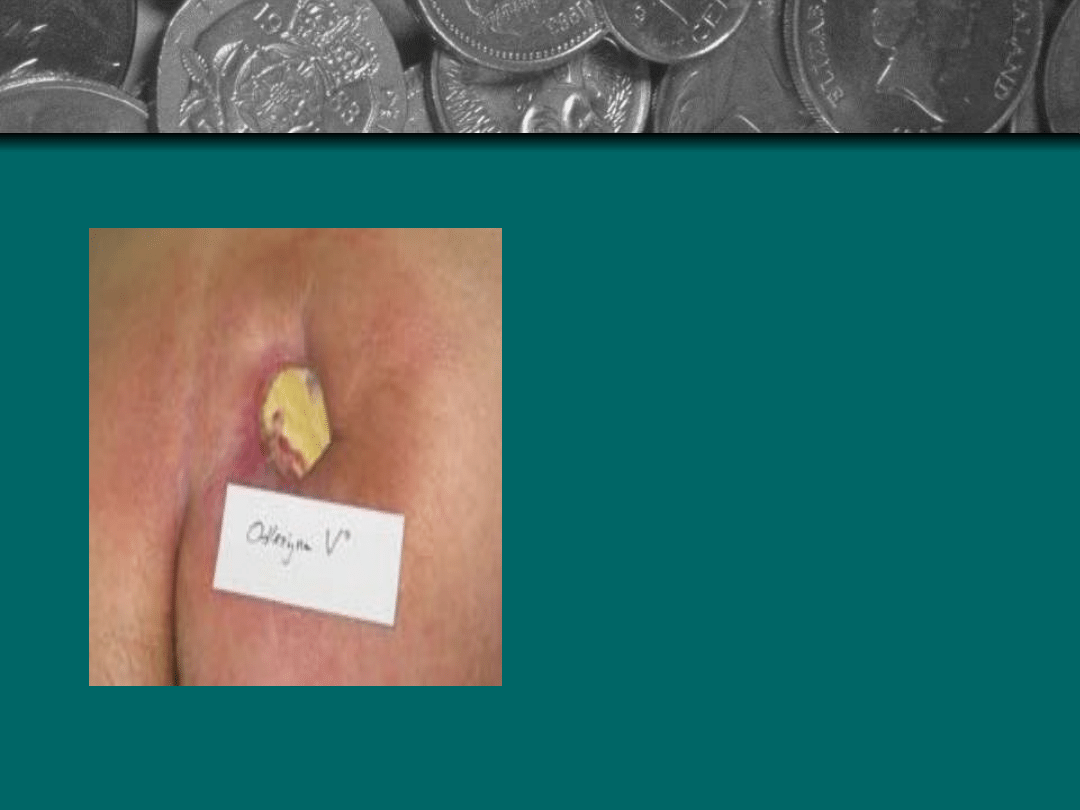
Stopień III: Uszkodzenie
pełnej grubości skóry
do granicy z tkanka
podskórna. Brzegi rany
są dobrze
odgraniczone, otoczone
obrzękiem i rumieniem.
Dno rany jest
wypełnione czerwona
ziarnina lub żółtymi
masami rozpadających
się tkanek.
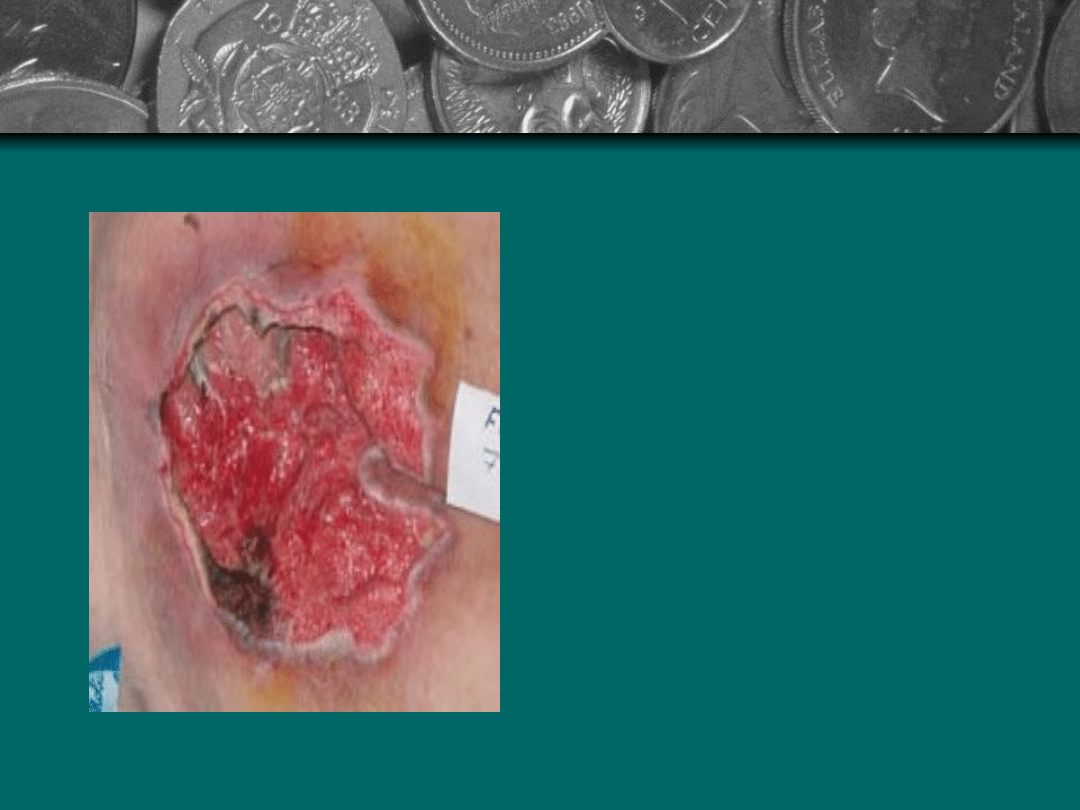
Stopień IV: Uszkodzenie
obejmuje również tkankę
podskórna. Martwica
tkanki tłuszczowej
spowodowana jest
zapaleniem i zakrzepica
małych naczyń. Brzeg
odleżyny jest zwykle
dobrze odgraniczony, lecz
martwica może także
dotyczyć tkanek
otaczających. Dno może
być pokryte czarna
martwicą.
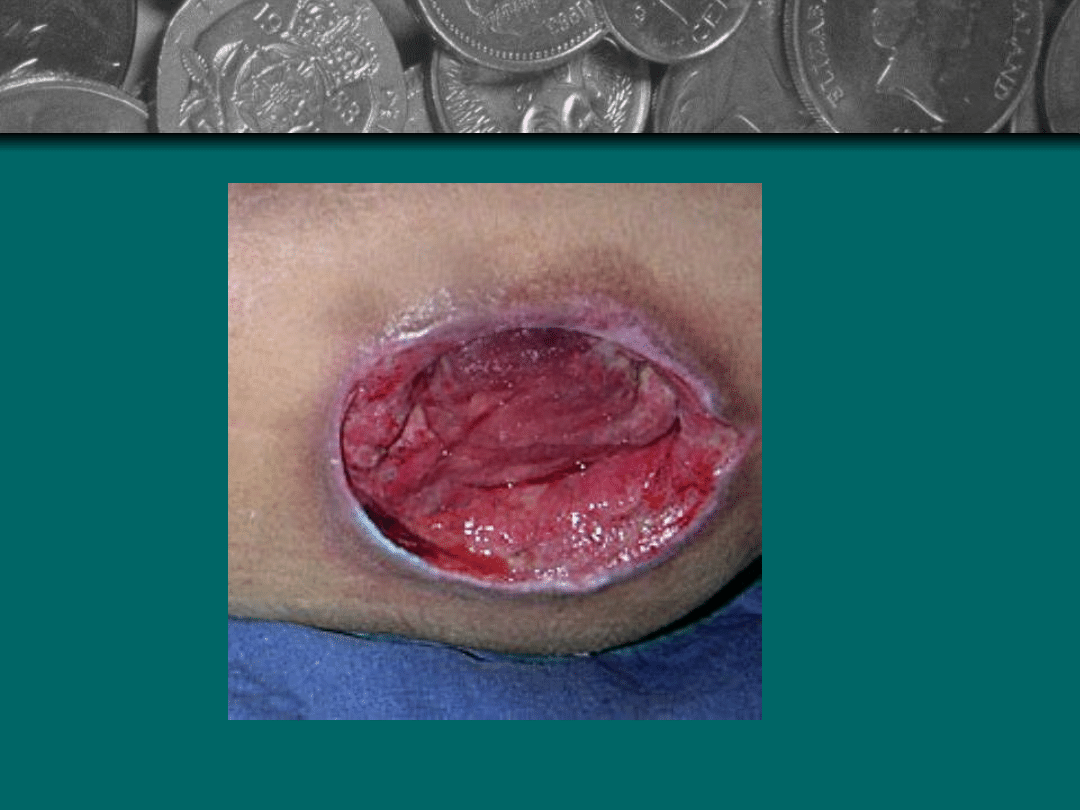
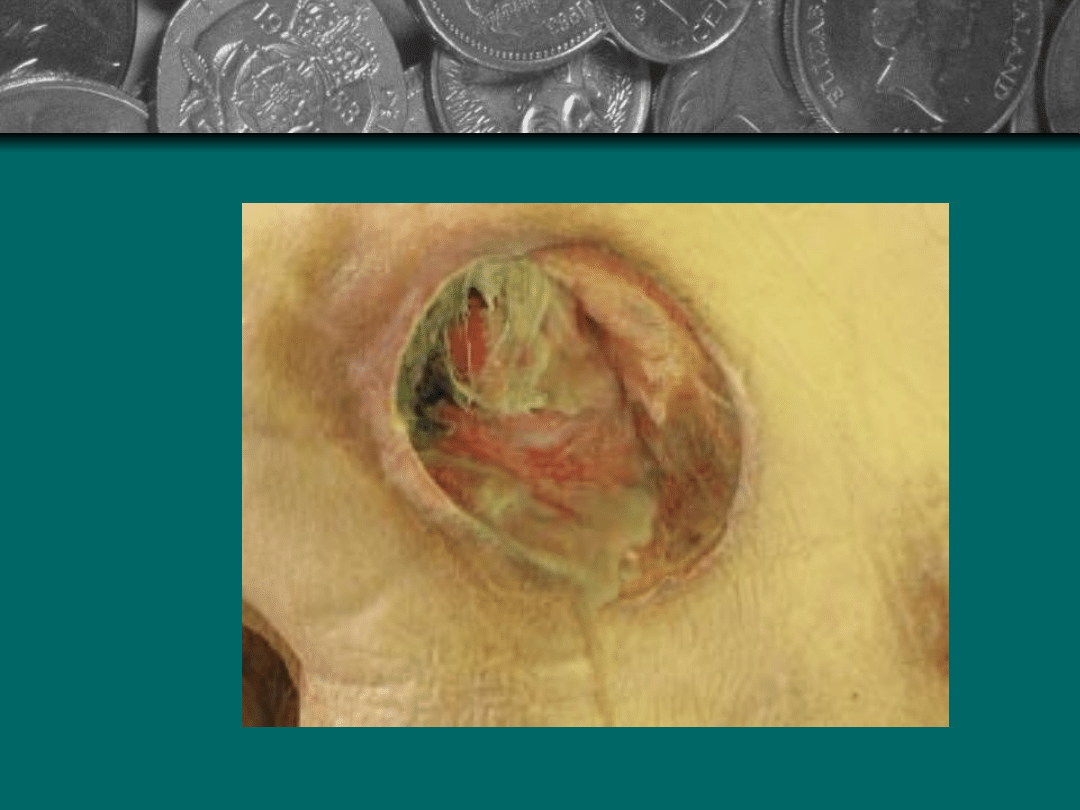
Stopień V
Zaawansowana
martwica rozpościera
się do powięzi i mięsni.
Zniszczenie może także
obejmować stawy i
kości. Powstają jamy
mogące się
komunikować miedzy
sobą. W ranie znajdują
się rozpadające masy
tkanek i czarna
martwica

Dziękuję za uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
- Slide 90
- Slide 91
- Slide 92
- Slide 93
- Slide 94
- Slide 95
- Slide 96
- Slide 97
- Slide 98
- Slide 99
- Slide 100
- Slide 101
- Slide 102
- Slide 103
- Slide 104
- Slide 105
- Slide 106
- Slide 107
- Slide 108
- Slide 109
- Slide 110
- Slide 111
- Slide 112
- Slide 113
- Slide 114
- Slide 115
- Slide 116
- Slide 117
- Slide 118
- Slide 119
- Slide 120
Wyszukiwarka
Podobne podstrony:
WYKŁAD 8- c.d.7 i Zakażenia szpitalne, GUMed, Medycyna, Mikrobiologia, Mikrobiologia, III KOLOKWIUM
wykłady, Wyklad 19, Zakażenia szpitalne
Chirurgia wyklad 3 cz III Zasady postepowania z zakazeniami szpitalnymi
WYKŁAD 8- c.d.7 i Zakażenia szpitalne, GUMed, Medycyna, Mikrobiologia, Mikrobiologia, III KOLOKWIUM
Definicja zakażenia szpitalnego
Zakażenia szpitalne, Mikrobiologia
zapobieganie zakażeniom szpitalnym, opieka nad os starsza
10 Zakażenia szpitalne. Rodzaje, opiekun medyczny
8 Zakażenia szpitalne TSM
10 Zakażenia szpitalne. Rodzaje, Opiekun Medyczny(1)
Zakażenia szpitalne, dokumenty, szkoła ola
CP5 Zakażenia szpitalne, Medycyna Ratunkowa - Ratownictwo Medyczne
Kontrola zakażeń szpitalnych w oddziałach pediatrycznych, pielęgniarstwo
wzw c - 2, mikrobiologia+ zakażenia szpitalne
Mikrobiologia sciaga pomniejszona, mikrobiologia+ zakażenia szpitalne
zakażenia szpitalne, Zakazenia szpitalne, 1
więcej podobnych podstron