

Plan prezentacji:
Plan prezentacji:
Entalpie przemian fizycznych i entropia
reakcji
Warunek termodynamicznej samorzutności
reakcji
Stała równowagi a samorzutność reakcji
Diagram Ellinghama
Zmiany entalpii swobodnej reakcji
utleniania węgla i tlenku węgla w funkcji
temperatury
2

Przypomnienie:
Przypomnienie:
II zasada termodynamiki
W przemianach samorzutnych entropia
W przemianach samorzutnych entropia
układu izolowanego rośnie:
układu izolowanego rośnie:
Δ
Δ
S
S
cał
cał
>0
>0
III zasada termodynamiki
W temperaturze zera bezwzględnego 0K
W temperaturze zera bezwzględnego 0K
entropia kryształu doskonałego równa
entropia kryształu doskonałego równa
się zeru.
się zeru.
3

Entalpie przemian fizycznych
Entalpie przemian fizycznych
4

Entalpie przemian fizycznych
Entalpie przemian fizycznych
5

Entalpie przemian fizycznych
Entalpie przemian fizycznych
6
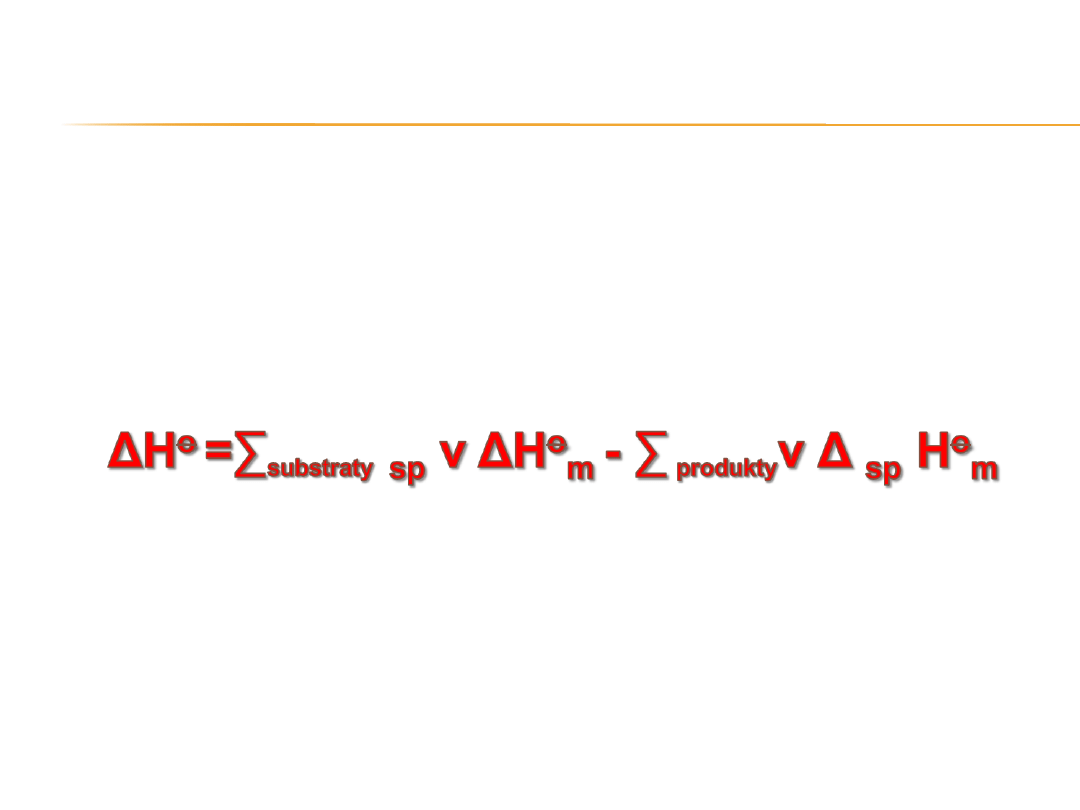
7
Standardowa molowa entalpia spalania
związku chemicznego jest to entalpia
towarzysząca reakcji spalania 1 mola
związku chemicznego.
Molowe entalpie spalania pierwiastków nie są
Molowe entalpie spalania pierwiastków nie są
równe 0 !!!
równe 0 !!!
Entalpie przemian fizycznych
Entalpie przemian fizycznych

8
Funkcja ta związana jest z podziałem energii
wewnętrznej układu na poszczególne drobiny
występujące w układzie
oraz różne rodzaje ruchu tych drobin.
Jest więc miarą wewnętrznej różnorodności układu
(„nieporządku” panującego w układzie).
Entropia reakcji (S)
Entropia reakcji (S)
Entropia przyjmuje tym większą wartość, im :
więcej jest różnych substancji w układzie,
większa jest liczba cząstek,
więcej jest faz (np. substancja o różnym stanie
skupienia)
S
kryst
S
cieczy
S
gazów
większa jest swoboda ruch cząstek.

9
Entropia jako funkcja stanu zależeć musi od parametrów
opisujących jego stan, a w szczególności od :
temperatury – wzrost temperatury zwiększa energię,
a w konsekwencji swobodę ruchu
cząstek,
a wiec i entropię układu
ciśnienia – zwiększenie ciśnienia ogranicza swobodę
ruchu
cząstek przez co maleje entropia
liczby moli – im więcej moli tym większa entropia .
Entropia reakcji (S)

Prawo Hessa
Efekt cieplny reakcji nie zależy od drogi
przemiany pod warunkiem, że wszystkie
procesy są izobaryczne lub izochoryczne, a
jedyną formą wymiany energii na sposób
pracy jest praca objętościowa.
ΔH = q
p
p = const
Entalpia reakcji sumarycznej jest sumą entalpii
etapów, na które reakcje tą można podzielić.
10
Entalpie przemian fizycznych
Entalpie przemian fizycznych

Prawo Lavosiera i Laplace’a
Efekt cieplny reakcji przebiegającej w
danym kierunku równy jest efektowi
cieplnemu reakcji odwrotnej z przeciwnym
znakiem.
A + B → C + D
A + B → C + D
Δ
Δ
H
H
C + D → A + B
C + D → A + B
–
–
Δ
Δ
H
H
11
Entalpie przemian fizycznych
Entalpie przemian fizycznych

Entalpie przemian fizycznych
Entalpie przemian fizycznych
12

Standardowa molowa entalpia swobodna
Standardowa molowa entalpia swobodna
reakcji
reakcji
13

Δ G < 0
Δ G < 0
proces samorzutny
proces samorzutny
Δ G > 0 - proces wymuszony
Δ G = 0 - stan równowagi
termodynamicznej
14
Warunek samorzutności reakcji
Warunek samorzutności reakcji

G
G
r
r
o
o
=
=
H
H
r
r
o
o
-
-
T
T
S
S
r
r
o
o
15
Z definicji zmiany entalpii swobodnej Δ G
wynika,
że o samorzutności procesu decydują trzy
czynniki :
Efekt energetyczny
Efekt energetyczny
-
tj. tendencja do
obniżenia
energii układu
Efekt entropowy
Efekt entropowy
-
czyli skłonność do
zwiększenia
entropii
Temperatura
Temperatura
Warunek samorzutności reakcji
Warunek samorzutności reakcji

Warunek samorzutności reakcji
Warunek samorzutności reakcji
16
Entalpia Entropia
Samorzutność
Reakcje egzotermiczne
Н < 0
Н < 0
Reakcje endotermiczne
Н > 0
Н > 0
.
S > 0
S < 0
.
S > 0
S < 0
.
+
+
(G < 0)
+
+
jeśli |TS| < |Н|
to (G
< 0)
.
+
+
jeśli TS > Н
to
(G < 0)
-
-
(G > 0)
Udziały decydujące o samorzutności procesu:
Stała równowagi a
Stała równowagi a
samorzutność reakcji
samorzutność reakcji
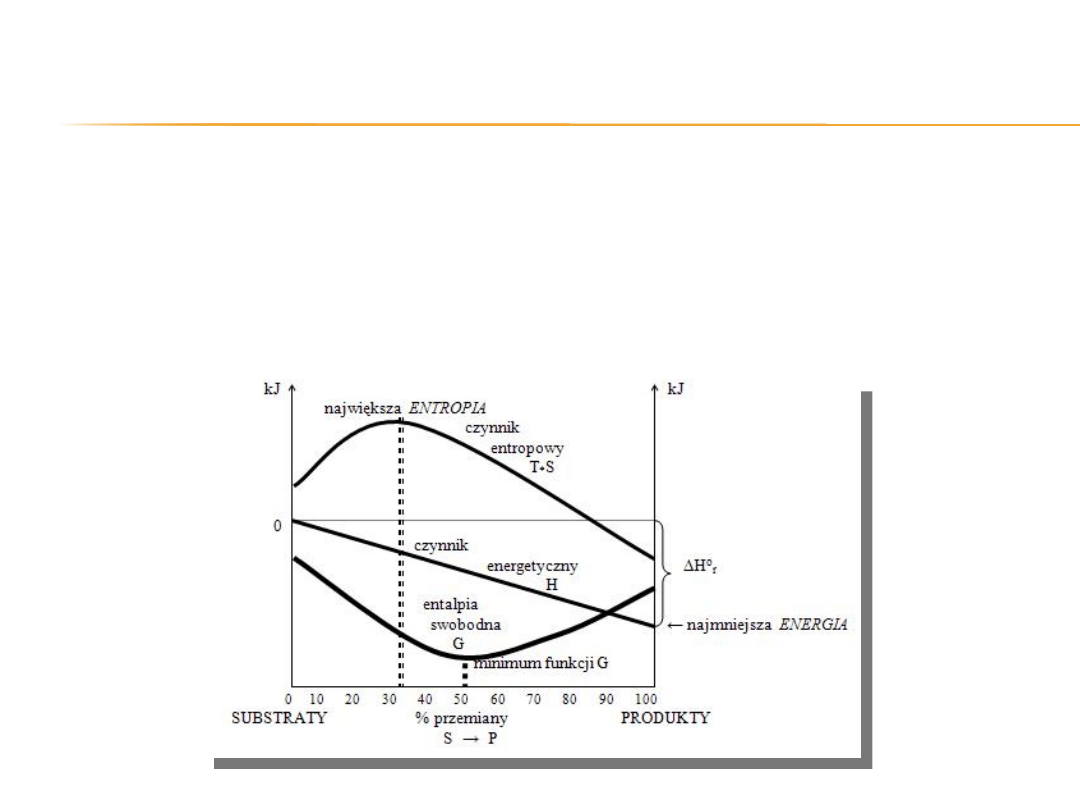
Układ w którym entalpia swobodna osiąga
minimum (∆G) znajduje się w stanie
równowagi termodynamicznej, czyli w takim
stanie w którym nie działają na układ
czynniki entropowy i energetyczny.
17
18
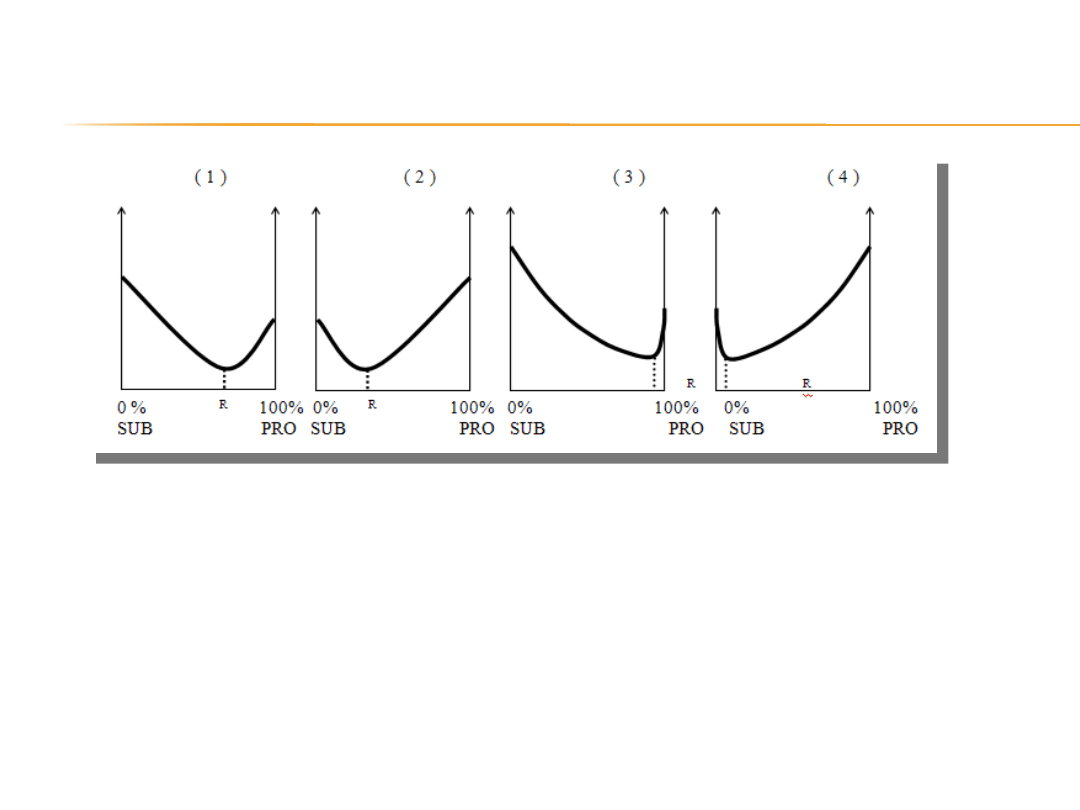
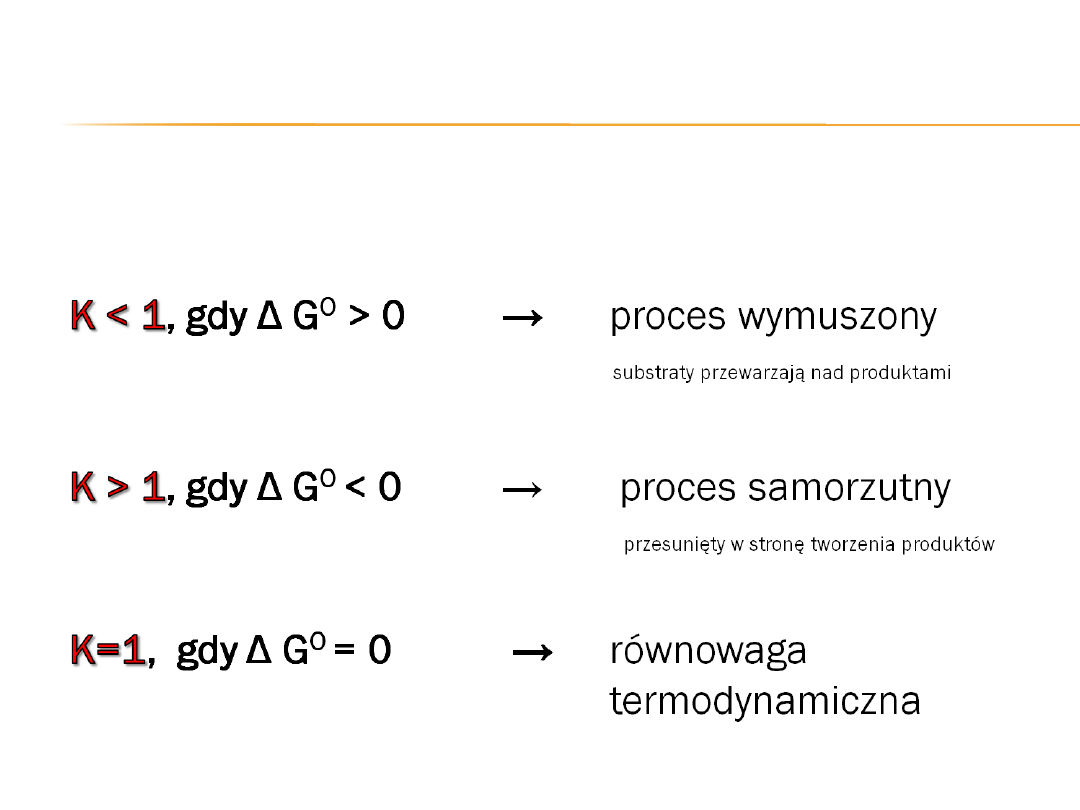
( 1 ) reakcja z dużą wydajnością (tj. głównie biegnie w prawo)
( 2 ) reakcja z małą wydajnością (tj. głównie biegnie w lewo)
( 3 ) reakcja z praktycznie 100 % wydajnością (prawie do wyczerpania
substratów)
( 4 ) reakcja praktycznie nie zachodzi (wydajność bliska 0 %)
Analizując uzyskane w praktyce kształty krzywej funkcji G zaobserwować
można cztery typowe przypadki przebiegu przemiany
SUBSTRATY ⇄ PRODUKTY :
Stała równowagi a
Stała równowagi a
samorzutność reakcji
samorzutność reakcji
19
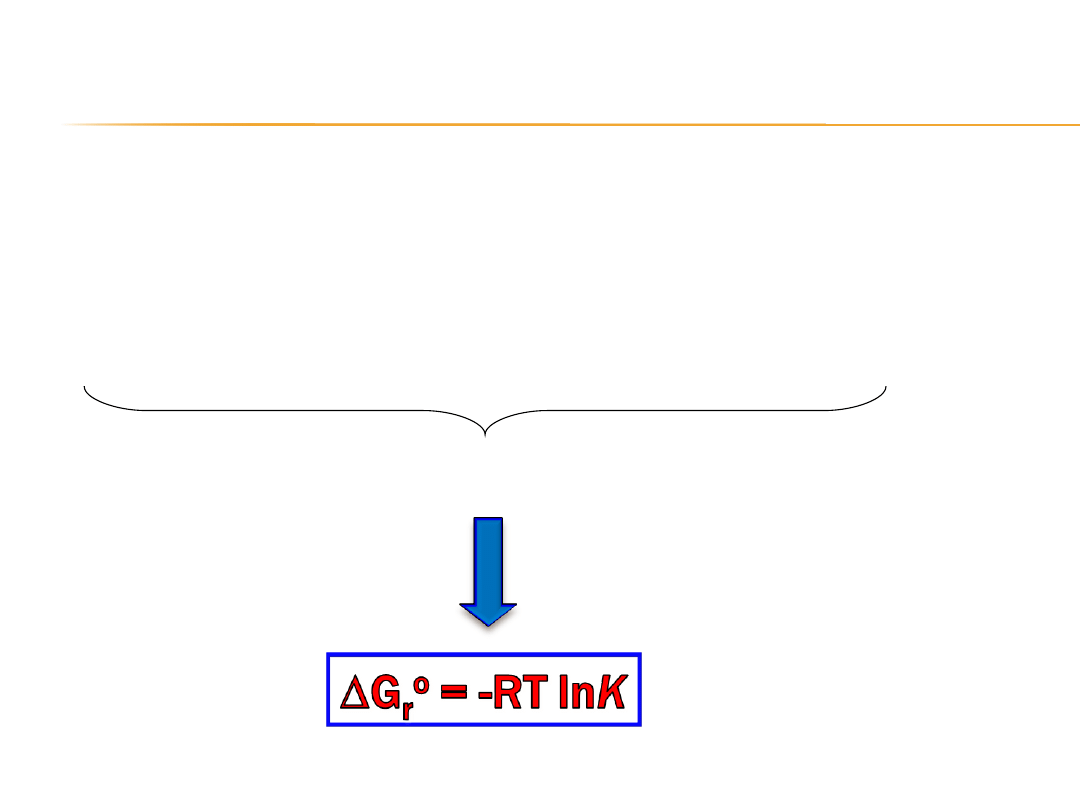
Gdy reakcja osiąga stan równowagi chemicznej to:
G
r
= 0
Iloraz reakcji Q = K
G
r
= G
r
o
+ RT lnQ
0 = G
r
o
+ RT lnK
Stała równowagi a samorzutność
Stała równowagi a samorzutność
reakcji
reakcji
20

Diagram Ellinghama
Diagram Ellinghama
Diagram Ellinghama:
Diagram Ellinghama:
określa zakres temperatur, w których mogą
zachodzić procesy redukcji.
przedstawia graficzną zależność zmiany entalpii
swobodnej reakcji (Δ G
0
) od temperatury (T).
wykorzystywany jest do analizy redukcji rud
metali.
21

Diagram Ellinghama
Diagram Ellinghama
Przeanalizujmy
równowagi
reakcji
na
podstawie
funkcji
termodynamicznych
następujących reakcji:
22
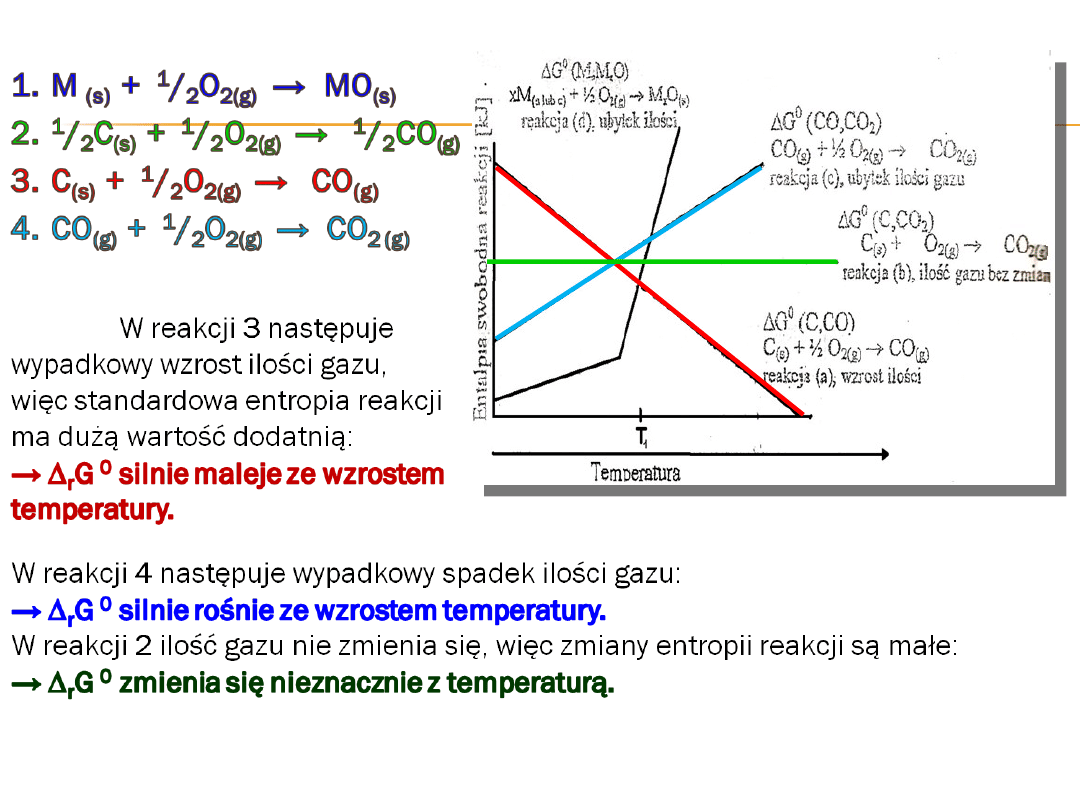
1.
1.
M
M
(s)
(s)
+
+
1
1
/
/
2
2
O
O
2(g)
2(g)
→ MO
→ MO
(s)
(s)
2.
2.
1
1
/
/
2
2
C
C
(s)
(s)
+
+
1
1
/
/
2
2
O
O
2(g)
2(g)
→
→
1
1
/
/
2
2
CO
CO
(g)
(g)
3.
3.
C
C
(s)
(s)
+
+
1
1
/
/
2
2
O
O
2(g)
2(g)
→ CO
→ CO
(g)
(g)
4.
4.
CO
CO
(g)
(g)
+
+
1
1
/
/
2
2
O
O
2(g)
2(g)
→ CO
→ CO
2 (g)
2 (g)
23
Diagram
Diagram
Ellinghama
Ellinghama
24
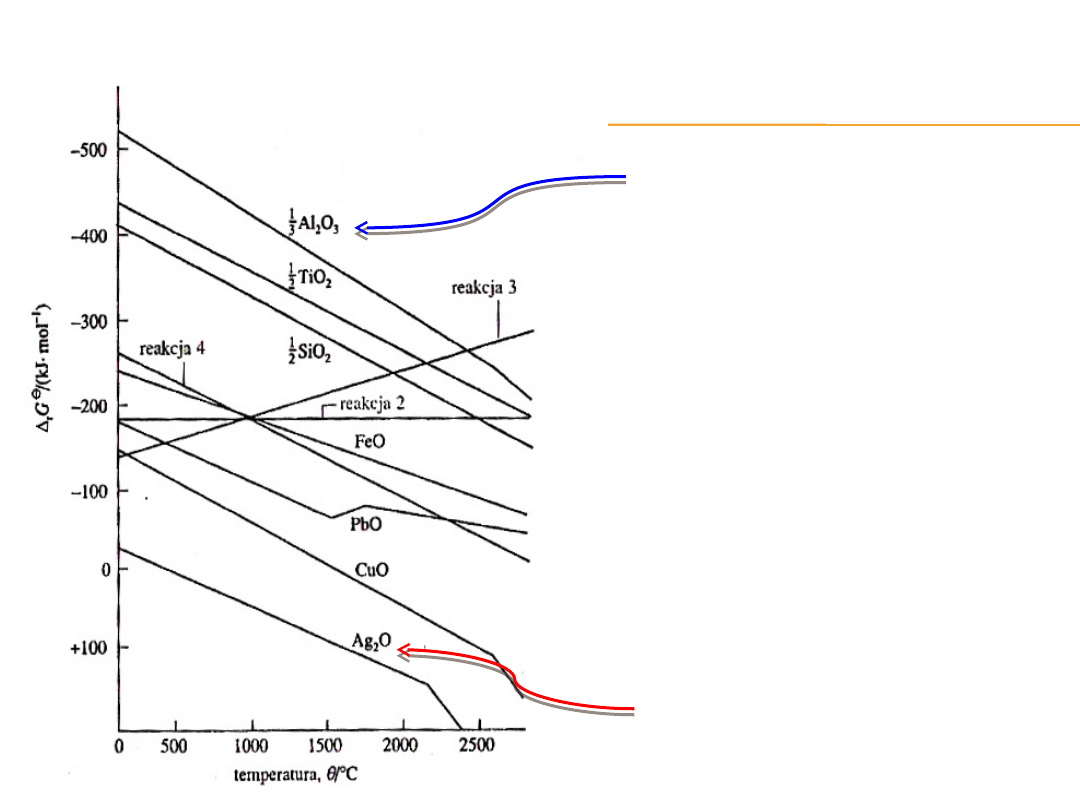
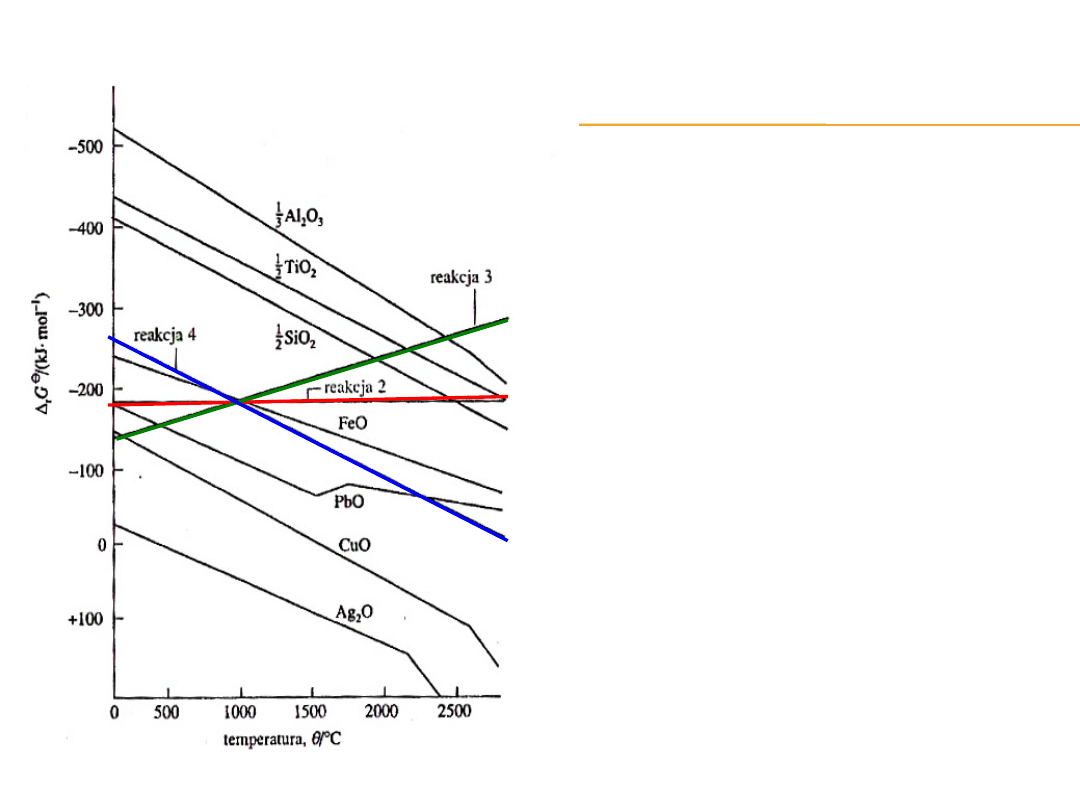
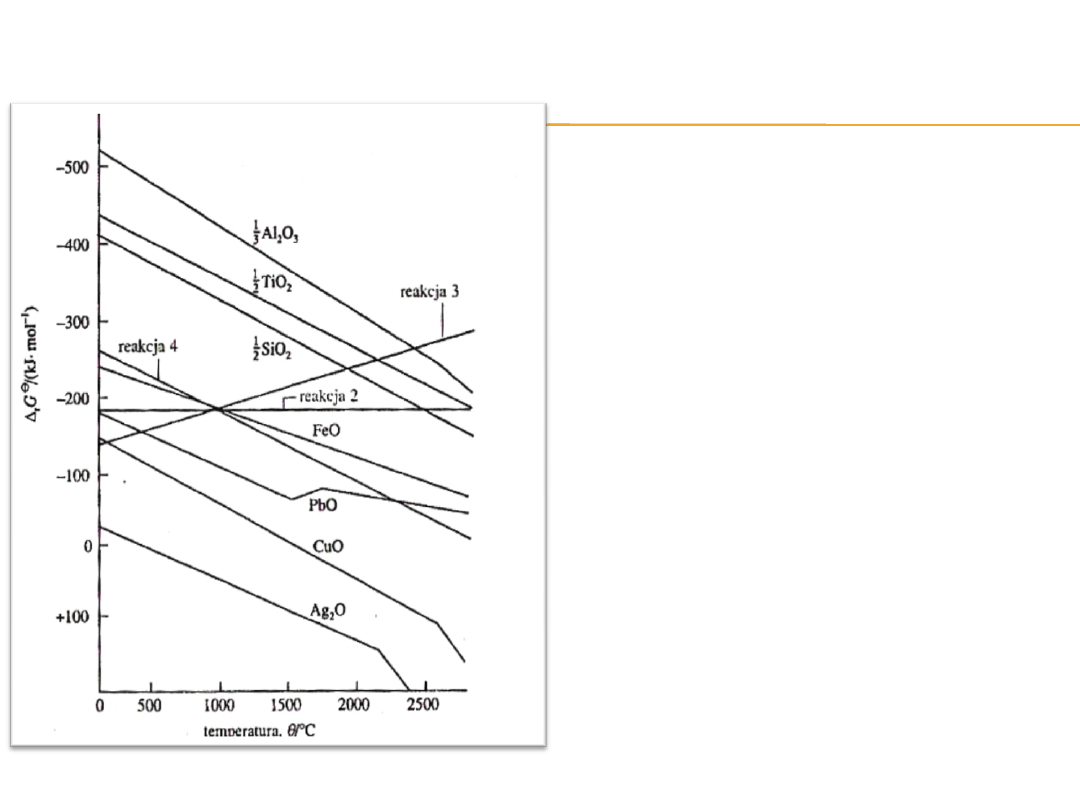
Proces najbardziej
egzotermiczny
Proces najmniej
egzotermiczny
Standardowa entropia
tych reakcji jest
porównywalna dla
wszystkich metali,
ponieważ w każdej z
nich usuwany jest tlen
gazowy, a powstający
tlenek jest zwartym
ciałem stałym.

Diagram Ellinghama
Diagram Ellinghama
25

26
Aby reakcja redukcji tlenku metalu
zachodziła to entalpia swobodna reakcji
sumarycznej ( ΔG
0
)
musi być mniejsza od zera
.
ΔG
0
tw
= Σ ΔG
0
prod
- Σ ΔG
0
subst
MO + C M + CO
ΔG
0
= ΔG
0
tw
(M) + ΔG
0
tw
(CO) - ΔG
0
tw
(C) - ΔG
0
tw
(MO)
< 0
ΔG
0
tw
pierwiastków w stanie podstawowym
równa jest 0
i dlatego:
ΔG
0
tw
(CO) - ΔG
0
tw
(MO)
< 0
ΔG
0
tw
(CO) < ΔG
0
tw
(MO)
Diagram
Diagram
Ellinghama
Ellinghama
27
28
Diagram
Diagram
Ellinghama
Ellinghama
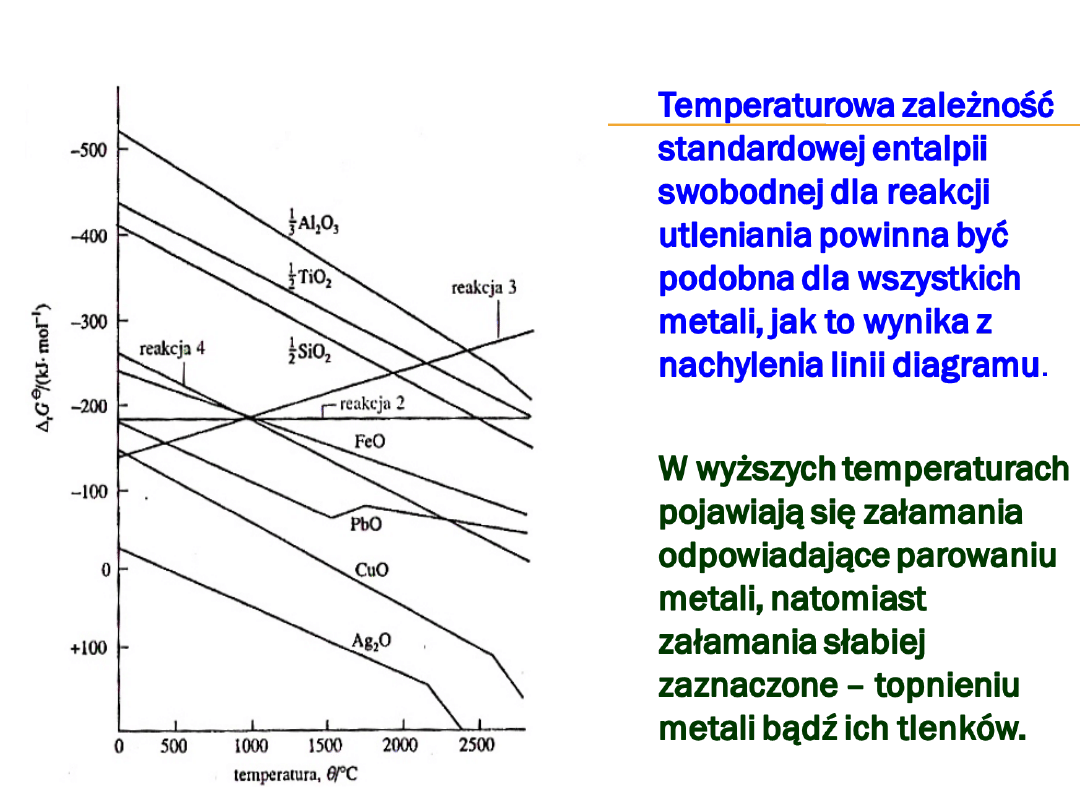
Gdy
r
G
0
< 0
, to równowaga
jest przesunięta w prawo, czyli
w układzie przeważają
produkty nad substratami.
Taki przypadek ma miejsce,
gdy linia odpowiadająca
reakcji:
1. M
(s)
+
1
/
2
O
2(g)
→ MO
(s)
Leży poniżej linii opisującej
jedną z reakcji :
2.
1
/
2
C
(s)
+
1
/
2
O
2(g)
→
1
/
2
CO
(g)
3. C
(s)
+
1
/
2
O
2(g)
→ CO
(g)
4. CO
(g)
+
1
/
2
O
2(g)
→ CO
2 (g)
to znaczy odpowiada bardziej
dodatnim wartościom
r
G
0
.
29
Samorzutność reakcji w dowolnej
temperaturze można przewidzieć
w prosty sposób, korzystając z
diagramu.
Tlenek metalu można
zredukować
w każdej reakcji z węglem, której
linia
r
G
0
leży powyżej, ponieważ
wówczas
dla sumarycznej reakcji
r
G
0
<
0.
Na przykład CuO można
zredukować do Cu w każdej
temperaturze wyższej od
pokojowej.
Natomiast Ag
2
O ogrzany
powyżej 200ºC ulega rozkładowi
nawet pod nieobecność węgla,
ponieważ standardowa entalpia
swobodna reakcji (1) staje się
dodatnia,
a więc samorzutny staje się
proces odwrotny.
Z kolei Al
2
O
3
nie ulega redukcji
węglem zanim temperatura nie
przekroczy 2300ºC.

30
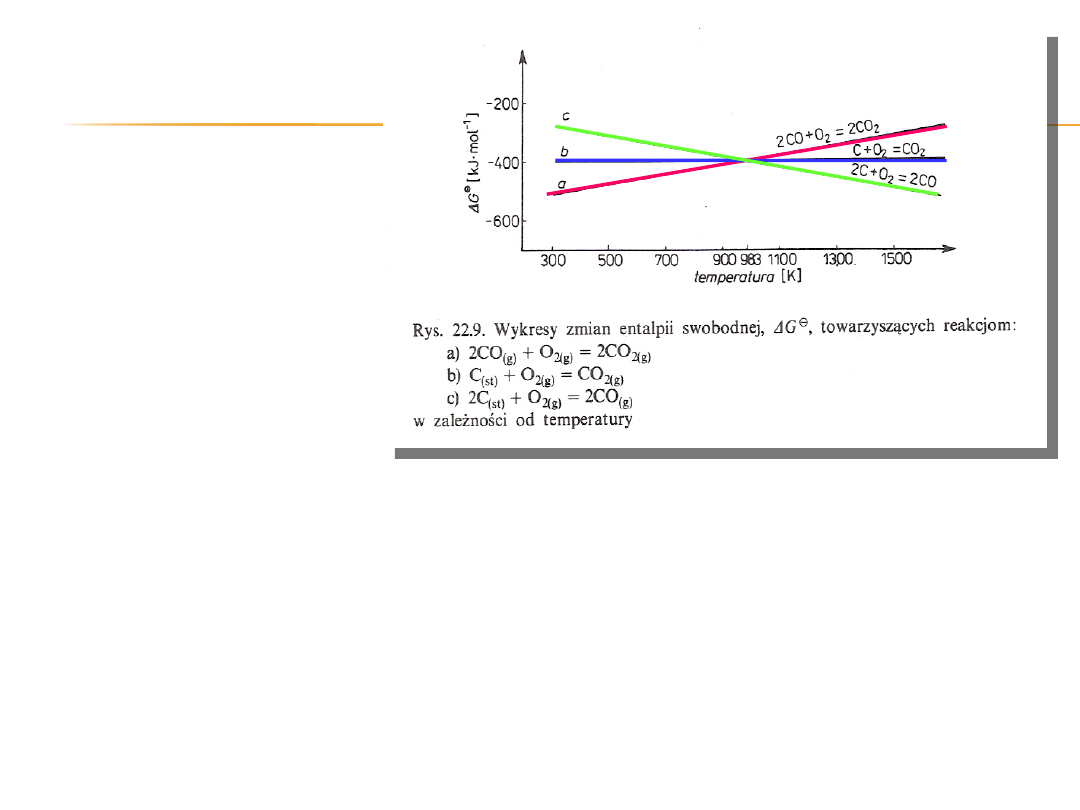
Przebieg reakcji redukcji tlenków metali pod działaniem węgla elementarnego
lub tlenku węgla możemy przewidzieć rozpatrując odpowiednie zmiany entalpii
swobodnej.
Rozpatrzmy w tym celu najpierw następujące reakcje:
Dla każdej z nich możemy obliczyć ∆G⁰ w zależności od temperatury. W
przybliżeniu możemy przyjąć, że wartości ∆H i ∆S nie zależą od temperatury i
zamiast trudniej dostępnymi
danymi odnoszącymi się do dowolnej temperatury, posłużyć się wartościami
∆H⁰
298
i ∆S⁰
298
podanymi przy równaniach (a), (b) i (c).
31
Zależności uzyskanych w ten
sposób przedstawiono
na diagramie.
Zgodnie z równaniem
∆G⁰
T
= ∆H⁰
298
– T∆S⁰
298
mają one przebieg liniowy.
We wszystkich trzech
przypadkach w zakresie
temperatur 300 – 1500 K
wartość ∆G⁰
T
są ujemne, co oznacza, że reakcje te mogą zachodzić w
sposób samorzutny w warunkach standardowych.
Niemniej jednak zmiana ∆G towarzysząca reakcji (a) rośnie z temperaturą
i w temperaturach powyżej 3300 K przyjmuje wartości dodatnie, a to
oznacza, że w warunkach standardowych może zachodzić wówczas
samorzutnie tylko reakcja odwrotna czyli rozpad CO
2
na CO i tlen. Wzrost
∆G⁰
T
dla reakcji (a) spowodowany jest ujemną ∆S⁰
298
.
W przypadku reakcji (b) ∆G⁰
T
nieznacznie zmienia się z temperaturą.
Reakcji (c) odpowiada dodatnia wartość ∆S⁰
298,
a to pociąga zmniejszenie
się ∆G⁰
T
w miarę wzrostu temperatury.
32
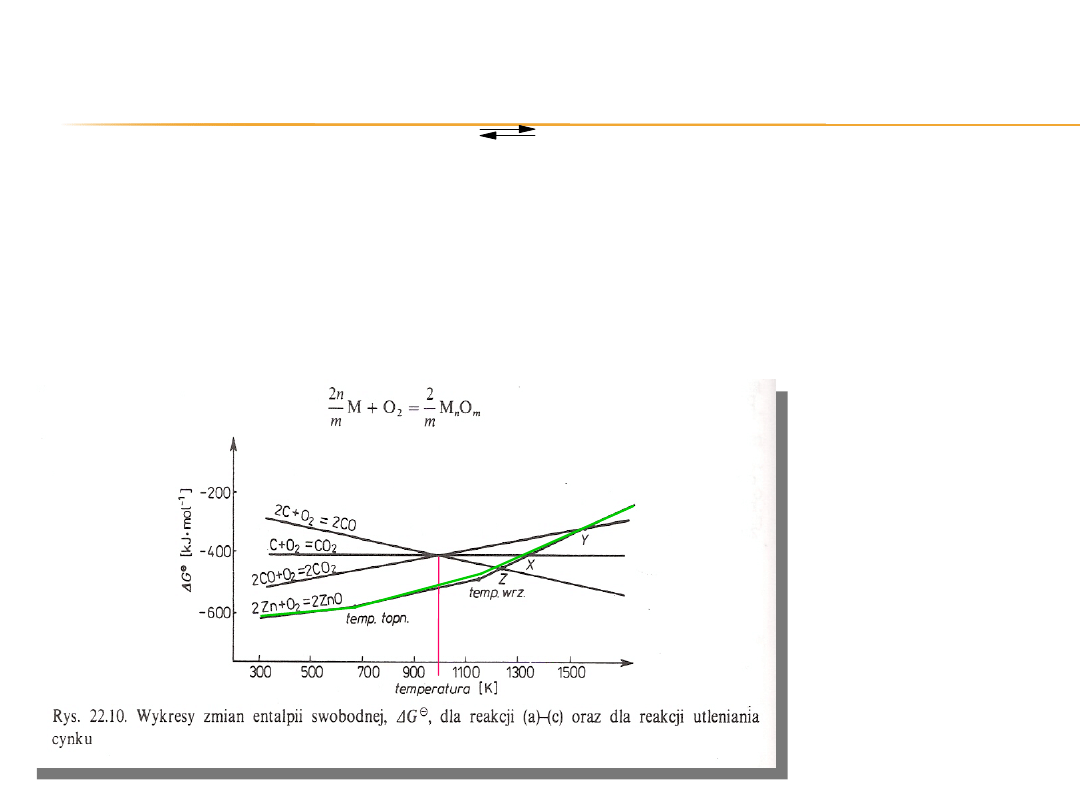
Odejmując równanie reakcji (b) od równania reakcji (c) dochodzimy do
równania wyrażającego tzw. równowagę Boudouarda:
2 CO
(g)
CO
2(g)
+ C
(s)
Wartość ∆G⁰
T
dla tej reakcji stanowi różnicę ∆G⁰
T(c)
i ∆G⁰
T(b)
i wobec tego
możemy
na podstawie poprzedniego diagramu stwierdzić, że w zakresie temperatur
poniżej 983 K
dla powyższej reakcji ∆G⁰
T
> 0 oraz w zakresie temperatur powyżej 983 K
∆G⁰
T
< 0.
Oznacza to, że w wyższych temperaturach w równowadze przeważać
będzie CO,
a w niższych CO
2 .
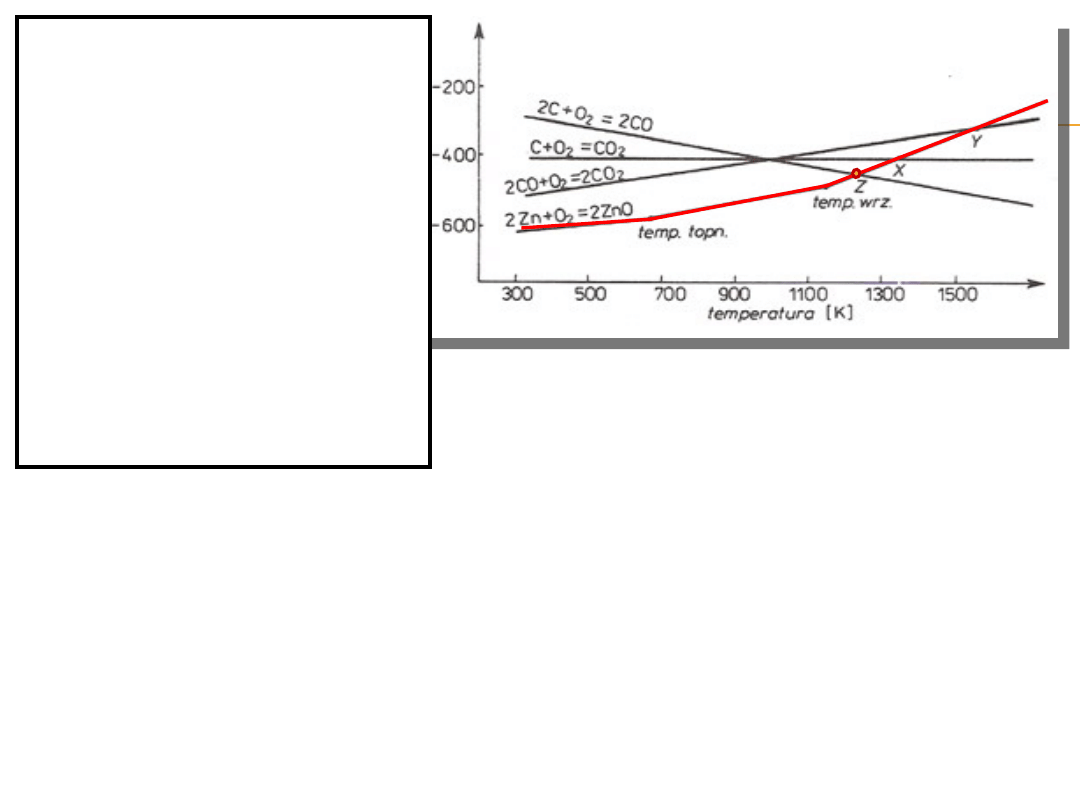
Na poniższym diagramie dodano linię ∆G⁰
T
(T) dla reakcji
tworzenia się tlenku cynku w reakcji typu:
Załamania linii
prostej następują w
punktach
odpowiadających
temperaturze
topnienia
i wrzenia metalu
(lub tlenku).
Wewszystkich
przypadkach wraz
ze wzrostem
temperatury
wartość ∆G⁰
T(M)
rośnie.
CO
CO
2
33
Biorąc pod uwagę punkt Z,
w którym to przecinają
się wykresy odpowiadające
reakcjom:
2 Zn + O
2
= 2 ZnO (e)
2 C + O
2
= 2 CO (c)
W punkcie tym ∆G⁰
T
dla reakcji
2 ZnO + 2 C = 2 Zn + 2 CO (f)
wynosi 0.
W temperaturze odpowiadającej punktowi Z mamy do
czynienia z równowagą
pomiędzy stałym węglem, ciekłym cynkiem, stałym tlenkiem
cynku oraz gazowym
tlenkiem węgla pod ciśnieniem 1 atm.
W temperaturach wyższych ∆G⁰
T
przyjmuje wartości ujemne, co
oznacza,
że następuje redukcja ZnO węglem w obecności tlenku węgla pod
ciśnieniem atmosferycznym.
W temperaturach niższych od temperatury odpowiadającej
punktowi Z reakcja
taka nie może zachodzić samorzutnie.
Samorzutnie może zajść reakcja odwrotna do reakcji (f), czyli
utleniania cynku
przez CO z wydzieleniem węgla.
Z
Reakcja redukcji ZnO
węglem:
ZnO + C CO + Zn
ΔG
0
tw
= ΔG
0
tw
(CO) + ΔG
0
tw
(Zn) - ΔG
0
tw
(C) - ΔG
0
tw
(ZnO)
< 0
ΔG
0
tw
(CO) - ΔG
0
tw
(ZnO)
<
0
ΔG
0
tw
(CO)
<
ΔG
0
tw
(ZnO)
34
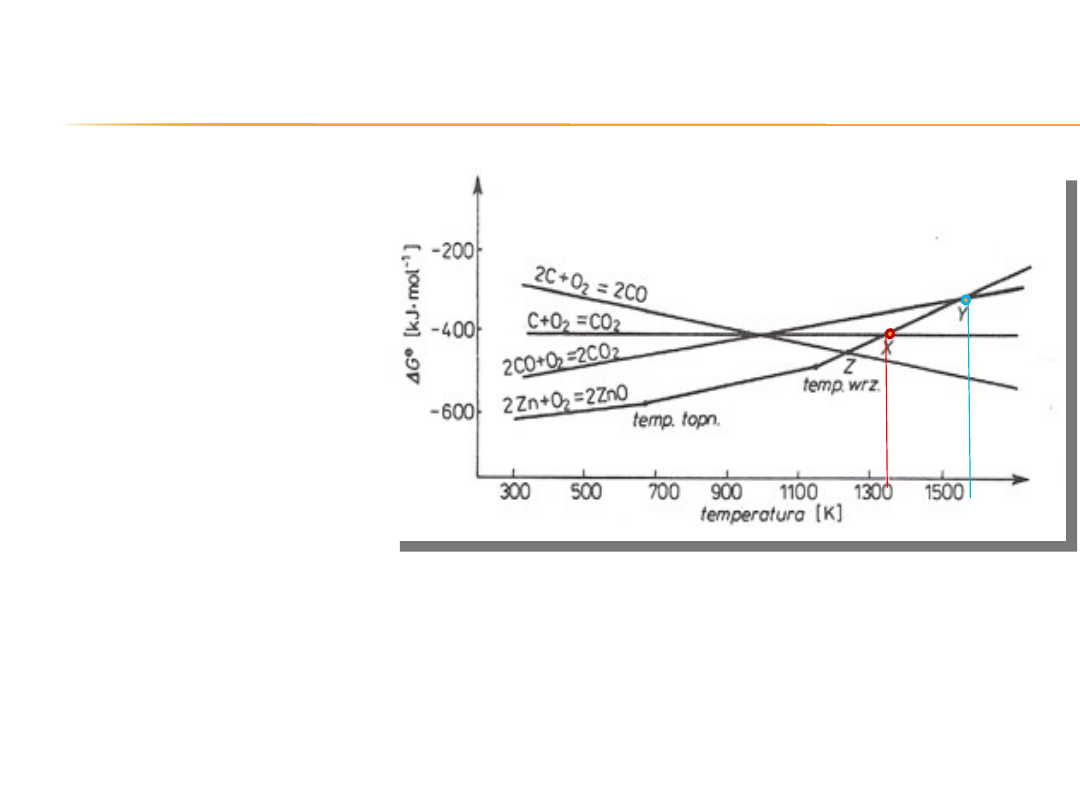
Analogicznie możemy wykazać,
że powyżej temperatury dla
punktu X może nastąpić
redukcja ZnO węglem
z utworzeniem CO
2
.
2 ZnO + C = 2 Zn + CO
2
Ponad to w temperaturze
wyższej od temperatury
wyznaczonej przez punkt Y
możliwa staje się redukcja ZnO przez CO.
2 ZnO + 2 CO = 2 Zn + 2 CO
2
X
Y
Y

35
M
1
O + M
2
M
2
O + M
1
ΔG
0
tw
= ΔG
0
tw
(M
2
O) + ΔG
0
tw
(M
1
) - ΔG
0
tw
(M
1
O) -
ΔG
0
tw
(M
2
)
< 0
ΔG
0
tw
(M
2
O) - ΔG
0
tw
(M
1
O)
< 0
ΔG
0
tw
(M
2
O)
<
ΔG
0
tw
(M
1
O)
36
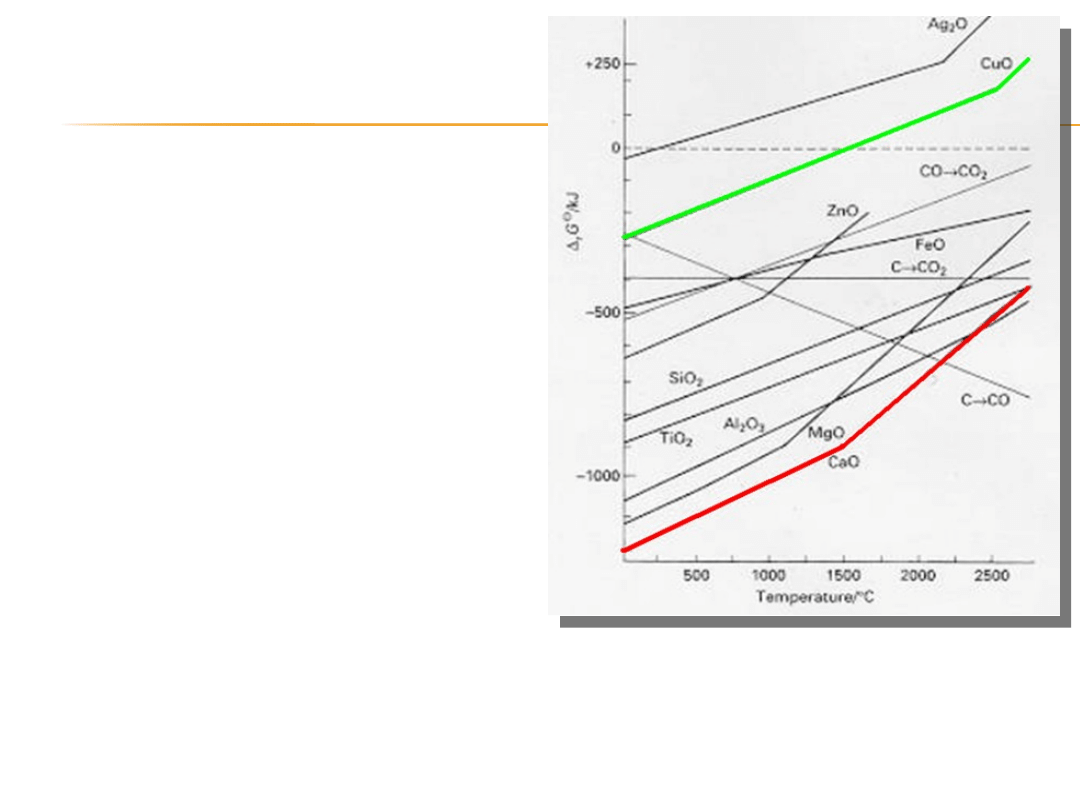
Z diagramu Ellinghama
można odczytać, który
pierwiastek zredukuje dany
tlenek.
Okazuje się że pierwiastkiem
tworzącym najtrwalsze tlenki
jest wapń. Redukuje on takie
tlenki jak:
FeO, ZnO, CuO, SiO
2
Przykładowa reakcja przedstawia
się następująco:
CuO + Ca CaO + Cu
ΔG
0
tw
= ΔG
0
tw
(CaO) + ΔG
0
tw
(Cu) – ΔG
0
tw
(Ca) – ΔG
0
tw
(CuO)
< 0
ΔG
0
tw
(CaO) – ΔG
0
tw
(CuO)
< 0
ΔG
0
tw
(CaO)
<
ΔG
0
tw
(CuO)
Po naniesieniu na jeden wykres
zależności dla różnych tlenków
możemy porównywać ich trwałość.
Tlenki dla których linie leżą niżej na
wykresie są bardziej stabilne.

37
1.
„ Chemia fizyczna” P.W. Atkins, Wydawnictwo Naukowe PWN
2.
„ Podstawy chemii nieorganicznej” A. Bielański, Wydawnictwo
Naukowe PWN
3.
Internet:
http://www.doitpoms.ac.uk/tlplib/ellingham_diagrams/thermodynamics.php
http://www.engr.sjsu.edu/ellingham/tutorial.html
BIBLIOGRAFIA:
BIBLIOGRAFIA:

38
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
Wyszukiwarka
Podobne podstrony:
prezentacja diagram Ellinghama Kopia
Diagram Ellinghama
Prezentacja Diagram Czekanowskiego
prezentacja fuzje pody Kopia
diagram ellinghama
Prezentacja praca inzynierskiej Kopia
Diagram Ellinghama
PREZENTACJA DIAGRAMY UDZWIGU
Kopia Prezentazja z zarządania
Zestaw 4 Ellingham diagrams
Kopia Najciekawsze portrety kobiet w znanych, Szkoła, Matura, Polski, ustna, rozne gotowe prezentacj
Kopia PREZENTACJA
Kopia Prezentacja o przemocy
Lekcja matematyki w klasie V - diagramy procentowe, prezentacje i referaty, Scenariusze
Plan prezentacji — kopia
Kopia jugosławia prezentacja
Kopia RYZYKO Pojęcie i podstawowe rodzaje ryzyka bankowego prezentacja EW 26 10 2009 (3)
więcej podobnych podstron