Źródła i detektory
światła
Wykład 2
SIEĆ KRYSTALICZNA
CIAŁ STAŁYCH
Optoelektronika zaoczny
Optoelektronika zaoczny
2011/12
2011/12

Wszyscy znamy budowę powłok elektronowych
atomu. Atomy, dzięki występującym między nimi siłom
przyciągania, mogą łączyć się w cząsteczki chemiczne
(molekuły) albo w ze-społy zawierające olbrzymie
ilości atomów, które w zależności od stanu skupienia
zaliczamy do
ciał stałych lub cieczy
. Przedmiotem
aktualnych naszych rozważań będą właściwości
elektronowe
ciał
stałych,
a
w
szczególności
półprzewodników, dlatego najpierw zaznajomimy się z
budową tych ciał.
Ciało stałe definiuje się jako ciało
odznaczające się stabilnością kryształu
. W
zależności od stopnia uporzą-dkowania struktury
wewnętrznej ciała stałe dzielimy na krysta-liczne i
amorficzne, czyli bezpostaciowe.
2

Jeśli położenia atomów wykazują okresowe
uporządko-wanie w przestrzeni (uporządkowanie
dalekiego zasię-gu) to takie ciało stałe nazywamy
ciałem krystalicznym lub kryształem
.
W przypadku gdy uporządkowanie występuje w
całej objętości kryształu, to taki kryształ nazywamy
monokryszta-łem.
Jeżeli natomiast prawidłowe uporządkowanie
występuje tylko wewnątrz pewnych obszarów zwanych
ziarnami
krystali-cznymi,
wówczas
mówimy
o
polikryształach. Zwykle wię-kszość występujących w
przyrodzie i otrzymanych sztucznie ciał krystalicznych
stanowią polikryształy.
3

Jedną z cech charakterystycznych kryształu jest
anizo-tropia jego właściwości polegająca na tym, że
kryształ wyka-zuje w różnych kierunkach różne
właściwości fizyczne.
W odróżnieniu od kryształów, ciecze i ciała
amorficzne (których typowym przykładem jest szkło)
nie mają prawidłowej struktury krystalicznej i nie
wykazują anizotropii właściwości. W ciałach tych
występuje tzw. uporządkowanie bliskiego zasięgu.
Ciała krystaliczne charakteryzują się ponadto
skokową zmianą właściwości przy przejściach z jednej
fazy do drugiej
. W ciałach amorficznych właściwie nie
istnieje granica między fazami (ciekłą i stałą). Z tego
powodu ciała amorficzne są często traktowane jako
przechłodzone ciecze.
4

W tym miejscu należy zaznaczyć, że niektóre
ciecze również charakteryzują się uporządkowaniem
cząsteczek. Związana z tym jest anizotropia ich
różnych właściwości fizycznych, mechanicznych,
optycznych, elektrycznych, magnetycznych i wielu
innych. Takie ciecze nazywamy ciekłymi kryształami.
5

Ciała stałe
to substancje o regularnej, przestrzennej budowie
krystali-cznej, czyli regularnym uporządkowaniu w
przestrzeni elementów tworzących ciało (atomów,
jonów, cząsteczek)
w zależności od stopnia uporządkowania struktury
wewnętrznej wyróżniamy ciała
krystaliczne (kryształ) gdy elementy uporządkowane są w
sposób okresowy tzw. uporządkowanie dalekiego zasięgu,
anizotropia
polikryształy – uporządkowanie wewnątrz obszarów (ziaren)
amorficzne (bezpostaciowe) – uporządkowanie bliskiego zasięgu
ciekłe kryształy – ciecze anizotropowe, charakteryzują
się uporządkowanym ułożeniem cząsteczek
6

SIEĆ KRYSTALICZNA I
UKŁADY
KRYSTALOGRAFICZNE
7
Idealny nieskończony kryształ jest strukturą
utworzoną
przez
regularne
powtarzanie
w
przestrzeni
identycznych
elementów.
Ten
charakterystyczny dla danego ciała układ
atomów nazywamy jego siecią krystaliczną
.
Najmniejszy
pojedynczy
element
sieci,
powtarzający się periodycznie w trzech wymiarach
przestrzeni,
nazywamy
bazą
tej
sieci
.
W
najprostszym przypadku baza jest utwo-rzona z
jednego atomu danego pierwiastka. Na ogół zawie-
ra ona 2 lub więcej atomów, przy czym mogą to być
atomy tego samego lub różnych pierwiastków.
Grupy atomów stanowiące bazę są ustawione
w kry-sztale wg określonej sieci przestrzennej, którą
nazywamy siecią translacyjną lub siecią punktową.
Jest ona utworzona z punktów nazywanych węzłami
sieci.
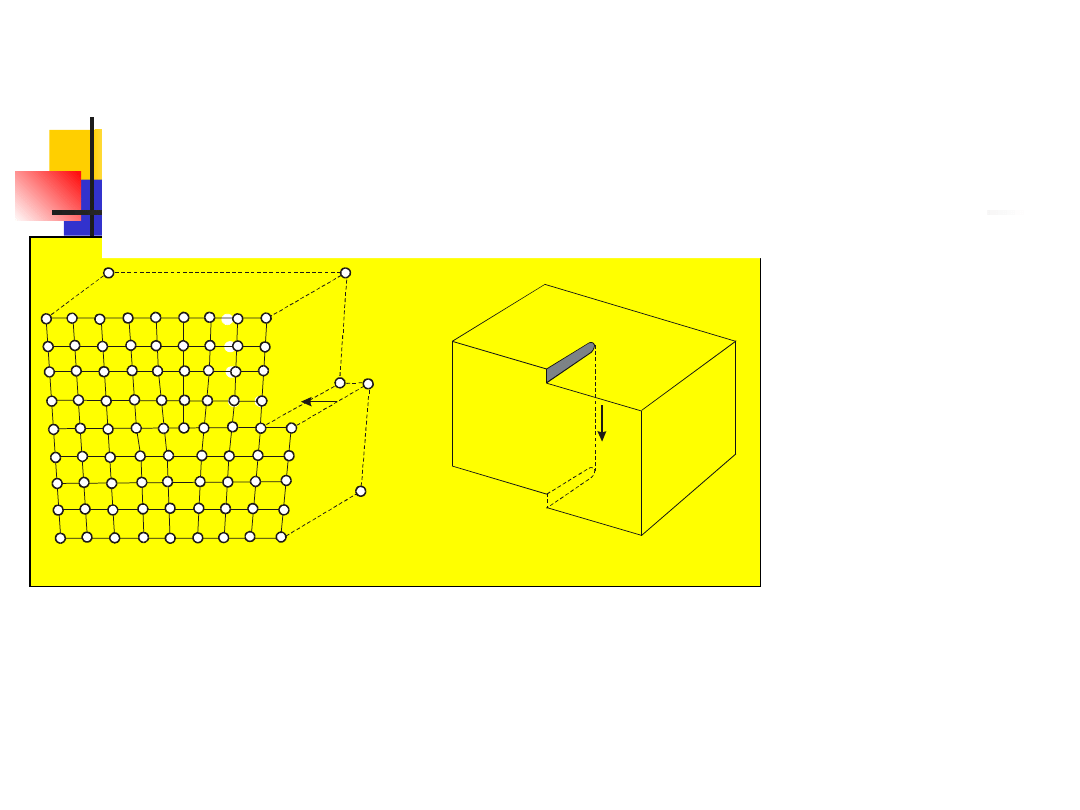
Na rysunku w celu ułatwienia zobrazowania
pokazano sieć dwuwymiarową. Można jednak z
łatwością
rozszerzyć
rozważania
na
sieć
trójwymiarową.
8
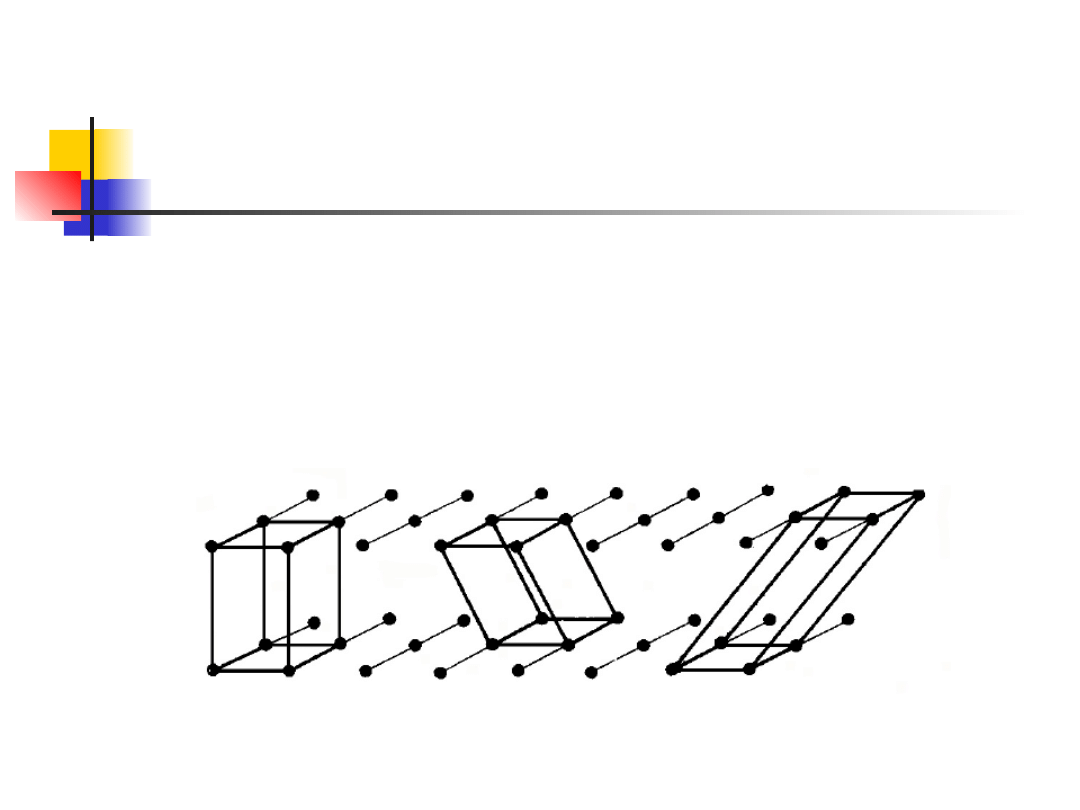
Przykład sieci
dwuwymiarowej
sieć krystaliczna
sieć translacyjna
baza
9

Sieć krystaliczna
sieć krystaliczna określa charakter okresowego
uporządkowania w przestrzeni powtarzających
się elementów strukturalnych kryształu
baza sieci to najmniejszy powtarzający się
element strukturalny:
pojedynczy atom
grupy atomów
jon
molekuła
sieć
translacyjna
to
sieć
przestrzenna
utworzona przez punkty bazy – węzły sieci
10

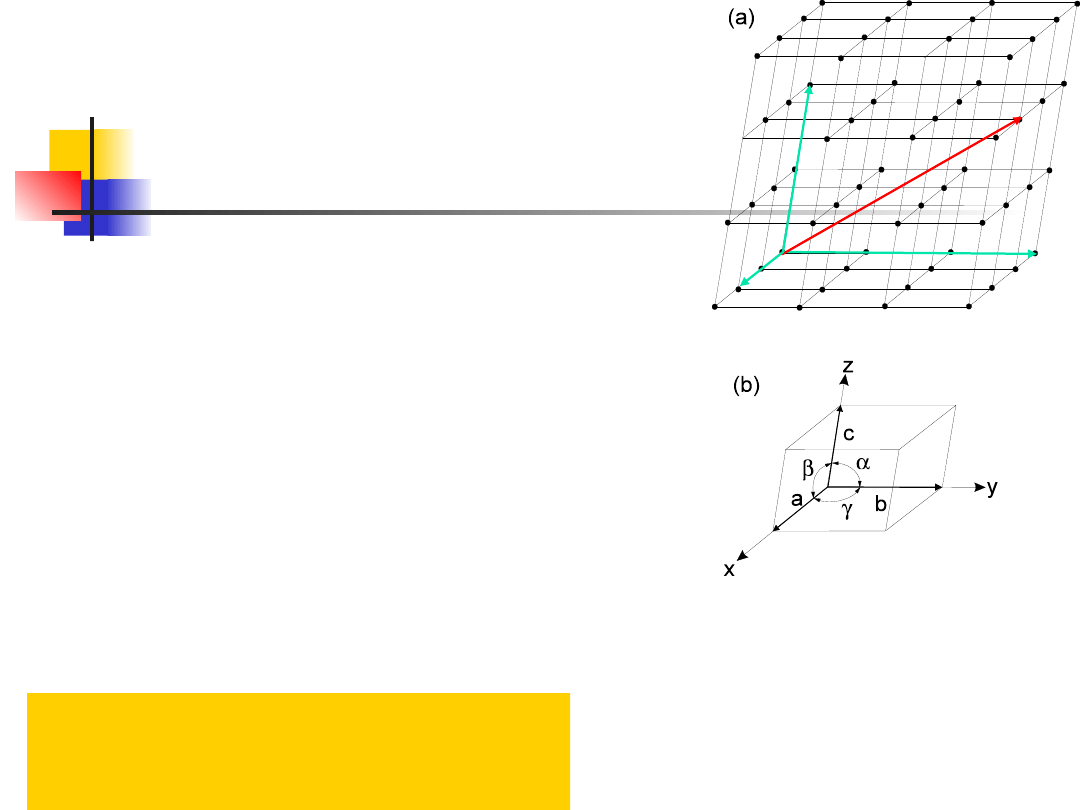
Symetria translacyjna sieci wyraża się tym, że
położenie dowolnego węzła w stosunku do węzła
przyjętego za punkt odniesienia, może być
określone za pomocą wektora translacji
gdzie: m, n, p – liczby całkowite, zaś
–
odpowiednio
dobrane
wektory,
nazywane
elementarnymi wektorami translacji.
Długości tych
wektorów, tzn. liczby a, b, c nazywamy stałymi
sieci.
Równoległościan zbudowany na elementarnych
wektorach
translacji
nazywamy
komórką
elementarną prostą lub pry-mitywną. Jak widać z
rys.,
sieć
przestrzenną
kryształu
sta-nowi
nieskończony
zbiór
jednakowych
komórek
ułożonych
równolegle
względem
siebie
i
wypełniających całą przestrzeń.
c
p
b
n
a
m
R
c
,
b
,
a
11
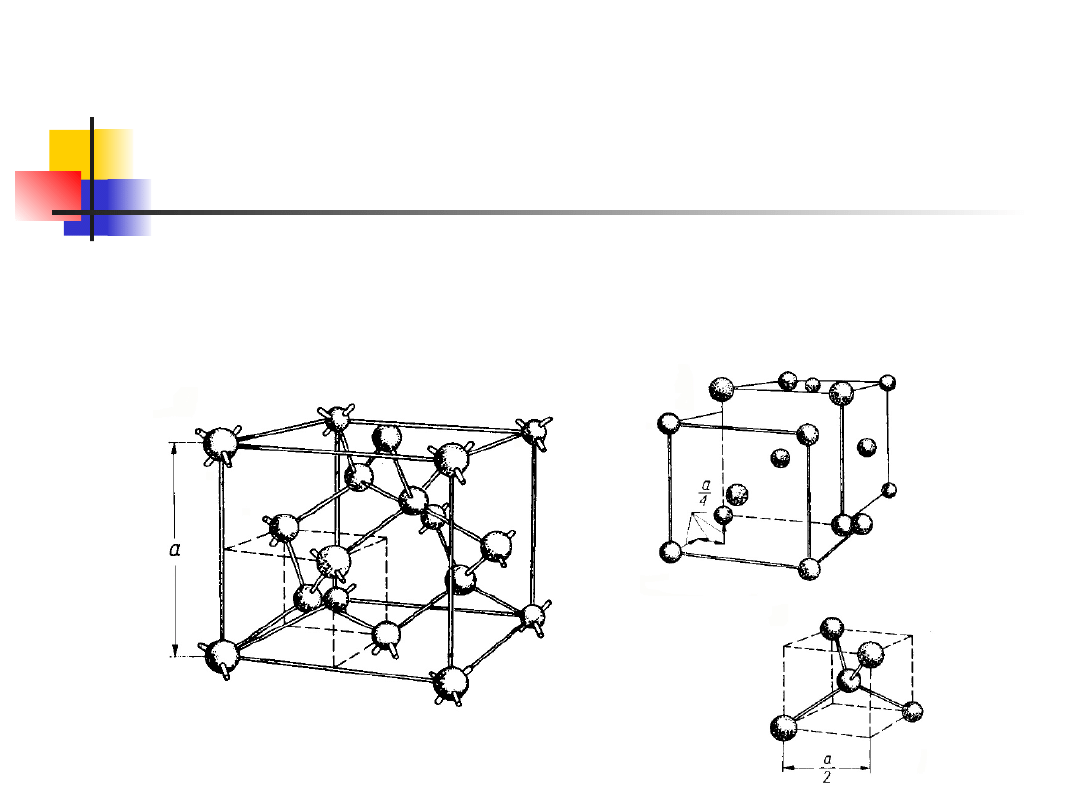
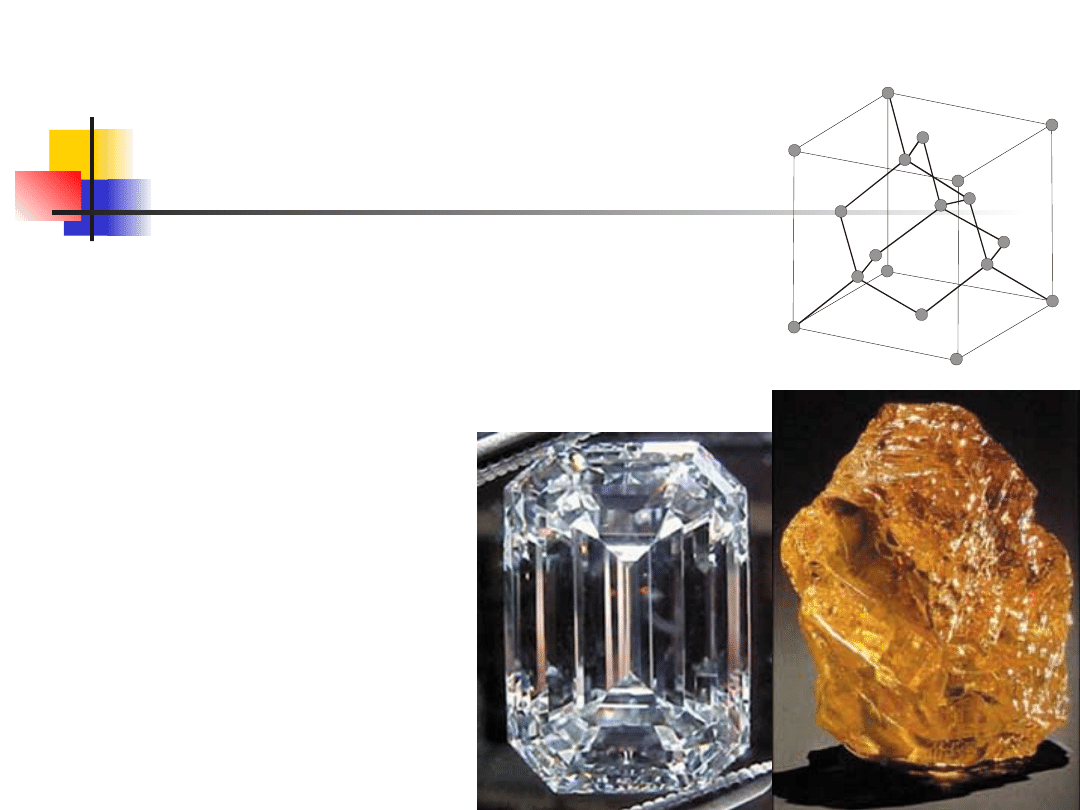
Sieć z bazą
Sieć diamentu - dwie sieci regularne centrowane
płasko przesunięte o 1/4 przekątnej przestrzennej.
Komórka elementarna
Z danej sieci można wybrać dowolną liczbę
różnych komórek elementarnych. Ich objętości
są jednakowe, bo na każdą z nich przypada (w
przypadku sieci regularnej) jeden atom.
Sieć Bravais’go
Trójwymiarowa sieć translacyjna Bravais’go
jest zbiorem wszystkich tych punktów
przestrzeni, których wektory wodzące
mają postać:
c
p
b
n
a
m
R
gdzie m, n, p dowolne liczby całkowite
dowolna trójka wektorów nie
leżących w jednej płaszczyźnie,
wektory te generują sieć (sieć jest
rozpięta na tych wektorach)
c
b
a
,
,
długości tych wektorów tzn.
liczby a, b i c nazywamy
stałymi sieci
Równoległościan
zbudowany na
elementarnych wektorach
translacji nazywamy
komórką elementarną
c
b
a
R
2
3
2
14

Równoległościan zbudowany na elementarnych
wektorach
translacji
nazywamy
komórką
elementarną prostą lub pry-mitywną. Jak widać z
rys.,
sieć
przestrzenną
kryształu
sta-nowi
nieskończony zbiór jednakowych komórek ułożonych
równolegle względem siebie i wypełniających całą
prze-strzeń.
W komórce prostej węzły sieci przestrzennej
znajdują się tylko w narożach, a zatem na jedną
komórkę przypada jeden węzeł. W niektórych
rodzajach sieci wygodniej jest posługiwać się
komórkami o większych rozmiarach, ale za to o
niższym stopniu symetrii niż komórka prosta. Są to
tzw. komórki złożone, które oprócz węzłów w
narożach zawierają dodatkowe węzły. Sieci takie
nazywamy sieciami centrowanymi.
Komórka elementarna jest scharakteryzowana
przez tzw. parametry sieci, tzn. długości jej krawędzi
a, b, c oraz kąty α, β, γ, zawarte między tymi
krawędziami. Kierunki wyznaczone przez wektory
nazywamy osiami kry-stalograficznymi.
c
,
b
,
a
15
Właściwości sieci
krystalicznej
komórka prosta – węzły tylko
w narożach (jeden węzeł na komórkę)
komórki złożone – sieci centrowane
komórka elementarna – odzwierciedla symetrię
sieci
stałe sieci i kąty to tzw. parametry sieci
liczba atomów w komórce elementarnej
liczba koordynacyjna – liczba punktów
sieci leżących najbliżej danego węzła
współczynnik upakowania k
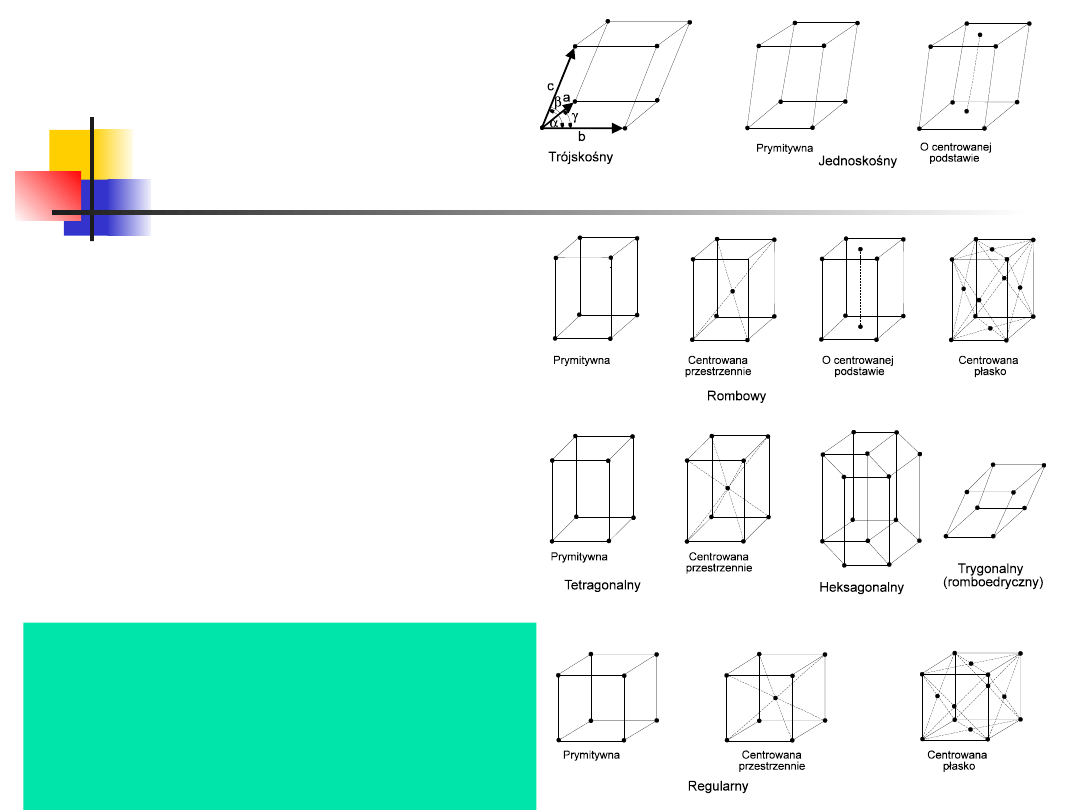
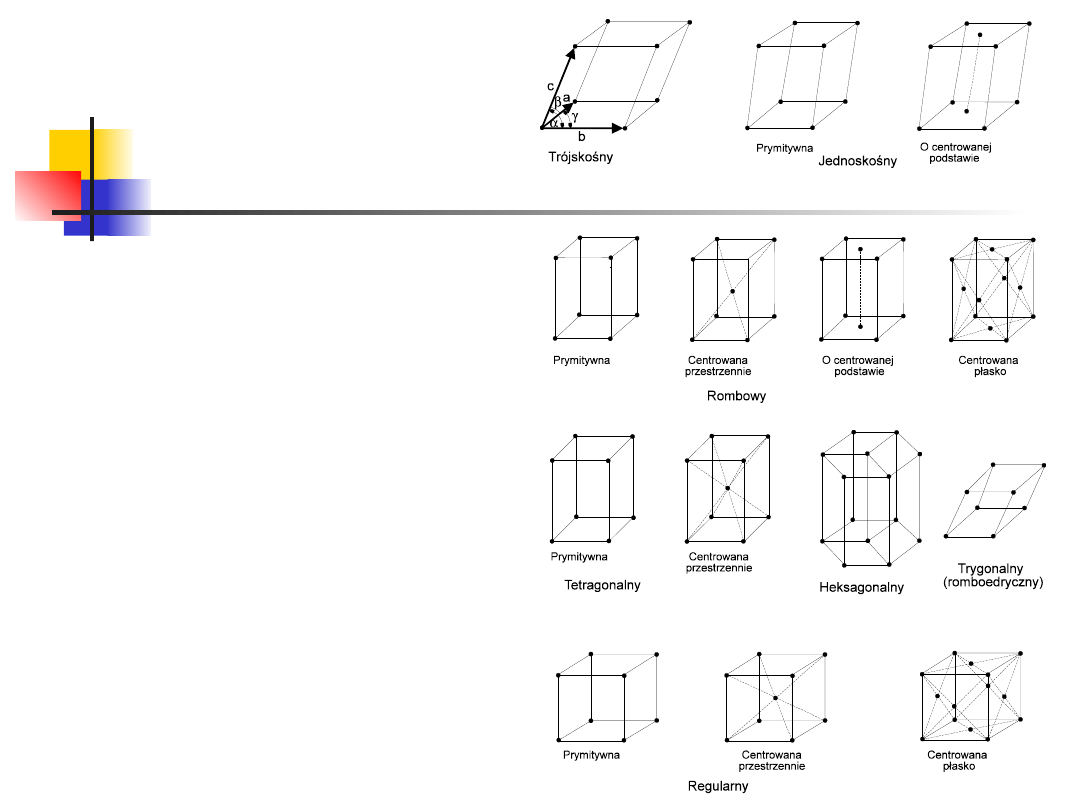
7 układów krystalograficznych:
regularny,
tetragonalny, rombowy, jednoskośny, trójskośny,
heksagonalny i trygonalny
a=b=c, ===90
16
a b c
90
90
o
o
a b c
90
o
a b c
90
o
a b c
90
o
a b c
90
o
a b c
krystalograficzne
układy
W zależności od stopnia symetrii,
sieci Bravais’go dzieli się na
siedem układów
krystalograficznych:
regularny,
tetragonalny,
rombowy,
jednoskośny,
trójskośny,
heksagonalny i trygonalny
Wśród nich wyróżnia się 14
typów sieci krystalograficznych
o różnym centrowaniu:
przestrzennym,
powierzchniowym i w
podstawach.
17

W zależności od stosunku długości i
wzaje-mnej orientacji krawędzi komórki
elementarnej, istnieje 14 typów sieci
krystalograficznych, tzw. sieci Bravais’go.
W zależności od stopnia symetrii, sieci
Bravais’go dzieli się na siedem układów
krystalograficznych: regu-larny, heksagonalny,
tetragonalny,
trygonalny
(rombo-edryczny),
rombowy, jednoskośny i trójskośny
W
układzie
regularnym
W
układzie
regularnym,
komórką
elementarną jest sześcian. Występują trzy rodzaje
sieci:
prosta,
centrowa-na
przestrzennie
i
centrowana powierzchniowo.
Elementarna
komórka
układu
układu
heksagonalnego
heksagonalnego
ma
postać
prostego
graniastosłupa, którego podstawą jest romb o
kątach 60 i 120. Trzy takie komórki tworzą gra-
niastosłup heksagonalny, który bardziej oddaje
symetrię układu niż komórka prosta.
18

W
układzie
tetragonalnym
tetragonalnym
komórką
elementarną jest prostopadłościan o podstawie
kwadratowej. Występują dwa rodzaje sieci: prosta i
centrowana przestrzennie.
W
układzie
trygonalnym
trygonalnym
komórka
elementarna ma postać romboedru (w związku z
tym układ ten nazywa się romboedrycznym). Kąty
α, β, γ, są jednakowe, różne od 90 i mniejsze od
120.
W
układzie
jednoskośnym
jednoskośnym
komórka
elementarna
ma
postać
pochyłego
równoległościanu, którego dwie pary ścian są
prostokątami, a dwie ściany są równoległobokami.
W układzie tym występują dwie sieci: prosta i z
centro-waną podstawą.
Komórka elementarna układu
trójskośnego
trójskośnego
jest równoległościanem, którego krawędzie a, b i c i
kąty α, β, γ są różne.
19
a b c
90
90
o
o
a b c
90
o
a b c
90
o
a b c
90
o
a b c
90
o
a b c
krystalograficzne
układy
W zależności od stopnia symetrii,
sieci Bravais’go dzieli się na
siedem układów
krystalograficznych:
regularny,
tetragonalny,
rombowy,
jednoskośny,
trójskośny,
heksagonalny i trygonalny
20
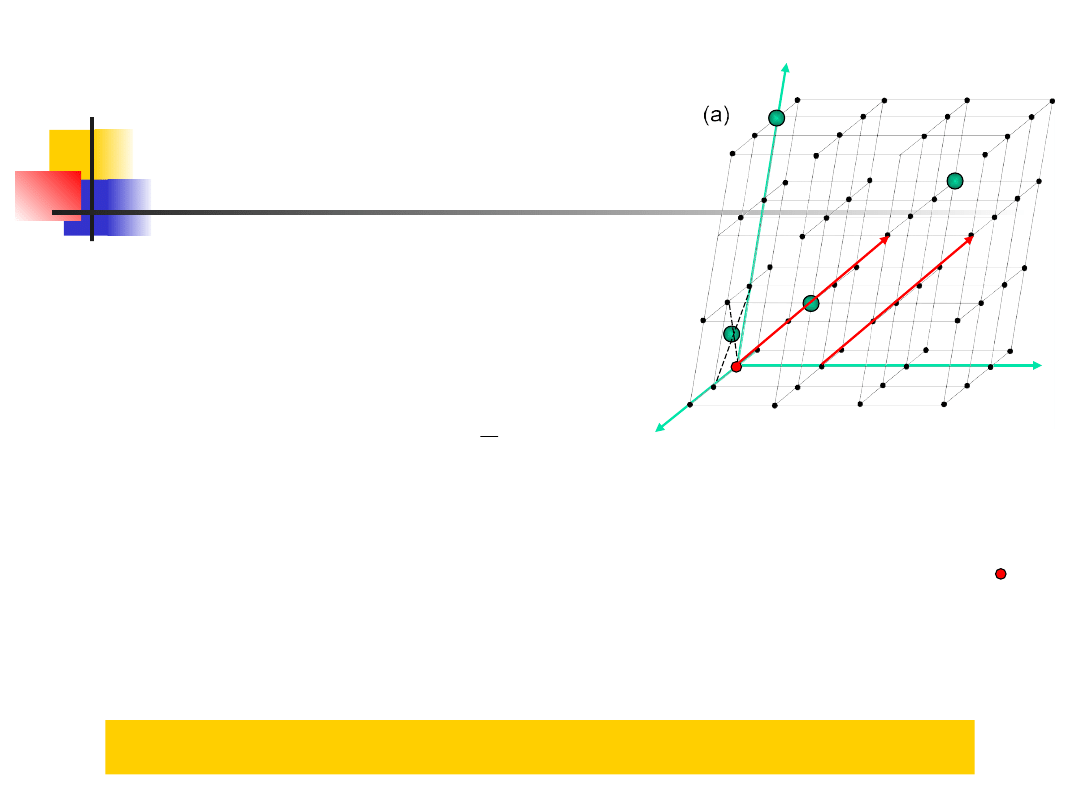
Wskaźniki węzłów
i kierunków
wskaźniki węzła to liczby mnp
określające jego położenie
x=ma, y=nb, z=pc
np. 111, 003, ½0½,
wskaźniki kierunków to wskaźniki pierwszego węzła przez
który przechodzi ten kierunek licząc od środka układu 000
kierunki równoległe mają identyczne wskaźniki
np. [111], [001],
22
1
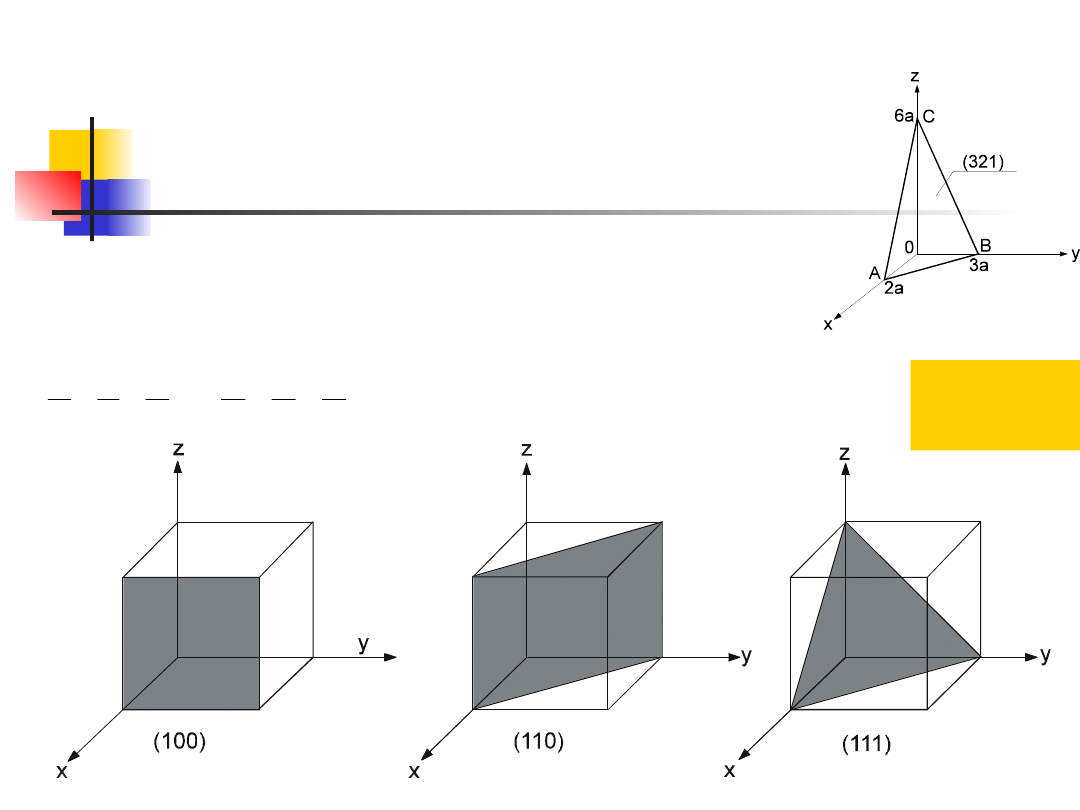
Wskaźniki płaszczyzn
odwrotności punktów przecięcia płaszczyzny z osiami
sprowadzamy do wspólnego mianownika
D
l
D
k
D
h
C
B
A
,
,
,
,
1
1
1
i liczniki zapisujemy w postaci (hkl)
wskaźniki
Millera
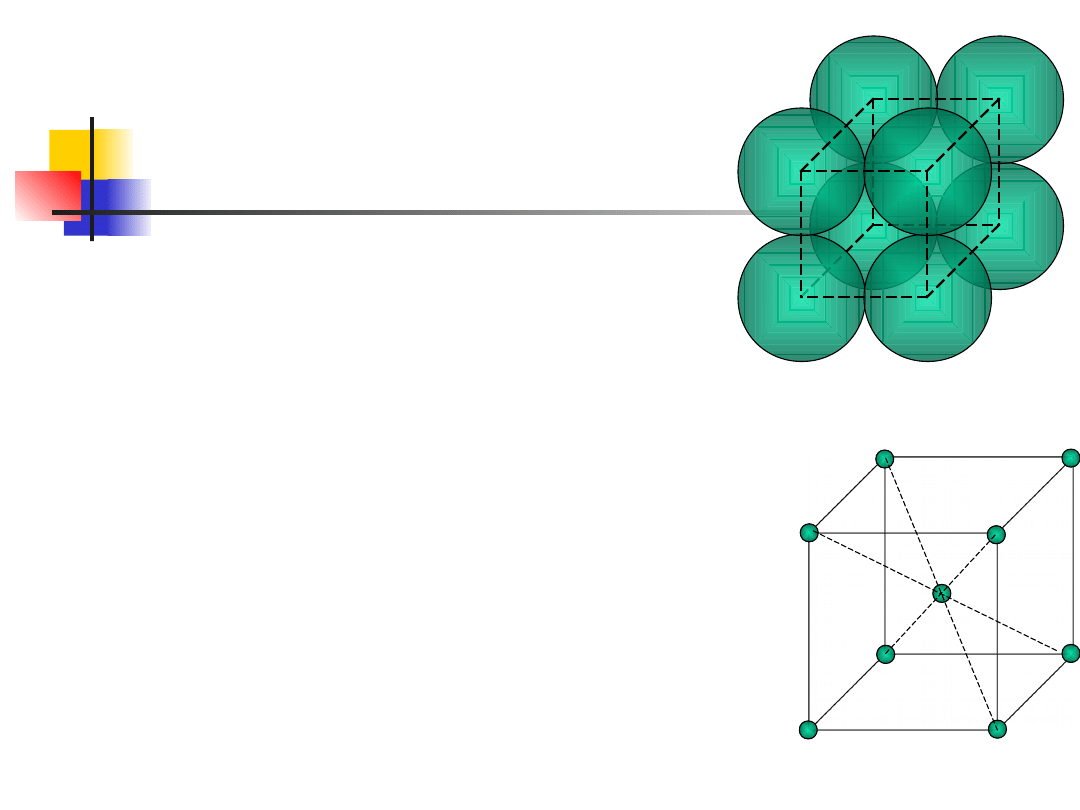
Kryształy metaliczne są
gęsto upakowane
regularna
płasko
centrowana
k = 0,74
heksagonalna
k = 0,74
regularna
objętościowo
centrowana
k = 0,68

PROSTE STRUKTURY
KRYSTALICZNE
24
Typowe struktury krystaliczne
struktura diamentu
płasko centrowana sieć
regularna
z dwupunktową bazą (dwa
atomy węgla przesunięte
wzdłuż głównej przekątnej o ¼
długości),
liczba koordynacyjna 4
pierwiastki C (diament),
Si (krzem), Ge (german)
C
25
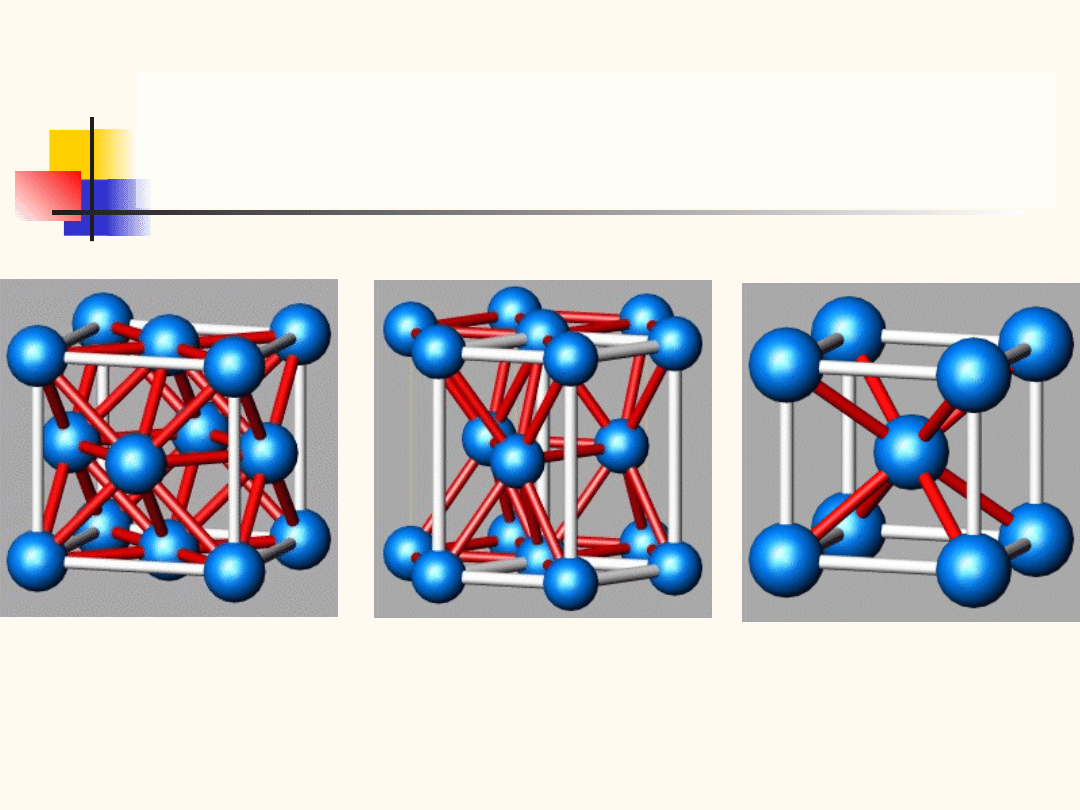
Struktura diamentu jest strukturą regularną,
będącą kombinacją dwóch sieci regularnych
powierzchniowo
centrowanych,
przesuniętych
względem siebie o jedną czwartą głównej
przekątnej.
Rys. przedstawia strukturę diamentu.
Każdy atom ma czterech najbliższych sąsiadów. W
komórce elementarnej znajduje się osiem atomów,
a odległość między nimi wynosi
gdzie a jest długością krawędzi komórki
elementarnej. We wszystkich węzłach sieci
znajdują się atomy tego samego rodzaju. W
strukturze tej krystalizuje między innymi diament,
krzem i german.
4
3/
a
Jeżeli dwie przecinające się sieci regularne centrowane
powierz-chniowo obsadzone są przez atomy różnych
pierwiastków, po-wstaje nowa struktura zwana strukturą
siarczku cynku. W stru-kturze tej krystalizują między
innymi GaAs, CuCl oraz ZnS od którego pochodzi nazwa
struktury.
26
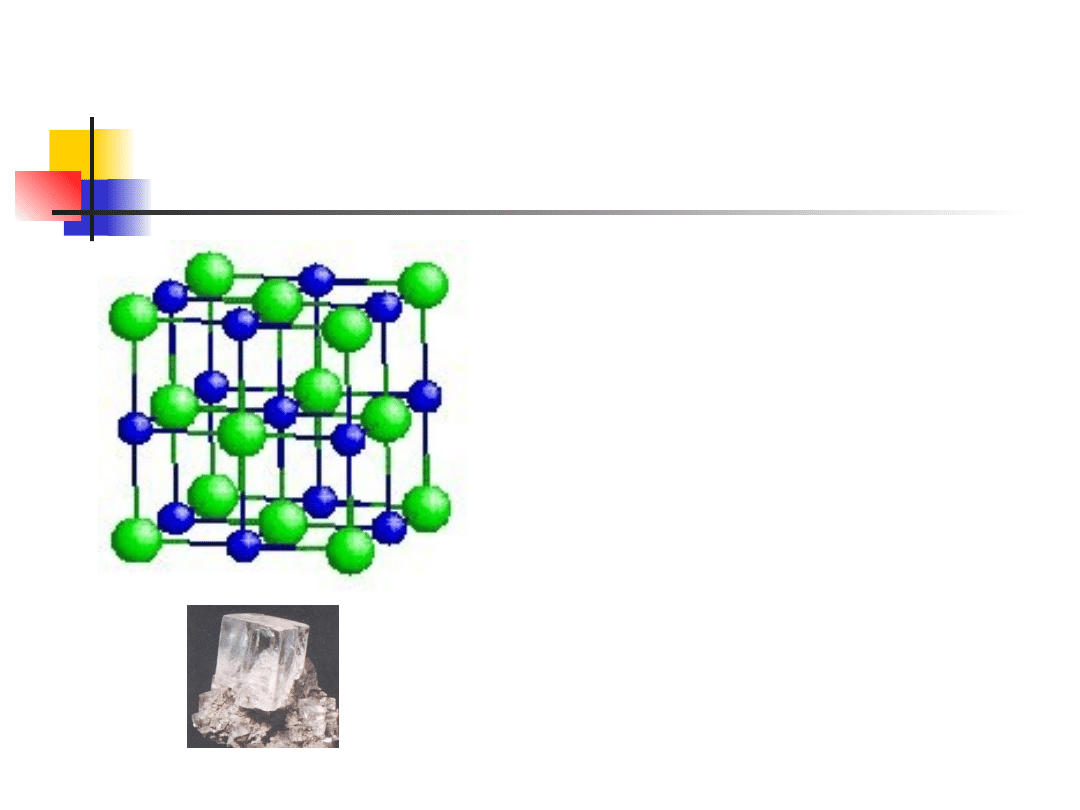
Typowe struktury krystaliczne
struktura chlorku sodu
Chlorek sodu (NaCl) –
struktura jonowa – sieć
regularna, centrowana
powierzchniowo, z bazą
dwupunktową z jonu Na i
jonu Cl przesuniętego o ½
głównej przekątnej (dwie
podsieci: sodu i chloru)
liczba koordynacyjna 6
inne związki: LiF, KCl, PbS
Na
+
Cl
-
27

Na rys. przedstawiono strukturę chlorku sodu. W
elementar-nej komórce znajdują się cztery jony Na i
cztery jony Cl, czyli cztery cząsteczki NaCl. Każdy jon
jednego rodzaju jest oto-czony sześcioma jonami
drugiego rodzaju, a w związku z czym liczba
koordynacyjna równa się 6.
28
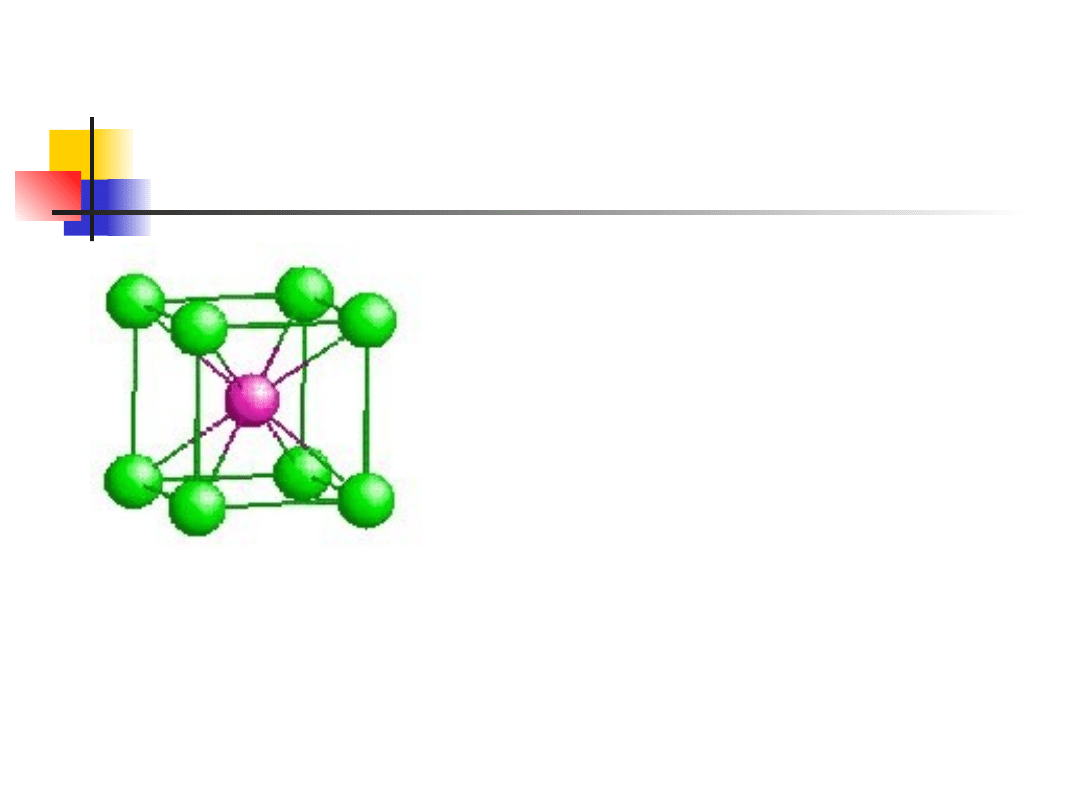
Typowe struktury krystaliczne
struktura chlorku cezu
Chlorek cezu, CsCl – sieć
regularna przestrzennie
centrowana
liczba koordynacyjna 8
inne związki: AgMn, LiHg
Cs
+
Cl
-
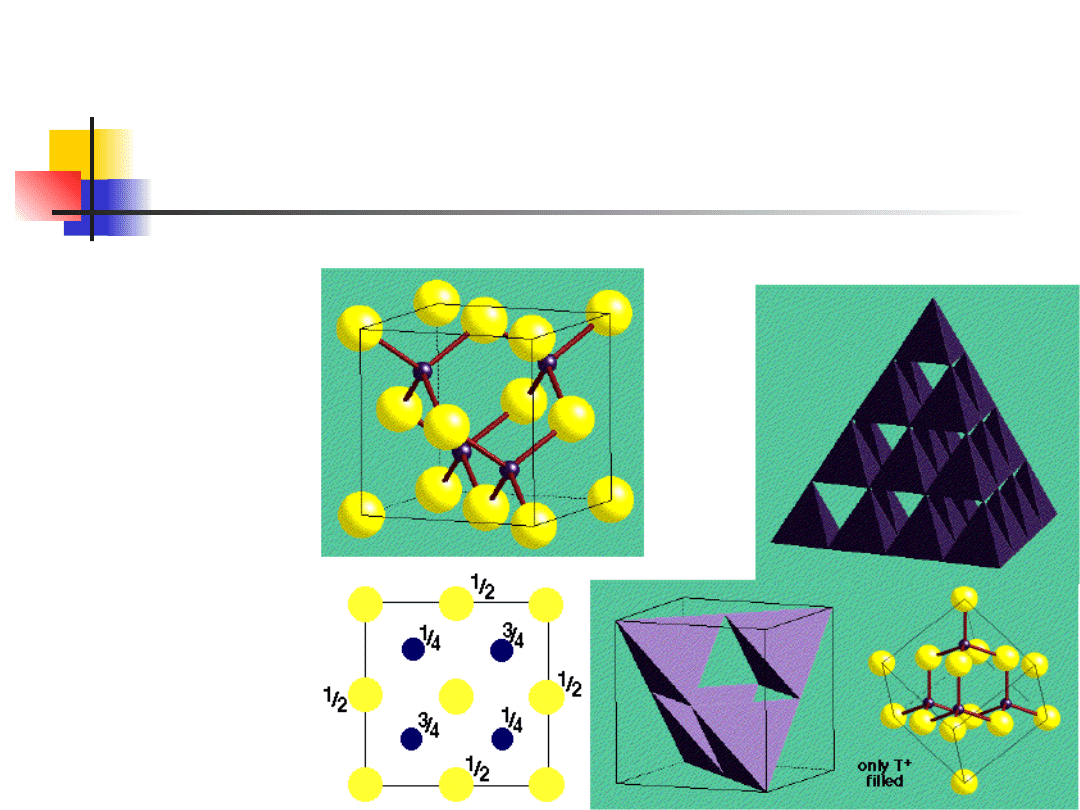
Typowe struktury krystaliczne
struktura blendy cynkowej
Siarczek cynku
blenda cynkowa
ZnS – jony
cynku i siarki
umieszczone w
punktach
struktury
diamentu
liczb. koordyn. 4
inne: GaAs, InSb
Zn
S
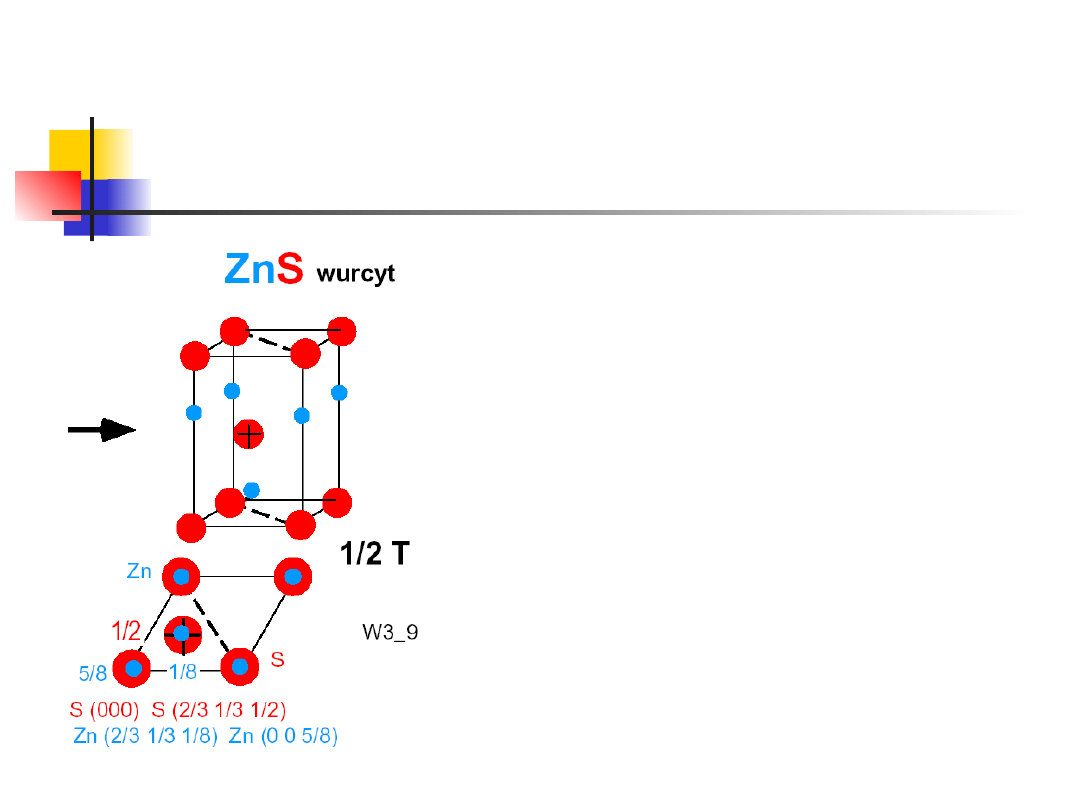
Typowe struktury krystaliczne
struktura wurcytu
liczba koordynacyjna 4
związki: GaN, ZnO, CdS
struktura o wiązaniach
tetraedrycznych
Dwie gęsto upakowane sieci
heksagonalne przesunięte względem
siebie wzdłuż osi c
Bliskie uporządkowanie takie samo jak
dla struktury blendy cynkowej, daleki
porządek inny, różne struktury
krystaliczne

DEFEKTY SIECI
KRYSTALICZNEJ
32

W rzeczywistych kryształach występują odstępstwa
od ide-alnej struktury krystalicznej. Oznacza to, że
prawidłowość rozmieszczenia atomów jest w pewien
sposób zaburzona. Odchylenia od idealnej struktury
nazywamy niedoskonało-ściami lub defektami.
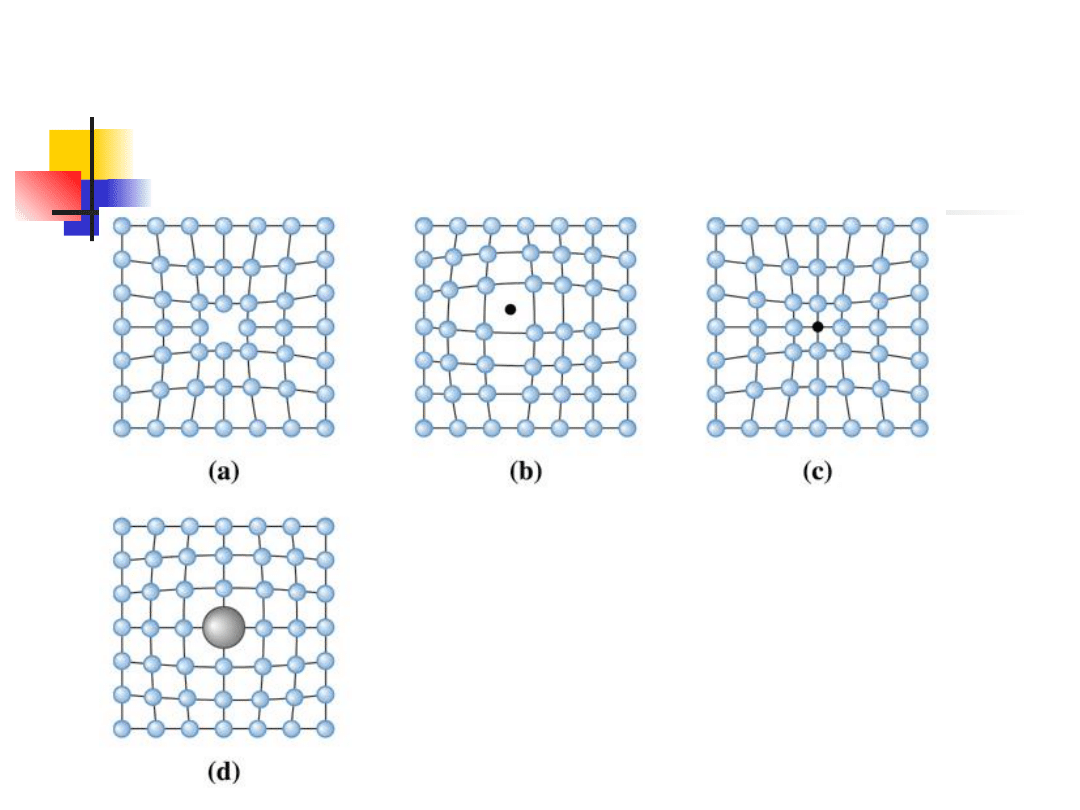
Spośród różnych defektów sieci, najważniejsze
są tzw. defekty punktowe. Defektami punktowymi
mogą być: puste węzły sieci (luki), atomy
międzywęzłowe oraz domie-szki chemiczne.
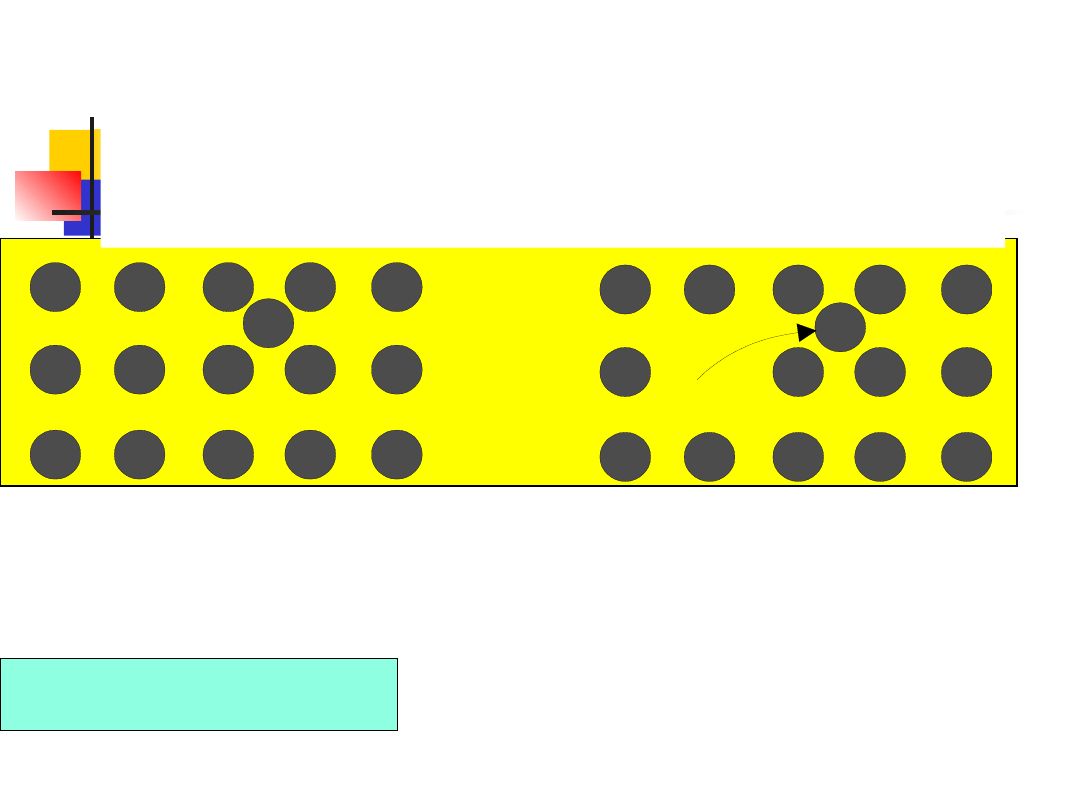
Najprostszym defektem jest
lu-ka w sieci, zwana też
defektem
Schottky'ego,
która
jest
wywo-łana
brakiem atomu lub jonu w
węźle sieci
33
Luki występują we wszystkich kryształach. Energia Ev
potrzebna do wytworzenia luki wynosi zwykle około 1 eV.
Ponieważ energia ta jest znacznie większa od średniej
energii drgań cieplnych atomów, wnioskujemy, że tylko
niewielka ilość atomów na skutek drgań będzie mogła
wyrwać się z sieci i zająć miejsce na powierzchni
kryształu. Można wykazać, że w temperaturze T
koncentracja luk wyraża się wzorem
kT
/
E
exp
n
n
v
v
Defekt Schottky'ego można sobie wyobrazić jako
prze-mieszczenie atomu z węzła sieci leżącego w
głębi kry-ształu do węzła leżącego na jego
powierzchni. Istnienie defektów Schottky'ego
powoduje
zmniejszenie
gęstości
kryształu
(wzrasta objętość przy niezmienionej masie).
gdzie n jest koncentracją atomów, Ev – energią aktywacji
potrze-bną
do
wytworzenia
luki.
Ze
wzrostem
temperatury liczba luk sil-nie wzrasta i w pobliżu
temperatury topnienia wynosi około 0.1% W temp.
pokojowej ilość luk wynosi zaledwie 10
–10
%.
34
Innym rodzajem defektów punktowych są atomy
między-węzłowe, czyli dodatkowe atomy nie
zajmujące węzłów sieci. Atom może też zająć
położenie międzywęzłowe przeskakując z węzła
sieci i pozostawiając za sobą lukę. Oba rodzaje
tych defektów przedstawiono na rys.
Obliczenia wskazują, że równowagowa koncentracja
atomów międzywęzłowych może być określona za
pomocą następu-jącej zależności
kT
/
E
exp
kn
n
i
i
gdzie jest energią aktywacji potrzebną
do
wy-tworzenia
atomu
międzywęzłowego, n – liczbą węzłów w
jednostce objętości, k – liczbą całko-witą
(na ogół bliską 1) określającą liczbę rów-
noważnych położeń międzywęzłowych
wokół atomu w węźle.
35

Energia E
i
jest większa od energii E
v
, dlatego
zwy-kle koncentracja atomów międzywęzłowych
jest znacznie mniejsza niż koncentracja luk.
Luki i atomy międzywęzłowe nie pozostają trwale
w miej-scach gdzie zostały wytworzone, lecz
przemieszczają się w krysztale na skutek dyfuzji.
Dyfuzja
jest
procesem
samorzutnym
prowadzącym do wyrównania rozkładu koncentracji
defektów
punktowych
wsku-tek
ich
nieuporządkowanych ruchów cieplnych. Ruchliwość ato-
mów międzywęzłowych jest na ogół większa niż
ruchliwość luk.
Oprócz drgań mogą istnieć jeszcze inne powody
występowania defektów w kryształach. Wówczas ich
ilość przewyższa wartości równowagowe dla danej
temperatury określone powyższymi wzorami.
Inne
sposoby
wytwarzania
defektów
to:
gwałtowne
ochłodzenie
kryształu,
obróbka
plastyczna,
bombardowanie
kryształu
wysokoenergetycznymi
naładowanymi cząstkami.
36
Oprócz defektów punktowych dużą rolę w fizyce
ciała stałego (szczególnie półprzewodników)
odgrywają
defekty liniowe, zwane dyslokacjami.
Wśród
nich
wyróżniamy
dyslokacje
krawędziowe i śrubowe.
( a ) ( b )
c
37

Dyslokacja
krawędziowa
jest
najprostszym
rodzajem dys-lokacjom polegającym na tym, że w
pewnej płaszczyźnie sieciowej ciągłość sieci urywa
się wzdłuż linii (krawędzi) oznaczonej na rys. a
symbolem c. To zaburzenie struktury można sobie
wyobrazić jako wynik ”wsunięcia” półpłaszczyzny
sieciowej do jednej części kryształu. Strzałka
wskazuje kierunek, w którym górna część sieci
krystalicznej została przesunięta w stosunku do
dolnej.
Dyslokacja
śrubowa
oznacza
granicę
między
przesuniętą a nie-przesuniętą częścią kryształu.
Granica ta biegnie równolegle do kierunku poślizgu; a
nie prostopadle, jak to zachodzi w przypa-dku dyslokacji
krawędziowej. Można sobie wyobrazić, że dyslo-kacja
śrubowa powstaje przy częściowym nacięciu kryształu
no-żem i przesunięciu części naciętej o jeden odstęp
atomowy równolegle do krawędzi cięcia. Dyslokacja
śrubowa przekształca kolejne płaszczyzny atomowe w
powierzchnie śrubowe, z czego wywodzi się nazwa tej
dyslokacji.
38

Bardzo poważnym defektem strukturalnym jest
powie-rzchnia kryształu
na której raptownie
urywa się periodyczna struktura sieci krystalicznej.
Ponadto powierzchnia kryształu jest narażona na
oddziaływanie
zewnętrznego
otoczenia.
Na
powierzchni gromadzi się (zostają zaabsorbowane)
znaczne ilości obcych atomów.
39

Defekty sieci krystalicznej, a szczególnie obce
atomy, w zasadniczy sposób wpływają na
właściwości fizyczne, zwłaszcza elektryczne i
optyczne ciał stałych. Występują one w każdym,
nawet najbardziej czystym krysztale. Współczesne
sposoby oczyszczania nie pozwalają na uzy-skanie
substancji zawierających mniej niż 10
–9
% domie-
szek, tzn. około 10
17
atomów domieszkowych w 1
m
3
.
Najbardziej czułe na obce domieszki są półprzewodniki
,
w któ-rych wprowadzenie nawet bardzo małych ilości
pewnych pier-wiastków (np. 1 atom na miliard atomów
własnych) może spo-wodować wzrost przewodności
elektrycznej o kilka rzędów wielkości. W celu więc
osiągnięcia
określonych
właściwości
fizycznych
półprzewodników
stosuje
się
domieszkowanie
kryształów.
40
(c
) 2
0
0
3
B
ro
o
k
s/
C
o
le
P
u
b
lis
h
in
g
/
T
h
o
m
so
n
L
e
a
rn
in
g
Defekty punktowe
41

DRGANIA SIECI
KRYSTALICZNEJ
42
Rozpatrując sieć krystaliczną zakładaliśmy, że
atomy są nieruchome, utrzymywane przez
oddziaływania międzya-tomowe. W rzeczywistości
atomy wykonują drgania wokół swoich położeń
równowagi. Drgania te występują w każ-dej
temperaturze, nawet w temperaturze zera
bezwzglę-dnego jako tzw. drgania zerowe.
Amplituda drgań ciepl-nych nie przekracza 10
–11
m.
Z drganiami atomów związanych jest wiele
ważnych zaga-dnień, jak np. rozszerzalność cieplna i
przewodnictwo cieplne ciał stałych. Drgania cieplne
atomów są najważniejszą przyczyną występowania
oporu elektrycznego.
Ponieważ amplituda drgań cieplnych jest znacznie
mniej-sza od odległości międzyatomowych można w
pewnym przybli-żeniu przyjąć, że oddziaływanie między
atomami jest harmoni-czne, tzn. że siła oddziaływania
jest proporcjonalna do wychyle-nia.
43

Drgania każdego atomu naruszają równowagę
sąsie-dnich atomów, w wyniku czego rozciągają
się one na całą sieć w postaci fal sprężystych
rozchodzących się w krysztale we wszystkich
możliwych kierunkach. Taki ruch atomów w
postaci fali sprężystej nosi nazwę drgań nor-
malnych.
Fale
te
nazywamy
też
falami
sieciowymi.
Widmo częstotliwości drgań sieci obejmuje zakres od
zera do ponad 10
13
Hz. Fale sieciowe o najmniejszych
częstotliwościach są to dobrze nam znane fale
akustyczne.
Zamiast rozpatrywać drgania 3-wymiarowej sieci
krystali-cznej,
posłużymy
się
prostym
jednowymiarowym modelem w postaci periodycznego
łańcucha złożonego z oddziaływujących na siebie
atomów.
44
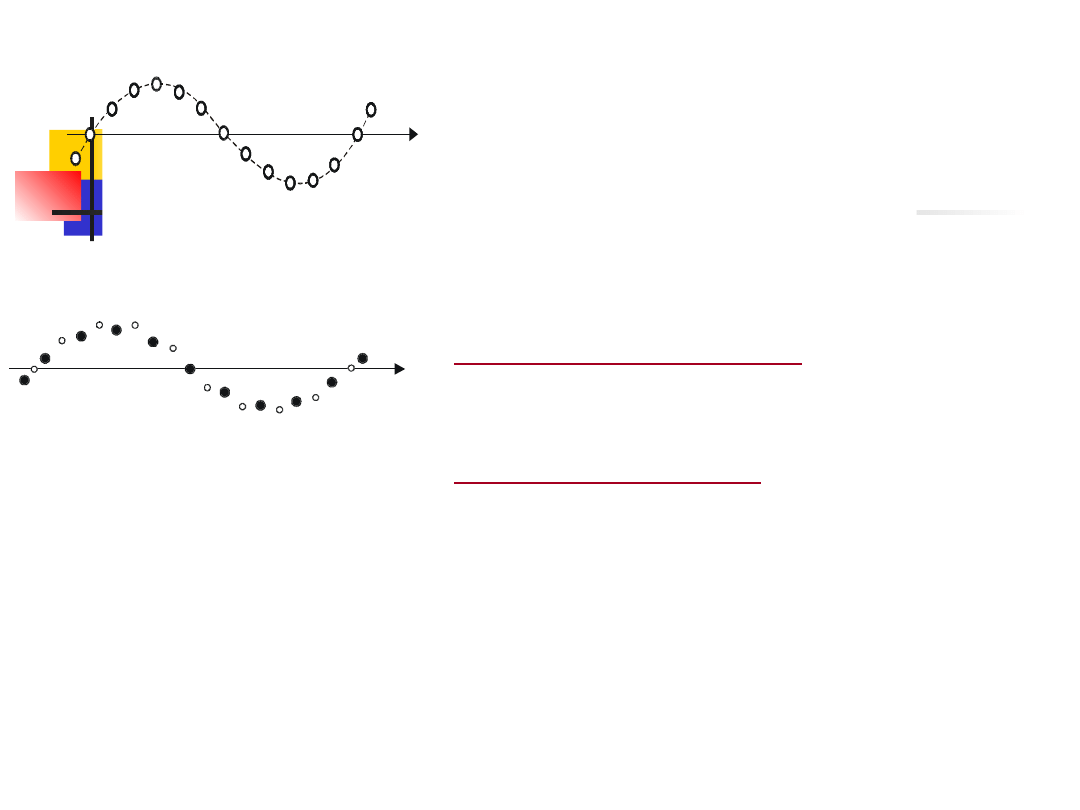
Jeden z możliwych sposobów
drgań
takiego
łańcucha
przedstawiono na rys. 14.12.
W łańcuchu zbudowanym nie z
jedne-go, lecz z dwóch rodzajów
atomów,
mogą
występować
następujące dwa typy drgań:
drgania akustyczne
(rys. 14.13a),
w których oba rodzaje atomów
drgają w tych samych fazach, oraz
drgania optyczne
(rys. 14.13b), w
któ-rych atomy różnych rodzajów
drgają w przeciwnych fazach.
Drgania tego typu mogą być
wywołane
zmiennym
polem
elektrycznym,
np.
falą
elektromagnety-czną
o
częstotliwości
zwykle
zakresu
podczerwieni – tym tłumaczy się
nazwa ”drgania
optyczne”.
x
x
x
( a )
( b )
45

Drgania akustyczne obejmują zakres mniejszych
częstotli-wości (od zera do pewnej częstotliwości
granicznej)
i
mniejszych
wartości
energii,
natomiast drgania optyczne obejmują zakres tylko
największych częstotliwości i są związane ze
stosunkowo wysokoenergetycznymi zjawiska-mi
elektro-magnetycznymi.
Rozważmy bliżej drgania akustyczne. Ponieważ
drgania każdego atomu można rozłożyć na dwa drgania
poprzeczne i je-dno podłużne, liczba drgań które mają
powstać w krysztale wy-nosi 3N, gdzie N jest całkowitą
liczbą atomów.
Mówiąc inaczej, w ciele stałym
propagują się trzy fale akustyczne: jedna
podłużna i dwie poprzeczne.
Fale te dochodzą do
powierzchni kryształu, odbijają się od niej i interferują z
falami nadbiegającymi tworząc układ fal stojących.
Oznacza to, że na całej długości kryształu L musi odłożyć
się całkowita liczba połówek długości fal
2
n
L
46

Drgania sieci krystalicznej
atomy sieci krystalicznej wykonują drgania wokół swoich położeń
równowagi
drgania te występują nawet w T=0K
amplituda drgań (10
-11
m) jest dużo mniejsza od odległości
międzysieciowych, tak że można je traktować jako drgania
harmoniczne
rozszerzalność cieplna i przewodnictwo cieplne związane są z
drganiami atomów
drgania cieplne są przyczyną występowania oporu elektrycznego
drgania rozchodzą się w krysztale w postaci fal sprężystych
zwanych sieciowymi
ze względu na ograniczoność sieci krystalicznej energia tych
drgań jest skwantowana w postaci porcji zwanych fononami
47

WIĄZANIA ATOMÓW W
KRYSZTALE
48
REFERAT ??
?
Zrozumienie wielu procesów zachodzących w ciałach stałych
wyma-ga znajomości charakteru wiązań między atomami
występujących w tych ciałach.
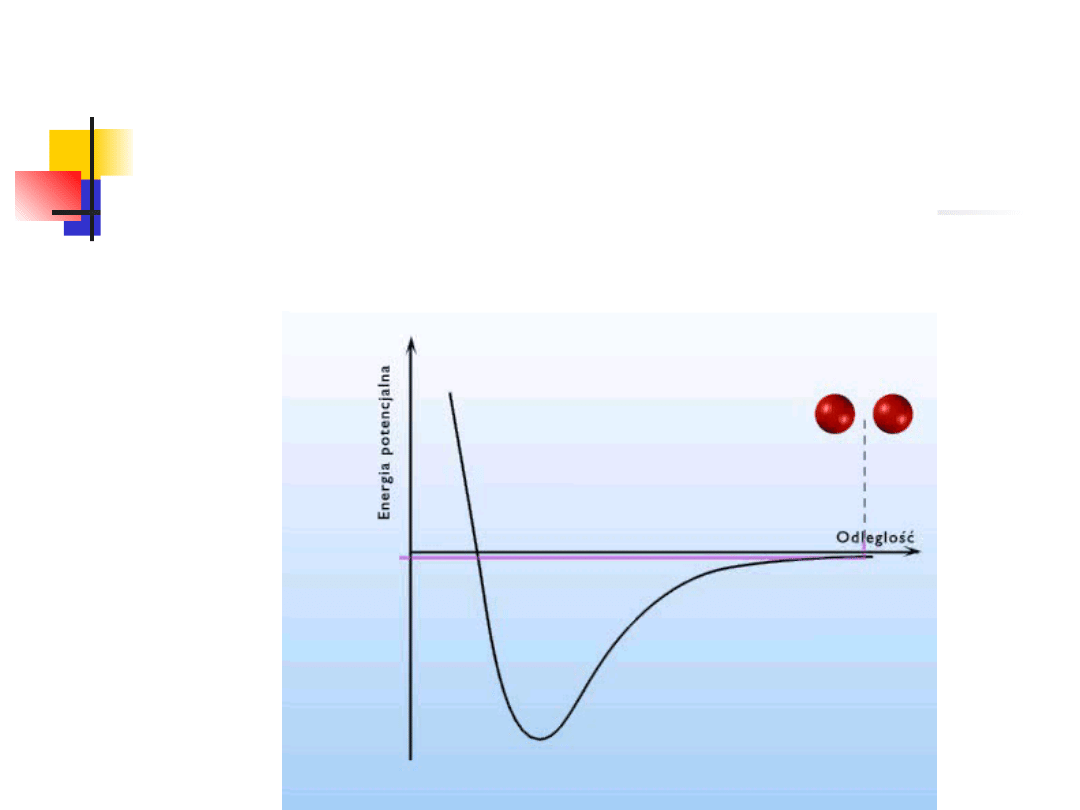
Istnienie ciał stałych świadczy o występowaniu sił
międzyatomowych, które dla dużych odległości są siłami
przyciągania, a dla małych odle-głości – siłami odpychania.
Przy odległościach międzyatomowych rzę-du 10
–10
m siły te
równoważą się
49
Charakter wiązań
B
r
n
A
r
m
A
r
B
r
m
n
n
m
r
B
r
A
r
U
Niezależnie od natury sił
międzyatomowych, przebieg energii
potencjalnej w funkcji odległości między
atomami ma podobną postać:
siły przyciągania
siły odpychania
Siły przyciągania są bardziej dalekozasięgowe więc n>m
W stanie równowagi trwałej dla r=r
o
energia osiąga
minimum
dr
dU
F
Siły odpychania
wynikają z
nakładania się jąder
atomowych
Siły przyciągania
mają charakter sił
elektromagnetyczny
ch
50

Rodzaje wiązań
wiązania jonowe
elektrostatyczne przyciąganie się ładunków
wiązania kowalencyjne
nakładanie się powłok elektronowych
wiązania metaliczne
oddziaływanie chmury elektronów z jądrami
wiązania molekularne
wiązania między cząsteczkowe siłami van der
Walsa
51

Natura sił działających między atomami i jonami jest
często podstawą klasyfikacji kryształów. Mamy więc
kryształy jono-we, kowalencyjne, metaliczne i
molekularne. Wymienione wyżej rodzaje wiązań
rzadko występują w czystej postaci.
Miarą wielkości sił wiążących atomy w
krysztale jest energia wiązania, czyli minimalna
energia potrze-bna do rozdzielenia kryształu na
swobodne atomy
. Wyraża się ją w elektronowoltach
na atom lub w dżulach na mol. Energia ta zawiera się
w bardzo szerokich granicach od 0,02 eV/atom dla
neonu (temperatura topnienia –249C) do 8,9 eV/atom
dla wolframu (temperatura topnienia + 3370C). Dla
kryształów jonowych może być większa
52

Energia wiązania atomów
Typ wiązania
Przykłady
Energia
kJ/mol
jonowe
LiF
1014
NaCl
765
kowalencyjne
Ge
374
Si
448
metaliczne
Cu
338
Fe
393
molekularne
Ne
1,9
Kr
3,2
100kJ/mol =
1eV/atom
53
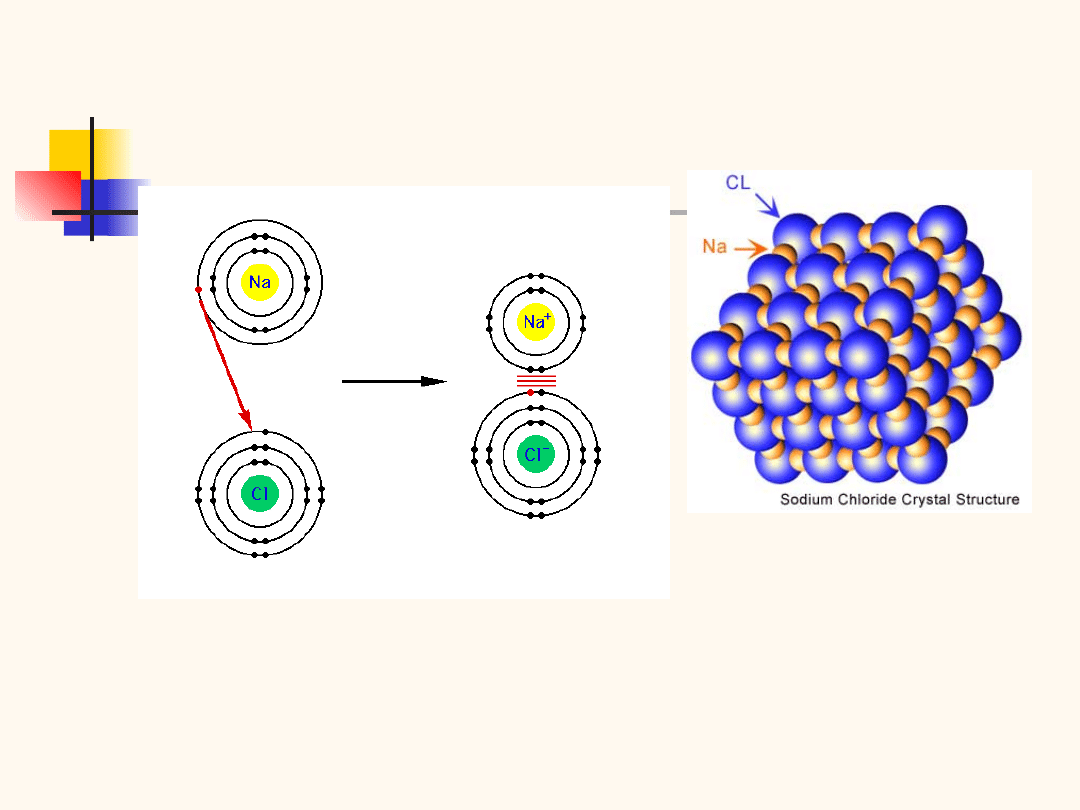
Wiązanie jonowe
występuje w kryształach utworzonych z silnie
elektrododatnich atomów metali i silnie elektroujemnych
atomów chlorowców (NaCl, CsCl, KJ)
wzajemne oddziaływanie jonów Na
+
i Cl
-
kryształy jonowe są twarde, o wysokiej temperaturze
topnienia, złe przewodniki ciepła i prądu
54

Wiązanie jonowe w czystej postaci występuje w
kryszta-łach typu NaCl, CsCl, KJ itp, a więc w
kryształach utwo-rzonych z silnie elektrododatnich
atomów metali i silnie elektroujemnych atomów
chlorowców.
Wiązania te omówimy na przykładzie
kryształu NaCl, którego strukturę przedstawiono na
rys. W węzłach sieci znajdują się przemiennie jony
Na+ i Cl–. Powstanie jonów możemy wytłumaczyć
w sposób następujący. Ener-gia jonizacji atomu Na
wynosi około 5,2 eV, przyłączenie elektronu od
atomu chloru jest związane z wydzieleniem energii
3,8 eV. Do przemieszczenia elektronu z atomu
sodu do atomu chloru potrzebna jest zatem
energia 1,4 eV. Jeżeli więc atomy (jony) znajdują
się od siebie w tak dużej odległości, że można
zaniedbać ich wzajemne oddziaływanie, to układ
Na
+
+ Cl– posiada energię o 1,4 eV wyższą od
energii układu Na + Cl.
55

Przy zmniejszeniu odległości r między jonami
coraz
wię-kszą
rolę
zaczyna
odgrywać
oddziaływanie kulombowskie. Wartość energii 1,4
eV
jest osiągana przy odległości r =
10
–9
m.
Przy mniejszych odległościach układ jonów jest
bardziej stabilny niż układ atomów. Przy jeszcze
większym zbliże-niu się jonów pojawiają się siły
odpychające, o których mówiliśmy poprzednio. W
wyniku
otrzymujemy
przebieg
energii
przedstawiony na rys.
r
/
e
=
o
4
2
Energia oddziaływania dwóch jonów sieci krystalicznej
może być przedstawiona w postaci wzoru
Parametr n wynosi około 10, tzn. że siły odpychania
maleją bar-dzo szybko ze wzrostem odległości i można
ograniczyć się do oddziaływania najbliższych sąsiadów.
n
o
r
B
r
e
r
U
4
2
56

Natomiast w przypadku bardziej długo zasięgowych
oddziały-wań
kulombowskich
należy
uwzględnić
oddziaływanie z dalszy-mi sąsiadami. W rezultacie
energia potencjalna jonu w kryszta-le wynosi
gdzie α
M
nosi nazwę stałej Madelunga i uwzględnia
oddziały-wanie
kulombowskie
jonu
z
dalszymi
sąsiadami.
n
o
M
r
B
r
e
r
U
4
2
57
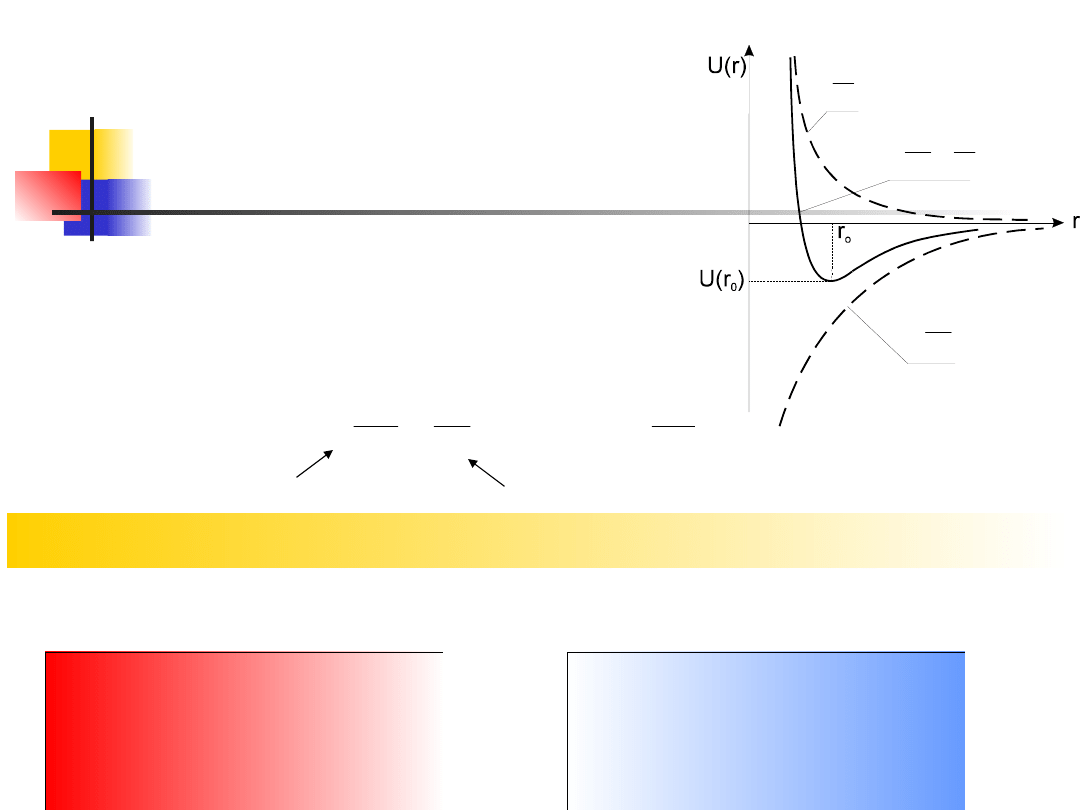
Wiązanie kowalencyjne
(atomowe)
występuje w atomach leżących blisko siebie w układzie
okresowym, o tej samej lub zbliżonej elektroujemności
U ( r )
r
orbital wiążący
siły przyciągania
orbital antywiążący
siły odpychania
Oddziaływanie uwarunkowane wymianą elektronów między
atomami ma kwantowy charakter i nosi nazwę oddziaływania
wymiennego
W przypadku jodowodoru HJ po utworzeniu wspólnej pary
elektronowej wodór ma dublet charakterystyczny dla He, a jod
oktet taki jak ksenon
H· + ·Ï: = H:Ï:
..
..
wodór H
2
, azot
N
2
58
Przy zbliżaniu się dwóch atomów nakrywają się ich chmury
elektrono-we
i
rośnie
prawdopodobieństwo
przejścia
elektronu z jednego atomu do drugiego. Przy odpowiednio
małej odległości stopień pokrywania się chmur jest tak duży,
że można powiedzieć, iż elektrony należą do obu jąder.
Mówimy wówczas, że są skolektywizowane lub uwspólnio-ne.
Okazuje się ponadto, że nakrywaniu chmur elektronowych
towa-rzyszy przegrupowanie gęstości elektronowej i zmiana
energii układu.
Jeżeli spiny elektronów są ustawione przeciwnie, to gęstość chmury
elektrono-wej w przestrzeni między jądrami będzie większa niż ta,
którą otrzymalibyśmy w wyniku dodania chmur elektronowych
dwóch odosobnionych atomów. Jednocześnie poza tym obszarem
gęstość chmury jest mniejsza niż w odoso-bnionych atomach.
Funkcję falową opisującą gęstość chmury elektronowej utworzonej w
ten sposób nazywamy orbitalem wiążącym. Pojawienie się stanu o
większej
gęstości
chmury
elektronowej
(przy
przeciwnie
ustawionych spi-nach) powoduje zmniejszenie energii układu i
prowadzi do pojawienia się sił przyciągania. Jeżeli natomiast spiny
elektronów są skierowane zgodnie, mię-dzy atomami pojawiają się
siły odpychania. Układ taki może więc znaleźć się w stanie
równowagi, a przypisany temu stanowi orbital nazywamy antywią-
żącym. Oddziaływanie uwarunkowane wymianą elektronów
między atomami ma kwantowy charakter i nosi nazwę
oddziaływania wymiennego. Siły takiego oddziaływania
nazywamy siłami wymiany, a ich energię - energią wymiany.
59

Wyżej omówione wiązanie, które powstaje za
pośredni-ctwem
oddziaływania
elektronów
walencyjnych
nazywamy
wiązaniem
kowalencyjnym.
W kryształach typowe wiązanie kowalencyjne
występuje w pierwiastkach czwartej grupy (węgiel
o
strukturze
dia-mentu,
krzem,
german).
Wszystkie te kryształy posiadają strukturę
diamentu.
Atomy IV grupy mają na orbicie walencyjnej cztery
elektrony (np. o konfiguracji 2s
2
2p
6
dla węgla): dwa w
stanie s (o spinach przeciwnych) i dwa w stanie p (o
spinach zgodnych). Na skutek oddziaływania między
atomami w krysztale, konfiguracja elektro-nów w atomie
zmienia się w ten sposób, że w stanie s jest jeden
elektron, a w stanie p trzy elektrony, przy czym
wszystkie cztery elektrony mają spiny równoległe. Każdy
elektron może uczestni-czyć w czterech wiązaniach i
będzie tworzył pary elektronowe z czterema sąsiednimi
atomami.
60
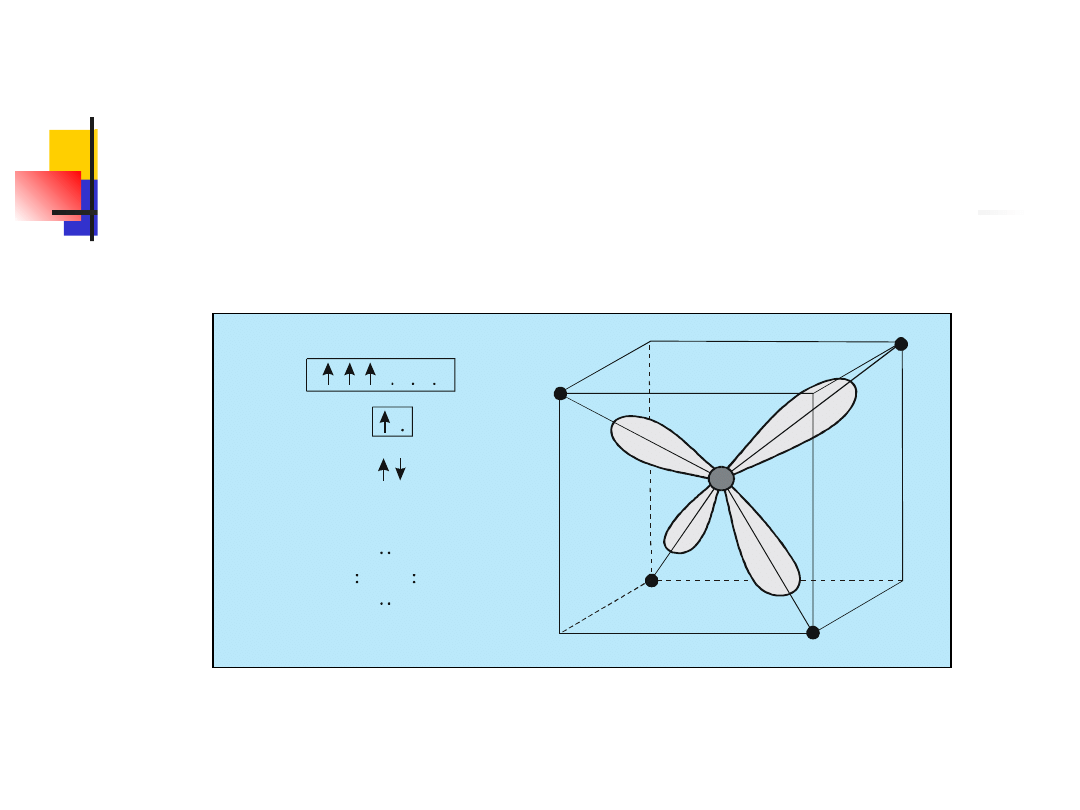
W cząsteczce CH
4
orbitale 2s i 2p atomu węgla nie
zacho-wują swego normalnego kształtu, lecz
ulegają zmieszaniu (czyli tzw. hybrydyzacji), w
wyniku czego powstaje orbital będący kombinacją
liniową jednej funkcji falowej 2s oraz trzech funkcji
falowych 2p. Nosi on nazwę orbitalu zhy-
brydyzowanego sp
3
. Jego kształt przedstawiono w
sposób poglądowy na rys.
Chmura elektronowa otaczająca rdzeń atomowy węgla
ma czte-ry równoważne ”ramiona” skierowane wzdłuż
osi
łączących
śro-dek
czworościanu
foremnego
(tetraedru) z narożami.
C
C
H
H
H
H
H
H
H
H
( a ) ( b )
( c )
2 p
2 s
1 s
61

Wiązanie
kowalencyjne
jest
wiązaniem
silnym
. Ma charakter wysoce kierunkowy,
ponieważ powstaje w tym kierunku, w którym
skupiona
jest
największa
część
chmu-ry
elektronowej skolektywizowanych elektronów.
Sztywność struktury elektronowej powoduje, że
kryształy są twarde i niepodatne na odkształcanie.
W temperaturach bardzo niskich kryształy kowalencyjne
są izola-torami,
gdyż każdy elektron walencyjny jest
związany z atomem. Ponieważ jednak powłoka
walencyjna nie jest zamknięta, siły wiążące na tej
powłoce nie są zbyt duże. W wysokiej temperatu-rze
energia drgań cieplnych jest wystarczająco duża do
zerwania niektórych wiązań i uwolnienia pewnej liczby
elektronów. Kryształ staje się przewodnikiem prądu.
Wiązanie kowalen-cyjne jest typowym wiązaniem
kryształów półprzewo-dnikowych.
62

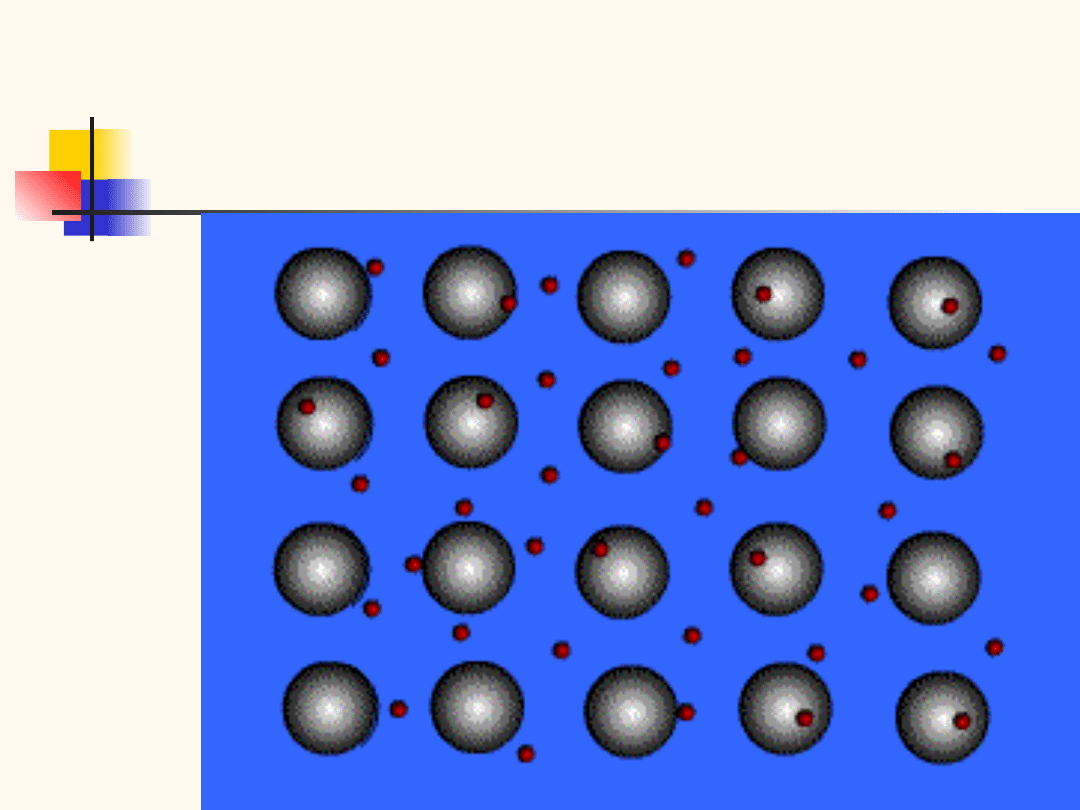
Wiązanie metaliczne
występuje dla atomów o małej liczbie elektronów
wa-lencyjnych
przy zbliżaniu atomów następuje przekrywanie
funkcji falowych tych elektronów tak, że gęstość
prawdopo-dobieństwa ich znalezienia jest stała
delokalizacja
elektronów
i
łatwość
ich
przemieszcza-nia pod wpływem pola elektrycznego
wiązanie ma charakter kolektywny i objętościowy
do-datnio naładowane jądra oddziaływają z chmurą
oderwanych elektronów swobodnych
wiązanie metaliczne nie jest skierowane, więc
metale są plastyczne. Koncentracja elektronów
10
23
cm
-3
miedź, żelazo
63
Wiązanie metaliczne
64

Wiązanie molekularne
W przypadku kryształów molekularnych w węzłach sieci
krysta-licznej znajdują się molekuły połączone ze sobą
siłami moleku-larnymi, zwanymi inaczej siłami van der
Walsa.
Oddziaływanie tego typu występuje w każdej
substancji, jest jednak zdominowane przez inne
(omówione wcześniej) oddziaływania. Jeżeli jednak
powłoki elektronowe w atomach są całkowicie
wypełnione, to siły van der Walsa są głównymi siłami
jakie występują między atomami i cząstkami. Sytuacja
taka występuje np. w gazach szlachetnych. Wiązania
moleku-larne
mają
charakter
wiązań
elektrostatycznych. Wyróżniamy trzy rodzaje sił:
orientacyjne, indukcyjne i dyspersyjne.
65
Siły orientacyjne występują w przypadku, gdy
cząstki mają trwałe elektryczne momenty dipolowe.
Siły oddzia-ływania elektrostatycznego starają się
ułożyć je w okre-ślonym porządku, któremu
odpowiadać będzie minimum energii. Ruchy
termiczne cząstek burzą to uporządkowa-nie,
dlatego energia tych oddziaływań zmniejsza się ze
wzrostem temperatury.
Siły indukcyjne występują w przypadku, kiedy tylko część
mo-lekuł ośrodka ma trwałe momenty dipolowe. Pole
elektryczne wytworzone przez te dipole indukuje momenty
dipolowe w pozo-stałych niepolarnych cząstkach i
powoduje ich przyciąganie.
Oddziaływanie
dyspersyjne
występuje
między
molekułami, które nie mają trwałych elektrycznych
momentów dipolowych. Ponieważ molekuła jest układem
dynamicznym, to w poszczegól-nych chwilach występuje
pewne rozsunięcie środków ciężkości ładunków dodatnich i
ujemnych. Kierunki tych momentów są w każdej chwili
różne. Jednak w wyniku ich oddziaływania zmiany
kierunków oddziaływania mogą odbywać się w sposób
skoordy-nowany, co prowadzi do pojawienia się trwałej siły
przyciągania
.
66

Na ogół w kryształach występują wszystkie rodzaje
oddziały-wań, przy czym największa część energii
przypada
na
od-działywanie
orientacyjne
i
dyspersyjne.
Warto
również
zapa-miętać,
że
wymienione oddziaływania są oddziaływaniami
krótkiego zasięgu. Niewielka wartość tych sił
powoduje, że wiązania międzycząsteczkowe łatwo
ulegają zniszczeniu na skutek ruchów termicznych.
Na skutek tego kryształy cząste-czkowe (hel, azot,
wodór) topią się w niskich temperaturach i łatwo
parują. Słabe wiązania sprawiają także, że kryształy
molekularne są podatne na odkształcenia, a brak
swobo-dnych elektronów powoduje, że są one bardzo
złymi prze-wodnikami ciepła i prądu elektrycznego.
67

Wiązanie molekularne
Wiązania molekularne mają charakter wiązań
elektrostatycznych (siły van der Walsa) i
dzielimy na:
oddziaływanie trwałych lub indukowanych
momentów dipolowych cząsteczek
oddziaływania te są krótkiego zasięgu i łatwo
ni-szczone na skutek ruchów termicznych –
istotne w procesach biologicznych
kryształy molekularne są podatne na
odkształce-nia,
topią
się
w
niskich
temperaturach, źle prze-wodzą ciepło i prąd
argon, krypton,
naftalen
68

Proponowane tematy referatów
69
1. Wiązania chemiczne i ich wpływ na właściwości
materiałów.
2. Wybrane technologie stosowane w wytwarzaniu
elementów elektronicznych – dyfuzja, epitaksja,
fotolitografia.
3. Tranzystor unipolarny i polowy budowa, zasady
pracy.
4. Półprzewodnikowe elementy fotowoltaiczne.
5. Budowa lasera na ciele stałym – budowa i zasady
pracy.
6. Zastosowanie światła laserowego – omów kilka
wybranych zastosowań.
7. Zastosowanie techniki światłowodowej w
telekomunikacji.

Kolejne tematy
referatów
1. Wyświetlacze ciekłokrystaliczne: efekt TN,
problemy adresowania matrycowego,
budowa kolorowego wyświetlacza video.
2. Wyświetlacze plazmowe: budowa
kolorowego wyświetlacza plazmowego i
technika jego adreso-wania.
3. Wyświetlacze elektroluminescencyjne: EL,
OLED, PLED, LED – budowa, efekt fizyczny,
realizacja zobrazowania barwnego,
zastosowania, kierunki rozwoju.
4. Systemy projekcyjne: historia, współczesne
LCD, DLP, budowa, sposób realizacji
zobrazowania, kino cyfrowe.
5. Wyświetlacze na podłożach giętkich –
problemy budowy i kierunki rozwoju.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
Wyszukiwarka
Podobne podstrony:
Wykł 09L Ciało stałesiećkryst
02 Wykł 02 PODSTAWY KINEMATYKI
Wykł 02 Elementy szczególnej teorii względności
archi wykl 02 uklady logiczne
archi wykl 02
INF1 2012 Wykl 02 Zaoczne
Prawo budowlane wykł 22 02 13
02 rachunek różniczkowy pól wektorowych [feynmana wykl z fizyki tom2 1]fizyka] [www osiolek com] WYV
wykl 16.02.2010
pedagogika 23-02-2010 wykł słuch
02 geochemia pierwiastków i wiązań krystalochemia
02 Wiazania chemiczne I rzeduid Nieznany (2)
★ 02 IWONA NOWAKOWSKA KEMPNA, Język ciała czy ciało w umyśle, czyli o metaforyce uczuć
02 Materia, wiązania N
FIZA-2~1, Ciało stałe - Struktura kryształu o wiązaniu jonowym...
Prawo budowlane wykł 22 02 13
więcej podobnych podstron