KWASY
KWASY
KARBOKSYLOW
KARBOKSYLOW
E
E
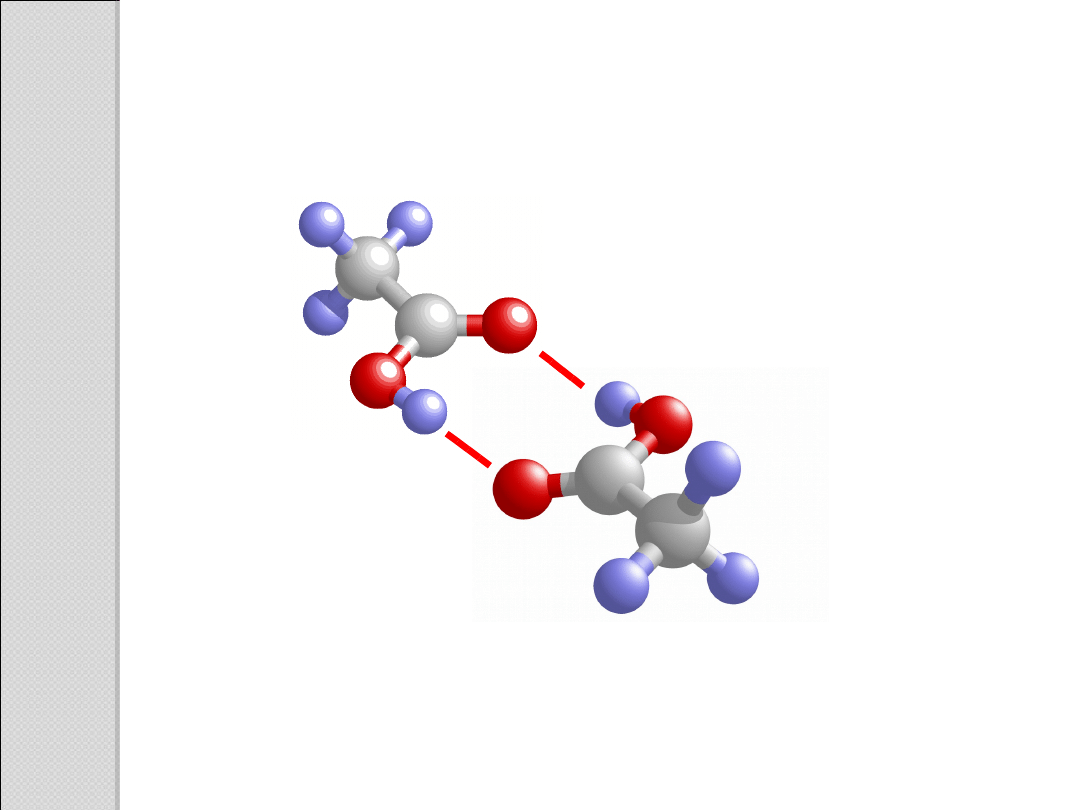
ASOCJACJ
A
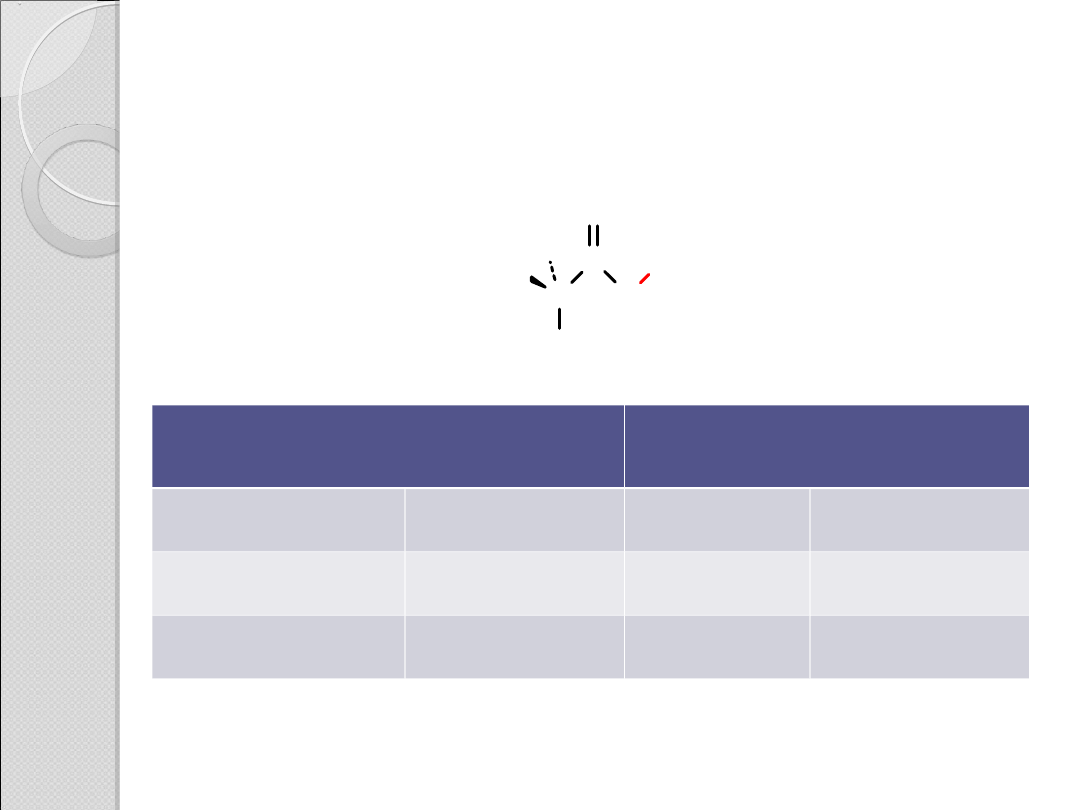
PARAMETRY STRUKTURALNE
CZĄSTECZKI KWASU OCTOWEGO
Kąt między wiązaniami
[stopnie]
Długość wiązania [Å]
C–C=O
119
C–C
1,52
C–C–OH
119
C=O
1,25
O=C–OH
122
C–OH
1,31
C
C
O
O
H
H
H
H
BUDOWA CZĄSTECZKI KWASU
METANOWEGO (MRÓWKOWEGO)
H
C
HO
O
π
σ
σ
––
σ
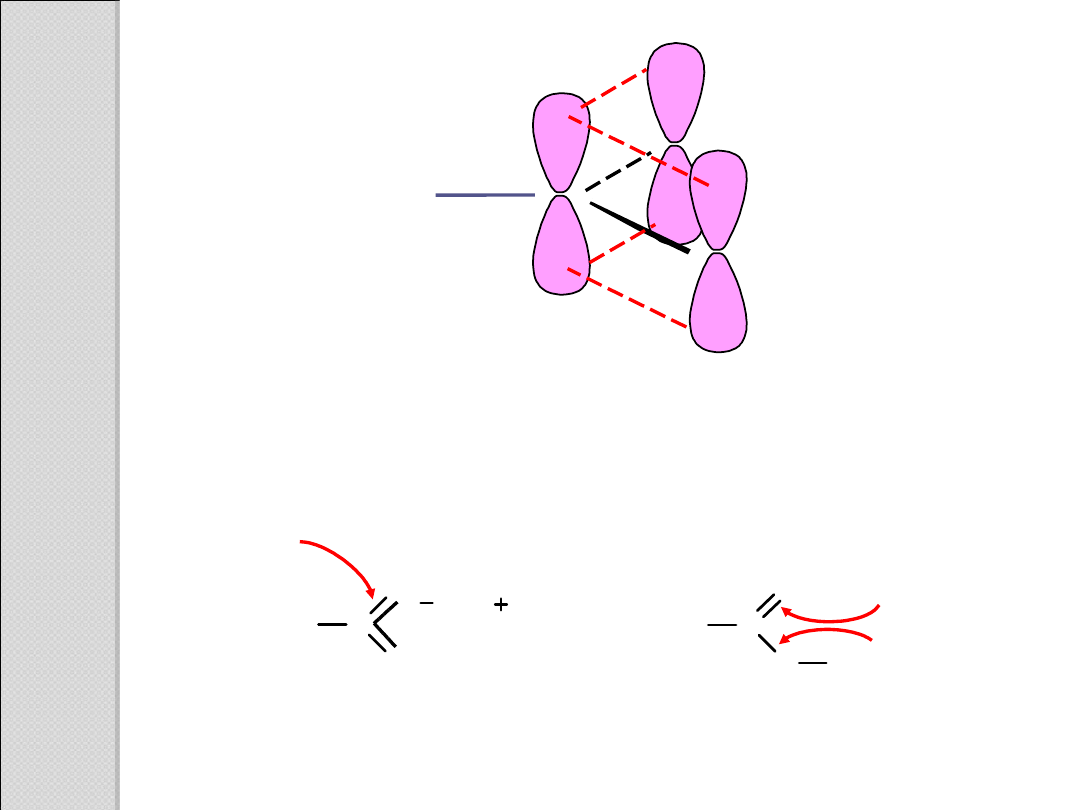
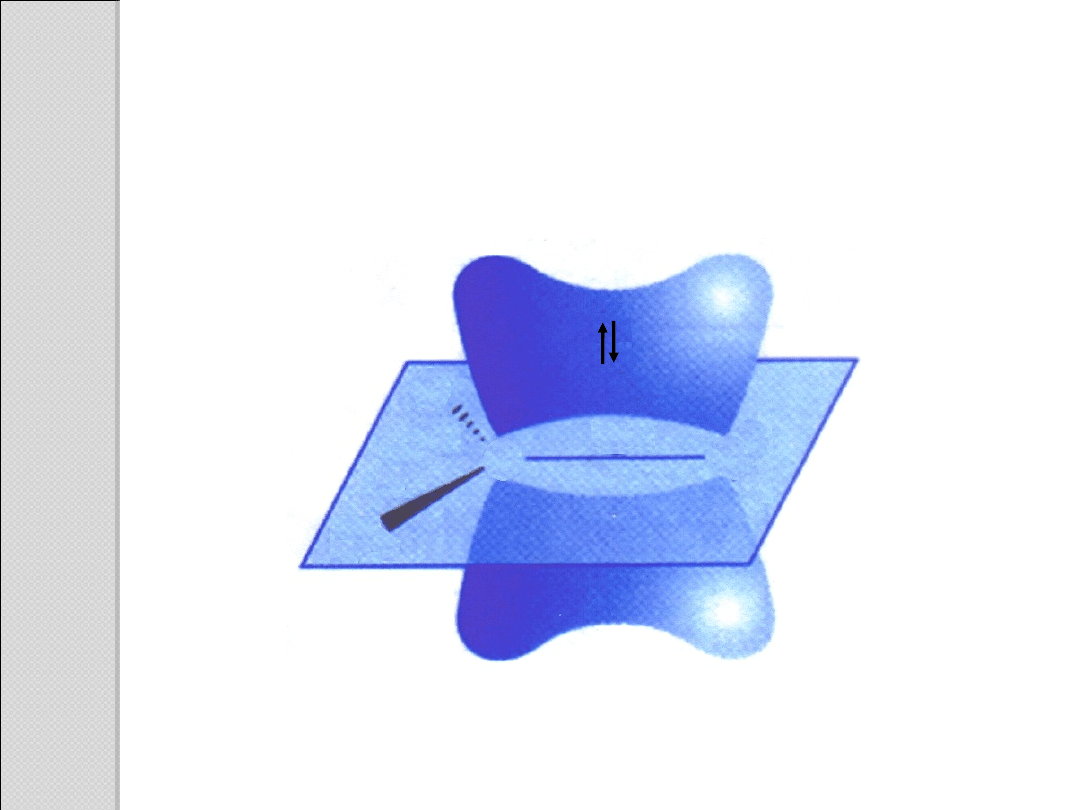
Schemat orbitali anionu octanowego, ukazujący równocenność
dwóch atomów tlenu
H C
O H
O
1,20
Å
1,34
Å
H C
O
O
Na
1,27
Å
kwas mrówkowy
mrówczan sodu
C
O
O
H
3
C
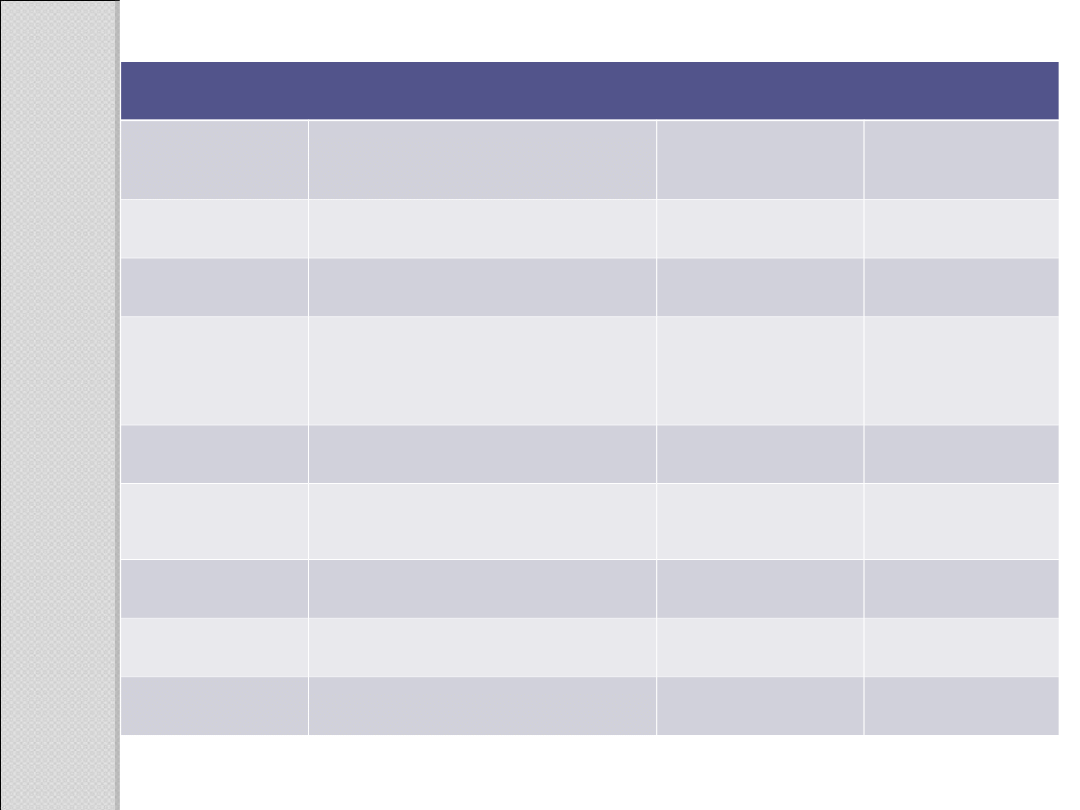
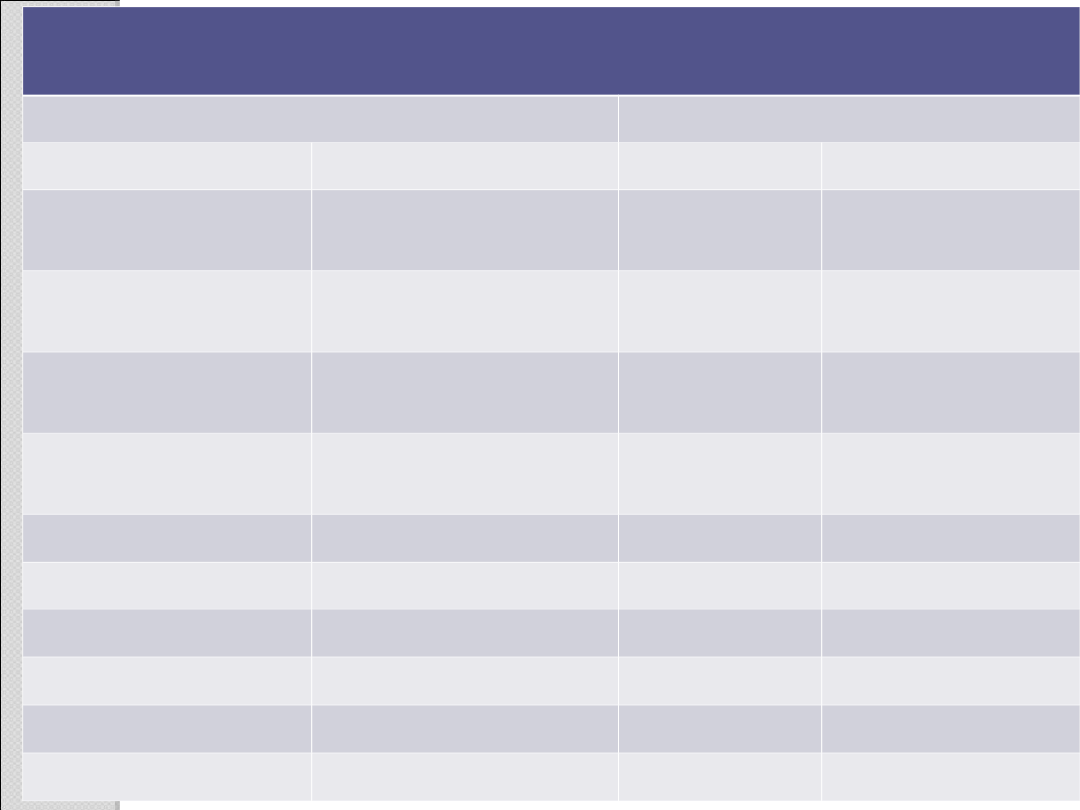
Stałe fizyczne niektórych kwasów karboksylowych
Nazwa
Struktura
Temperatura
topnienia [
o
C]
Temperatura
wrzenia [
o
C]
Mrówkowy
HCOOH
8,4
100,7
Octowy
CH
3
COOH
16,6
117,9
Propionowy
(propanowy
)
CH
3
CH
2
COOH
–20,8
141
Propenowy
H
2
C=CHCOOH
13
141,6
Benzoesow
y
C
6
H
5
COOH
122,1
249
Szczawiowy (COOH)
2
189,5
rozkład
Malonowy
CH
2
(COOH)
2
135,6
rozkład
Maleinowy
(Z)–HOOCCH=CHCOOH
139
rozkład
Wiązania wodorowe w kwasach karboksylowych:
a)pomiędzy dwiema cząsteczkami kwasu
b)pomiędzy cząsteczkami kwasu i wody
R C
O
O H
C R
O
O
H
a)
R C
O
O H
O H
H
O H
H
b)
NAZEWNICTWO SYSTEMATYCZNE
KWASÓW KARBOKSYLOWYCH
CH
3
CH
2
C
O
OH
kwas propanowy
CH
3
CHCH
2
CH
2
C
CH
3
O
OH
1
2
3
4
5
kwas 4–metylopentanowy
kwas 4–etylo–6–metylooktanodiowy
CCH
2
CHCH
2
CH
2
CHCH
2
C
O
OH
HO
O
CH
2
CH
3
CH
3
1 2
3
4
5
6
7
8
Br
COOH
1
2
3
4
5
6
kwas
3–bromocykloheksanokarboksylowy
COOH
1
2
3
4
5
kwas
1–cyklopentenokarboksylowy
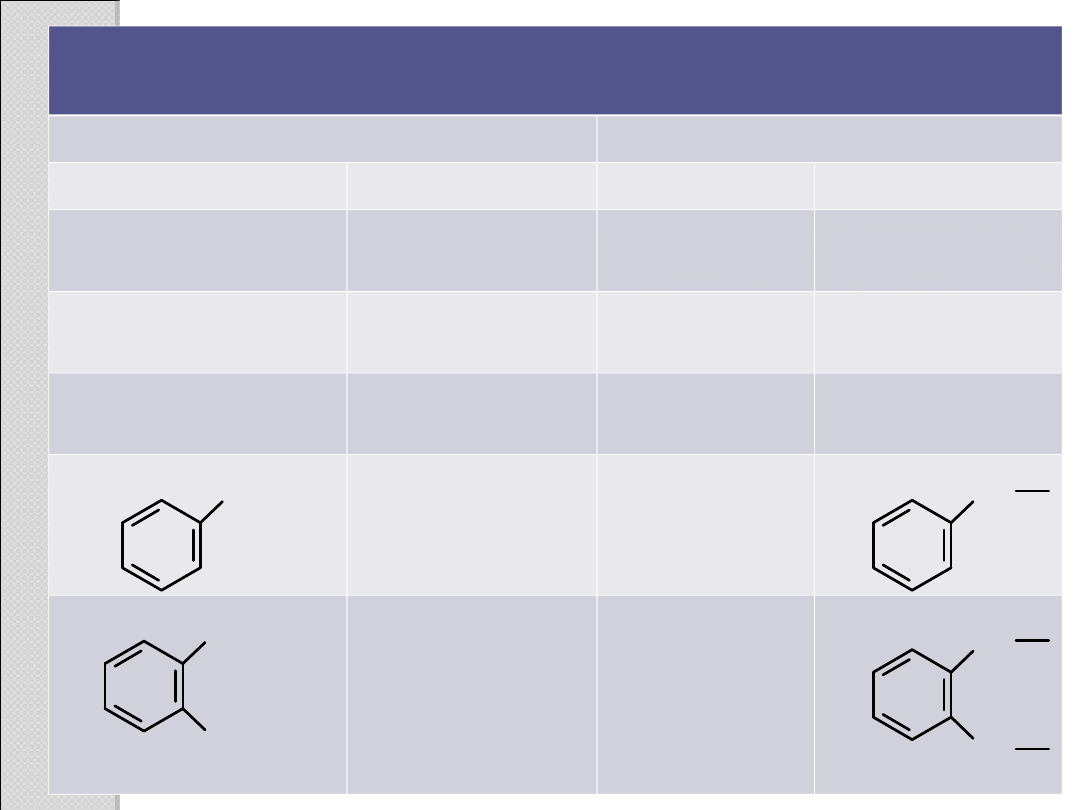
Zwyczajowe i systematyczne nazwy niektórych kwasów
karboksylowych i grup acylowych
Kwas karboksylowy
Grupa acylowa
Struktura
Nazwa
Nazwa
Struktura
HCOOH
mrówkowy
(metanowy)
formyl–
(metanoil–)
HCO–
CH
3
COOH
octowy (etanowy)
acetyl–
(etanoil–)
CH
3
CO–
CH
3
CH
2
COOH
propionowy
(propanowy)
propionyl–
(propanoil–)
CH
3
CH
2
CO–
CH
3
CH
2
CH
2
COOH
masłowy (butanowy) butyryl–
(butanoil–)
CH
3
CH
2
CH
2
CO–
(CH
3
)
3
CCOOH
piwalinowy
piwaloil–
(CH
3
)
3
CCO–
HOOCCOOH
szczawiowy
oksalil–
–OCCO–
HOOCCH
2
COOH
malonowy
malonyl–
–OCCH
2
CO–
HOOC(CH
2
)
2
COOH
bursztynowy
sukcynyl–
–OC(CH
2
)
2
CO–
HOOC(CH
2
)
3
COOH
glutarowy
glutaryl–
–OC(CH
2
)
3
CO–
HOOC(CH
2
)
4
COOH
adypinowy
adypil–
–OC(CH
2
)
4
CO–
Zwyczajowe i systematyczne nazwy niektórych kwasów
karboksylowych i grup acylowych
Kwas karboksylowy
Grupa acylowa
Struktura
Nazwa
Nazwa
Struktura
H
2
C=CHCOOH
akrylowy
akryloil–
H
2
C=CHCO–
H
2
C=C(CH
3
)COOH
metakrylowy
metakryloil–
H
2
C=C(CH
3
)CO–
HOOCCH=CHCOOH
cis-maleinowy
trans-fumarowy
maleoil–
fumaroil–
–OCCH=CHCO–
benzoesowy
benzoil–
ftalowy
ftalol–
COOH
COOH
COOH
CO
CO
CO

PODSTAWOWE REGUŁY NAZEWNICTWA
POCHODNYCH KWASÓW
KARBOKSYLOWYCH
Grupa funkcyjna
Struktura
Końcówka nazwy
Kwas karboksylowy
kwas...–owy
(kwas...–
karboksylowy)
Halogenek
kwasowy
halogenek...–ilu
(ylu)
Bezwodnik
kwasowy
bezwodnik
Amid
...–amid
(...–karboamid)
Ester
...–an
(karboksylan)
R
C
OH
O
R
C
X
O
R
C
O
O
C
R
O
R
C
NH
2
O
R
C
OR'
O
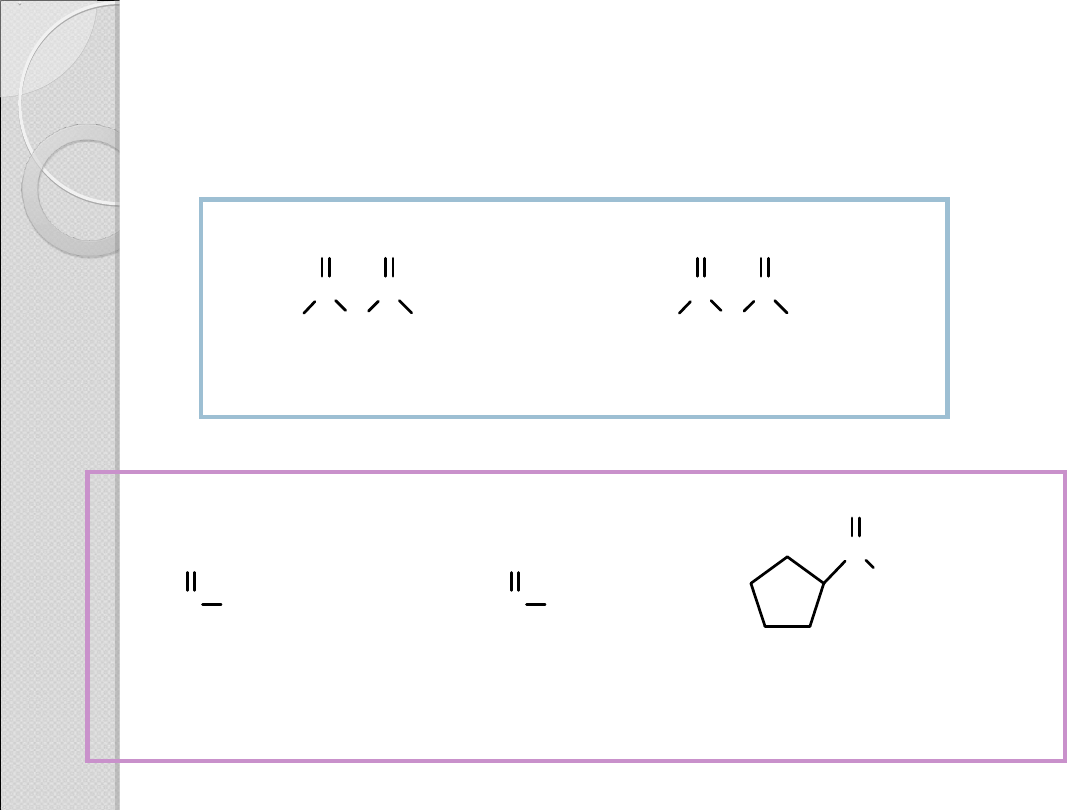
NAZEWNICTWO POCHODNYCH
KWASÓW KARBOKSYLOWYCH
H
3
C
C
O
O
C
CH
3
O
ClH
2
C
C
O
O
C
CH
2
Cl
O
bezwodnik octowy
bezwodnik
bis(chlorooctowy)
CH
3
C
O
NH
2
CH
3
(CH
2
)
4
C
O
NH
2
C
O
NH
2
acetamid
(z kwasu
octowego)
heksanoamid
(z kwasu
heksanowego)
cyklopentanokarboksyamid
(z kwasu
cyklopentanokarboksylowego)
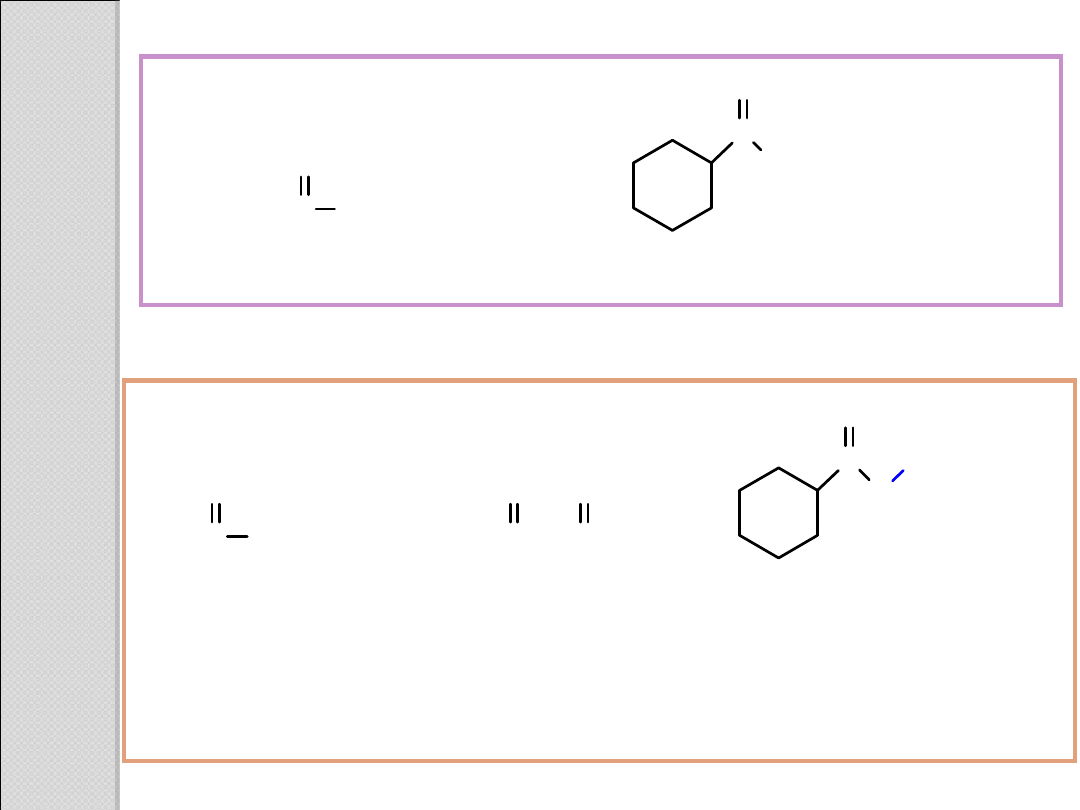
CH
3
CH
2
C
O
NHCH
3
C
O
N(CH
2
CH
3
)
2
N–
metylo
propanoamid
N,N–
dietylo
cykloheksanokarboksyamid
CH
3
C
O
OCH
2
CH
3
CH
3
O
CCH
2
C
OCH
3
O
O
C
O
O
C(CH
3
)
3
octan
etylu
(ester etylowy
kwasu
octowego)
malonian
dimetylu
(ester dimetylowy
kwasu
malonowego)
cykloheksanokarboksylan
tert–butylu
(ester tert-butylowy
kwasu cykloheksano-
karboksylowego)
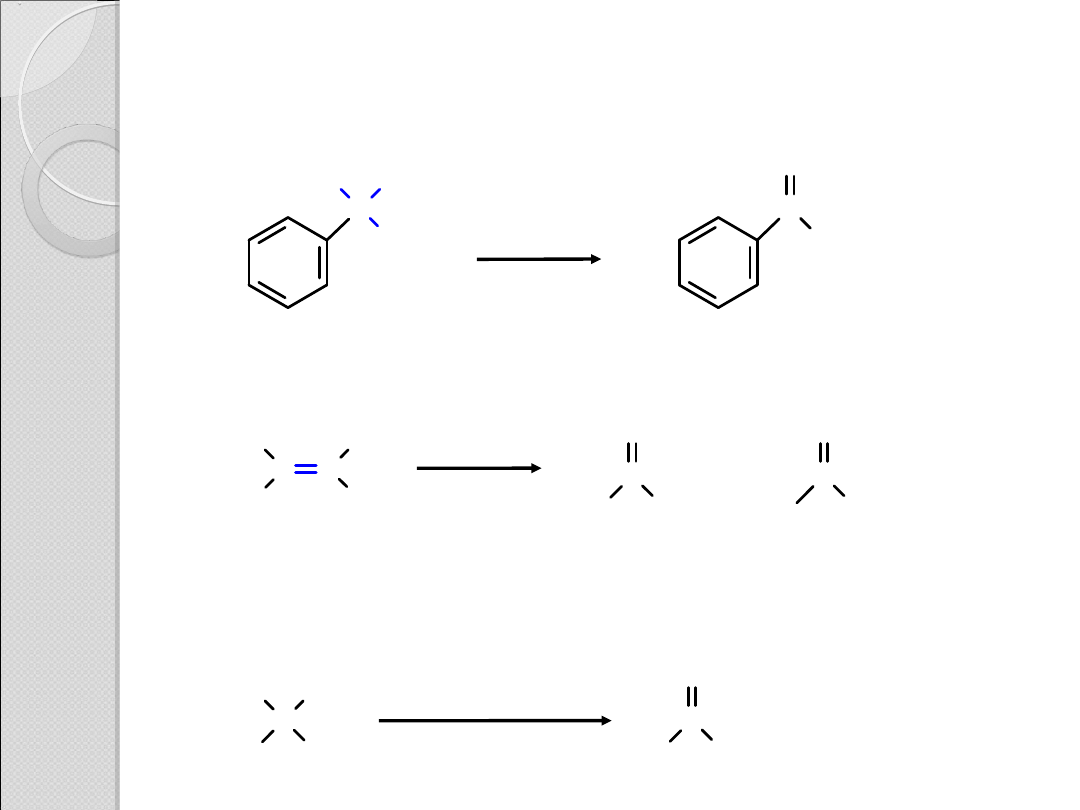
OTRZYMYWANIE KWASÓW
KARBOKSYLOWYCH
Utlenianie alkilobenzenów
Utleniające rozszczepienie wiązania C=C w alkenach
C
H
R
R
C
O
OH
KMnO
4
H
2
O, Δ
KMnO
4
H
3
O
+
C C
H
H
R
R'
C
R
O
OH
C
R'
O
OH
+
Utlenianie alkoholi pierwszorzędowych
C
R
O
OH
C
R
H
H
OH
odczynnik Jonesa
(CrO
3
,H
3
O
+
)
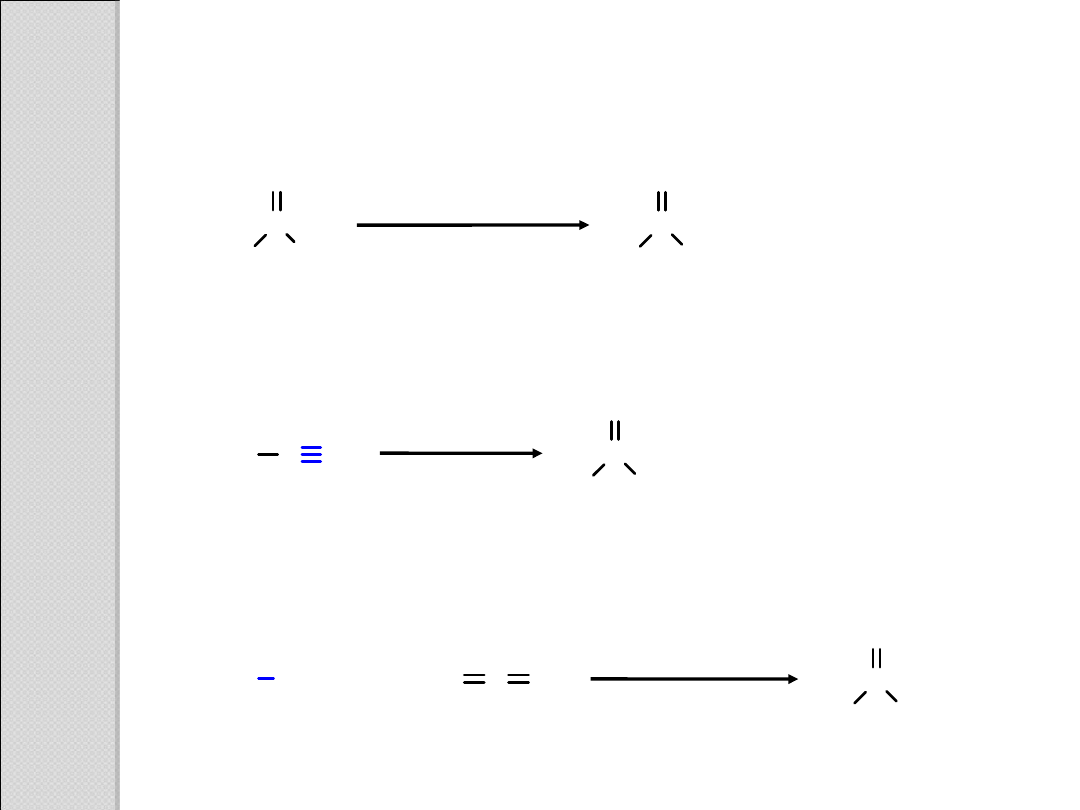
Utlenianie aldehydów
Hydroliza nitryli
Karboksylowanie związków Grignarda
C
R
O
OH
odczynnik Jonesa
lub Ag
+
, NH
4
OH
C
R
O
H
H
3
O
+
NaOH, H
2
O
C
R
O
OH
R
C N
mieszanie
następnie
H
3
O
+
C
R
O
OH
R MgX
+
O
C
O
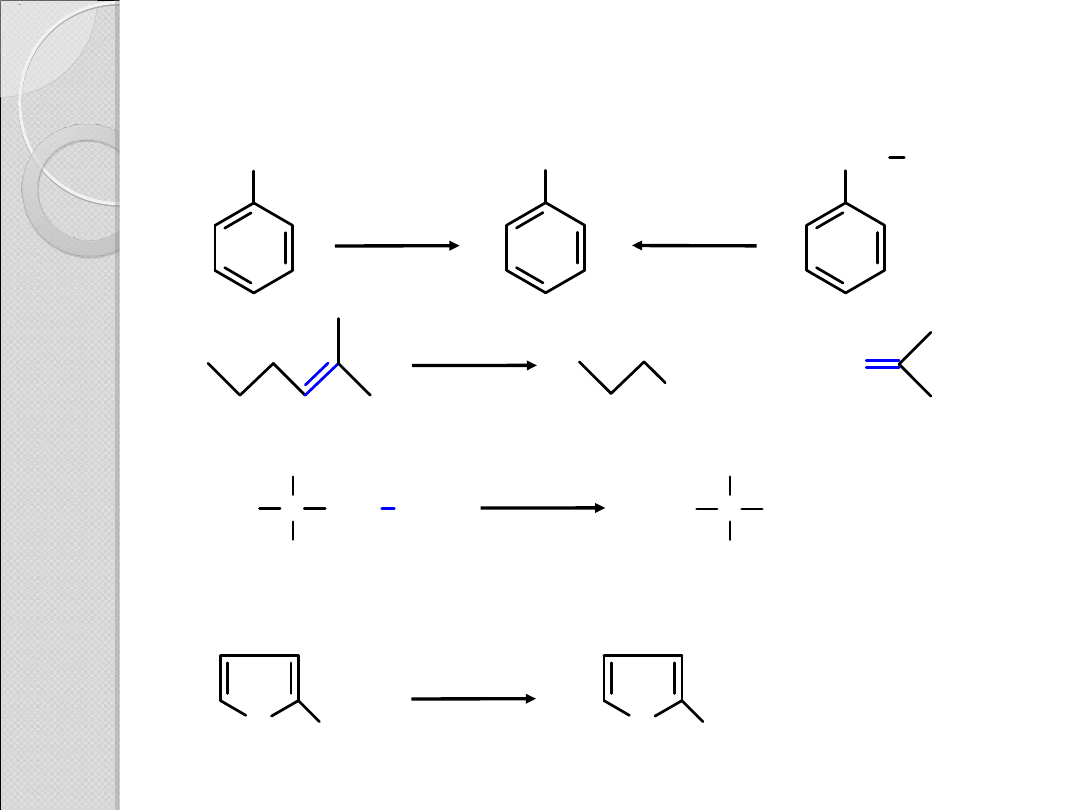
PRZYKŁADY REAKCJI SYNTEZY
KWASÓW KARBOKSYLOWYCH
COOH
CH
3
CH
2
CH
3
KMnO
4
H
+
KMnO
4
H
+
KMnO
4
/H
+
Δ
COOH
O
+
H
3
C C
CH
3
CH
3
CH
2
OH
H
3
C C
CH
3
CH
3
COOH
K
2
Cr
2
O
7
H
2
SO
4
alkohol
kwas karboksylowy
K
2
Cr
2
O
7
H
2
SO
4
O
CHO
O
COOH
kwas karboksylowy
aldehyd
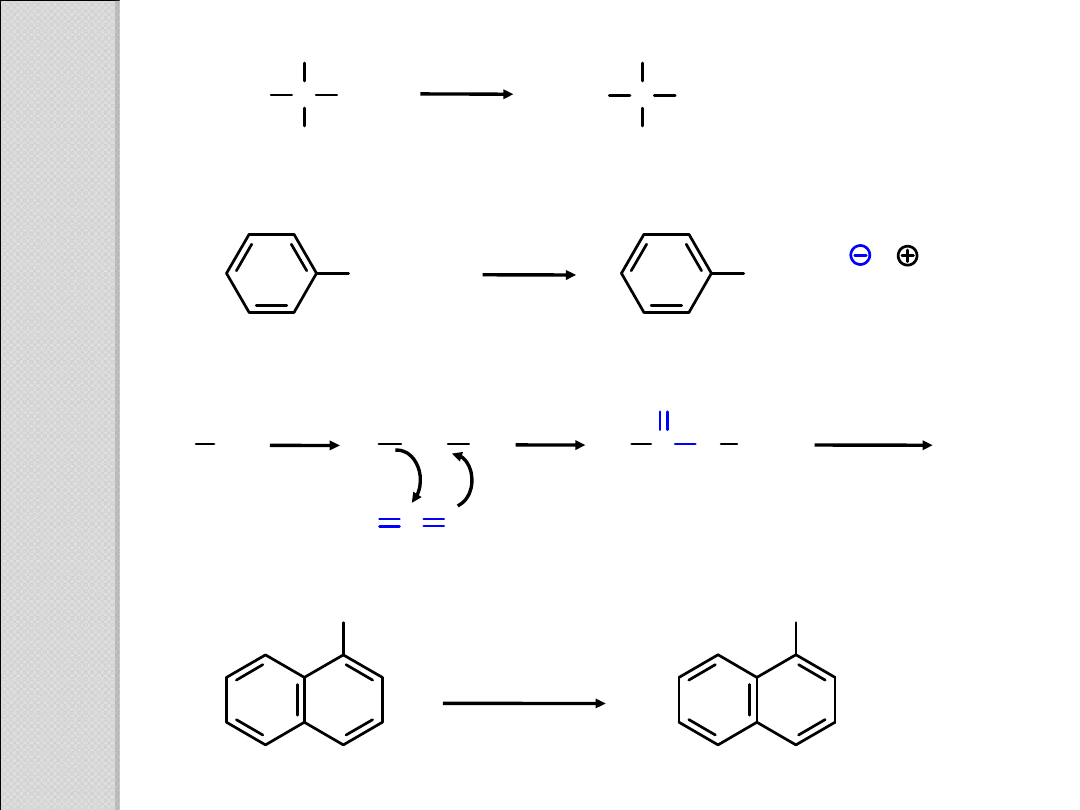
H
3
C C
CH
3
CH
3
CN
H
3
C C
CH
3
CH
3
COOH
H
2
O
H
+
nitryl
kwas
H
2
O
NaO
H
CH
2
CN
nitryl
CH
2
COO
Na
sól kwasu
R X
R Mg X
R
C
O
O
MgX
R
COOH
Mg
H
2
O/H
+
O C O
δ+
δ+
δ–
δ–
δ–
MgBr
COOH
1. CO
2
2.
H
2
O/H
+
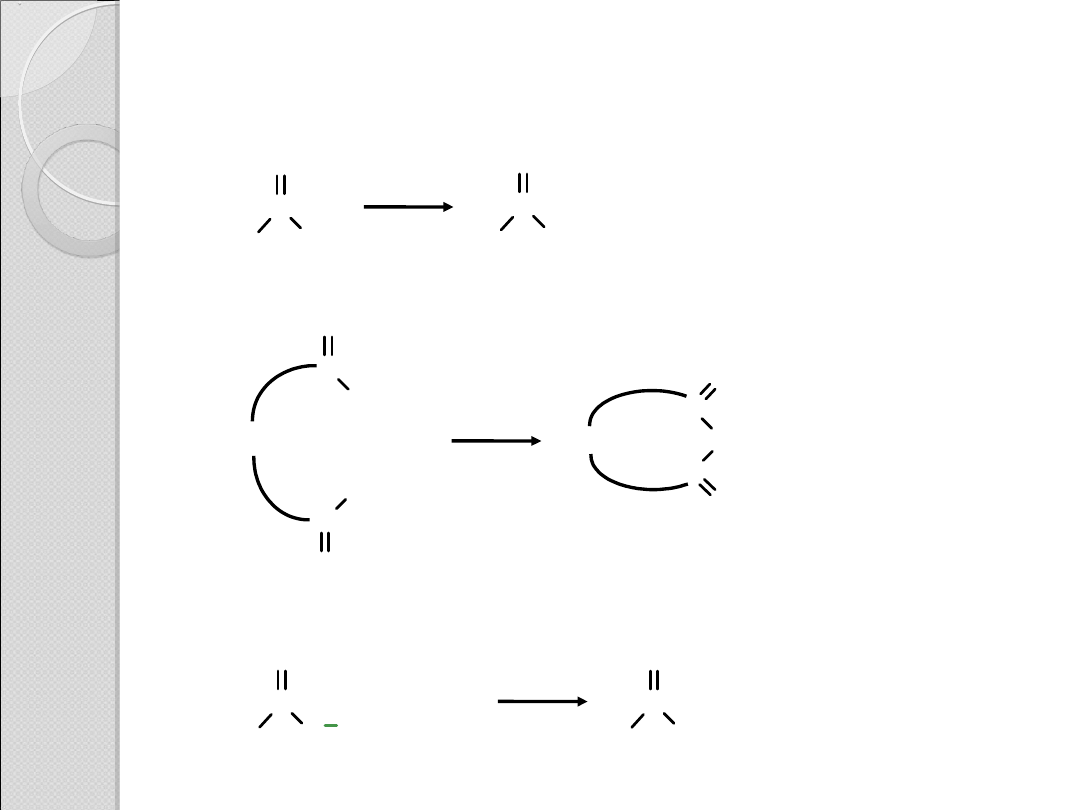
REAKCJE KWASÓW KARBOKSYLOWYCH
Przekształcenie w chlorki kwasowe
Przekształcenie w cykliczne bezwodniki kwasowe
R
C
O
OH
R
C
O
Cl
SOCl
2
CHCl
3
+
+
SO
2
H
Cl
Przekształcenie w estry
200
o
C
(CH
2
)n
C
O
OH
C
O
OH
(CH
2
)n
C
O
O
C
O
+
H
2
O
gdzie n = 2 lub 3
R
C
O
O
+
R'X
reakc
ja
S
N
2
R
C
O
O
R'
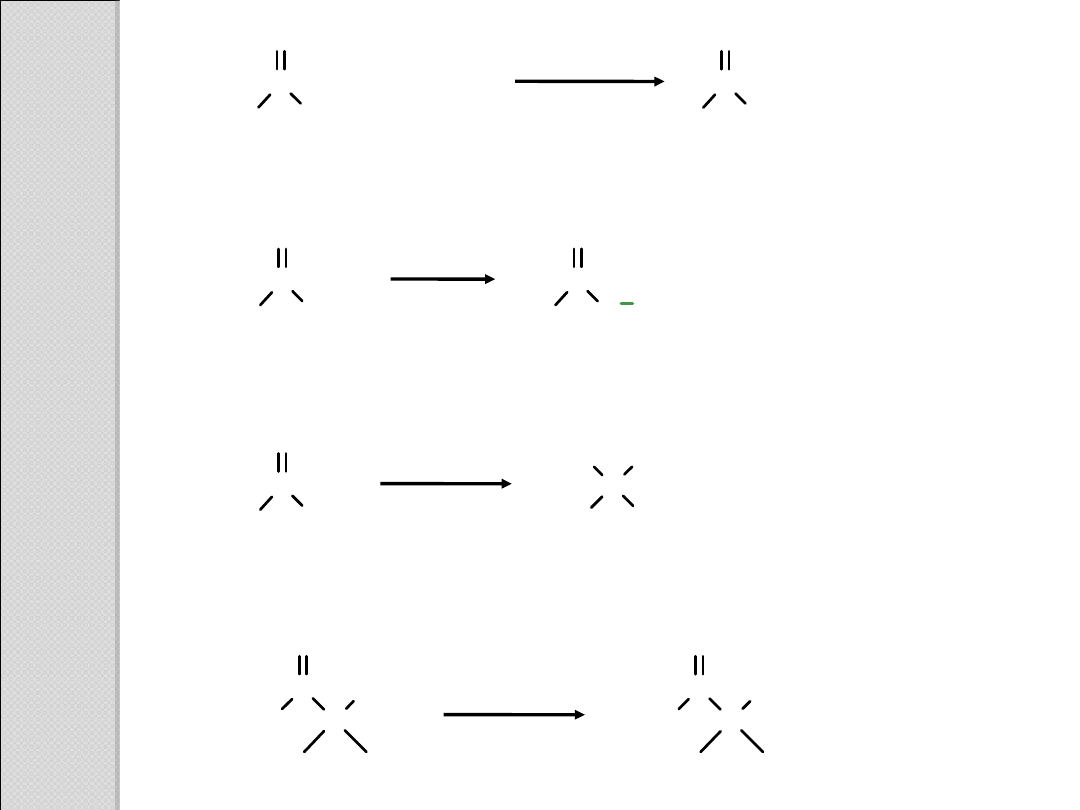
R
C
O
OH
+
R'OH
katalizato
r
kwasowy
R
C
O
OR'
+
H
2
O
Dysocjacja (deprotonowanie)
R
C
O
O
R
C
O
OH
zasada
Redukcja do alkoholi pierwszorzędowych
R
C
O
OH
C
R
H
H
O
H
1.
LiAlH
4
2.
H
3
O
+
Bromowanie kwasów metodą Hella–Volharda–
Zielińskiego
C
O
HO
C
H
C
O
HO
C
Br
1
. Br
2
,
PBr
3
2.
H
2
O
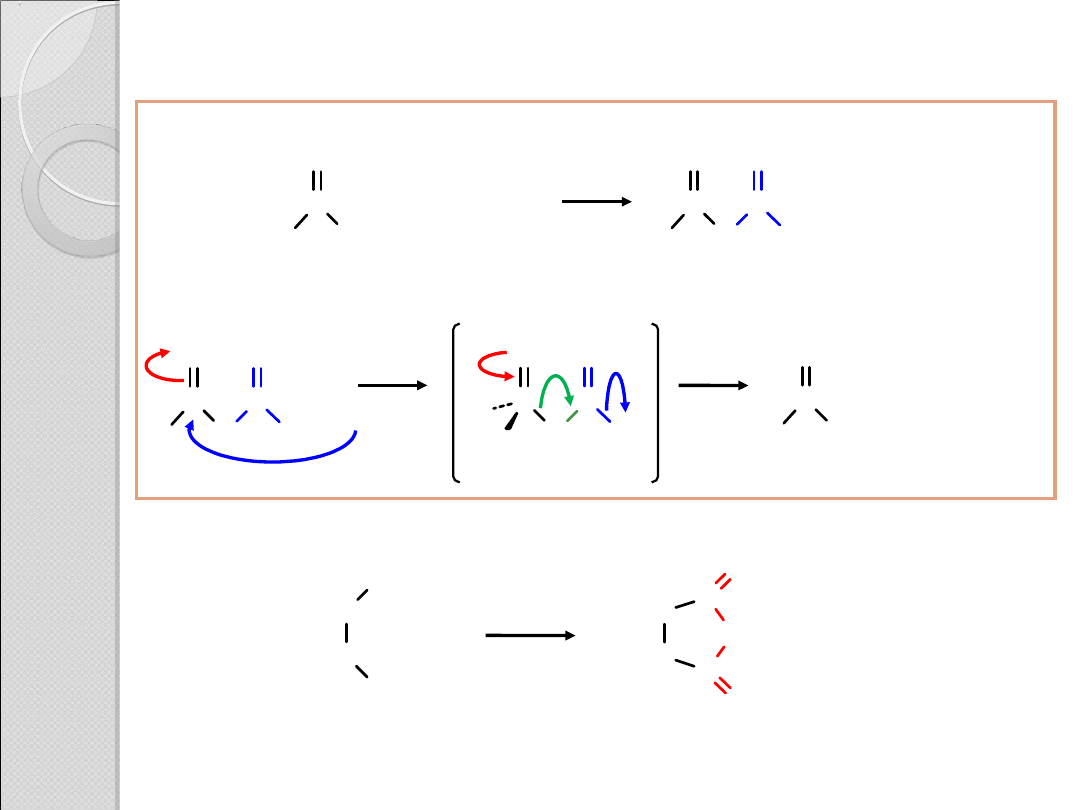
PRZYKŁADY REAKCJI KWASÓW
KARBOKSYLOWYCH
H
2
C
H
2
C
COOH
COOH
H
2
C
H
2
C
C
O
C
O
O
200
o
C
+
H
2
O
kwas bursztynowy
bezwodnik bursztynowy
R
C
O
OH
SOCl
2
+
H
Cl
R
C
O
O
S
O
Cl
+
kwas karboksylowy
chlorosiarczyn
R
C
O
O
S
O
Cl
.
. .
.
.
.
.
.
Cl
.
.
.
.
–
C
O
O
S
O
Cl
Cl
R
.
.
.
. .
.
–
+
SO
2
R
C
O
Cl
+
Cl
–
chlorek kwasowy
CH
3
CH
2
CH
2
CO Na
O
.
.
.
.
.
.
CH
3
I
+
reakc
ja
S
N
2
CH
3
CH
2
CH
2
CO
CH
3
O
+
Na
I
butanian (maślan)
sodu
butanian (maślan)
metylu, ester (97%)
C
O
R
O H
.
. .
.
.
..
.
R MgBr
.
.
+
H R
C
O
R
O MgBr
.
.
.
.
.
. .
..
.
Reakcja kwas – zasada między odczynnikiem
Grignarda a kwasem karboksylowym
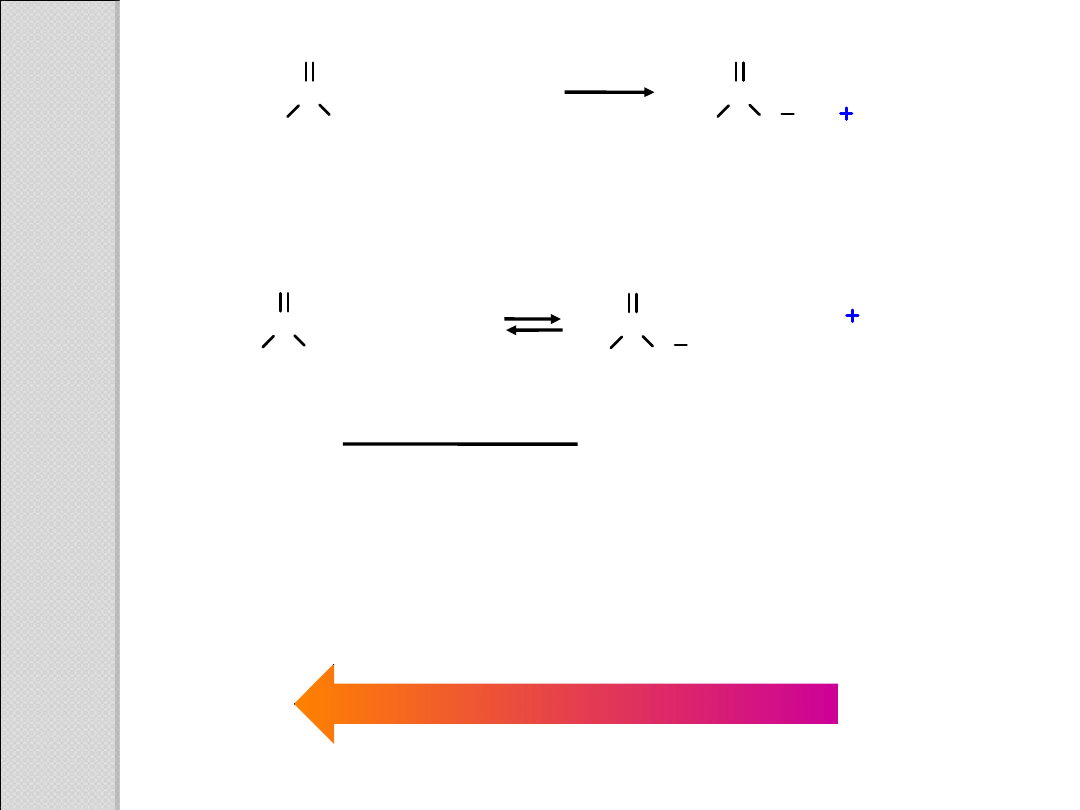
C
O
R
O
H
NaOH
C
O
R
O
Na
H
2
O
+
+
H
2
O
kwas karboksylowy
(nierozpuszczalny w
wodzie)
sól kwasu
karboksylowego
(rozpuszczalna w
wodzie)
C
O
R
O
H
+
H
2
O
C
O
R
O
+
H
3
O
[RCOO
–
]
[H
3
O
+
]
[RCOOH]
K
a
=
i pK
a
= – log K
a
pK
a
= – 7
pK
a
= 4,75
pK
a
=
16
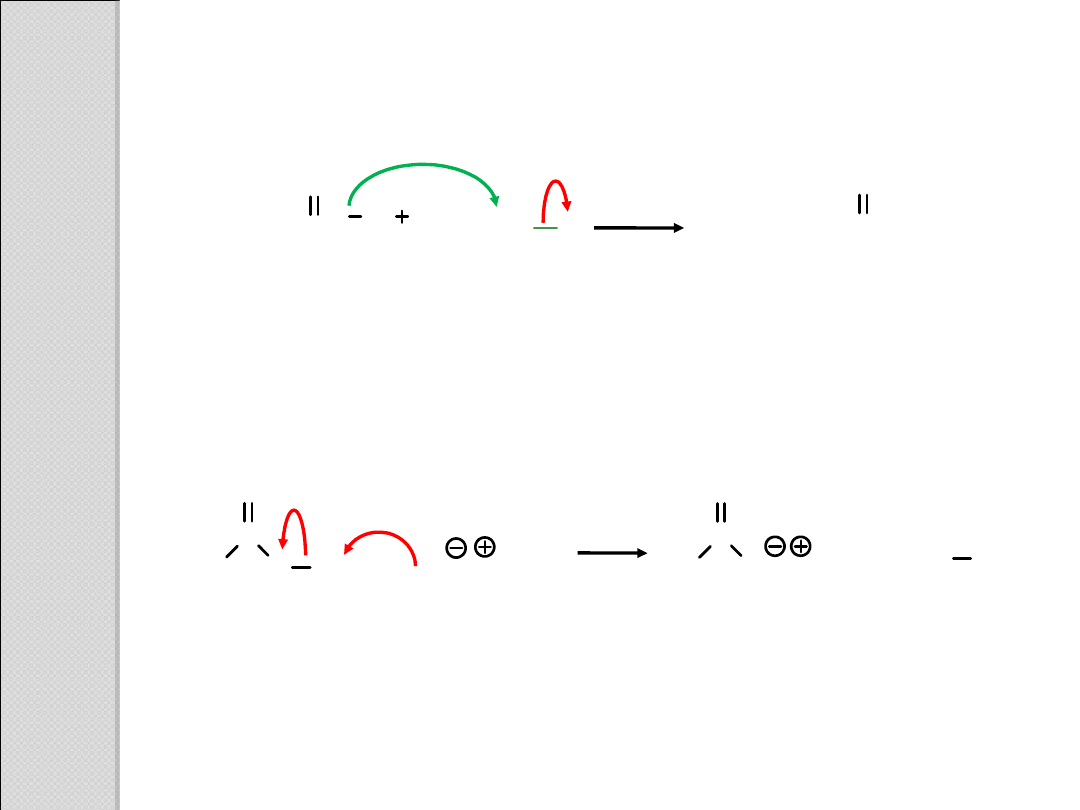
H
Cl
CH
3
COO
H
CH
3
CH
2
O
H
kwasowość
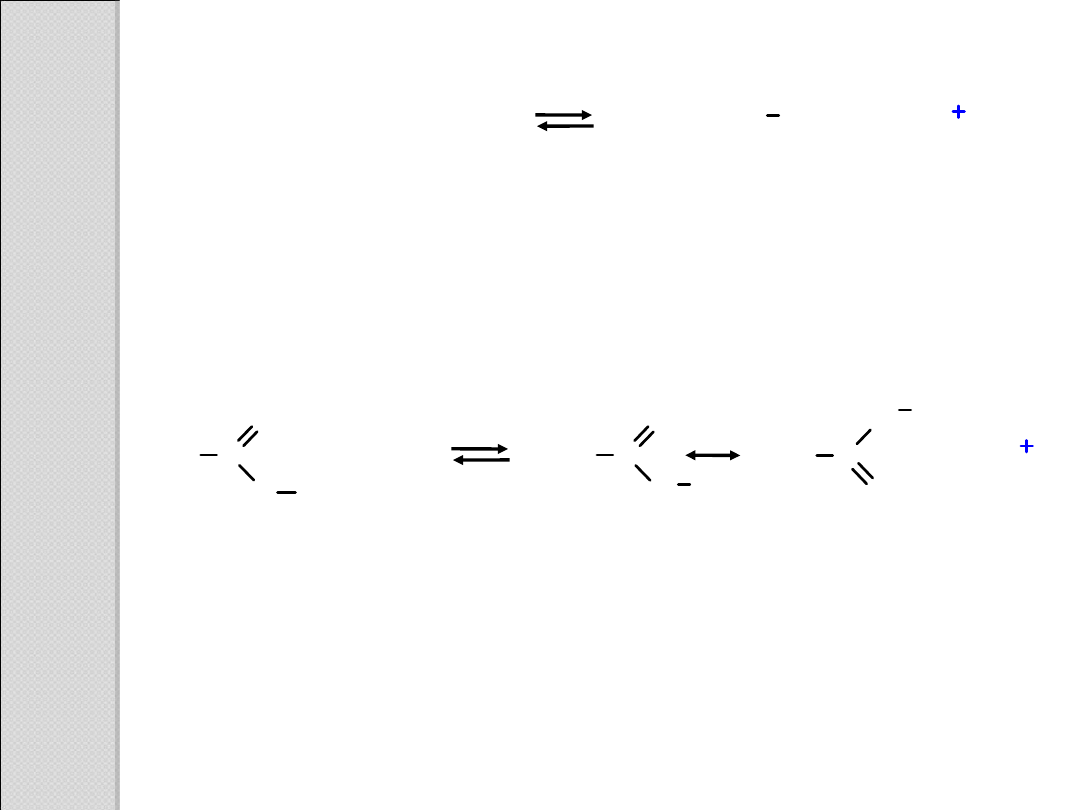
niestabilizowany
jon alkoksylowy
alkohol
H
2
O
+
H
3
O
+
CH
3
CH
2
O
H
.
..
.
CH
3
CH
2
O
.
. .
..
.
H
2
O
H
3
O
+
+
CH
3
C
O
O
H
.
..
.
.
.
.
.
CH
3
C
O
O
.
..
.
.
.
.
.
.
.
CH
3
C
O
O
.
.
.
.
.
.
.
.
.
.
kwas
karboksylowy
jon karboksylanowy stabilizowany
rezonansowo
(dwie równoważne struktury
rezonansowe)
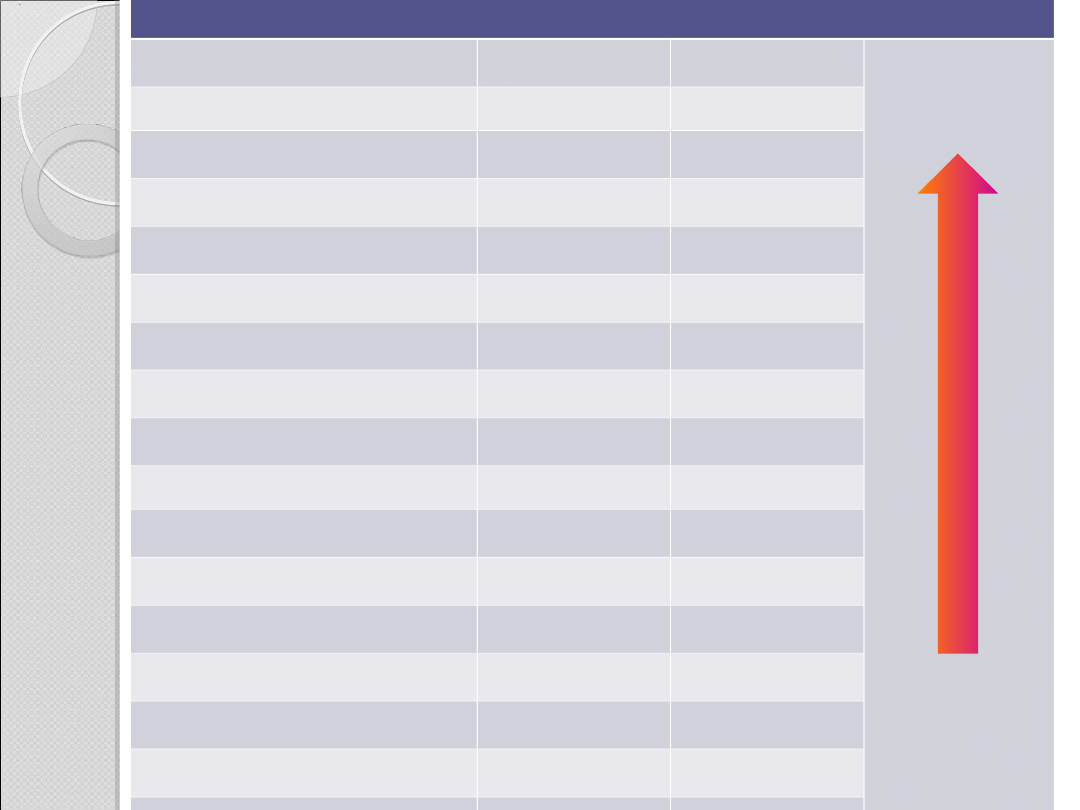
Kwasowość niektórych kwasów karboksylowych
Struktura
K
a
pK
a
mocniejszy
kwas
słabszy
kwas
H
Cl (kwas solny)
a
(10
7
)
(–7)
CF
3
COO
H
0,59
0,23
CCl
3
COO
H
0,23
0,64
CHCl
2
COO
H
3,3 · 10
–2
1,48
CH
2
FCOO
H
2,6 · 10
–3
2,59
CH
2
ClCOO
H
1,4 · 10
–3
2,85
CH
2
BrCOO
H
2,1 · 10
–3
2,68
CH
2
ICOO
H
7,5 · 10
–4
3,12
HCOO
H
1,77 · 10
–4
3,75
HOCH
2
COO
H
1,5 · 10
–4
3,83
C
6
H
5
COO
H
6,46 · 10
–5
4,19
H
2
C=CHCOO
H
5,6 · 10
–5
4,25
C
6
H
5
CH
2
COO
H
5,2 · 10
–5
4,28
CH
3
COO
H
1,76 · 10
–5
4,75
CH
3
CH
2
COO
H
1,34 · 10
–5
4,87
CH
3
CH
2
O
H
(etanol)
a
(10
–16
)
(16)
a
wartości dla etanolu i kwasu solnego podano dla porównania
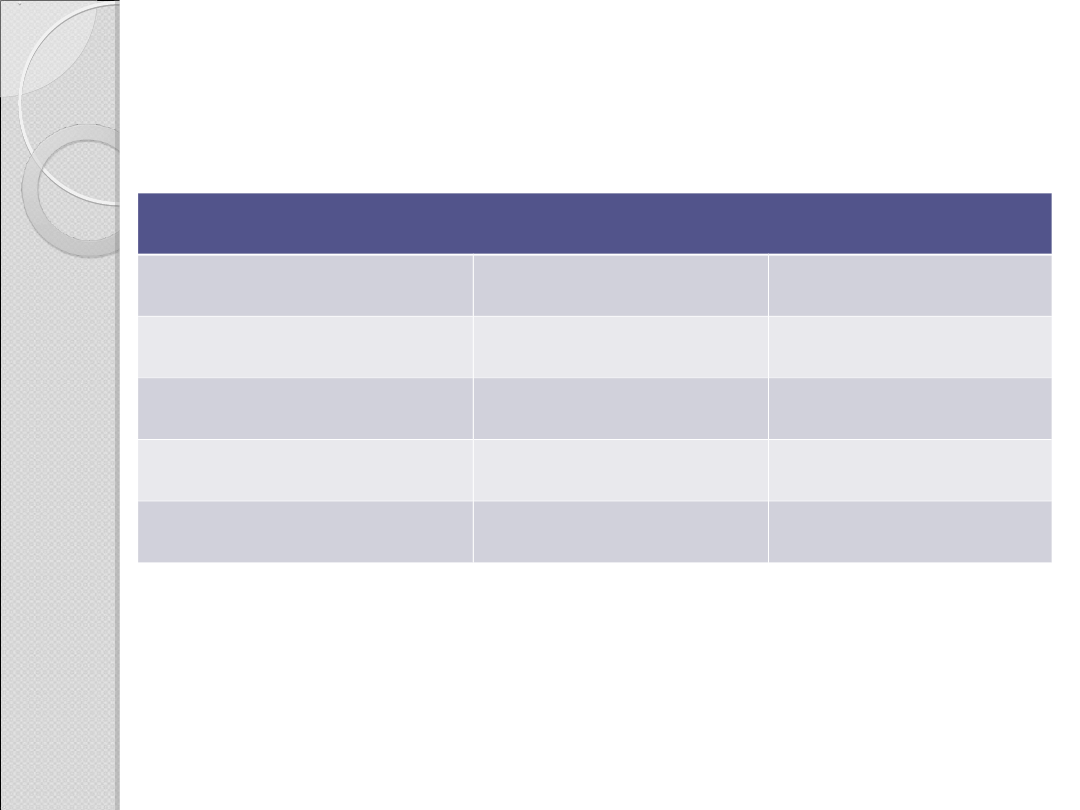
Kwasowość chloropodstawionych kwasów butanowych
Struktura
K
a
pK
a
CH
3
CH
2
CH
Cl
COO
H
1,39 · 10
–3
2,86
CH
3
CH
Cl
CH
2
COO
H
8,9 · 10
–5
4,05
Cl
CH
2
CH
2
CH
2
COO
H
3,0 · 10
–5
4,52
CH
3
CH
2
CH
2
COO
H
1,5 · 10
–5
4,82
C
O
O
H
CH
3
O
C
O
O
H
C
O
O
H
O
2
N
kwas p–
metoksybenzoesowy
(pK
a
= 4,46)
kwas
benzoesowy
(pK
a
= 4,19)
kwas p–
nitrobenzoesowy
(pK
a
=3,41)
słabszy
kwas
mocniejszy
kwas
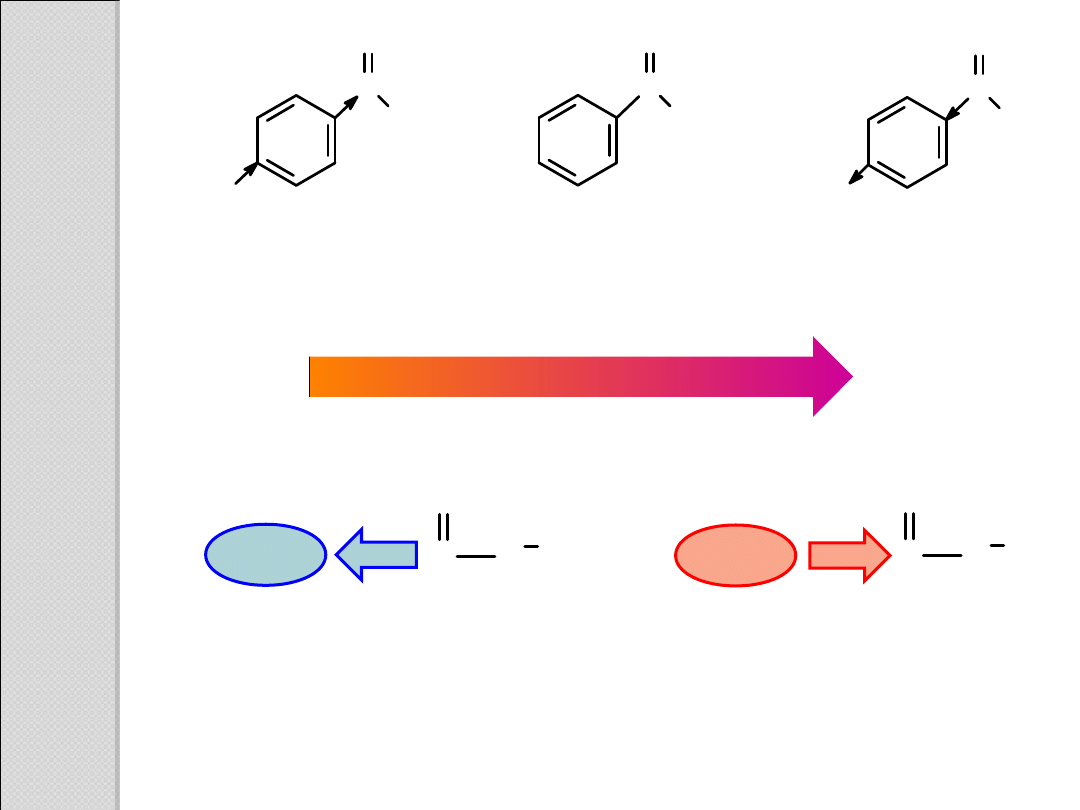
C
O
O
GW
E
C
O
O
GDE
grupa dostarczająca
elektrony
destabilizuje karboksylan
i zmniejsza moc kwasu
grupa wyciągająca
elektrony
stabilizuje karboksylan
i zwiększa moc kwasu

POCHODNE
POCHODNE
KWASÓW
KWASÓW
KARBOKSYLOWYC
KARBOKSYLOWYC
H
H
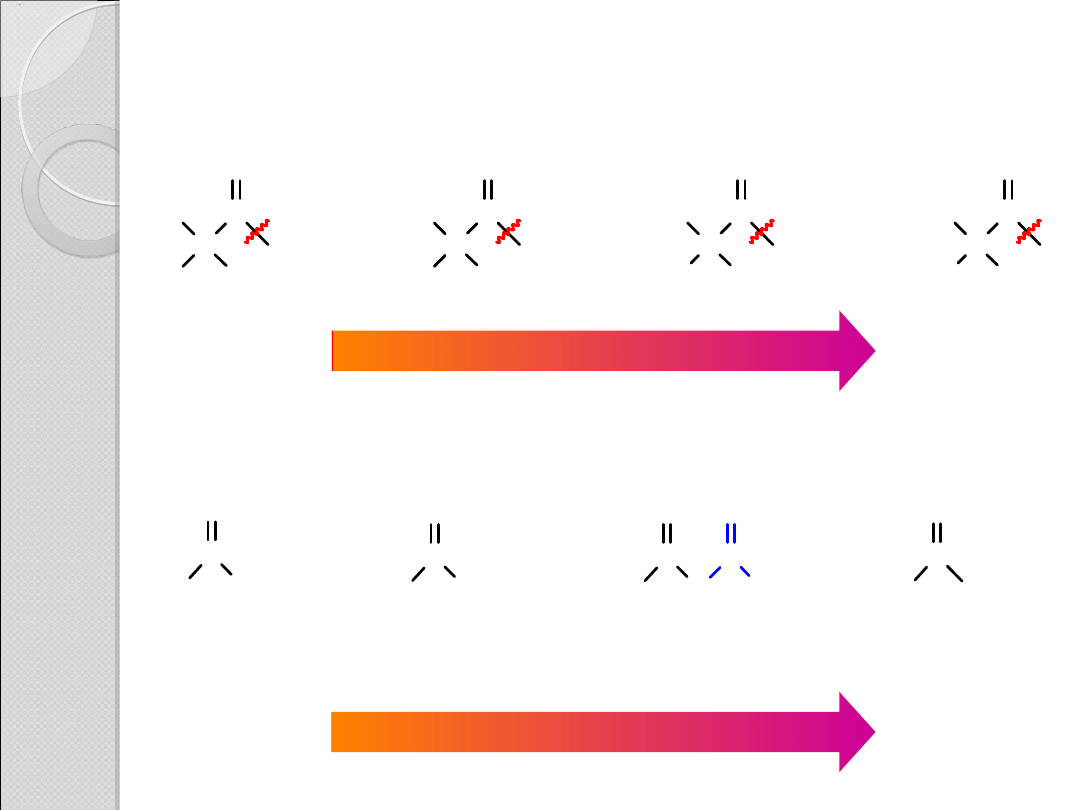
REAKTYWNOŚĆ POCHODNYCH
KWASÓW KARBOKSYLOWYCH
C
C
O
R
R
R
C
C
O
R
H
R
C
C
O
H
H
R
C
C
O
H
H
H
<
<
<
reaktywność
mniej
reaktywn
y
bardziej
reaktywn
y
reaktywność
mniej
reaktywny
bardziej
reaktywn
y
R
C
NH
2
O
R
C
OR'
O
R
C
Cl
O
R
C
O
O
C
R
O
amid
ester
bezwodnik
kwasowy
chlorek
kwasowy
<
<
<
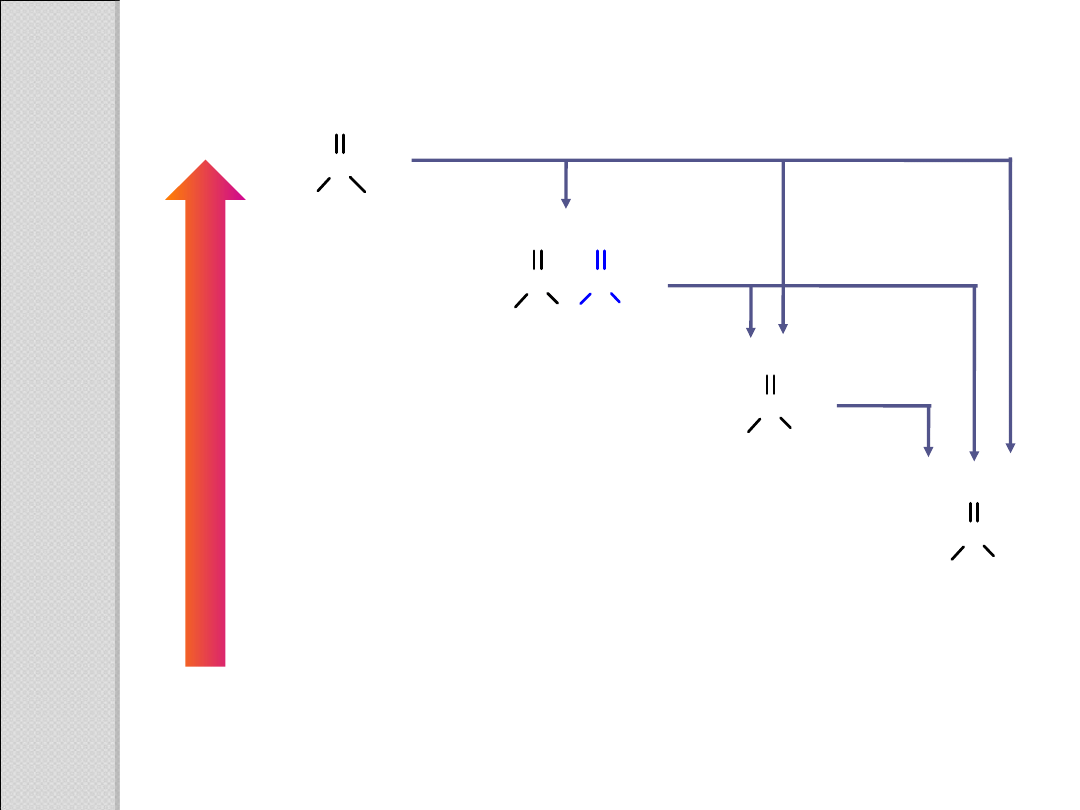
bardziej
reaktywny
mniej
reaktywny
R
C
NH
2
O
amid
R
C
OR'
O
ester
R
C
O
O
C
R
O
bezwodnik
kwasowy
R
C
Cl
O
chlorek
kwasowy
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
Wyszukiwarka
Podobne podstrony:
3 kwasy karb cz 2
Chemia - kwasy karb. - amidy, Ściągi (liceum)
Kwasy nukleinowe i białka – cz II
Biol kom cz 1
Systemy Baz Danych (cz 1 2)
cukry cz 2 st
wykłady NA TRD (7) 2013 F cz`
JĘCZMIEŃ ZWYCZAJNY cz 4
Sortowanie cz 2 ppt
CYWILNE I HAND CZ 2
W5 sII PCR i sekwencjonowanie cz 2
motywacja cz 1
02Kredyty cz 2
Ćwiczenia 1, cz 1
Nauki o zarzadzaniu cz 8
Wzorniki cz 3 typy serii 2008 2009
więcej podobnych podstron