
1
SPRZĘŻENIE MOMENTÓW
PĘDU W ATOMACH
WIELOELEKTRONOWYCH;
SPRZĘŻENIE L-S, j-j.
REGUŁY WYBORU.
EFEKT ZEEMANA.

2
Sprzężenie L – S
Atom He: energia kulombowska (S, P, D…)
i wymiany (multipletowość); termy i
multiplety
Dwa elektrony: S = 0 (singlety), S = 1
(tryplety)
Trzy elektrony: S = 1/2 (dublety), S = 3/2
(kwartety)
Cztery elektrony: S = 0 (singlety), S = 1
(tryplety),
S = 2 (kwintety)
Pięć elektronów: S = 1/2 (singlety), S =
3/2 (kwartety),
S = 5/2 (sekstety), itd…
(mimo wzg. słabego oddziaływania spinów,
znaczenie części przestrzennej funkcji i
oddziaływania e
2
/r
12
)
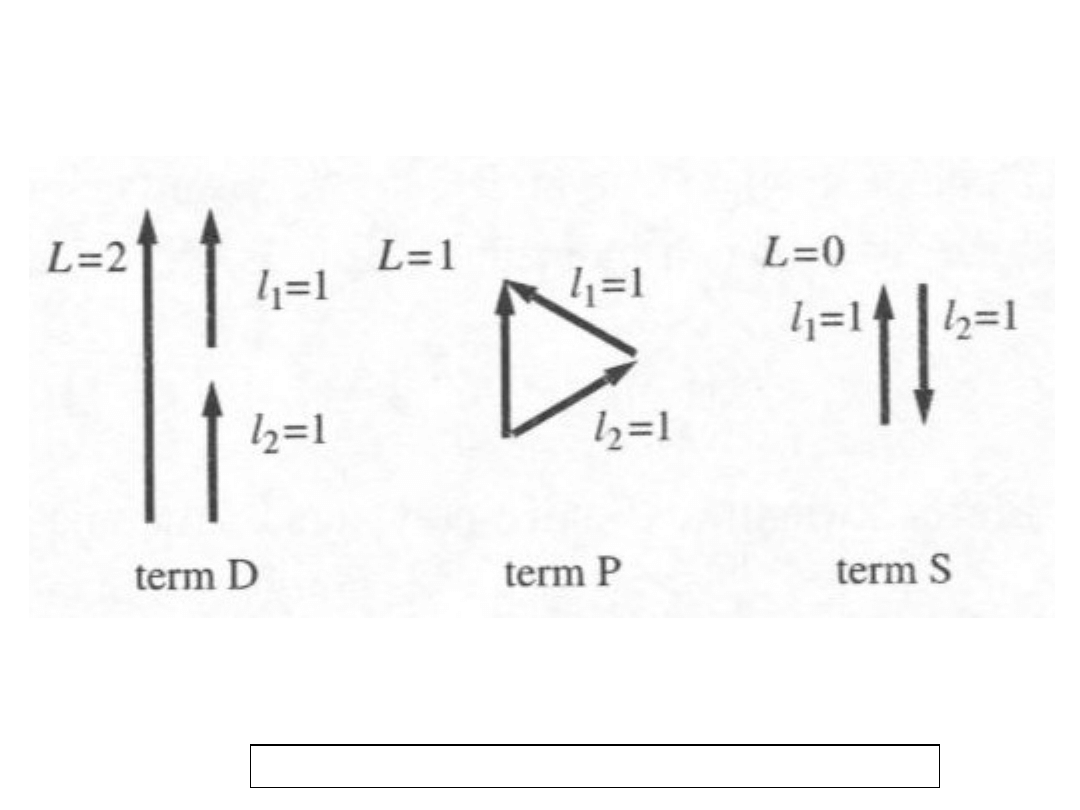
3
Składanie orbitalnych momentów pędu
dwóch elektronów p; model wektorowy
Copyright © Springer-Verlag, The Physics of Atoms and Quanta by Hermann Haken and
Hans Christoph Wolf
Copyright © for the Polish edition by Wydawnictwo Naukowe PWN SA, Warszawa 2002

4
Termy; nierozszczepione multiplety (bez
s – o)
J
1
S
2
L
Konfiguracja np. 1s2p (pole centralne)
Niecentralna część e
2
/r
12
(różne L)
Energia wymiany (termy)
Spin – orbita (różne J, multiplety: zbiory
poziomów)
Pole magnetyczne (różne m
J
, stany)
5
Oddziaływanie spin – orbita
S
L
h
1
S
,
L
'
H
2
S
-
L
...
1,
-
S
L
S,
L
J
L
i
S
dla
podobnie
,
h
1
J
J
J
S
L
J
W modelu wektorowym:
Reguła trójkąta; ponieważ J = L + S, trzy
wektory tworzą trójkąt; trzeci bok nie
może być…
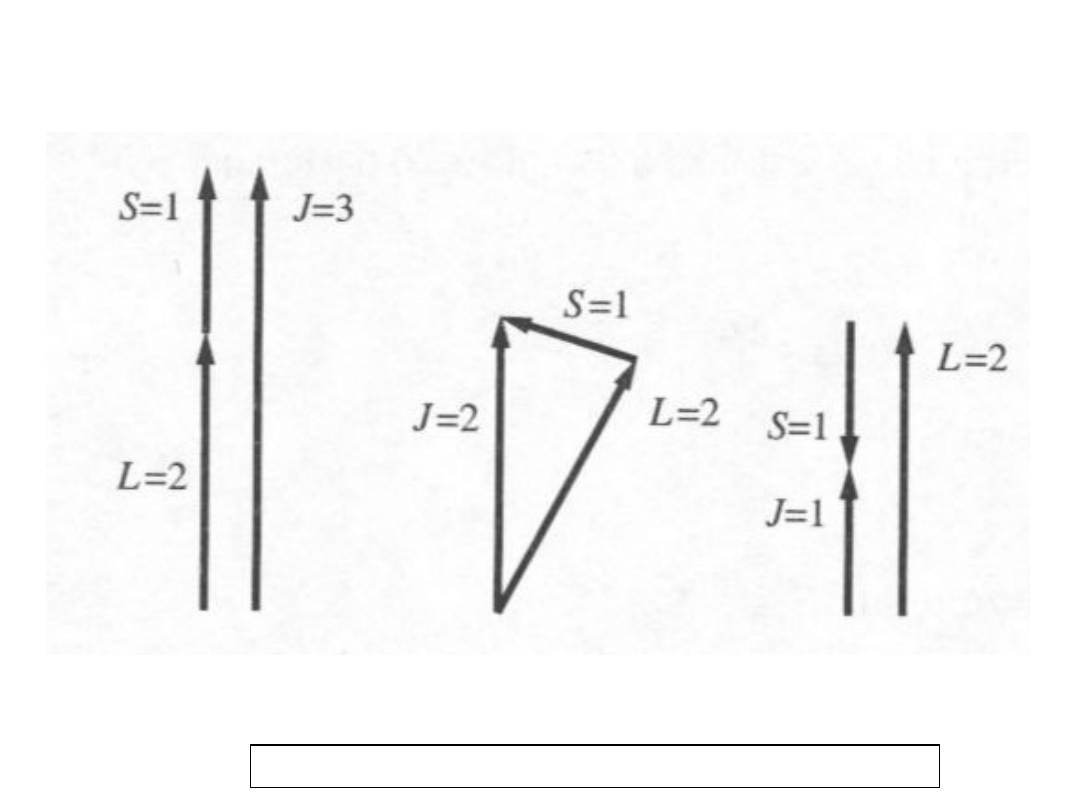
6
Składanie spinowego i orbitalnego
momentu pędu; model wektorowy
Copyright © Springer-Verlag, The Physics of Atoms and Quanta by Hermann Haken and
Hans Christoph Wolf
Copyright © for the Polish edition by Wydawnictwo Naukowe PWN SA, Warszawa 2002
7
Oddziaływanie spin – orbita
S
L
h
1
S
,
L
'
H
2
1
S
S
1
L
L
1
J
J
S
,
L
2
1
E
S
L
2
1
S
S
1
L
L
1
J
J
S
L
J
J
W modelu wektorowym:

8
A więc, dla prostych multipletów (J
wyżej od J – 1):
J
S
,
L
1
S
S
1
L
L
J
1
J
1
S
S
1
L
L
1
J
J
S
,
L
2
1
E
E
1
J
J
Reguła interwałów Landégo; kryterium
na spełnienie przybliżenia Russela –
Saundersa
(sprzężenie L–S) przez atom
wieloelektronowy

9
Przykład; termy konfiguracji stanu
podstawowego atomu azotu, 2p
3
Ponieważ:
1
l
,
1
l
,
1
l
3
2
1
L = 3, 2, 1, 0
a S = 3/2 bądź 1/2, zatem wydawałoby
się, że dozwolone termy powinny być S, P,
D, F, dublety i kwartety.
ZAKAZ PAULIEGO!
Rozważymy rozkład elektronów 3p w
stanach jednoelektronowych,
scharakteryzowanych liczbami m
l
i m
s
,
taki, by był spełniony zakaz Pauliego
10
Znak + i – oznaczają m
s
= 1/2 i -1/2
m
l
dla elektronu p (l = 1) może być równe
1, 0, -1
plus 10 dodatkowych stanów z
zamienionymi + i –
m
l
m
S
1
+ + +
–
+
+
+
–
+
–
0
+ +
–
+ +
–
+
–
+
+
-1
+
–
+ +
+ +
–
+
–
+

11
Rozkład 20 stanów pomiędzy stany
wieloelektronowe
o określonej wartości M
L
i M
S
M
L
/M
S
-3/2 -1/2 +1/
2
+3/
2
2
1
1
1
2
2
0
1
3
3
1
-1
2
2
-2
1
1
Są to składowe następujących termów:
4
S,
2
P,
2
D
12
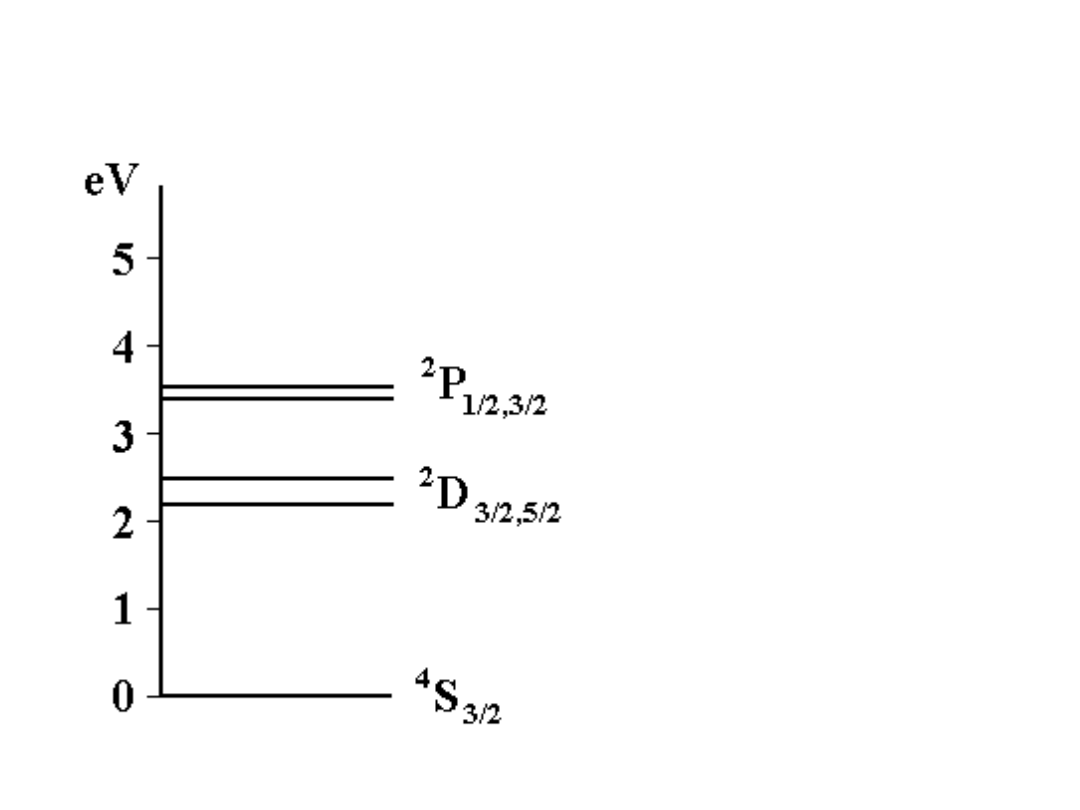
Układ poziomów zgodny z regułą Hunda
dla konfiguracji 2p
3
atomu azotu
/
Multiplety o
wyższej
multipletowości
niżej
Dla multipletów
o tej samej
multipletowości
niżej te z
większym L
Dla multipletów
prostych, niżej
leżą poziomy o
niższym J

13
Diagram termów dla atomu azotu (2p
3
)
/
Copyright © Springer-Verlag, The Physics of Atoms and Quanta by Hermann Haken and
Hans Christoph Wolf
Copyright © for the Polish edition by Wydawnictwo Naukowe PWN SA, Warszawa 2002
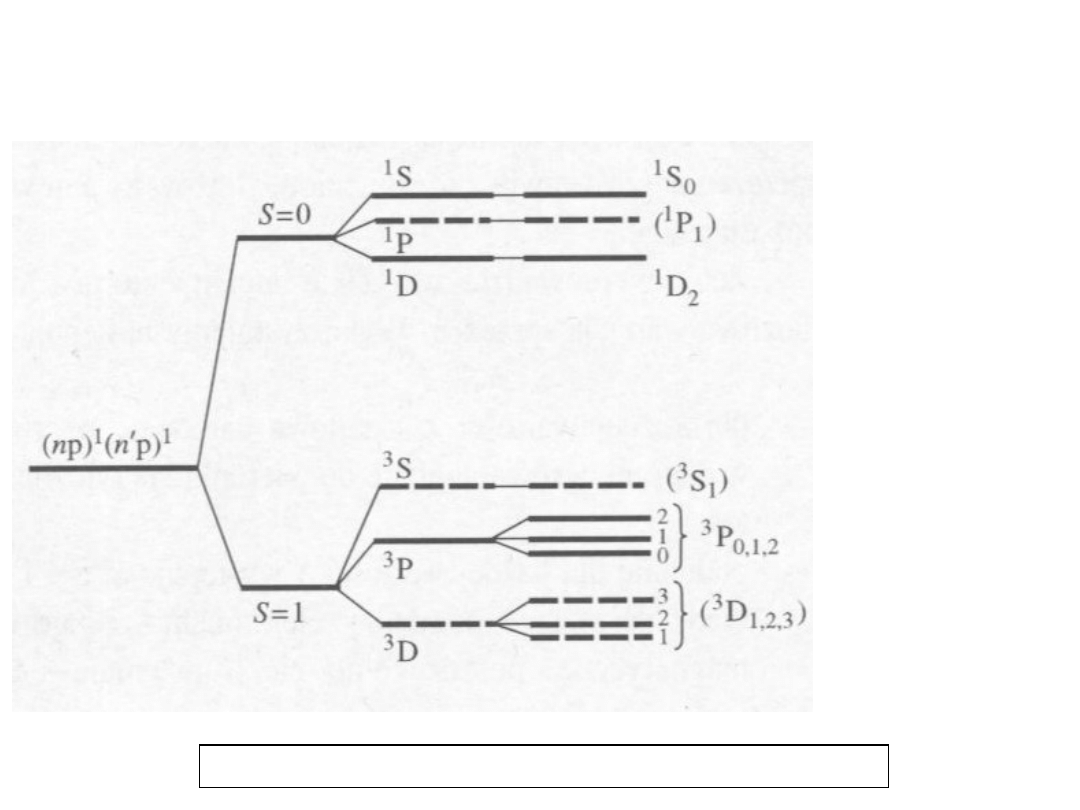
14
/
Sprzężenie dwóch elektronów p dla
konfiguracji (npnp) i (npn’p)
Copyright © Springer-Verlag, The Physics of Atoms and Quanta by Hermann Haken and
Hans Christoph Wolf
Copyright © for the Polish edition by Wydawnictwo Naukowe PWN SA, Warszawa 2002
Singlet,
antysymetrycz
na część
spinowa
(wymiana)
tryplet,
symetryczna
Całkowita
funkcja
falowa musi
być
antysymetrycz
na

15
Sprzężenie j – j
Stała sprzężenia spin – orbita dla
pojedynczego elektronu rośnie z Z:
s
l
a
s
l
r
m
c
8
h
Zq
E
3
e
2
0
2
2
e
zatem dla ciężkich atomów maleje
względne znaczenie energii wymiany;
maleje uporządkowanie
charakterystyczne dla sprzężenia L – S,
rośnie znaczenie sprzężenia s i l dla
pojedynczego elektronu

16
Musimy zastosować inny sposób składania
momentów pędu:
2
2
1
2
2
2
1
1
1
h
1
J
J
J
...
j
j
J
...
j
s
l
;
j
s
l
Wartości j i J znajdujemy stosując model
wektorowy:
j
1
= l
1
+ s
1
, l
1
–
s
1
, j
2
= l
2
+ s
2
, l
2
– s
2
J = j
1
+ j
2
, j
1
+ j
2
–
1, … |j
1
–
j
2
|
Ale nie wszystkie tak znalezione stany
(j
1
,j
2
)
J
będą spełniać zakaz Pauliego
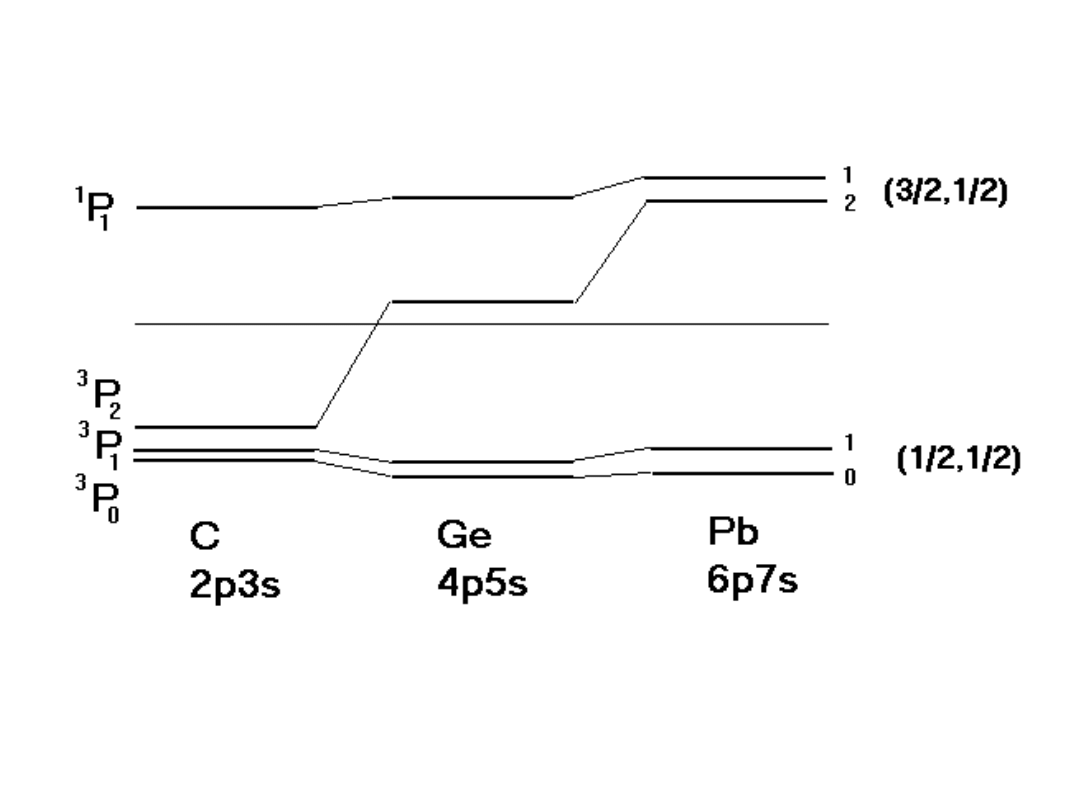
17
/
Przejście od sprzężenia L – S w atomach
lekkich do sprzężenia j – j w atomach
cięższych
Stany wzbudzone konfiguracji (np)
2
atomów
IV grupy układu okresowego (C, Si, Ge,
Sn, Pb)
1600 cm
-1
40 cm
-1
20 cm
-1

18
Reguły wyboru
(przejścia elektryczne – dipolowe)
ξ
= x, y, z dla światła spolaryzowanego
liniowo w kierunku x, y, z
= x + iy, x – iy, dla światła
spolaryzowanego
kołowo, rozchodzącego się w kierunku z
Całkowanie po współrzędnych
przestrzennych i spinowych
d
d
H'
2
1
j
*
k
kj
element macierzowy
odpowiedzialny za
przejścia ze stanu j
do k

19
Moment dipolowy (q
ξ
), nie zależy od
współrzędnych spinowych, zatem:
atom
0
S
elektron
0
s
zabronione przejścia
interkombinacyjne
Funkcje falowe są zbudowane z funkcji
jednoelektronowych
Część spinowa funkcji falowej daje się
wyodrębnić
(w przybliżeniu Russela – Saundersa)
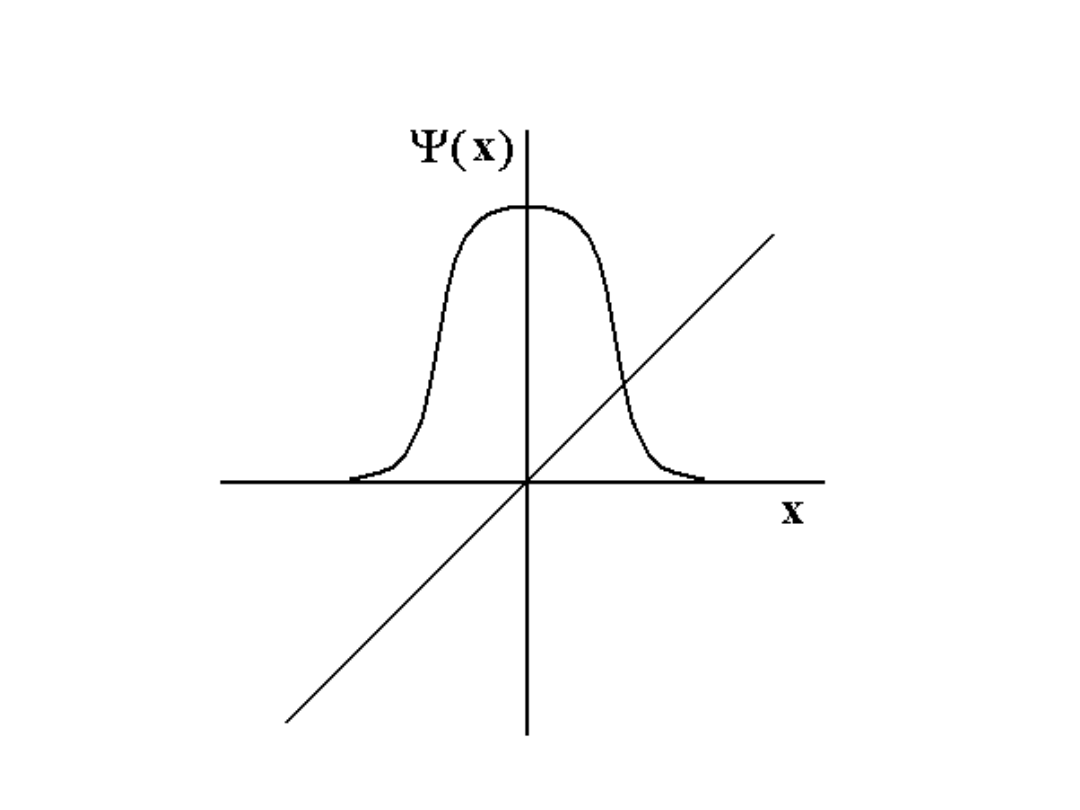
20
/
Całkowanie funkcji parzystych i
nieparzystych
0
dx
x
x
21
Radialna część funkcji falowej dla
wodoru:
l
1
i
2
2
2
,
2
i
1
,
2
2
20
i
1
,
1
10
00
e
sin
32
15
Y
e
sin
cos
8
15
Y
1
cos
3
16
5
Y
e
sin
8
3
Y
cos
4
3
Y
4
1
Y
parzystość
lub
r
r
inwersja

22
Zatem:
Dla funkcji s l = 0, funkcje parzyste
Dla funkcji p l = 1, funkcje
nieparzyste
Dla funkcji d l = 2, funkcje parzyste
Dla funkcji f l = 3, funkcje
nieparzyste
Iloczyn funkcji parzystych, parzysty
Iloczyn funkcji nieparzystych, parzysty
A więc: Δl = ± 1

23
Kątowa zależność funkcji falowej wodoru
od kąta φ (kąt azymutalny)
z
M
e
zd
e
d
,
zY
,
Y
z
M
e
,
Y
0
m
'
m
i
m
'
m
i
'
m
'
l
*
lm
im
lm
M(z) dla światła spolaryzowanego wzdłuż
osi z, nie powinno zależeć od obrotu
wokół osi z.
Δm = 0
obrót o φ
0
24
/
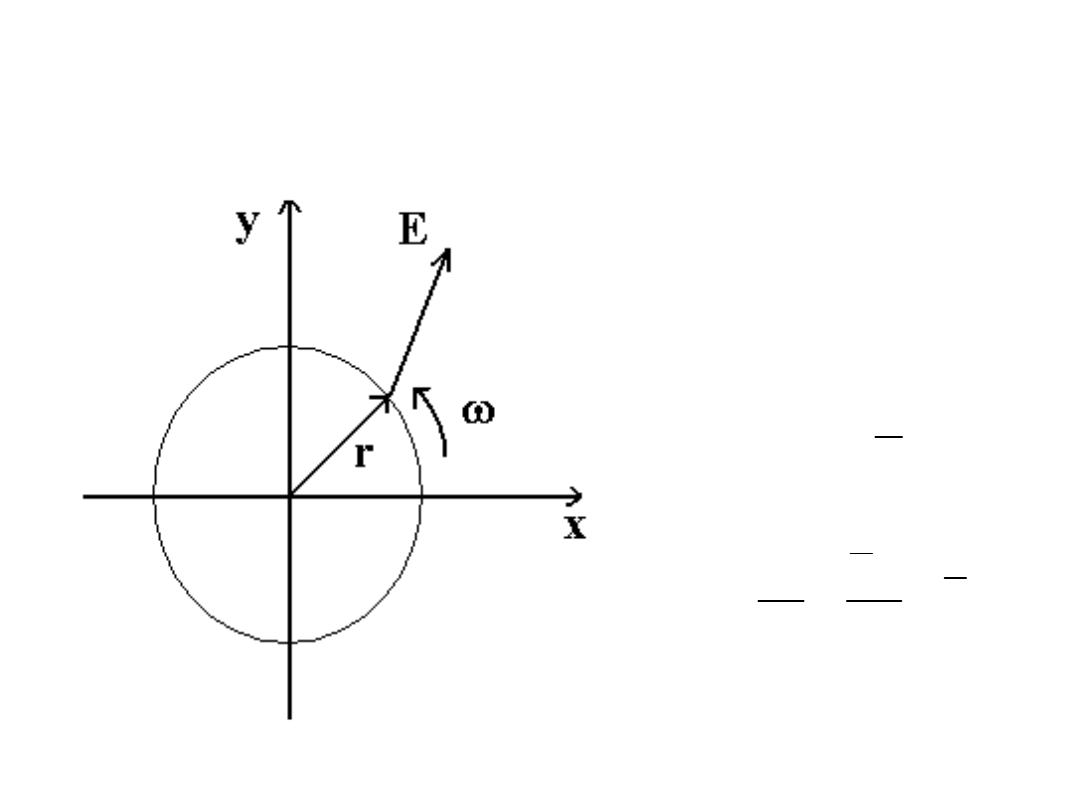
Moment pędu fotonu światła
spolaryzowanego kołowo
Elektron w ośrodku materialnym, pole
fali e-m spolaryzowanej kołowo w p-źnie
xy
E
h
h
W
M
t
M
t
t
r
v
r
F
vt
F
W
F
r
p
r
M
E
q
F
s
s
Porównujemy energię W i moment pędu
M przekazany elektronowi przez falę e-
m w czasie t

25
Moment pędu fotonu światła
spolaryzowanego kołowo, prawo- lub
lewoskrętnie, rozchodzącego się w
kierunku osi z jest równy:
±ħ
Z zasady zachowania momentu pędu,
moment pędu atomu musi się też zmienić
o tę samą wartość; więc, ponieważ:
J
z
= mħ
więc:
Δm = ±1
(polaryzacja lewo- lub prawoskrętna)

26
Reguły wyboru dla atomu w
sprzężeniu L–S:
1. przejścia elektryczno-dipolowe
zachodzą gdy jeden elektron
zmienia stan i Δl = ±1
2. Liczby kwantowe atomu
ΔS = 0
ΔL = ±1 lub 0
ΔJ = ±1 lub 0, ale 0 → 0 zabronione
Δm
J
= ±1 lub 0, ale Δm
J
= 0
zabronione
gdy ΔJ = 0

27
Reguły wyboru dla atomu w
sprzężeniu j–j:
1. przejścia elektryczno-dipolowe
zachodzą gdy jeden elektron zmienia
stan; dla tego elektronu:
Δl = ±1, ΔJ = ±1 lub 0,
dla pozostałych elektronów ΔJ = 0
2. Liczby kwantowe atomu
ΔJ = ±1 lub 0, ale 0 → 0 zabronione
Δm
J
= ±1 lub 0, ale Δm
J
= 0
zabronione
gdy ΔJ = 0
28
Atom wieloelektronowy w polu
magnetycznym; efekt Zeemana
gm
gm
m
2
h
q
B
e
e
mB
g
E
B
moment
magnetyczny w
kierunku pola B
energia w polu B
B
E
z
z
S
L
energia w polu B
Porównując oba wyrazy znajdujemy
efektywny czynnik Landego g
29
Obliczanie czynnika Landego g
Model
wektorowy
Sprzężenie L –
S
Słabe pole
magnetyczne
J, m
J
stałe,
wektor J
wykonuje
precesję
wokół B
L i S
wykonują
precesję
wokół J
Copyright © 1972 by Addison-Wesley Publishing Company, Inc, Introduction to Atomic
Physics by Harald A. Enge.
© Copyright for the Polish edition by Państwowe Wydawnictwo Naukowe, Warszawa
1983
30
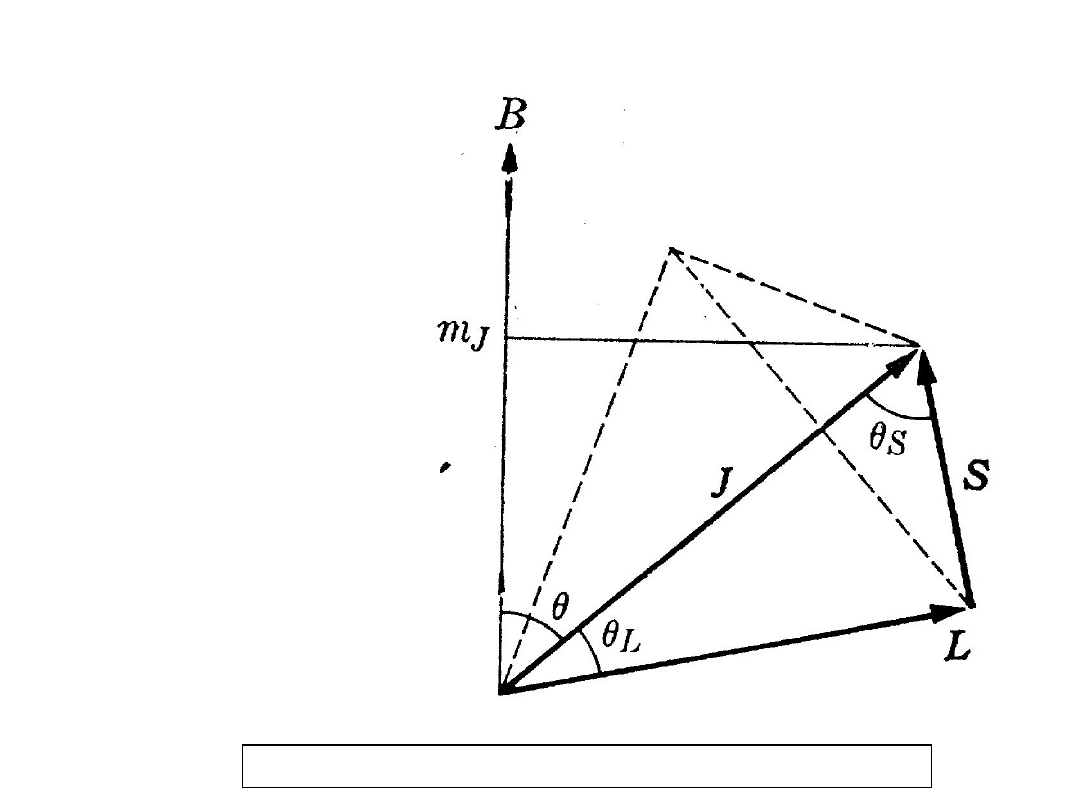
gdzie θ
L
to kąt pomiędzy L i J, θ
S
to kąt
pomiędzy S i J, a θ to kąt pomiędzy J i B
Ponieważ:
cos
cos
h
1
S
S
m
q
,
cos
cos
h
1
L
L
m
2
q
S
e
e
S
L
e
e
L
z
z
S
L
J
L
S
J
S
2
2
2
L
2
2
2
cos
1
S
S
1
J
J
2
1
S
S
1
J
J
S
J
2
S
J
1
L
L
L
cos
1
L
L
1
J
J
2
1
L
L
1
J
J
L
J
2
L
J
1
S
S
S
i

31
a także:
i z porównania odpowiednich
wyrażeń:
1
J
J
m
cos
J
B
m
1
J
J
2
1
L
L
1
S
S
1
J
J
1
m
2
h
q
E
J
e
e
1
J
J
1
L
L
1
S
S
1
J
J
1
g
Dla S = 0 mamy g = 1, tzw.
„normalne” zjawisko Zeemana, trzy
składowe nawet dla J > 1,
Δm
J
= 0, ±1
Dla S > 0, „anomalne” zjawisko
Zeemana
32
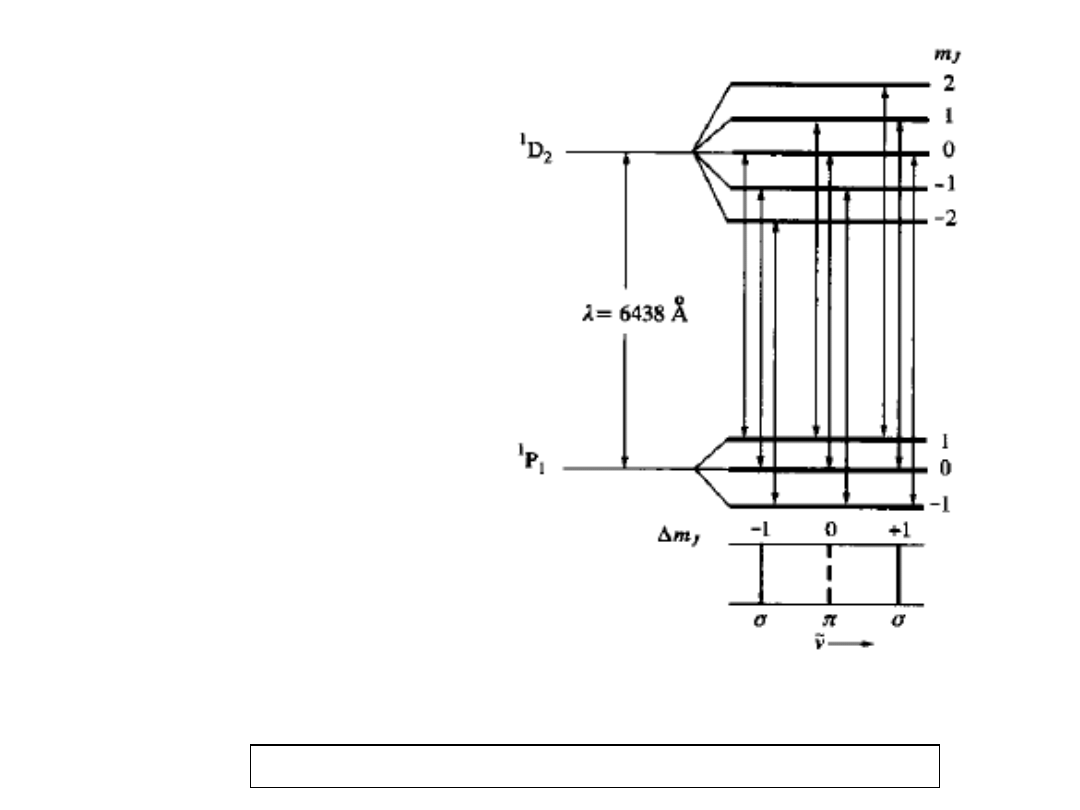
Normalne
zjawisko
Zeemana:
linia 643,8 nm
w Cd
(przejście
pomiędzy
wzbudzonymi
stanami
singletowymi
dla dwóch
konfiguracji,
5s5p i 5s5d):
1
P
1
→
1
D
2
Przypadek S =
0, trzy linie σ,
π, σ
Copyright © Springer-Verlag, The Physics of Atoms and Quanta by Hermann Haken and
Hans Christoph Wolf
Copyright © for the Polish edition by Wydawnictwo Naukowe PWN SA, Warszawa 2002

33
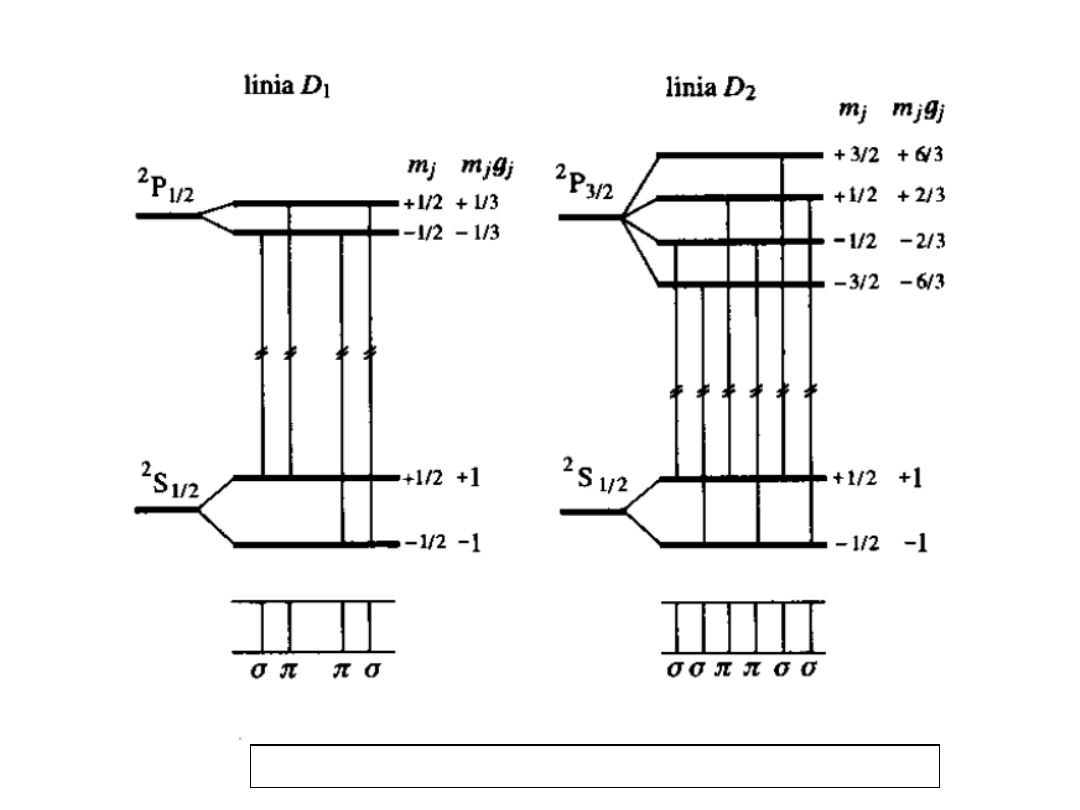
Anomalne zjawisko Zeemana,
rozszczepienie linii D
1
i D
2
sodu (3s-
3p):
2
S
1/2
→
2
P
1/2
(D
1
)
2
S
1/2
→
2
P
3/2
(D
2
)
Przypadek S > 0, σ,π,π,σ (D
1
)
σ,σ,π,π,σ,σ (D
2
)
34
Copyright © Springer-Verlag, The Physics of Atoms and Quanta by Hermann Haken and
Hans Christoph Wolf
Copyright © for the Polish edition by Wydawnictwo Naukowe PWN SA, Warszawa 2002
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
Wyszukiwarka
Podobne podstrony:
Wyklad 10 Fiz At Mol 2011
Wyklad 7a Fiz At Mol 2011
Wyklad 14 Fiz At Mol 2011
Wyklad 12 Fiz At Mol 2011 (1)
Wyklad 11 Fiz At Mol 2011
Wyklad 10 Fiz At Mol 2011
Wyklad 7 Fiz At Mol 2011
Wyklad 1 Fiz At Mol 2011
Wyklad 6 Fiz At Mol 2011
Wyklad 9 Fiz At Mol 2011 (1)
Wyklad 13 Retoryka 17 01 2011 r
P Społeczna TreściWord, 13. p społeczna 19.01.2011, PSYCHOLOGIA SPOŁECZNA - wykład, dn
IS 2011 12 wyklad 13 12 01 2012 MDW
Materiały do wykładu 2 (13 10 2011)
fiz wyklad 13
Wyklad112 i 13 2011 jezyk
Historia wykład 13 10 2011 W
więcej podobnych podstron