
Grupa XVI
Tlenowce

Symb
ol
Struktura
elektronow
a
I
St.
utlenienia
E
o
f
X+2e→X
2-
LK
Elektro-
ujemnoś
ć
O
2s
2
p
4
1313 -2, (-1)
+1.23
1, 2
3.5
S
3s
2
p
4
999.
5
-2, (+2),
+4, +6
+0.14
2, 4,
6
2.5
Se
3d
10
4s
2
p
4
940.
7
(-2), +2,
+4, +6
-0.40
2, 4,
6
2.4
Te
4d
10
5s
2
p
4
869.
3
+2, +4, +6
-0.72
6
2.1
Po
4f
14
5d
10
6s
2
p
4
813.
3
+2, +4
-1.00
6
?
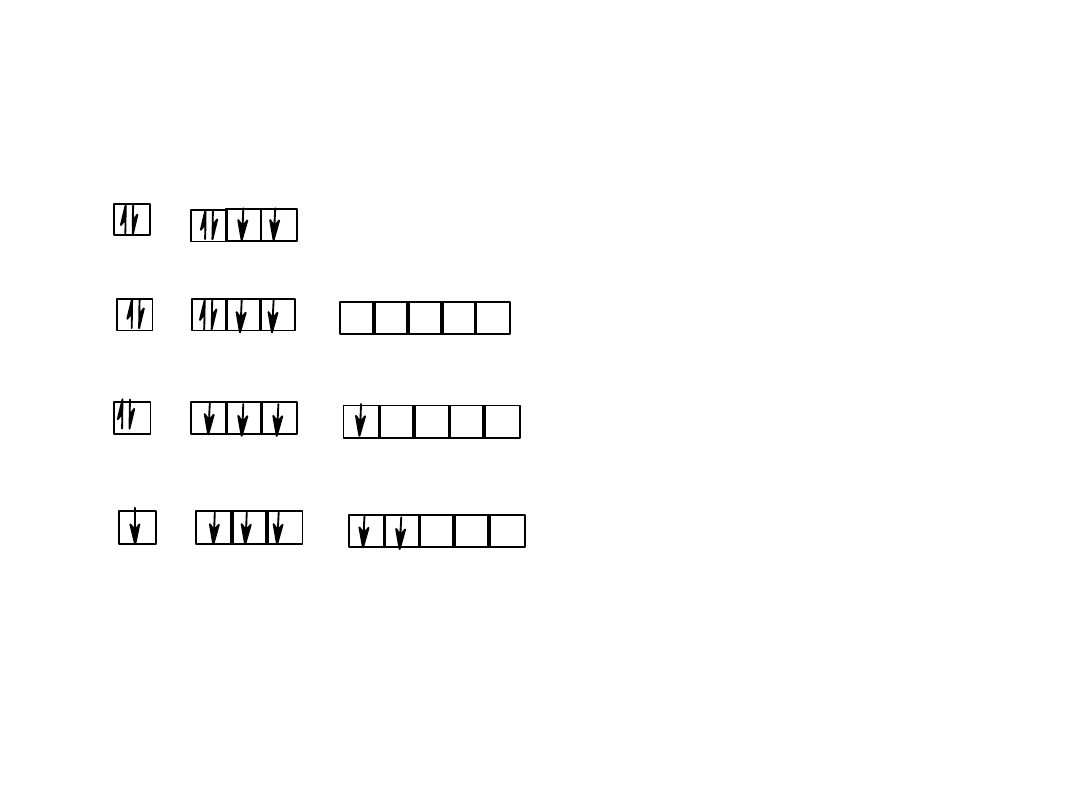
O
S
S*
S*
sp
3
tetraedr
sp
3
tetraedr
sp
3
d bipiramida trygonalna
sp
3
d
2
oktaedr

Rozpowszechnienie
• Tlen – najbardziej rozpowszechniony pierwiastek
– zawartość w skorupie ziemskiej – 46.6%
– atmosfera - 21%
– woda – 89%
• Siarka – 0.05%
– siarka rodzima
– siarczki
– siarczany
• Pozostałe pierwiastki występują w bardzo małych ilościach

Otrzymywanie tlenu
Metody przemysłowe:
• Destylacja skroplonego powietrza
• Elektroliza wody ( H
2
SO
4
lub Ba(OH)
2
)
W laboratorium:
2
Co
2
MnO
4
O
HCl
2
HClO
2
O
2
KCl
KClO
2
2

Otrzymywanie siarki
• Metoda Frasha
• W rafineriach:
2 H
2
S + 3 O
2
→ 2 SO
2
+ 2 H
2
O
SO
2
+ 2 H
2
S → 2 H
2
O + 3 S
• Duże ilości siarki otrzymuje się też ubocznie w procesach
przeróbki rud metali

Otrzymywanie pozostałych pierwiastków
• Selen i tellur – stanowią domieszkę rud siarczkowych.
Otrzymuje się je np. z pyłu powstającego po prażeniu pirytu FeS
2
• Polon występuje jako domieszka w rudach toru i uranu.
Został z nich wyodrębniony po raz pierwszy przez Marię Curie –
Skłodowską.
Obecnie otrzymuje się go w sztucznych przemianach jądrowych:
e
Po
Bi
n
Bi
0
1
210
84
210
83
1
0
209
83
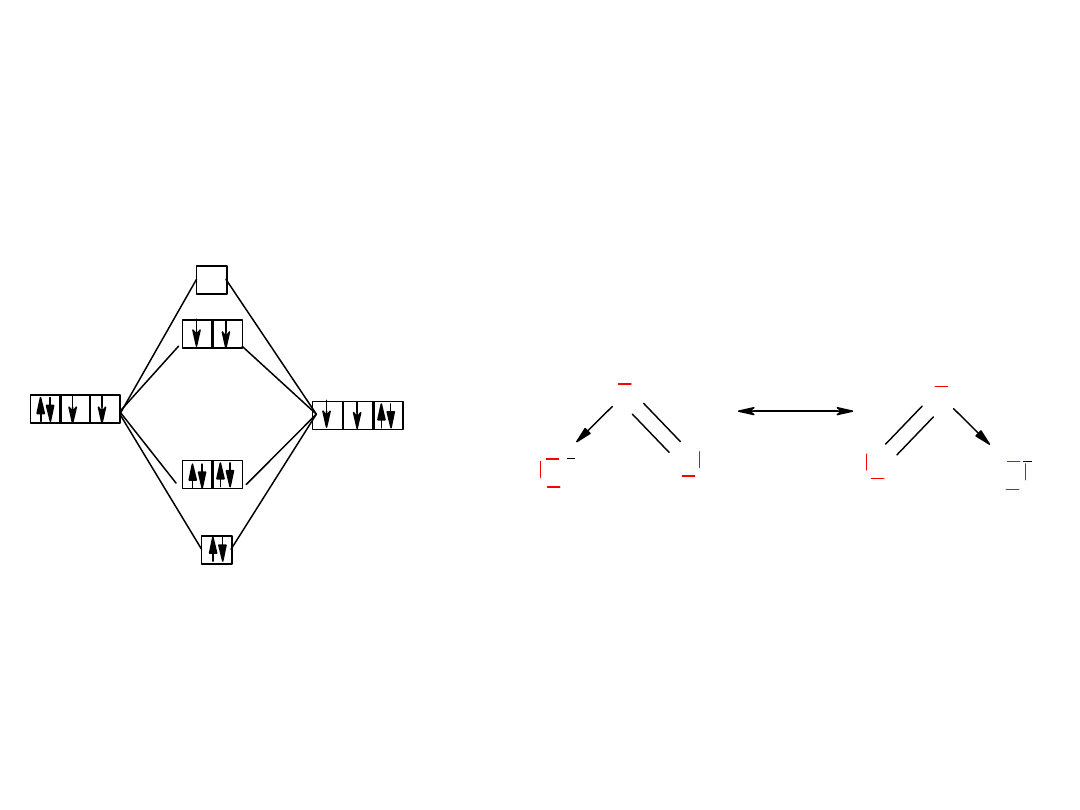
Wszystkie pierwiastki w grupie XVI są polimorficzne i
występują w różnych odmianach alotropowych:
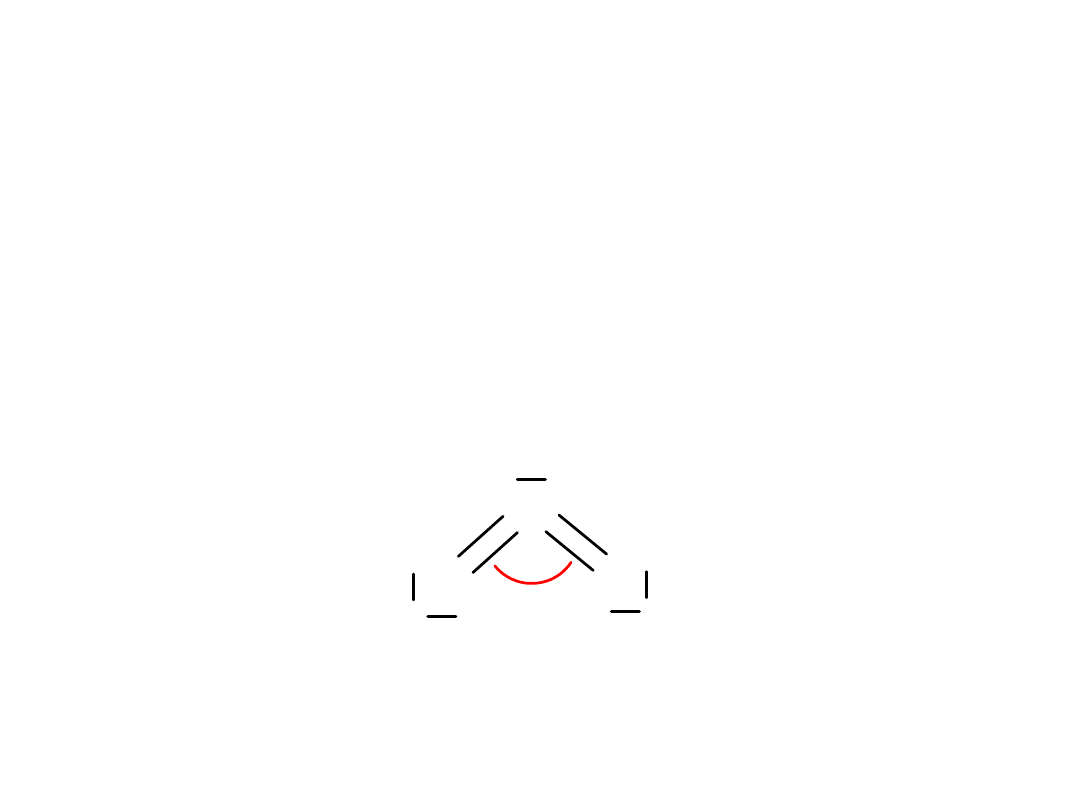
Tlen:
O
2
O
O
+
O
O
O
+
O
O
3

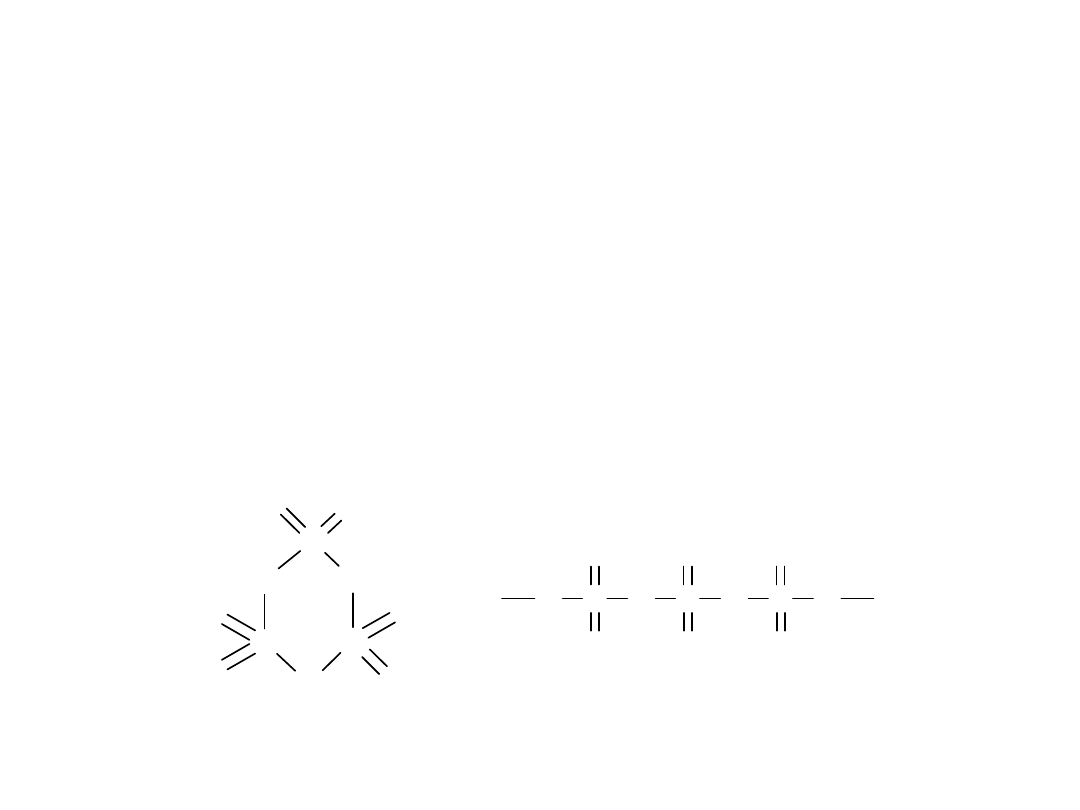
Odmiany alotropowe siarki
• Siarka występuje w wielu
odmianach alotropowych
zarówno w stanie stałym
jak i ciekłym.

Alotropia u pozostałych pierwiastków grupy
• Selen ma dwie odmiany pierścieniowe Se
8
o barwie
czerwonej i trwalszą odmianę szarą o budowie łańcuchowej.
• Tellur występuje w odmianach łańcuchowych. Niektóre z
nich wykazują połysk metaliczny i przewodzą prąd.
• Obie odmiany alotropowe polonu mają właściwości
typowego metalu
• W grupie struktura trwałych odmian pierwiastków zmienia
się od prostych cząsteczek dwuatomowych, poprzez
struktury pierścieniowe i łańcuchowe do sieci metalicznych.
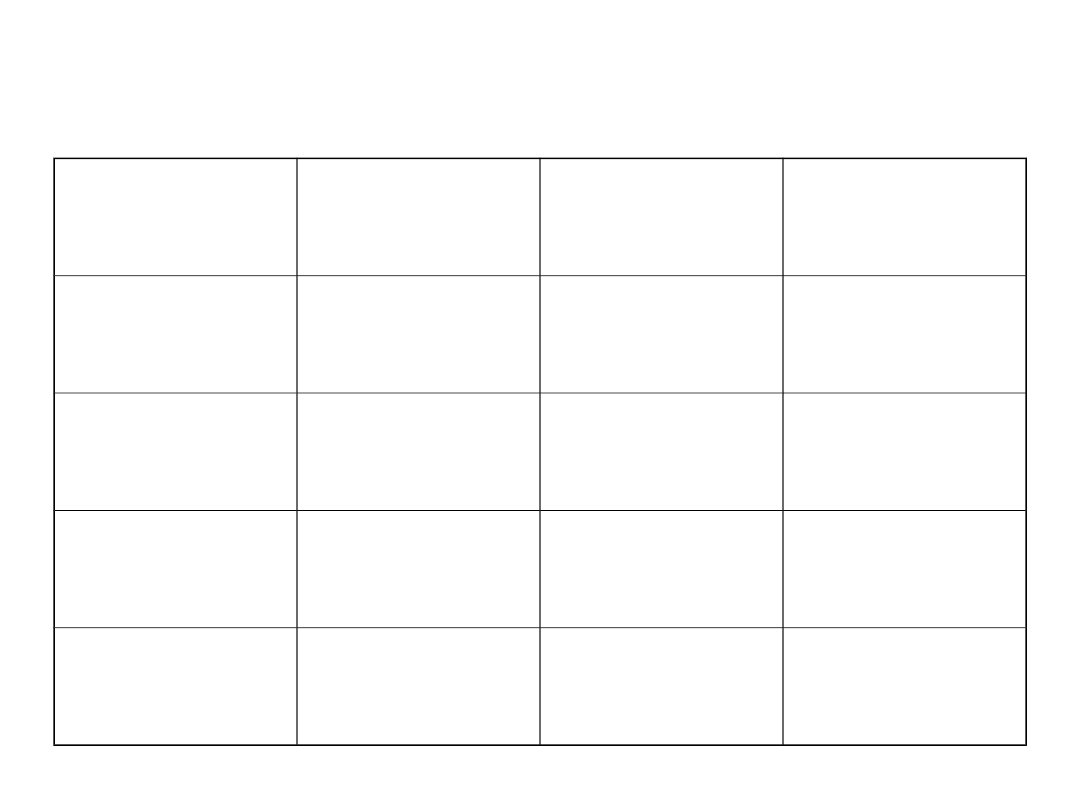
Wodorki
Ciepło
tworzenia
[kJ/mol]
Kąt między
wiązaniami
Temperatura
wrzenia [
o
C]
H
2
O
-242
105
100
H
2
S
-20
92
- 60
H
2
Se
+81
91
- 42
H
2
Te
+151
91
- 2.3
Wodorki wielordzeniowe
• H
2
S
n
i H
2
O
2
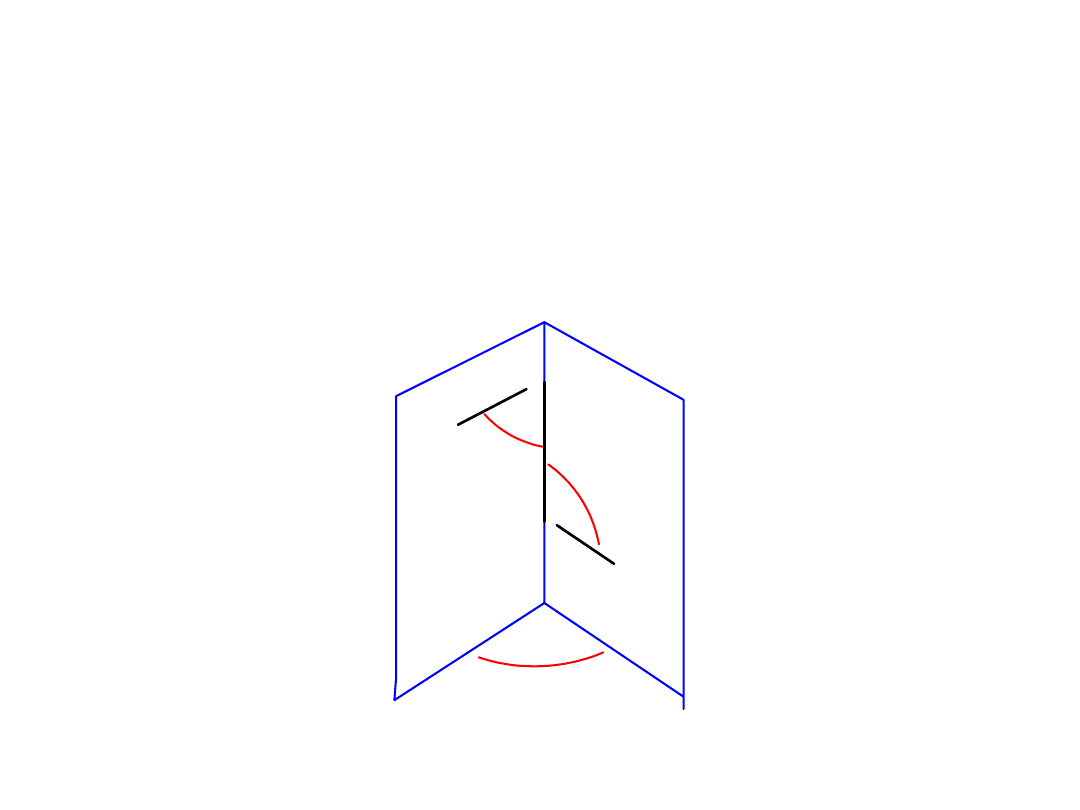
• Budowa cząsteczki H
2
O
2
O
H
O
H
90
o
90
o
90
o
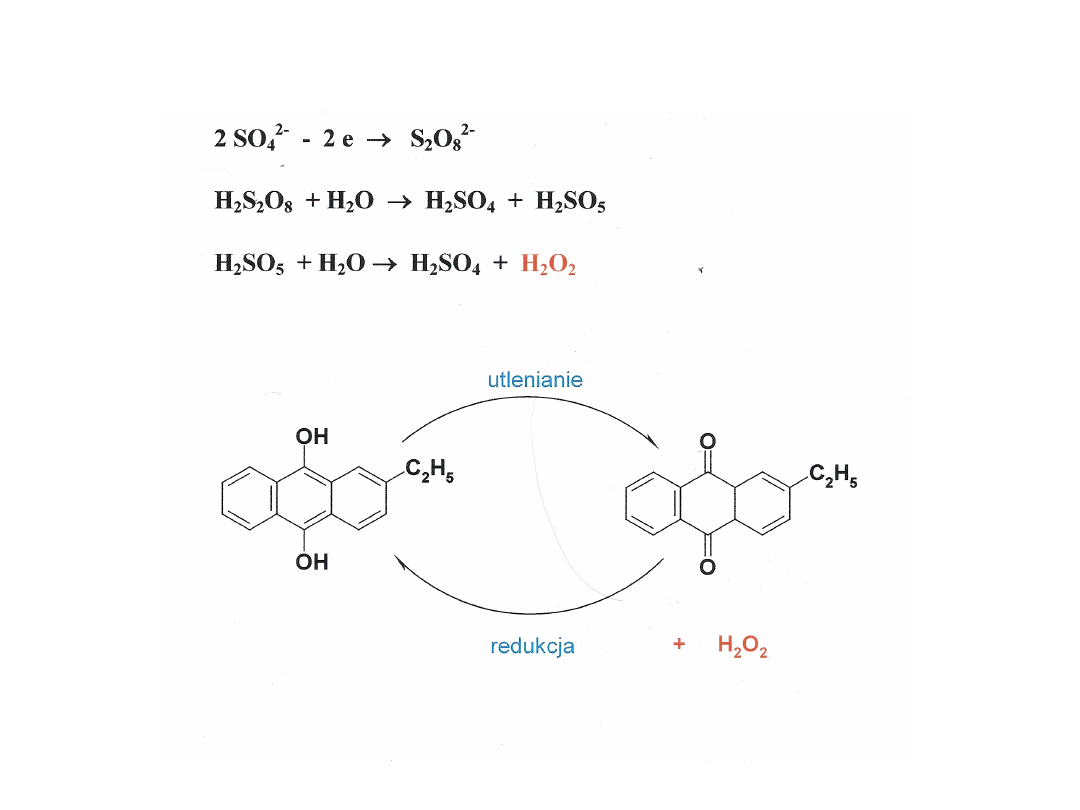
Otrzymywanie H
2
O
2
Tlenki
XO
2
XO
3
Inne
S
SO
2
SO
3
S
2
O (S
2
O
3
)
Se
SeO
2
SeO
3
Te
TeO
2
TeO
3
TeO
Po
PoO
2
PoO
Ditlenki
SO
2
Jest gazem. Zarówno w stanie gazowym jak i ciekłym i
stałym tworzy odrębne cząsteczki o kształcie trójkąta.
Rozpuszcza się w wodzie tworząc słaby nietrwały
dwuprotonowy kwas:
SO
2
+ H
2
O ↔ H
2
SO
3
Sole tego kwasu jak sam SO
2
mają właściwości redukujące
S
O
O
119
.
5
o

Ditlenki
SeO
2
Substancja stała tworząca długie łańcuchy.
Pojedyncze cząsteczki występują jedynie w fazie gazowej.
Z wodą tworzy słaby dwuprotonowy kwas H
2
SeO
3
, możliwy
do wydzielenia w formie krystalicznej.
S
eO
2
+ H
2
O ↔
H
2
SeO
3
SeO
2
i H
2
SeO
3
mają właściwości utleniające.
SeO
2
bywa używany jako selektywny utleniacz aldehydów i
ketonów.

Ditlenki
TeO
2
Ciało stałe o budowie jonowej.
Z wodą nie reaguje.
Reaguje z zasadami tworząc sole pochodzące od kwasu
H
2
TeO
3
2 NaOH + TeO
2
↔ Na
2
TeO
3
+ H
2
O
Reaguje także z kwasami tworząc sole.
Ma więc charakter amfoteryczny.
Trójtlenek siarki
• Jest jedynym ważnym trójtlenkiem w tej grupie.
• Jest bezwodnikiem H
2
SO
4
.
• Otrzymuje się utleniając SO
2
w obecności katalizatora.
• Używany jest do produkcji:
– kwasu siarkowego
– syntetycznych detergentów
• W temp. pokojowej jest ciałem stałym występującym w
odmianach polimerycznych
S
O
O
O
S
S
O
O
O
O
O
O
O S
O
O
O S O
O
O
S O
O
O

Kwasy tlenowe siarki
S OH
O
H
O
H
S OH
O
O
H
S OH
S
O
H
S S OH
O
O O
O
H
S S OH
O O
H
2
SO
2
kwas sulfoksylowy
Grupa kwasu siarkowego(IV)
H
2
SO
3
kwas siarkowy(IV)
H
2
S
2
O
2
kwas tiosiarkowy(IV)
H
2
S
2
O
5
kwas disiarkowy(IV)
H
2
S
2
O
4
kwas ditionowy(IV)
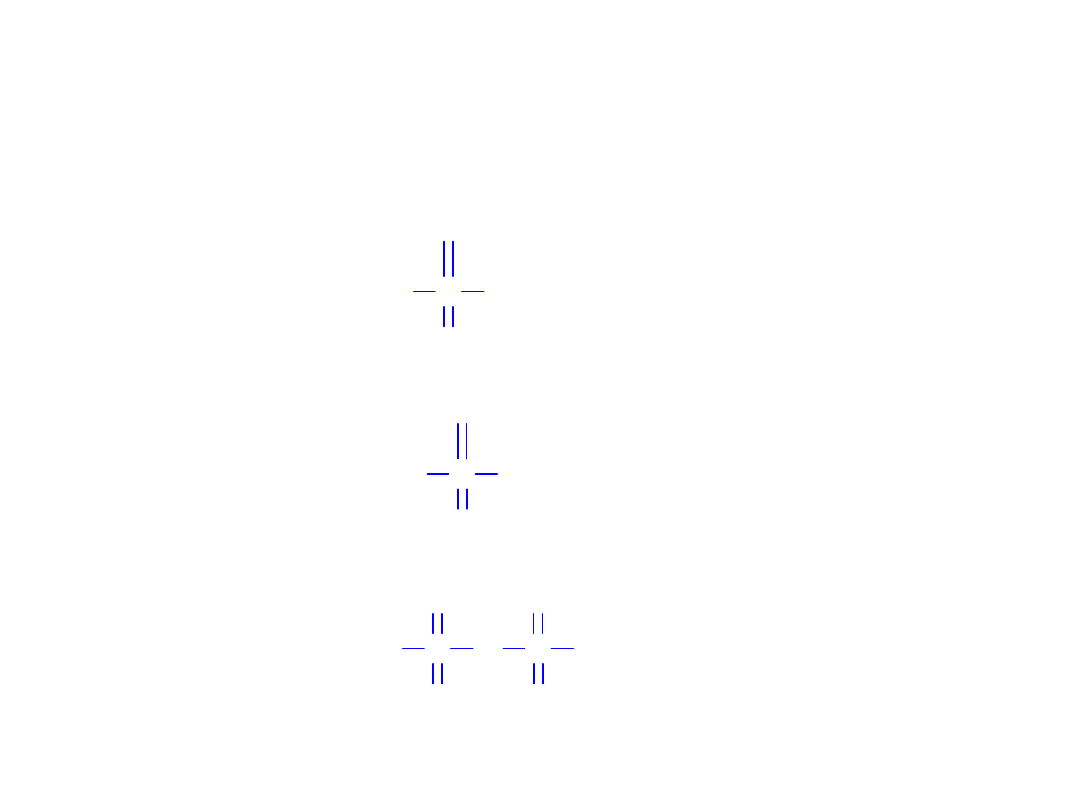
Kwasy tlenowe siarki
• Grupa kwasu siarkowego(VI)
O
H
S OH
O
O
O
H
S OH
O
S
O
H
S O S OH
O
O
O
O
H
2
SO
4
kwas siarkowy(VI)
H
2
S
2
O
3
kwas tiosiarkowy
kwas disiarkowy
pirosiarkowy
H
2
S
2
O
7
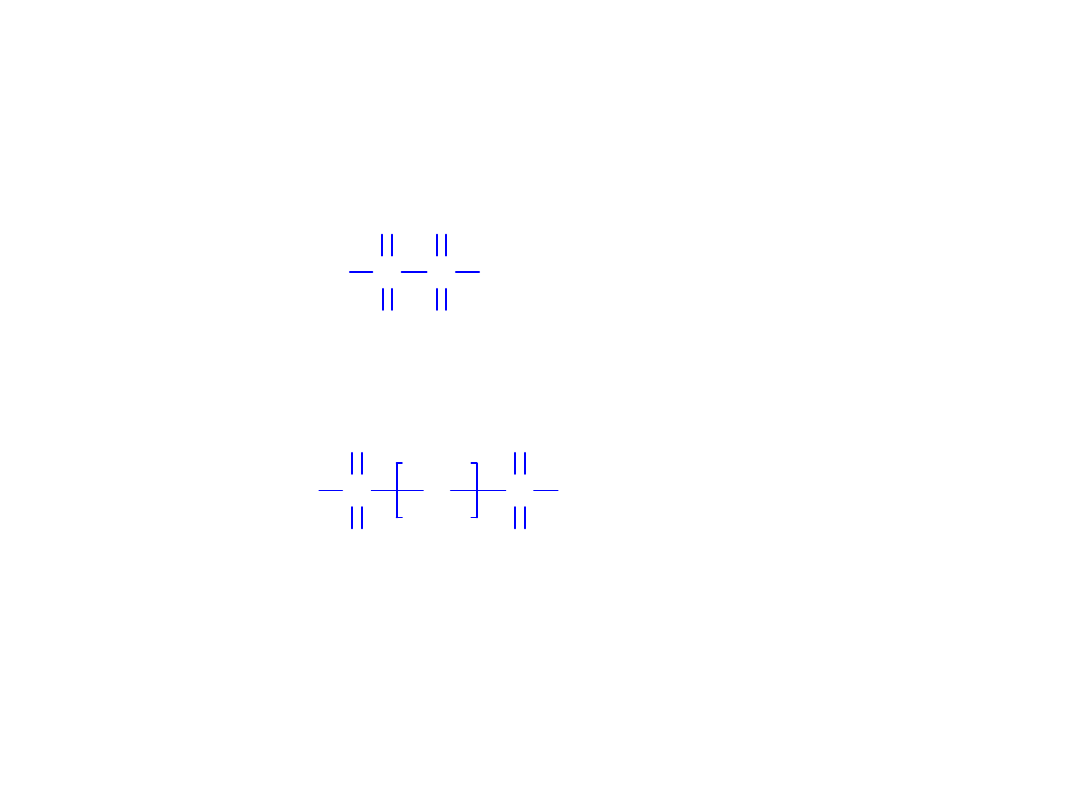
Kwasy tlenowe siarki
• Kwasy tionowe
O
H
S S OH
O O
O O
O
H
S
S
S OH
n
O
O
O
O
kwasy wielotionowe
H
2
S
2
O
6
kwas ditionowy
H
2
S
n
O
6
n = 1 - 12
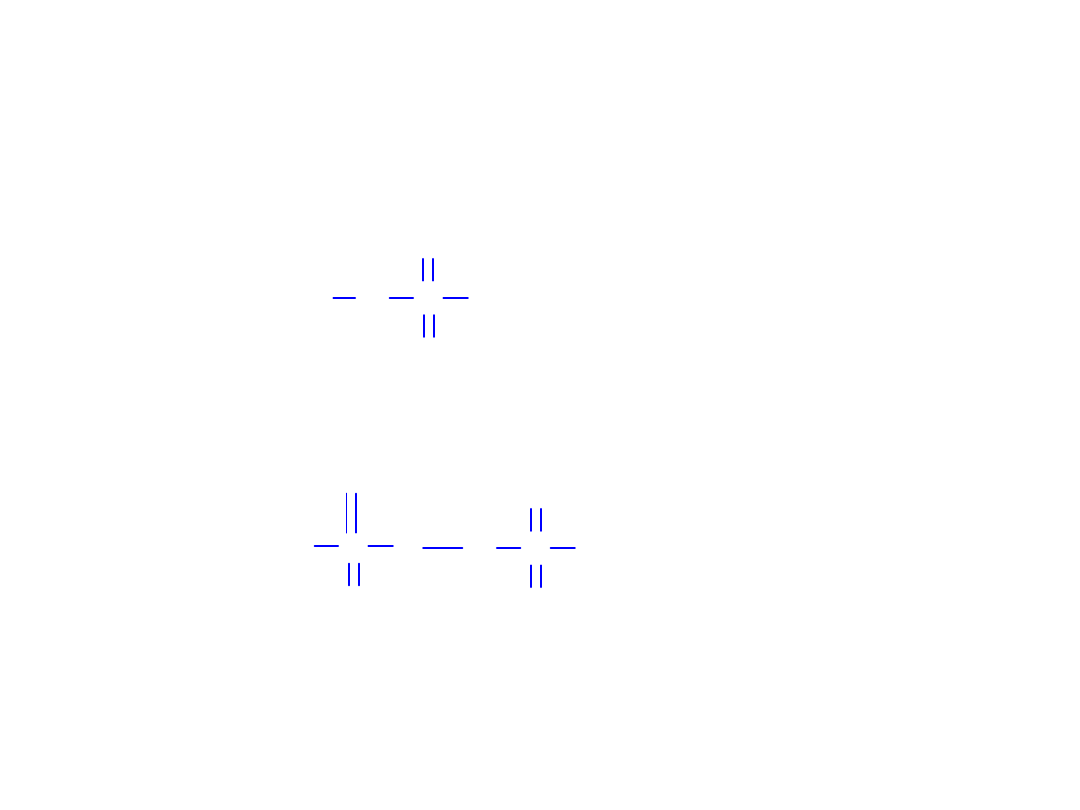
Kwasy tlenowe siarki
Kwasy nadtlenosiarkowe
O
H
O S OH
O
O
H
2
SO
5
kwas nadtlenosiarkowy (Caro)
O
H
S O
O
O
O S OH
O
O
H
2
S
2
O
8
kwas nadtlenodisiarkowy

Kwas siarkowy(IV) H
2
SO
3
• Słaby kwas dwuprotonowy
• Istnieje tylko w roztworach
• Jon SO
32-
ma strukturę
piramidy
o podstawie trójkątnej –
fragment czworościanu
• Kwas i jego sole mają właściwości redukujące:
SO
32-
+ H
2
O – 2e → SO
42-
+ 2 H
+
SO
3
2-
utlenianie
S
SO
2
Zn
temp.
SO
4
2-
S
2
O
3
2-
S
2
O
4
2-
S
2
O
5
2-

Kwas siarkowy(VI) H
2
SO
4
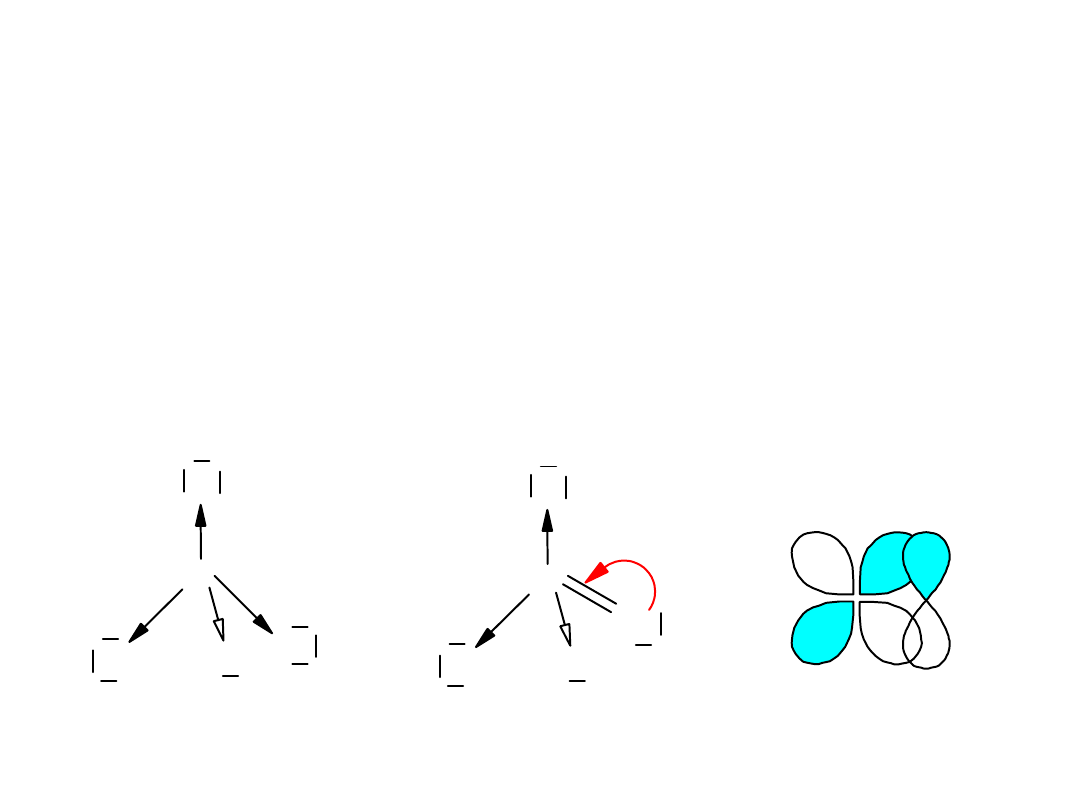
Kwas siarkowy(VI) H
2
SO
4
• Kwas dwuprotonowy. Zaliczany jest do kwasów mocnych ale w
wodzie tylko
I-szy etap dysocjacji jest nieodwracalny.
• Stężony kwas jest gęstą oleistą cieczą. Podczas rozcieńczania wodą
wydzielają się duże ilości ciepła.
• Jest higroskopijny
• Jest mało lotny
• Stężony kwas ma właściwości utleniające
• Cząsteczki mają strukturę tetraedryczną z udziałem wiązań
S
O
O
O
O
S
O
O
O
O
S
O
wiązanie p - d

Kwas siarkowy(VI) H
2
SO
4
• Zastosowania:
H
2
S
2
O
3
i tiosiarczany
Kwas w stanie wolnym nie istnieje.
Istnieje jednak wiele trwałych tiosiarczanów.
– Mają one właściwości redukujące:
2 S
2
O
32-
+ I
2
→ S
4
O
62-
+ 2 I
-
– i kompleksujące:
AgCl + 2 S
2
O
32-
↔ [Ag(S
2
O
3
)
2
]
3-
+ Cl
-
Struktura jonu tiosiarczanowego jest podobna do jonu
siarczanowego (VI)
S
O
O
O
S
O
O
O
S
O

Kwasy nadtlenosiarkowe
• H
2
S
2
O
8
– Otrzymuje się podczas elektrolizy siarczanów(VI) przy dużych
gęstościach prądu: 2 SO
42-
- 2 e → S
2
O
82-
– Jest jednym z najsilniejszych utleniaczy: utlenia np.. Mn
2+
do
MnO
4-
i Cr
3+
do Cr
2
O
72-
– Jest używany jako inicjator polimeryzacji C
2
F
4
– W wodzie hydrolizuje z utworzeniem kwasu Caro:
H
2
S
2
O
8
+ H
2
O → H
2
SO
5
+ H
2
SO
4
H
2
O
H
2
SO
4
+ H
2
O
2
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
Wyszukiwarka
Podobne podstrony:
01 Grupa A XVI popr
01 Grupa B XVI popr
test poprawkowy grupa 1
19 183 Samobójstwo Grupa EE1 Pedagogikaid 18250 ppt
Grupa 171, Podstawy zarządzania
hatala,januszyk grupa 2a prez 1
pilot a grupa
Wykład 6 Rodzina jako grupa społeczna
Projekt grupa 3 2
Grupa rówieśnicza jako środowisko wychowawcze ptt(1)
Grupa przestrzenna id 196528 Nieznany
GRUPA 01 ZADANIA
Paszkowska Rogacz, Tarkowska Metody parcy z grupą w poradnictwie zawodowym NOTATKI
Ciekawa Chemia Sprawdzian 10 Grupa B
Ciekawa Chemia Sprawdzian 8 Grupa A
Psalm 38, Komentarze do Psalmów-Papież Jan Paweł II,Benedykt XVI
Grupa B, Studia dziennikarstwo i komunikacja społeczna, Ekonomika mediów - pytania i notatki
GRUPA I7X6S1, WAT, semestr III, Podstawy miernictwa
więcej podobnych podstron