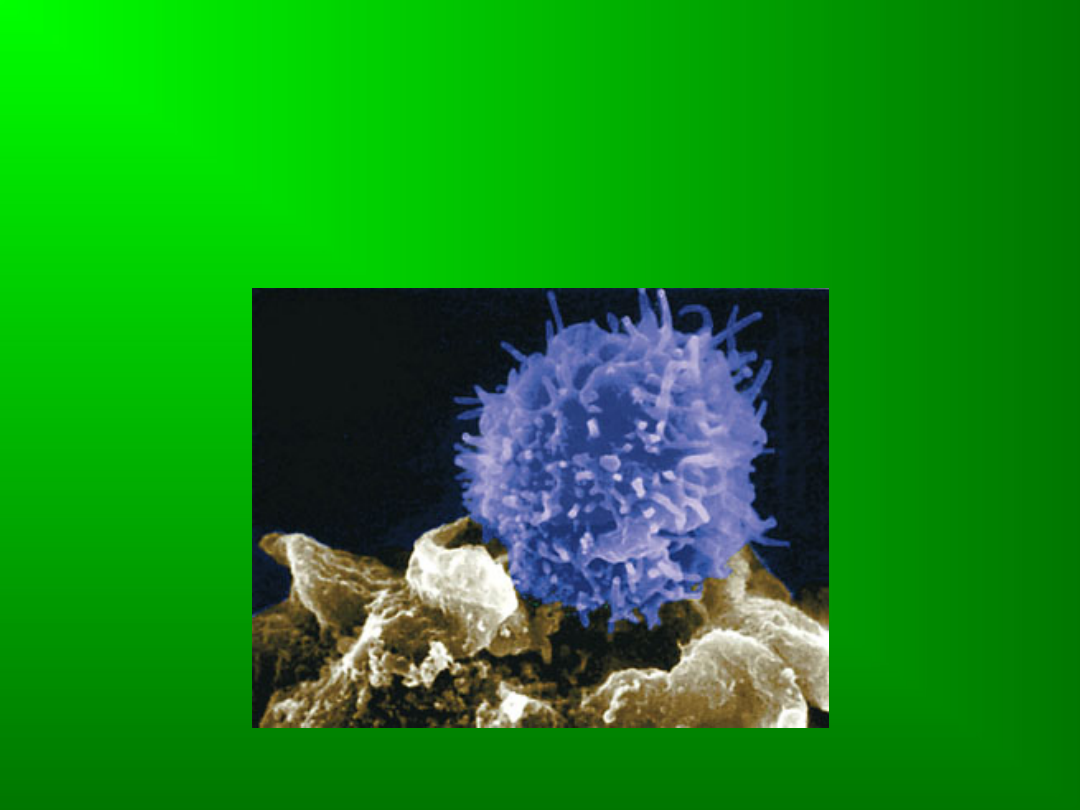
Limfocyty T
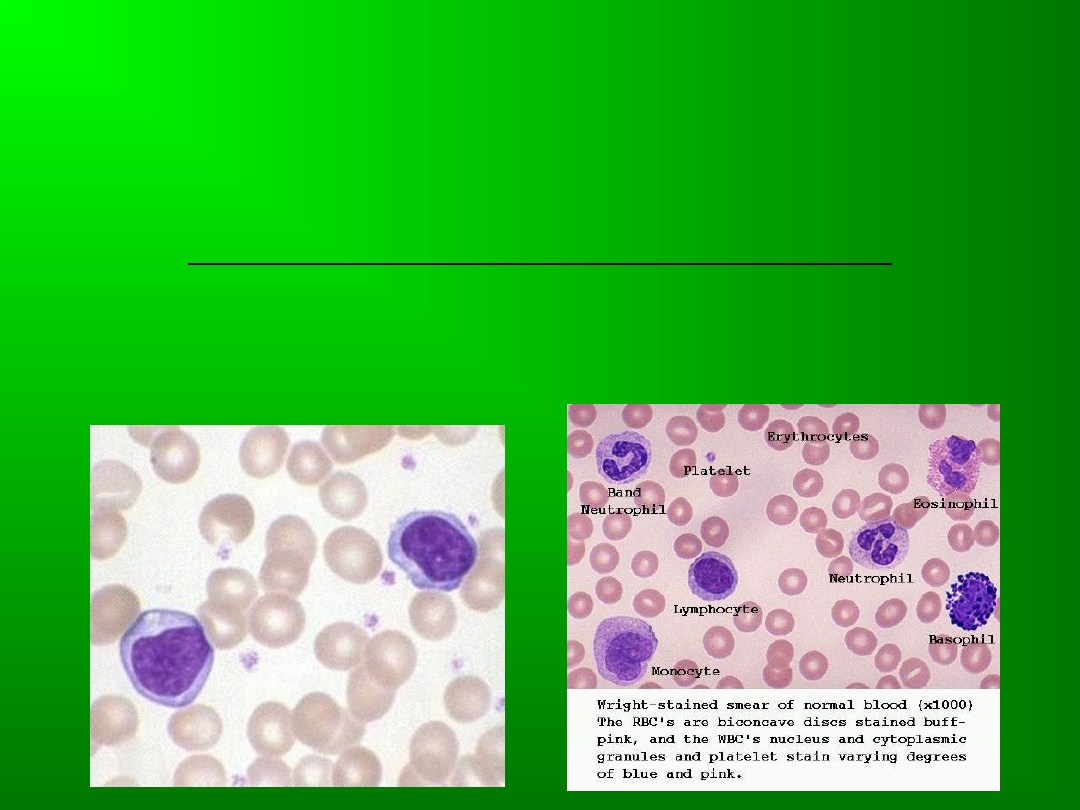
Limfocyty-komórki układu odpornościowego, należące do
leukocytów. Morfologicznie charakteryzują się obecnością
dużego jądra komórkowego oraz małą ilością cytoplazmy.
Stanowią ok. 25% całkowitej liczby leukocytów.
Morfologicznie możemy podzielić limfocyty na:
*małe limfocyty -duże jądro, mało cytoplazmy
*duże limfocyty -mniejsze jądro, więcej cytoplazmy
zawierającej ziarna azurofilne

Morfologiczne właściwości limfocytów nie pokrywają się z
funkcjami jakie pełnią w organizmie, tzn. na podstawie
morfologii danego limfocytu nie można ustalić jego funkcji.
Jest to możliwe dzięki obecności markerów powierzchniowych
charakterystycznych dla danej grupy limfocytów.
Receptory powierzchniowe
limfocytów T:
TCR (T-cell receptor)- receptor
limfocytów T
CD2
CD3
CD4
CD5
CD7
CD8
CD28
CD40L
TCR (T cell receptor)-receptor limfocytów T
Wyróżniamy dwa główne rodzaje receptorów TCR:
składające się z łańcuchów α i β (90% limfocytów krwi człowieka)
składające się z łańcuchów γ i δ.
Receptory αβ oraz γδ łączą się w błonie limfocytów T
z kompleksem CD3.
Średnio na limfocycie znajduje się ok. 5x104 receptorów TCR.
Receptory TCR biorą udział w
rozpoznawaniu przetworzonego
antygenu występującego na
powierzchni komórki prezentującej
antygen (APC- antigen presenting
cell).

Wyróżniamy dwa główne rodzaje receptorów TCR:
składające się z łańcuchów α i β (90% limfocytów krwi
człowieka)
składające się z łańcuchów γ i δ.
Receptory αβ oraz γδ łączą się w błonie limfocytów T z kompleksem
CD3.
TCR
• W receptorach αβ łańcuchy połączone
są mostkiem dwusiarczkowym.
• W częściach zmiennych łańcuchów
TCR można wyróżnić trzy regiony
hiperzmienne, czyli regiony
determinujące dopasowanie
(CDR). W kontakcie z antygenem
prezentowanym przez cząsteczki MHC
najistotniejsze znaczenie mają
regiony CDR3 łańcuchów α i β w
których występuje największa
zmienność.
• TCR zbudowany jest z dwóch łańcuchów, z których każdy
posiada część zmienną oraz część stałą.
• Łańcuchy związane są z komórką poprzez krótki odcinek
śródbłonowy i krótki odcinek wewnątrzkomórkowy.
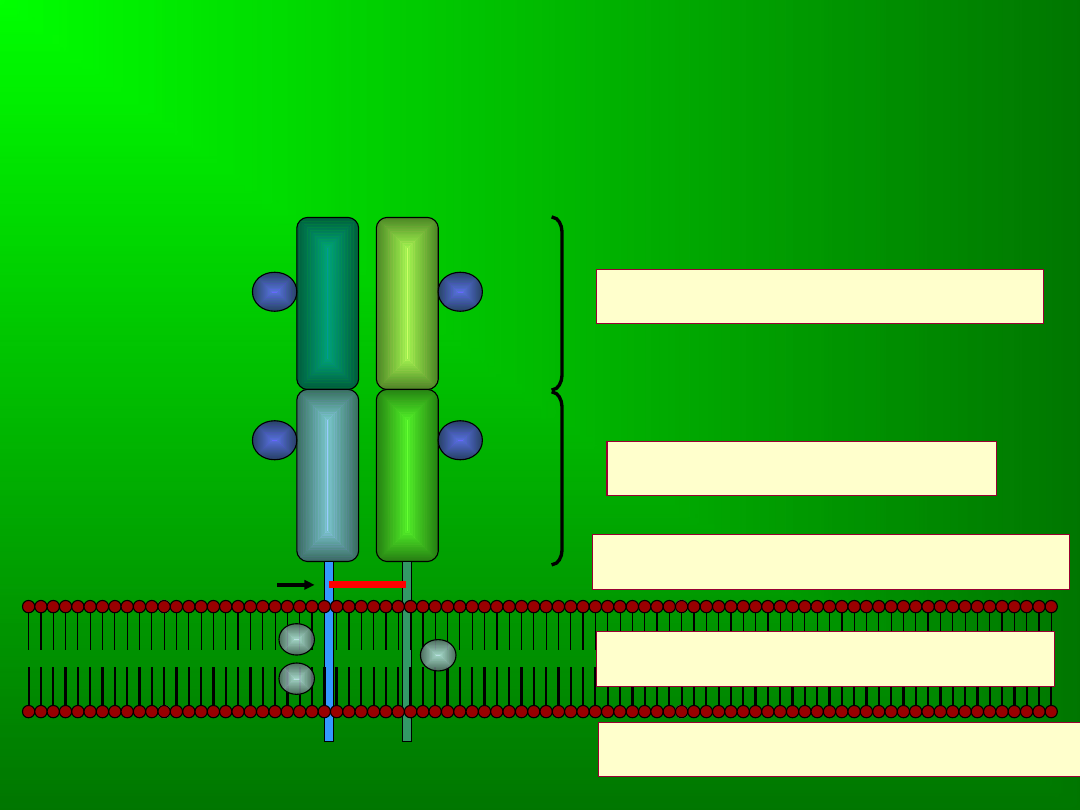
Struktura TCR
CHO
CHO
CHO
CHO
Region “V”- zmienny
Region “C” - stały
Region zawiasowy “H”
Łańcuch
Alpha
Łańcuch
Beta
Mostek dwusiarczkowy
Odcinek śródbłonowy
Cześć cytoplazmatyczna
+
+
+
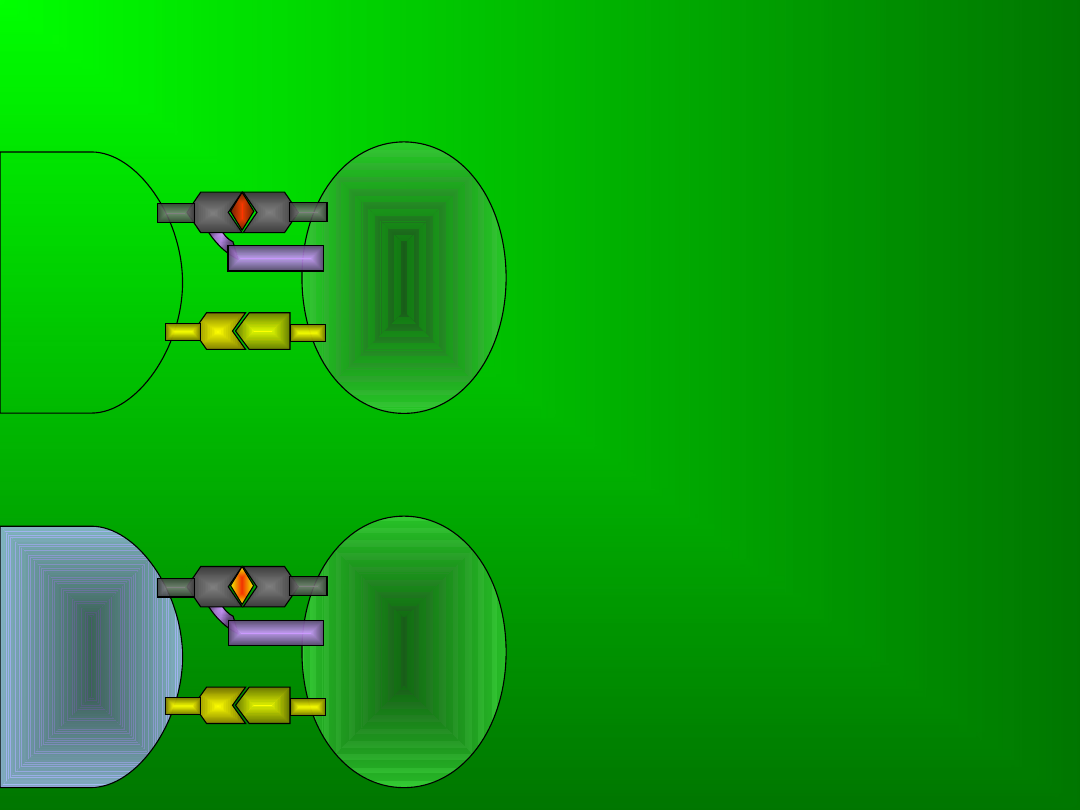
TCR rozpoznaje właściwy
sobie antygen – pobudzenie
receptora i rozwój
odpowiedzi
immunologicznej
TCR wiąże antygen podobny
– brak odpowiedzi
immunologicznej/hamowani
e odpowiedzi na właściwy
antygen
APC
limfocy
t
CD28
TCR
MHC
B7.1/B7
.2
APC
limfocy
t
CD28
TCR
MHC
B7.1/B7
.2
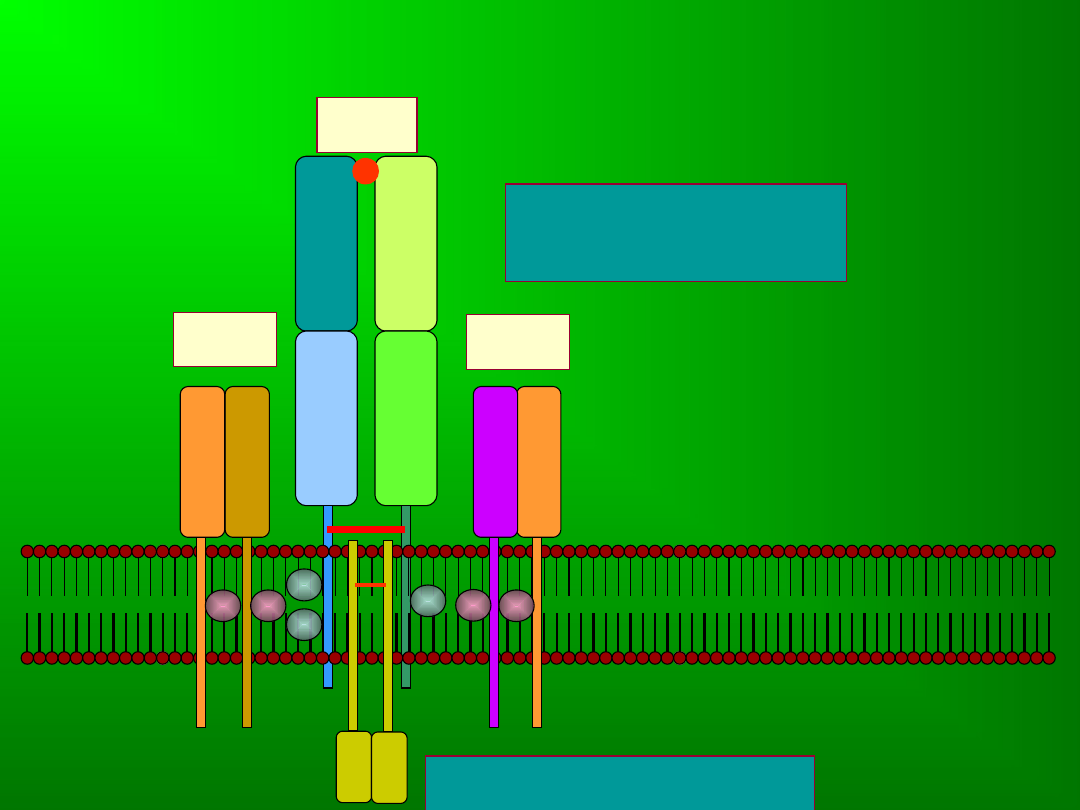
Kompleks CD3 i TCR
α
β
+
+
+
δ
ε
ε
γ
ζ ζ
-
-
- -
TCR
CD3
CD3
Rozpoznanie
antygenu
Przekazanie sygnału
Łańcuchy CD3 pośredniczą w
przekazywaniu sygnału
aktywującego komórkę z
receptora limfocytu T, który
związał antygen, do wnętrza
komórki. Kompleks CD3 u
człowieka składa się z czterech
łańcuchów: γ, , ε, .
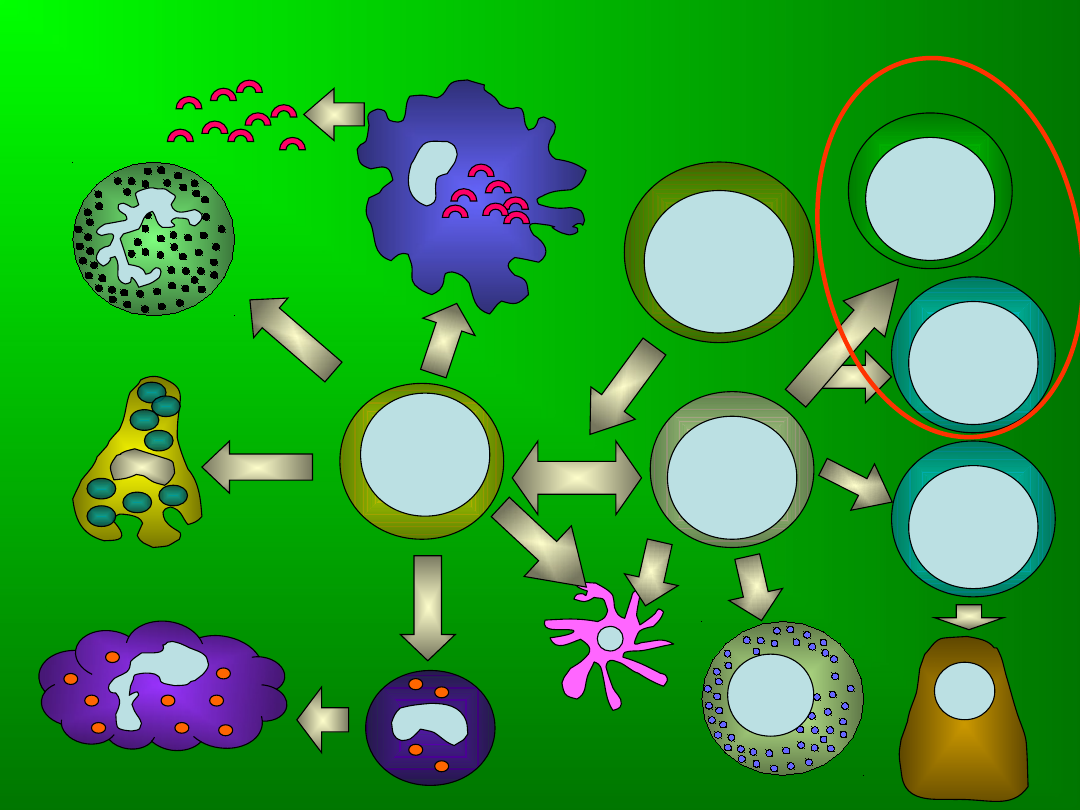
Hematopoeza
NK
Limfoidalna
komórka
progenitorowa
Limfocyty Tc
Limfocyty Th
Komórka macierzysta
Limfocyty B
Granuloc
yty
Trombocyty
Megakariocyty
Makrofagi
Monocyty
Komórki
dendrytyczne
Komórki
plazamatyc
zne
Komórki tuczne
Mieloidalna
Komórka
progenitorowa

• Limfocyty T dojrzewają w
grasicy
.
• Komórki progenitorowe limfocytów T napływają do grasicy już w 7-8
tygodniu ciąży. Początkowo prekursory limfocytów T powstają w
płodowym pęcherzyku żółtkowym oraz w wątrobie płodowej. W
późniejszym okresie oraz po urodzeniu docierają do grasicy ze szpiku.
• Llimfocyty przebywające i dojrzewające w grasicy nazywamy
tymocytami
.
• W czasie dojrzewania w procesach selekcji ginie ok. 90% tymocytów
tzw. wąskie gardła tymopoezy.
• W grasicy możemy wyróżnić, w zależności od stopnia dojrzałości, cztery
populacje limfocytów T:
- tymocyty potrójnie ujemne CD4-/CD8-/TCR- (hetrogenna populacja
stanowiąca 1-2% wszystkich tymocytów grasicy)
- tymocyty podwójnie dodatnie CD4+/CD8+
- tymocyty CD4+ lub CD8+
- dojrzałe limfocyty T
• W procesie dojrzewania limfocytów T możemy wyróżnić dwie fazy:
– fazę wczesną
– fazę późną
Dojrzewanie limfocytów T

Faza wczesna dojrzewania
limfocytów T
• Zasiedlenie grasicy przez powstałe w szpiku komórki
progenitorowe
• Ekspansja komórek zasiedlających
• Ukierunkowanie w stronę wczesnych tymocytów
– komórki pro-T (Kit+/CD44+/CD25-)
– komórki pro-T (Kit+/CD44+/CD25+)
– wczesne komórki pre-T (Kit-/CD44-/CD25+)
Kit- (CD 117-receptor dla czynnika komórek macierzystych
CD44- (receptor zasiedlania umożliwiający dotarcie komórek progenitorowych do
grasicy)
CD25- (łańcuch α receptora dla IL-2)
• Rearanżacja genów dla TCR
• Selekcja β; komórki, które nie zaaranżowały prawidłowo genu TCRβ,
ulegają apoptozie lub mogą się rozwijać w kierunku limfocytów γδ.
W limfocytach, które z powodzeniem przeszły selekcję β, nie dochodzi do
rearanżacji genów TCRβ w chromosomie homologicznym- wyłączenie
alleliczne.
• Wyłączenie izotypowe polega na zahamowaniu rearanżacji i ekspresji
segmentów genów kodujących receptor TCR γδ
• Zróżnicowanie w kierunku linii αβ lub γδ

• Ma na celu wyłonienie limfocytów T mogących rozpoznawać
antygeny prezentowane w kontekście MHC i usunięcie
limfocytów mogących niszczyć własne antygeny organizmu.
• Uczestniczą w niej limfocyty mające na swej powierzchni
w pełni wytworzony kompleks TCR oraz cząsteczki CD4
i cząsteczki CD8.
• Wyróżniamy dwa główne etapy fazy późnej:
– selekcję pozytywną przebiegająca z restrykcją MHC
(z udziałem korowych komórek nabłonkowych, które
swoimi wypustkami otaczają nawet kilkaset tymocytów
prezentując im antygeny w połączeniu z cząsteczkami
MHC klasy I i II)
– selekcję negatywną (w której uczestniczą grasicze
komórki dendrytyczne oraz komórki nabłonkowe rdzenia
grasicy).
Późna faza dojrzewania
limfocytów T

Główny układ zgodności tkankowej
(MHC, z ang. major histocompatibility complex) – zespół
białek, odpowiedzialnych za prezentację antygenów
limfocytom T.
•
MHC klasy I
wystepują na powierzchni wszystkich
komórek jądrzastych.
•
MHC klasy II
wystepuja na powierzchni komórek
prezentujących antygeny jak: limfocyty B, makrofagi,
komórki dendrytyczne, a także na komórkach
nabłonkowych grasicy. W wyniku aktywacji lub
oddziaływania niektórych cytokin np. IFNγ mogą pojawiać
się na wielu innych komórkach – pobudzonych
limfocytach T, komórkach śródbłonka, komórkach
nabłonka tarczycy, komórkach nabłonka jelitowego,
fibroblastach, keratynocytach.
U człowieka cząsteczki MHC klasy II występują
konstytutywnie na komórkach śródbłonka naczyń w sercu
i nerce.
Selekcja pozytywna i restrykcja MHC
4-
8-
4+/-
8+
4+ 8+
TCR low
4+ 8+
TCR low
4+ 8+
TCR low
4+ 8+
TCR low
Rozpoznaje
MHC I
Rozpoznaje
MHC II
Nie rozpozanje
MHC
Apoptoza – „śmierć z
zaniedbania”
8+
TCR high
8+
TCR high
4+
TCR high
4+
TCR high
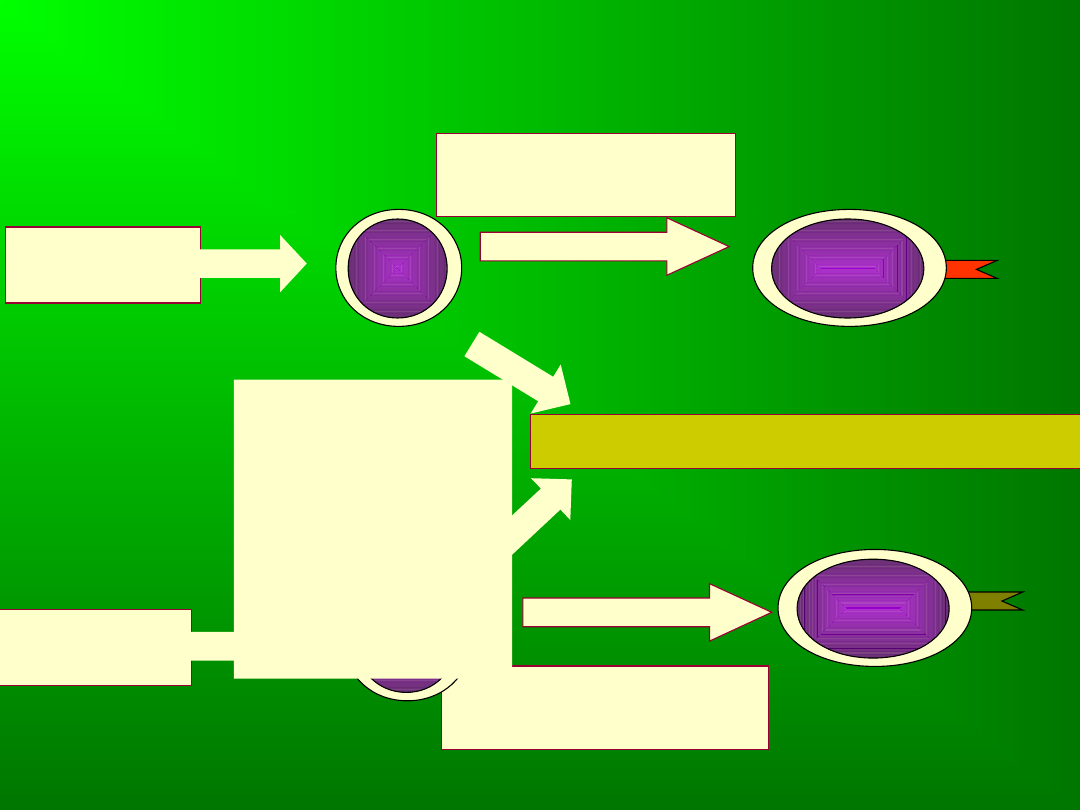
Selekcja negatywna
Brak reakcji z
autoantygenami
Brak interakcji
z autoantygenami
8+
TCR high
4+
TCR high
Apoptoza indukowana TCR
Dojrzałe limfocyty T
Rozpoznaje
MHC I
Rozpoznaje
MHC II
8+
TCR high
4+
TCR high
Duże
powinnowactw
o
do
autoantygenó
w
Dojrzałe limfocyty T
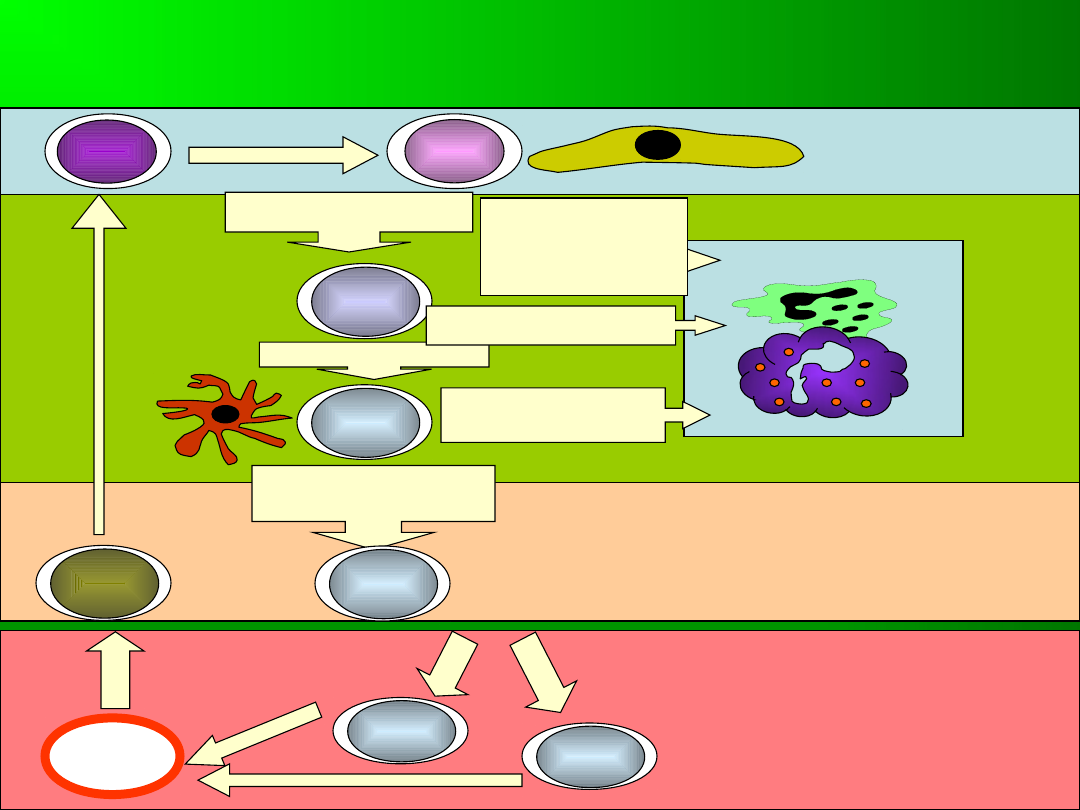
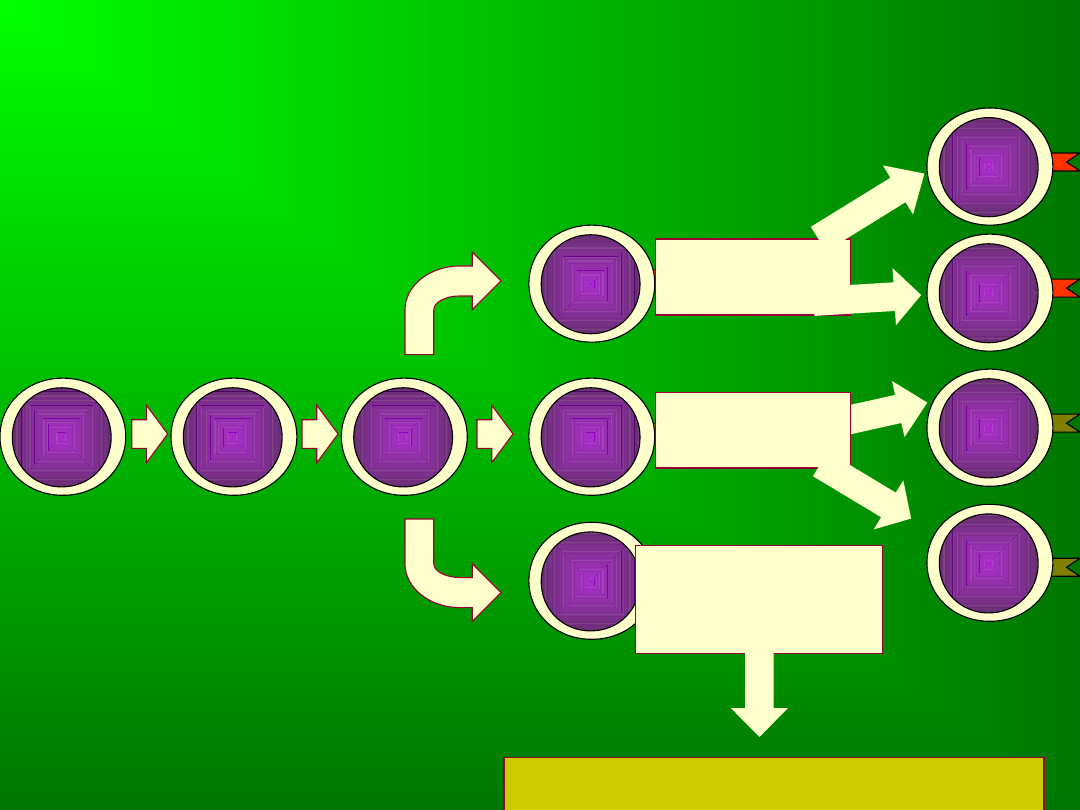
Dojrzewanie limfocytów T i ich migracja w
grasicy
4 -
8 low
4 low
8 low
4 + 8 +
TCR
4 + 8 +
TCR
makrofag
makrofag
Prawidłowa rearanżacja
TCR
Nieprawidłow
a rearanżacja
TCR
Rozpoznanie auto MHC
Brak interakcji z auto MHC
TCR nie rozpoznaje
własnych antygenów
TCR
rozpoznaje własne
antygeny
APOPTOZA
4 + 8 +
TCR
4 - 8 -
Region
podtorebkow
y
Kora
Granica kory i rdzenia
4 + 8 -
TCR
4 - 8 +
TCR
Krwiobieg
Rdzeń

Limfocyty T możemy podzielić:
• ze względu na budowę TCR
– Tαβ
– Tγδ
• ze względu na ekspresję cząsteczek CD4
i CD8
– limfocyty T CD4+
– limocyty T CD8+
• ze względu na funkcję
– limfocyty T pomocnicze Th
– limfocyty T cytotoksyczne Tc
– limocyty T regulatorowe Treg
Limfocyty T
Limfocyty T pomocnicze
(Th)
• Charakteryzują się ekspresją antygenu
CD4
, rozpoznają
antygen prezentowany w kontekście
MHC klasy II
.
• Wspomagają zarówno odpowiedź typu komórkowego, jak i
humoralnego.
• Limfocyty pomocnicze obejmują dwie subpopulacje
różniące się pod względem czynnościowym –
Th1 i Th2
.
Limfocyty
Th1
działają pomocniczo w odpowiedzi
typu
komórkowego
, a
Th2
w odpowiedzi
humoralnej
.
• Istnieje również subpopulacja
Th0
wydzielająca zarówno
cytokiny Th1 jak i Th2 (np. IL-2, IL-3, IL-4, IL-5, IL-10, IFNγ,
GM-CSF).
• Limfocyty wytwarzające duże ilości TGF-β określane są jako
Th3
.
• Działanie limfocytów Th odbywa się poprzez bezpośredni
kontakt między komórkami, a także poprzez wydzielanie
odpowiednich cytokin.

Limfocyty pomocnicze Th1 i Th2
Th1
Th2
IL-2
+
-
INF-γ
+
-
LT-α
+
-
IL-3
+
+
GM-CSF
+
+
IL-4
-
+
IL-5
-
+
IL-6
-
+
IL-9
-
+
Il-10
-
+
IL-13
-
+
Udział w odpowiedzi typu komórkowego/Nadwrażliwość typu
późnego
++
-
Aktywacja makrofagów
++
-
Pomoc limfocytom B
+/-
++
Wpływ na produkcję IgM, IgG, IgA
+/-
++
Wpływ na produkcję IgE
-
++
Wpływ na powstawanie eozynofilów i komorek tucznych
-
++

Limfocyty T regulatorowe
(supresorowe)
• Limfocyty Treg biorą udział w:
– hamowaniu aktywności autoreaktywnych
limfocytów T-zabezpieczenie przed autoagresją
– tolerancji na antygeny podane doustnie,
„tolerancja pokarmowa”
– tolerancji na tzw. zmienione ligandy peptydowe,
czyli zmienione antygeny nabierające cech
antagonistów
– tolerancji na przeszczepy allogeniczne,
„tolerancja transplantacyjna”
• Limfocyty Treg mogą indukować powstawanie
kolejnych
limfocytów
Treg,
co
umożliwia
przenoszenie
stanu
tolerancji
pomiędzy
osobnikami, „tolerancja infekcyjna”
( Treg mogą hamować nieswoiście odpowiedź również na inne
antygeny, a nie tylko ten, który pobudził ich powstanie- próby
wykorzystania Treg do leczenia chorób autoimmunizacyjnych
w których nieznane są wszystkie autoantygeny indukujące
chorobę)

• Najważniejsze subpopulcje limfocytów Treg
:
–Limfocyty Th2 i Th1 biorące udział w zjawisku
antagonizmu Th1 i Th2, tzw.„dewiacji
immunologicznej”
–Limfocyty Th3 wydzielające głównie transformujący
czynnik wzrostu -TGF-β (transforming growth factor)
–Limfocyty Tr1 wydzielające głównie TGF-β i IL-10
–Limfocyty T CD4+/CD25+/CD62L+
–Limfocyty T CD8+/CD28-
–Wpływ regulatorowy mogą także wywierać niektóre
limfocyty Tc, NKT, Tγδ
Limfocyty T regulatorowe
(supresorowe)

Limfocyty T
cytotoksyczne
• Należą do nich głównie limfocyty T
CD8+
(Tc1-
wydzielające IFN-γ i Tc2 – wydzielające IL-4 i IL-5), ale
także:
– limfocyty T αβ CD4+ subpopulacji Th1
– limfocyty Tγδ
– limfocyty NKT
– komórki NK
• Limfocyty cytotoksyczne rozpoznają obce cząsteczki
MHC I
lub antygeny prezentowane w
kontekście MHC I
• Ich głównym zadaniem jest eliminacja komórek
zakażonych przez wirusy i inne patogeny
wewnątrzkomórkowe oraz niszczenia komórek
nowotworowych
• Limfocyty cytotoksyczne mogą także hamować
replikację wirusów w zakażonych komórkach bez ich
niszczenia.

Limfocyty Tγδ
• U człowieka stanowią ok. 5% obwodowych limfocytów
• Powstają w grasicy, mogą jednak różnicować się i
podlegać selekcji także poza nią.
• Biorą udział w odporności przeciwzakaźnej i
przeciwnowotworowej.
• Wydzielają cytokiny stymulujące odpowiedź
immunologiczną (np. IFNγ).
• Większość z nich ma zdolność rozpoznawania
antygenów nie przetworzonych przez komórki
prezentujące antygen i nie połączonych z MHC, a
także do cytotoksyczności komórkowej zależnej od
przeciwciał.
• Mogą rozpoznawać antygeny związane z cząsteczką
CD1.
• Rozpoznają antygeny takie jak:
– białka szoku cieplnego (HSP)
– cząsteczki MICA i MICB (występujące na komórkach podanych
szokowi cieplnemu i komórkach nowotworowych)
– tzw. fosfoantygeny (np. pirofosforan izopentynylu,
geranylopirofosforan, farnezylopirofosforan)

Komórki NK
• Są to duże ziarniste limfocyty
• Mają zdolność spontanicznego (bez wcześniejszego
kontaktu
z
antygenem)
zabijania
komórek
nowotworowych i zakażonych wirusami.
• Proces ten nie podlega restrykcji MHC
• Prawdopodobnie uczestniczą także w procesie
immunoregulacji.
• Stanowią ok. 10% limfocytów krwi obwodowej
człowieka i są pochodzenia szpikowego.
• Główną cytokiną stymulującą ich aktywność jest IL-2,
ale także IL-12, IL-15, IL-21. Hamująco na komorki NK
działają PGE2, TGF-β, kortyzol, PDGF (platelet-derived
growth factor)- płytkopochodny czynnik wzrostu

Komórki NK
• Morfologia komórek NK
– liczne azurofilne ziarnistości cytoplazmatyczne
– niska wartość stosunku powierzchni jądra do
powierzchni cytoplazmy (ok. 0,6)
– nerkowate jądro z heterogenną cytoplazmą i
jąderkiem
– liczne mikrokosmki i pofałdowania błony
komórkowej
• Immunofenotypowo komórki NK możemy
scharakteryzować jako CD3-/CD16+/CD56+

Limfocyty NKT (natural killer T
cells)
• Są to komórki mające cechy zarówno limfocytów T,
jak i komórek NK.
• TCR limfocytów NKT zbudowany z łańcuchów αβ.
Większość z nich należy do limfocytów T CD4- CD8-, a
tylko część z nich wykazuje ekspresję CD4.
• Rozpoznają głównie antygeny glikolipidowe
prezentowane poprzez cząsteczki CD1.
• Aktywowane wydzielają IL-4, IFNγ a także IL-13, GM-
CSF, chemokinę MIP-1α , limfotoksyny.
• Biorą udział w odpowiedzi przeciwnowotworowej
i immunoregulacji. Zaburzenia ich funkcji mogą
prowadzić do chorób autoimmunizacyjnych.

Komórki LAK
(lymphokine-activated killers)
Heterogenna grupa limfocytów aktywowanych
in vitro cytokinami (IL-2), wykazująca dużą
aktywność cytotoksyczną wobec autologicznych
komórek nowotworowych. Zakres ich działania
jest znacznie szerszy niż komórek NK. Mechanizm
cytotoksyczności jest podobny do mechanizmów
litycznych limfocytów T cytotoksycznych oraz
komórek NK i jest uzależniony od udziału
perforyny i granzymów zawartych w ich ziarnach.
Można wśród nich wyróżnić frakcję
charakteryzującą się zdolnością przylegania do
plastikowych powierzchni.

Komórki TIL
(tumor-infiltrating lymphocytes)
Heterogenna grupa limfocytów wyizolowanych z
guza
nowotworowego,
zdolna
do
zabijana
autologicznych
i
allogenicznych
komórek
nowotworowych.

Komórki „veto”
• Enigmatyczna subpopulacja komórek, nie
poznano charakterystycznego fenotypu.
• Mają zdolność inaktywowania i zabijania
limfocytów T na drodze bezpośredniego kontaktu.
• Ich działanie odbywa się poprzez oddziaływania
Fas – FasL.
• Podobne właściwości mogą przejawiać
keratynocyty, komórki dendrytyczne, komórki
nerwowe i mikrogleju, komórki nabłonka tarczycy.

Aktywacja limfocytów T
• Limfocyty powstałe w grasicy maja fenotyp
tzw. komórek spoczynkowych -limfocyty
dziewicze (naive lymphocytes)
• Aby limfocyt T mógł wziąć udział w odpowiedzi
immunologicznej musi rozpoznać swoisty antygen
prezentowany przez komórki prezentujące
antygen w kontekście MHC i zostać w pełni
aktywowany.
• Aktywacja limfocytu wiąże się z przejściem z fazy
G0 cyklu komórkowego do fazy G1. Morfologicznie
towarzyszy temu zwiększenie objętości całej
komórki i jądra komórkowego, zmiany jego
chromatyny i pojawienie się jąderek. Zmiany te
określamy
mianem
„transformacji
blastycznej”.

Antygenem - może być każda substancja, która wykazuje dwie
cechy:
• immunogenność, czyli zdolność wzbudzenia przeciwko sobie
odpowiedzi odpornościowej swoistej;
• antygenowość, czyli zdolność do reagowania z
przeciwciałami oraz TCR.
Ze względu na występowanie powyższych cech, wyróżnia się
dwa typy antygenów:
• immunogeny - charakteryzujące się tylko immunogenością
• hapteny - wykazujące tylko antygenowość
Ze względu na udział limfocytów T w rozwoju odpowiedzi
immunologicznej na dany antygen można wyróżnić:
• antygeny grasiczozależne, które wymagają udziału
limfocytów T do wzbudzenia odpowiedzi immunologicznej
• antygeny grasiczoniezależne, nie wymagające udziału
limfocytów T w indukcji odpowiedzi immunologicznej
Antygeny

Antygeny można także podzielić ze względu na liczbę
epitopów
na
pojedynczej
cząsteczce
antygenu
rozpoznawanych przez dane przeciwciało. Są to:
• antygeny monowalentne, zawierające tylko jeden
epitop i wiążące się z pojedynczym paratopem. Zawsze
monowalentne są hapteny.
• antygeny poliwalentne, wiążące się z kilkoma
paratopami jednocześnie. Ten typ antygenów może tworzyć
duże,
wytrącające
się
w
tkankach
kompleksy
immunnologiczne i być odpowiedzialny za pewne stany
patologiczne.
Można także dokonać podziału antygenów na podstawie
"pokrewieństwa"
z
antygenami
danego
organizmu.
Wyróżnia
się
wtedy
autoantygeny,
izoantygeny,
alloantygeny oraz heteroantygeny.
Antygeny mogą być pochodzenia zewnętrznego,
wprowadzone do organizmu, np. bakterie, ich toksyny, obce
białka.
Występują również antygeny naturalne, wytwarzane
przez organizm, np.: antygeny krwinkowe, zgodności
tkankowej.
Obecność
antygenów
naturalnych
na
powierzchni komórek powoduje, że każdy organizm jest
niepowtarzalny, a jego układ odpornościowy rozpoznaje i
akceptuje własne antygeny, a niszczy wszelkie ciała obce
(rozróżnia komórki własne od obcych).
Superantygeny
• Niektóre produkty białkowe pochodzenia
bakteryjnego lub wirusowego wiążące się z
zewnętrzną powierzchnią cząsteczki MHC klasy II i
z częścią zmienną łańcucha β TCR
• Nie ulegają przetworzeniu jak antygeny
konwencjonalne i mogą być wiązane przez
określoną grupę TCR stymulując nieswoiście
limfocyty T do wydzielania cytokin oraz efektu
cytotoksycznego
• Należą do nich enterotoksyny Staphyloccocus
oraz toksyna zespołu szoku toksycznego

Prezentacja antygenów z udziałem
cząsteczek MHC klasy I
• Fragmenty peptydów, które są związane przez
cząsteczki MHC klasy I najczęściej pochodzą z
degradacji wirusów zakażających komórki
gospodarza.
• Zdegradowane białka wirusowe (peptydy)
transportowane są do siateczki
śródplazmatycznej przez specyficzne białka
transportujące –TAP. Następnie dochodzi do
połączenia peptydów z cząsteczkami MHC klasy I
(szlak endogenny)
• Kompleks cząsteczka MHC klasy I- peptyd jest
przenoszony na powierzchnię komórki, a
następnie rozpoznawany przez limfocyty T
cytotoksyczne CD8+.
• Podobnie mogą być rozpoznawane komórki
gospodarza transformowane nowotworowo.

Prezentacja antygenów z udziałem
cząsteczek MHC klasy II
• Patogeny oraz antygeny pochodzące z zewnątrz
komórki (szlak egzogenny) są prezentowane
przede wszystkim w połączeniu z cząsteczkami
MHC klasy II.
• W prezentacji antygenów tą drogą uczestniczą
głównie komórki dendrytyczne, limfocyty B oraz
makrofagi.
• Zasadnicze jej etapy to :
- endocytoza antygenów
- proteoliza
- związanie powstałych peptydów przez cząsteczki
MHC klasy II
- egzocytoza i prezentacja antgenów związanych z
cząsteczkami MHC klasy II w błonie komórkowej
limfocytom T pomocniczym CD4+.

Prezentacja antygenów
limfocytom T
w połączeniu z cząsteczkami MHC
Limfocyty T
rozpoznające
CD8+(głównie Tc)
CD4+(głównie Th)
Antygeny
rozpoznawane
Wewnątrzkomórkowe
Głównie
zewnątrzkomórkowe
Miejsce proteolizy
antgenu
Cytoplazma
(proteasom)
Endosomy
Miejsce łączenia
się antygenu z
cząsteczkami MHC
Siateczka
śródplazmatyczna
Endosomy
MHC klasy I
MHC klasy II

Aktywacja limfocytów Th
• Aktywacja limfocytów jest procesem złożonym
obejmującym:
– wytworzenie synapsy immunologicznej – polaryzacja
limfocytu i adhezja limfocytu i APC
– przekazanie dwóch sygnałów aktywacji limfocytowi
dziewiczemu - poprzez receptor TCR rozpoznający
prezentowany antygen i poprzez CD28 pobudzaną przez
cząsteczki kostymulujące
– dojrzewanie synapsy immunologicznej
– przekazanie sygnału do wnętrza komórki i jądra
komórkowego
– transkrypcję genów związanych z procesem aktywacji i
produkcję białek niezbędnych do aktywacji limfocytu
– wydzielanie cytokin i proliferację aktywowanego
limfocytu – wytworzenie klonów limfocytów
rozpoznających i zwalczających antygen
APC
limfocy
t
CD28
TCR
MHC
B7.1/B7
.2
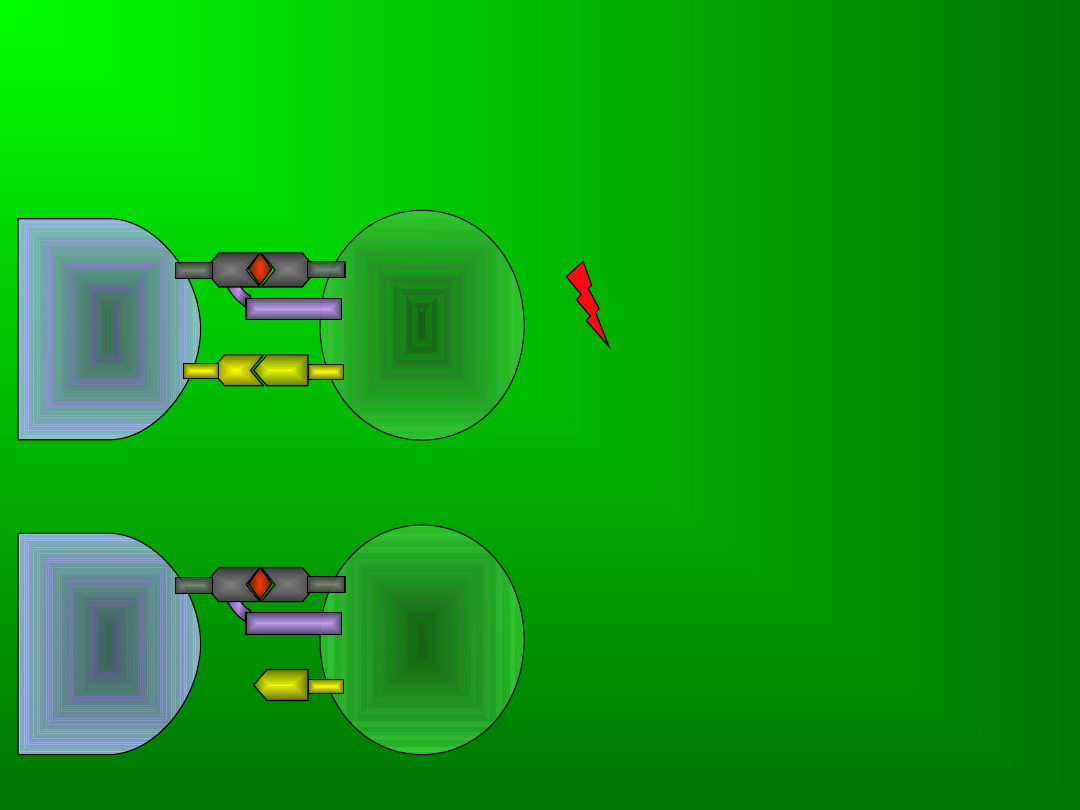
Dwa sygnały – pełna
aktywacja i
odpowiedź
immunologiczna
APC
limfocy
t
CD28
TCR
MHC
Brak drugiego
sygnału – anergia
Teoria „dwóch sygnałów”

Dojrzewanie synapsy
immunologicznej
• Aktywacja limfocytu prowadzi do przegrupowań
białkowo-lipidowych w błonie komórkowej i
skupiania się mikrodomen.
• Mikrodomeny są to rejony błony komórkowej
wzbogacone
w
sfingolipidy
i
cholesterol.
Zawierają także białka błonowe np.: kinazy z
rodziny Src, podjednostki α białek G, białka
powierzchniowe
związane
z
glikozylofosfatydyloinozytolem odpowiedzialne za
przekazanie sygnału aktywującego do wnętrza
komórki.
• Po rozpoznaniu antygenu mikrodomeny skupiają
się wokół kompleksu TCR/CD3.
• W czasie dojrzewania synapsy immunologicznej
rejony mikrodomen są nie tylko wzbogacane w
białka uczestniczące w przekazywaniu sygnału do
wnętrza komórki, ale także są usuwane białka
zbędne (np.CD43 i niektóre fosfatazy).

Przekazanie sygnału do wnętrza
komórki i jądra komórkowego
• Przekazanie sygnału do wnętrza komórki odbywa
się głownie na drodze fosforylacji białek
– aktywacja niereceptorowych kinaz tyrozynowych
– aktywacja białek adaptorowych i kaskada kinaz MAP
– aktywacja czynników transkrypcyjnych
• Transkrypcja genów związanych z procesem
aktywacji (pierwsze produkty tych genów można
wykryć już po 15 min. od kontaktu z antygenem,
a produkcja kolejnych białek wywołana aktywacją
trwa ok. 20 godzin).
• W aktywowanym limfocycie mamy do czynienia
także z ekspresją cząsteczek, które hamują
proces aktywacji np.: CTLA-4 (CD154). Prowadzi
to do ograniczenia odpowiedzi immunologicznej a
następnie do jej wygaśnięcia.
Aktywacja limfocytów Tc
pre-Tc
Tc cell
Th
MHC II
APC
1. Prezentacja
antygenu komórkom
pre-Tc w kontekście
MHC I
IFN
IL-
2
2. APC
prezentuje
antygen
limfocytowi Th w
kontekście MHC
II
3. Th wydziela cytokiny
stymulujące Tc
4. Limfocyt pre-Tc
różnicuje się w pełni
funkcjonalny limfocyt Tc
5. Limfocyt Tc rozpoznaje
antygen w kontekście MHC I na komórkach docelowych
6. Komórka docelowa
jest zabijana
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
Wyszukiwarka
Podobne podstrony:
limfocyty id 268478 Nieznany
Ćw 03c Izolacja limfocytów ze śledziony oraz określanie żywotności komórek
10 dojrzewanie limfoc
Limfocyty T
antygeny trichopyton wplyw na transformacje blastyczna limfocytow
3a Limfocyty
notatki gołąb, 12. Krążenie limfocytów, Immunologia rozrodu
Limfocyty regulatorowe w chorobach autoimmunologicznych, Limfocyty regulatorowe w chorobach autoimmu
immunology & microbiology, LIMFOCYTY Th1 I Th2, LIMFOCYTY Th1 I Th2
Białaczki limfocytowe
Ćw 06b Prezentacja antygenu limfocytom T Połączenie asocjatywne
notatki gołąb, 11. Populacje i subpopulacje limfocytów, Immunologia rozrodu
PREZENTACJA BUDOWA I FUNKCJE LIMFOCYTÓW B i T
Defekt limfocytów B
niedobory limfocytów B
Rola grasicy w powstawaniu limfocytów T, nowotwory grasicy
więcej podobnych podstron