
Katedra i Klinika Chorób Wewnętrznych i Diabetologii
Akademia Medyczna w Warszawie
Dr med. Roman Kuczerowski
Insulinoterapia
Wskazania, preparaty,
algorytmy leczenia

Insulinoterapia u chorych z cukrzyca
typu 2
•
Świeżo rozpoznana cukrzyca objawowa z glikemią
okolo 300 mg/dl (16.7 mmol/l)
•
Cukrzyca długotrwała
•
Stężenia HbA1c > 7% po nieskutecznej terapii
lakami doustnymi
Kryteria rozpoczęcia leczenia insuliną
Wg. Zaleceń PTD 2006

Insulinoterapia
•
Ciąża
•
Cukrzyca typu LADA
•
Zawał serca (3 miesiące)
•
Uzasadnione życzenie pacjenta
Wskazania do insulinoterapii „niezależnie”
od wartości glikemii

Insulinoterapia
•
Dekompensacja cukrzycy wywołana przemijającymi
przyczynami (infekcja, kortykoterapia)
•
Zabieg chirurgiczny
•
Udar mozgu
•
PTCA
Wskazania do czasowej insulinoterapii

Insulinoterapia
•
Kilkakrotnym potwierdzeniu stanu hiperglikemii
•
Rozpoznaniu potencjalnie usuwalnych przyczyn
hiperglikemii takich jak
•
błędy dietetyczne, brak aktywności fizycznej,
•
nieregularne przyjmowanie leków, niewłaściwa
dawka,
•
infekcja
Zmiana sposobu leczenia z terapii doustnej
na leczenie insuliną w przypadku
niewyrównania glikemii powinna nastąpić
po:

Wskazania do insulinoterapii
u chorych z cukrzycą typu 2
Nieskuteczność doustnych leków
hipoglikemizujacych
(u chorych, u których stężenie peptydu C wynosi: na
czczo 0.2 µmol/l, w 6 minucie testu po podaniu
glukagonu 0.4 µmol/l)
Ostre powikłania cukrzycy
Ciąża
Świeży zawał mięśnia sercowego,
Ostry zespół wieńcowy
Ciężkie zakażenia
Okres okołooperacyjny
Nefropatia w okresie niewydolności nerek

Choroba niedokrwienna serca a cukrzyca
Świeży zawał mięśnia serca/Ostry epizod wieńcowy
DIGAMI - 1
Diabetes Mellitus, Insulin Glucose Infusion
in Acute Myocardial Infarction
Choroba niedokrwienna serca a cukrzyca
Świeży zawał mięśnia serca/Ostry epizod wieńcowy
Zawał serca (w ciągu 24 h) + cukrzyca z glikemią >11
mmol/l
(lub + glikemią >11 mmol/l bez uprzednio znanej cukrzycy)
620 osób
Grupa leczona natychmiastowym
iv wlewem z insuliny i glukozy
przez 24h ;
po uzyskaniu stabilnej
normoglikemii - intensywna
insulinoterapia 4 x/d przez 3
miesiące
306 osób, wiek 67 9 l.
Grupa kontrolna
leczenie przeciwcukrzycowe
wg standardów ośrodka,
insulina przy wskazaniach
klinicznych
314 os., wiek 68 9 l.

Choroba niedokrwienna serca a cukrzyca
Świeży zawał mięśnia serca/Ostry epizod wieńcowy
•
Największe korzyści z zastosowania wlewu
insuliny
i glukozy oraz intensywnej insulinoterapii w
odniesieniu do rokowania po zawale serca u osób
z cukrzycą wykazano w podgrupie chorych o
niskim ryzyku ogólnym zgonu i nieleczonych
insuliną przed zawałem (wskaźniki śmiertelności
18% versus 33%, p - 0,004).
•
Na potwierdzenie wniosków postanowiono
przeprowadzić dodatkowe badanie DIGAMI - 2.

Choroba niedokrwienna serca a cukrzyca
Świeży zawał mięśnia serca/Ostry epizod wieńcowy
•
Wg badania DIGAMI-2 istotnym predyktorem
śmiertelności w zawale serca u chorych na cukrzycę jest
poziom glikemii.
•
Należy dążyć do jak najszybszej, pewnej i stałej
normalizacji glikemii.
•
W warunkach postępowania na oddziale intensywnej
terapii,
u chorego ze świeżym zawałem serca, najlepszym,
najszybszym i najbezpieczniejszym sposobem uzyskania
normoglikemii jest dożylne podawanie insuliny z
równoczesnym wlewem glukozy.
Wniosek:
obowiązują nadal wyniki DIGAMI-1

Po upływie ostrej fazy - insulinoterapia (np. insulina
w roztworze 3x oraz insulina NPH przed snem) przez
3 miesiące
Diabetologia pod red. A. Czech i J. Tatonia, t. 1, PZWL,
2001
A.
infuzja iv insuliny - 50j. insuliny w roztworze /50ml
0,9% NaCl; szybkość infuzji by uzyskać glikemię 100 -
150 mg/dl; równoczesna infuzja iv 5% + KCl lub
B.
Insulina, glukoza i KCl i ew. Mg podane w
jednoczasowym wlewie z zachowaniem odpowiednich
proporcji insuliny i glukozy:
(1 – 4j.m. insuliny/5 – 7,5 g glukozy)
Choroba niedokrwienna serca a cukrzyca
Świeży zawał mięśnia serca/Ostry epizod wieńcowy

Cele insulinoterapii
•
fizjologicznego, dobowego profilu zmian
w wydzielaniu insuliny przez komórki ß wysp
trzustkowych
•
odpowiednich zmian w regulacji aktywności tego
hormonu
Idealnym celem insulinoterapii powinno być
naśladowanie:

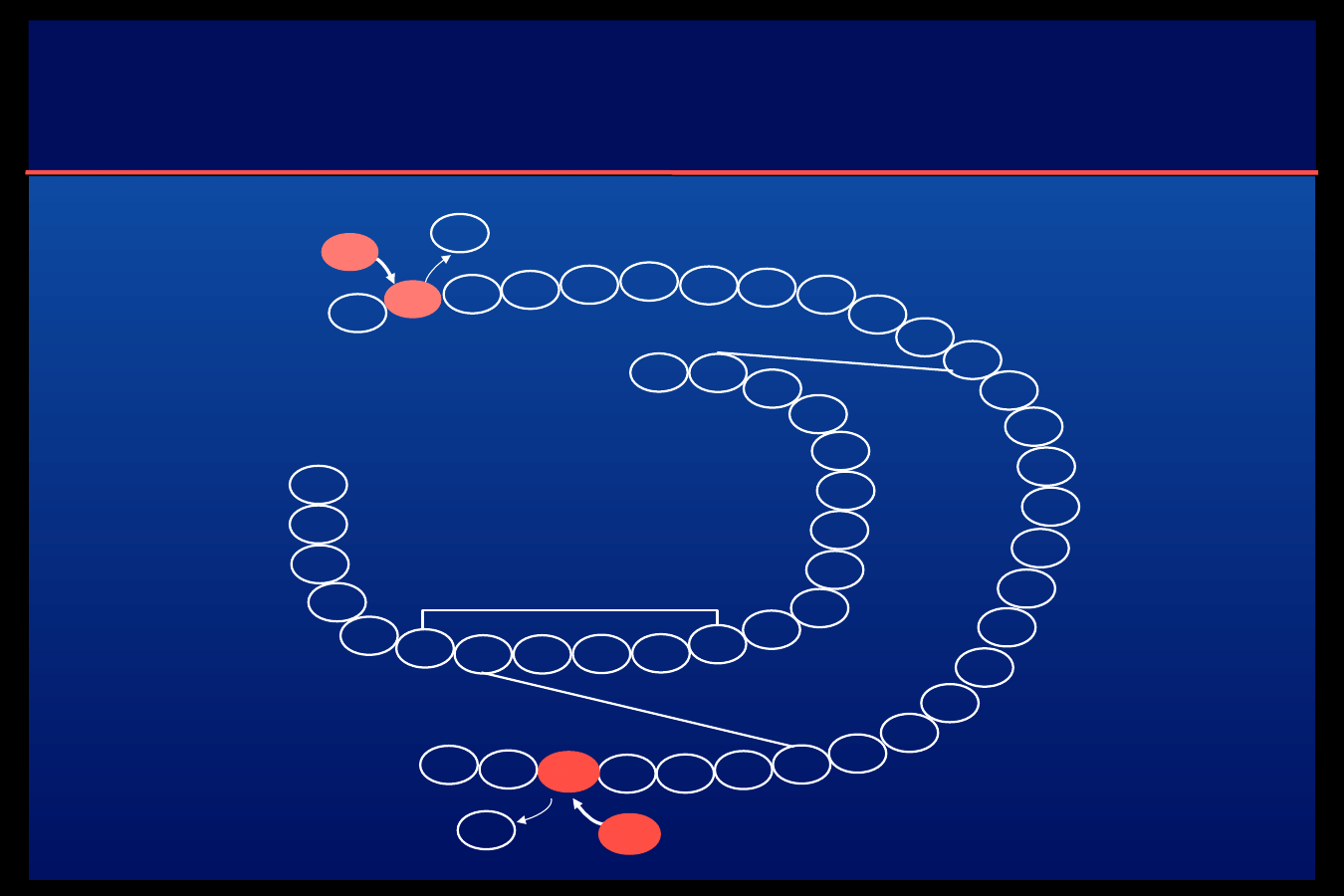
Algorytmy insulinoterapii
Rodzaje insulinoterapii
I n t e n s y w n o ś ć l e c z e n i a i s a m o k o n t r o l i
N a s i l e n i e n i e d o b o r u i n s u l i n y
1 wstrzyknięcie
2 wstrzyknięcia
3-5 wstrzyknięć
Infuzja ciągła
programowana
Pompa
osobista
Insulina
szybka
w roztworze,
insulina
powolna
Insulina
dwufazowa
(mieszanina
szybkiej
i
powolnej)
Insulina
jednofazowa,
powolna
Insulina
dwufazowa
(mieszanina
szybkiej
i
powolnej)
Insulina
jednofazowa,
powolna
Leczenie skojarzone z lekami
doustnymi:
- biguanidy
- akarboza
- pochodne sulfonylomocznika
- glinidy

Terapia skojarzona cukrzycy typu 2:
insulina + doustne leki
przeciwcukrzycowe
•
Terapia skojarzona oferuje:
- poprawę kontroli glikemii przy
zastosowaniu
mniejszej dawki insuliny
- mniejszy przyrost masy ciała
- mniejszą skłonność do hipoglikemii
•
Monoterapia insuliną jest mniej
korzystna:
-
wymaga wielokrotnych wstrzyknięć
- sprzyja szybkiemu przyrostowi masy
ciała
- może powodować stany hipoglikemii

Cele insulinoterapii konwencjonalnej
Zwiększenie podstawowego stężenia insuliny
w okresie nocnym
(jedno wstrzyknięcie na
noc)
- hamowanie glukoneogenezy wątrobowej
- hamowanie lipolizy w tkance tłuszczowej
2.
Podwyższenie podstawowego stężenia
insuliny w okresie dodatkowej choroby
(dwa
wstrzyknięcia)
3.
Dążenie do normoglikemii celem usunięcia
toksycznego wpływu hiperglikemii
(dwa
wstrzyknięcia, leczenie okresowe)

Algorytm jednego wstrzyknięcia
•W przypadku
•hiperglikemii porannej - insulina o
przedłużonym działaniu wieczorem
0,2 jm/kg mc.
•Normoglikemia na czczo insulina o
przedlużonym dzialaniu rano
•z doustnymi lekami
hipoglikemizującymi

Algorytm jednego wstrzyknięcia do 40 j/d
•Przed snem insulina NPH w dawce 0,2
– 0,3 jm/kg mc.
•Mieszanka insuliny szybko i
długodziałającej rano
•Element terapii skojarzonej z
doustnymi lekami
hipoglikemizującymi

Algorytm dwóch wstrzyknięć
• Zapotrzebowanie na insulinę mniejsze niż 60
j/dobę
• W okresie krótkotrwałego stresu katabolicznego
• W celu usunięcia „toksycznego” wpływu
hiperglikemii
• - przed śniadaniem mieszanki – 60% dawki
dobowej
mieszanina insuliny : 30/70 40/60 50/50
- przed kolacją mieszanki – 40% dawki dobowej
mieszanina insuliny : 20/80 30/70

Algorytm trzech wstrzyknięć
Przed śniadaniem: 35 – 40% dawki dobowej
- mieszanina insuliny o typie 30/70 ;
40/60
2. Przed obiadem (ok.16ºº): 15 – 20% dawki
dobowej
- insulina krótkodziałająca
3. Przed kolacją: 30 – 40% dawki dobowej
- mieszanina insuliny o typie 30/70 ;
20/80

Algorytm czterech wstrzyknięć
Przed śniadaniem: 20 – 25% dawki dobowej
- insulina krótkodziałająca
2. Przed obiadem: 15 – 25 % dawki dobowej
- insulina krótkodziałająca
3. Przed kolacją: 20% dawki dobowej
- insulina krótkodziałająca
4. Przed snem (ok.22ºº): 30 - 40% dawki
dobowej
- insulina NPH

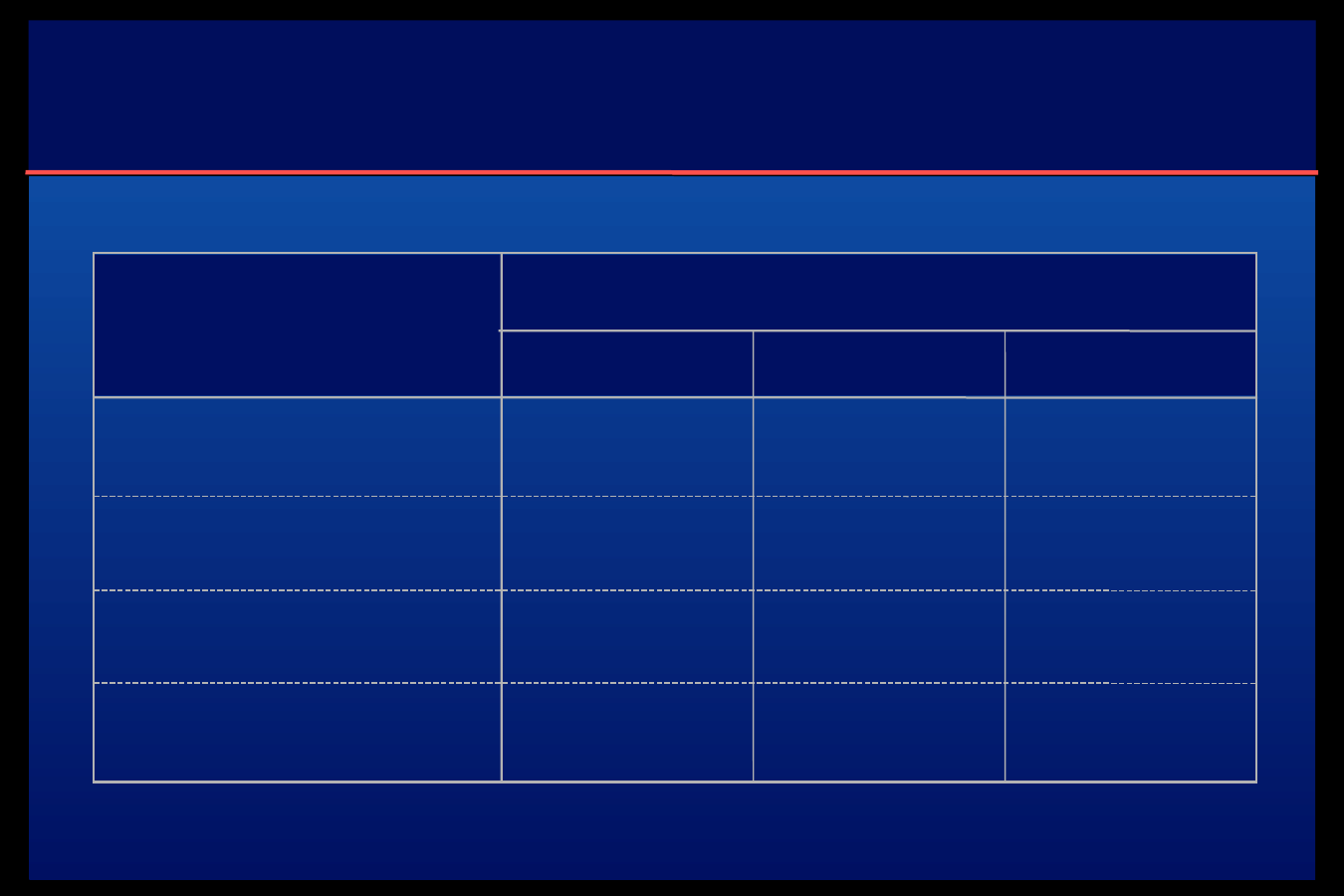
Preparaty insuliny krótkodziałajacej
Actrapid (0.5; 1-3; 8)
Gensulin R (0.5; 1-3; 6-8)
Humulin R (0.5; 1-3; 8)
Maxirapid WOS (0.5; 2.5-5; 7-8)

Preparaty insuliny o pośrednim okrtesie
dzialania
Insulatard (1.5; 4-12; 24)
Gensulin N (1.5; 3-10; 24)
Humulin N (0.5-1; 3-10; 18-20)
Isophanicum WOS (1-2;4-12; 22-24)
Semilente WOS (1-1.5; 5-10; 12-16)
Lente WOS (2; 6-12;24)

Przeszkody utrudniające osiągnięcie celów
idealnej insulinoterapii
•
Insulina podawana jest podskórnie a nie do dorzecza
żyły wrotnej
•
Zmienność wchłaniania
•
Niskie stężenie insuliny bezpośrednio po posiłkach,
a zbyt wysokie między posiłkami wynikające z
właściwości farmakodynamicznych preparatów insuliny

•
bardzo szybkie wchłanianie z miejsca
wstrzyknięcia,
•
bardzo szybkie osiąganie szczytu aktywności,
•
ograniczenie czasu działania do okresu
wchłaniania
z przewodu pokarmowego.
Profil farmakokinetyczny zbliżony do wydzielania
insuliny
w okresie okołoposiłkowym
Cechy idealnej insuliny stosowanej
w okresie okołoposiłkowym

Pod mianem „analogu insuliny” należy
rozumieć biotechnologicznie wytworzoną
cząsteczkę wykazującą:
Definicja analogu insuliny
•
duże podobieństwo do naturalnej insuliny, a więc jej
fizjologiczne działanie
•
jednocześnie różnice w sekwencji aminokwasów,
umożliwiające uzyskanie farmakodynamiki działania
hipoglikemizującego zmodyfikowanej w stosunku do
natywnej insuliny.

•
Region 26-30 łańcucha B insuliny nie ma
istotnego znaczenia dla wiązania z receptorem
insulinowym, natomiast odgrywa ważną rolę w
tworzeniu dimerów insuliny
•
Zmiany w tym regionie są wykorzystywane do
wytwarzania analogów, które zachowują
powinowactwo
do receptora insulinowego i nie mają tendencji
do tworzenia dimerów
Modyfikowanie tworzenia dimerów

•
Insulina Lispro (Humalog) - produkowana metodą
rekombinacji DNA przy użyciu niepatogennych
szczepów Escherichia coli.
•
Insulina Aspart (NovoRapid) - produkowana metodą
rekombinacji DNA z zastosowaniem drożdży
Saccharomyces cerevisiae.
•
Insulina Glulisine (Apidra) – produkowana metodą
rekombinacji DNA przy zastosowaniu
niepatogennych szczepów Escherichia coli (K12).
Analogi insuliny szybkodziałające
Struktura pierwszorzędowa insuliny Lispro
Rosskamp i wsp. Diabetes Care. 1999; 23 (suppl 2)
1
1
B28
Lys
S
S
S
S
S
S
łańcuch - A
łańcuch - B
B29
Pro
30
Lys(B28), Pro(B29)
- analog insuliny ludzkiej
otrzymany
metodą rekombinacji DNA
21
Strukutra insuliny Aspart
Thr
Lys
Asp Thr Tyr
Phe Gly Arg
Glu
Gly
Cys
Val
Leu
Tyr
Leu
Tyr
Ala
Glu
Val
His
Ser
Gly
Cys
Leu
His
Gln
Asn
Val
Phe
Gly
Ile
Val
Glu
Gln Cys Cys Thr Ser Ile Cys
Ser
Leu
Tyr
Gln
Leu
Glu
Asn
Tyr
Cys
Asn
10
20
Leu
B1
A1
10
21
Struktura insuliny Glulisine
Lys
Thr
Glu
Thr Tyr
Phe Gly Arg
Glu
Gly
Cys
Val
Leu
Tyr
Leu
Pro
Ala
Glu
Val
His
Ser
Gly
Cys
Leu
His
Gln
Lys
Val
Phe
Gly
Ile
Val
Glu
Gln Cys Cys Thr Ser Ile Cys
Ser
Leu
Tyr
Gln
Leu
Glu
Gln
Tyr
Cys
Asn
10
20
Leu
B1
A1
10
A21
Asp
Lys
B3
Phe
B29
Glu
B30
Farmakokinetyka preparatów insuliny
stosowanych jako bolusy przed posiłkami
Profil działania (godziny)
Preparat
Początek
0,5 - 1,0
0,2 - 0,5
0,2 - 0,5
0,15 -
0,3
Regular
Lispro
Aspart
Glulisine
Szczyt
Czas
2,0 - 3,0
0,5 - 2,0
0,5 - 2,0
0,5 - 2,0
6,0 - 8,0
3,0 - 4,0
3,0 - 5,0
3,0 - 4,0
Oiknine R. et al. Drugs 2005; 65 (3): 325-340
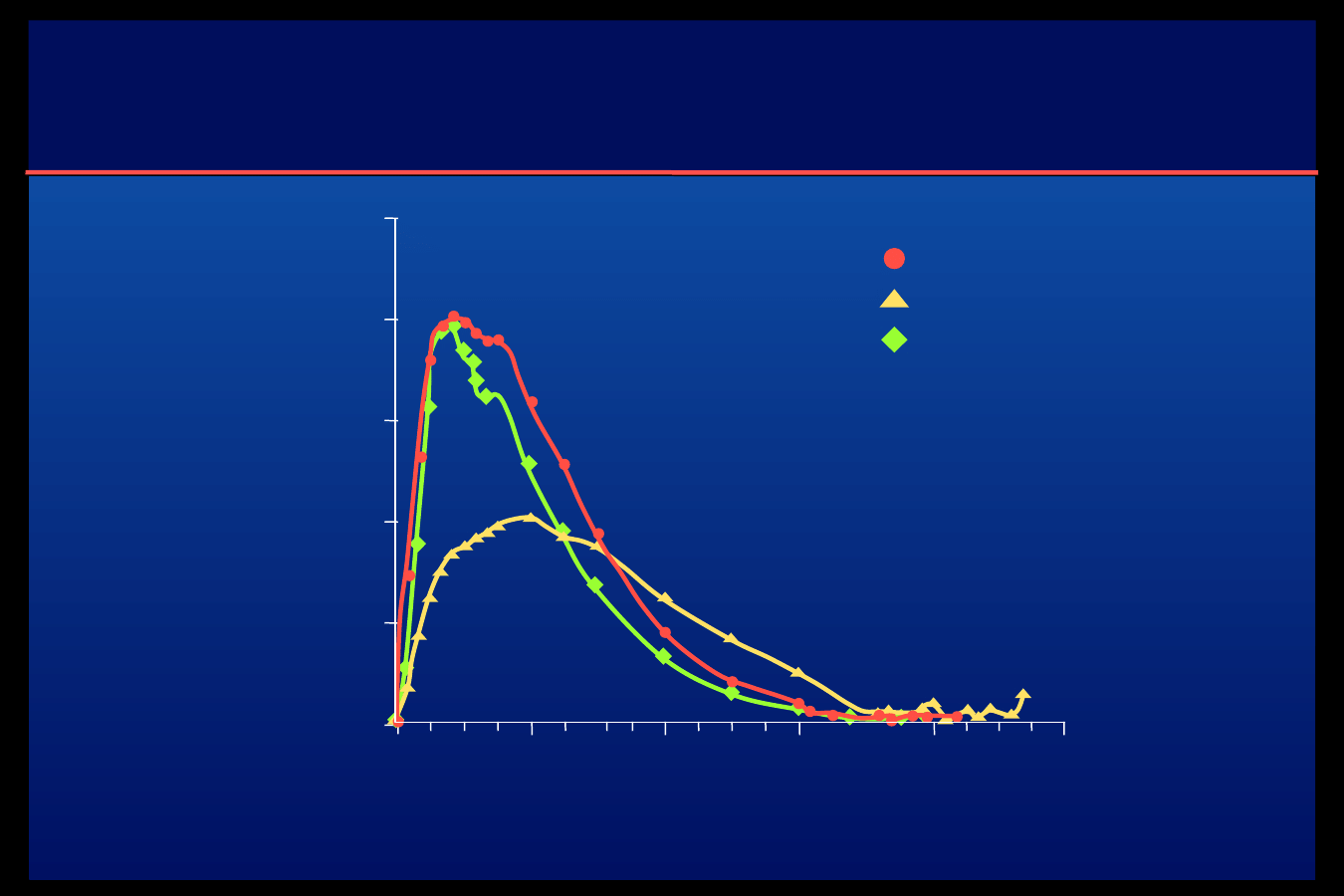
Porównanie właściwości
farmakokinetycznych insulin Glulisine, Lispro
i ludzkiej
Klamra euglikemiczna u 16 osób zdrowych po podskórnym podaniu 0,3 IU/kg
250
200
150
100
50
0
0
120
240
Czas (minuty)
480
600
Glulisine
Regular
Lispro
360
In
su
lin
a
(
µ
U
/l
)

Porównanie skuteczności i bezpieczeństwa
insuliny Glulisine i Lispro
•
672 osoby z cukrzycą typu 1 leczone insuliną > 1
rok
•
HbA
1c
: 6,0% - 11,0%
•
4 tyg. wstępnego leczenia lispro i glarginą
•
Pacjentów metodą randomizacji kwalifikowano do
leczenia insuliną glulisine i glarginą lub lispro i
glarginą
•
Badanie trwało 26 tygodni
Prager R. i wsp. (Abstract EASD 2004)
Prager R. i wsp. (Abstract EASD 2004)
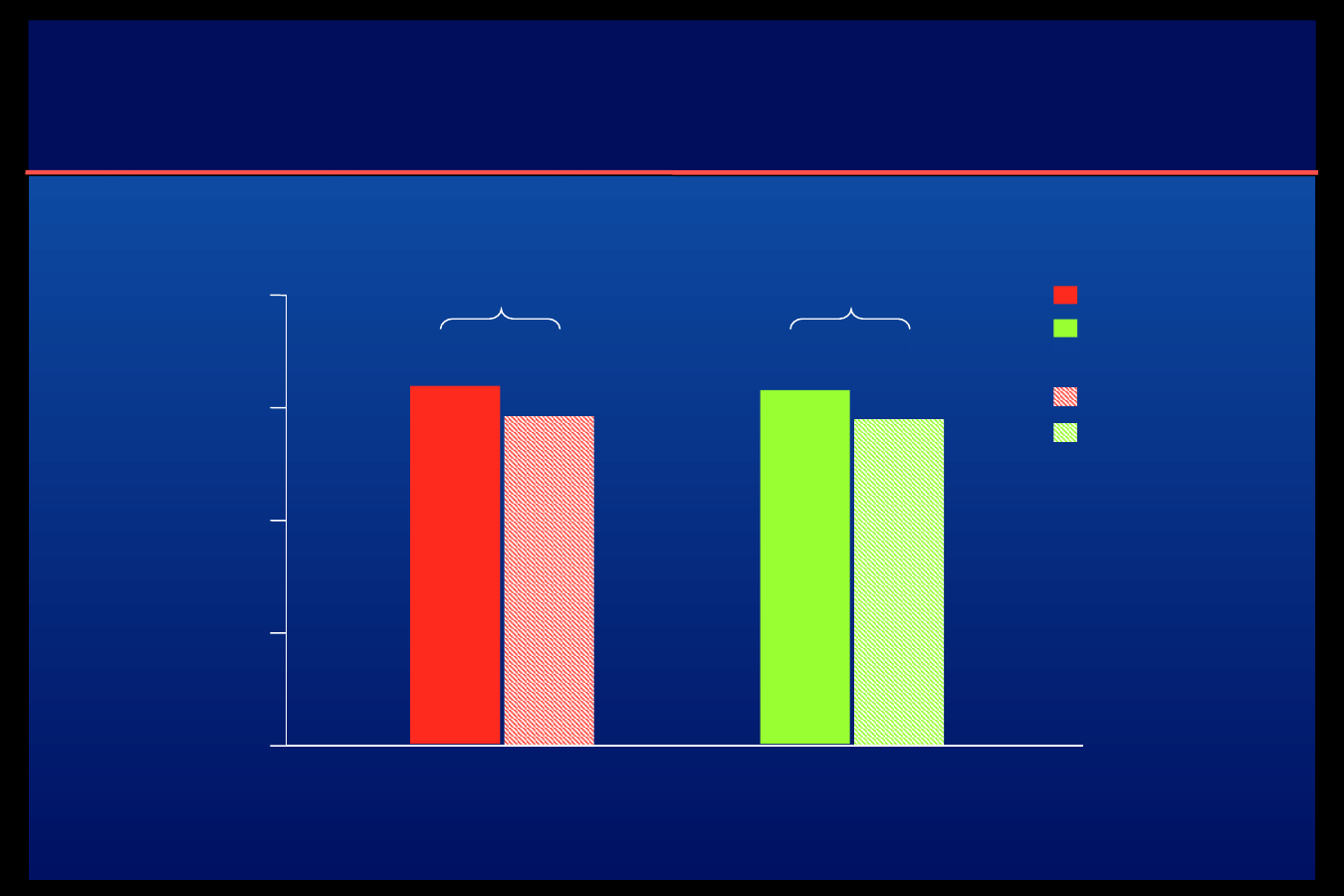
Zmiany w stężeniu HbA
1c
na początku
i na końcu badania
7,60
8,0
7,5
7,0
6,5
6,0
H
b
A
1
c
(
%
)
Insulina glulisine
Insulina lispro
Początek
badania
Koniec badania
7,46
p = 0,0001; = -0,14
7,58
7,45
p = 0,0001; = -0,14
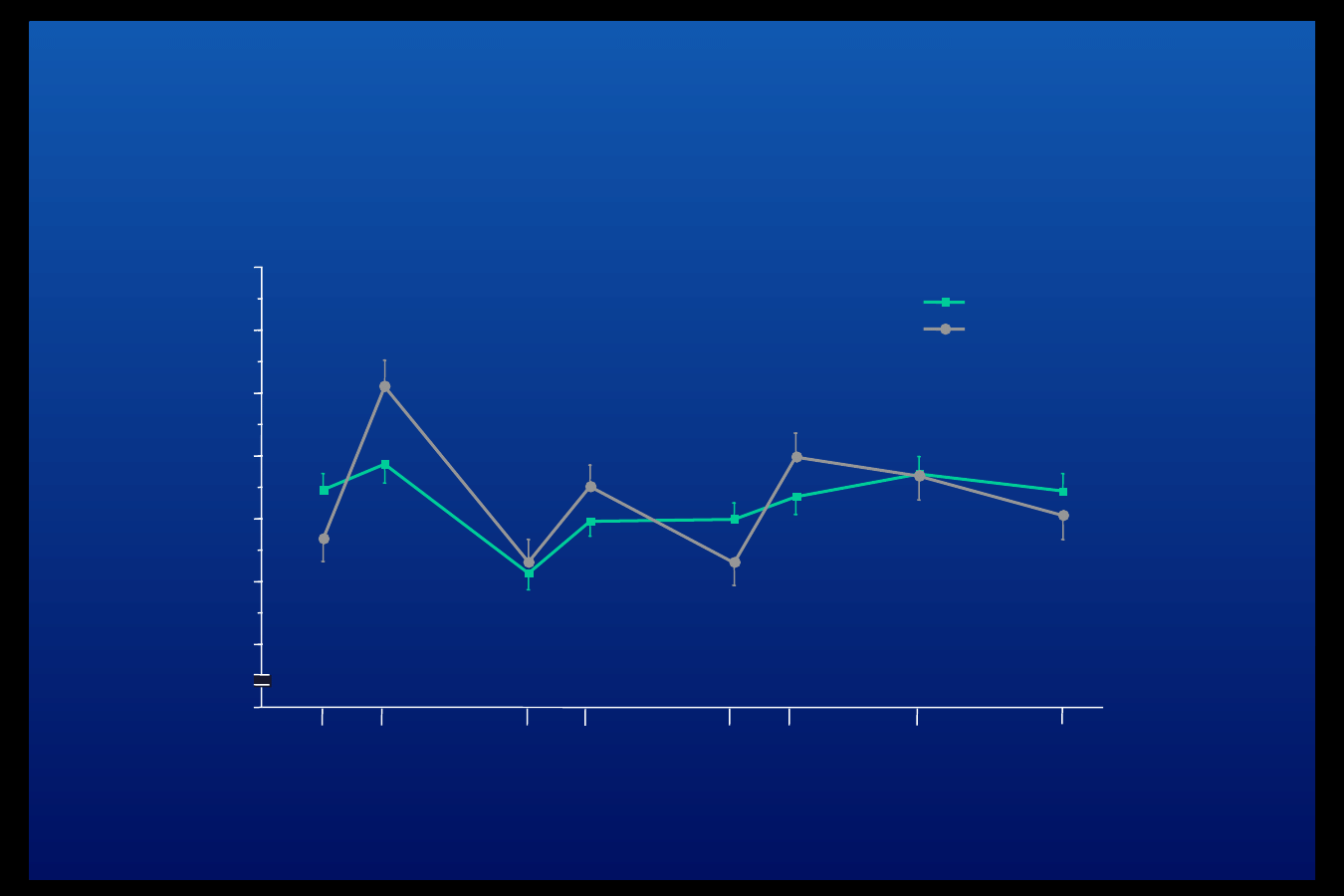
Porównanie stężeń glukozy w ciągu doby
podczas terapii insuliną Aspart i insuliną
ludzką
Insulina aspart
Insulina ludzka
S
tę
że
n
ie
g
lu
ko
zy
(
m
m
o
l/
l)
p < 0.001
p < 0.001
p < 0.01
p < 0.01
p < 0.01
6
7
8
9
10
11
12
0
Przed i
90 min po
śniadaniu
Przed i
90 min po
obiedzie
Przed i
90 min po
Kolacji
Przed
snem
2.00
Home et al. Diabetic Med 2000;17:762-70
n = 1070
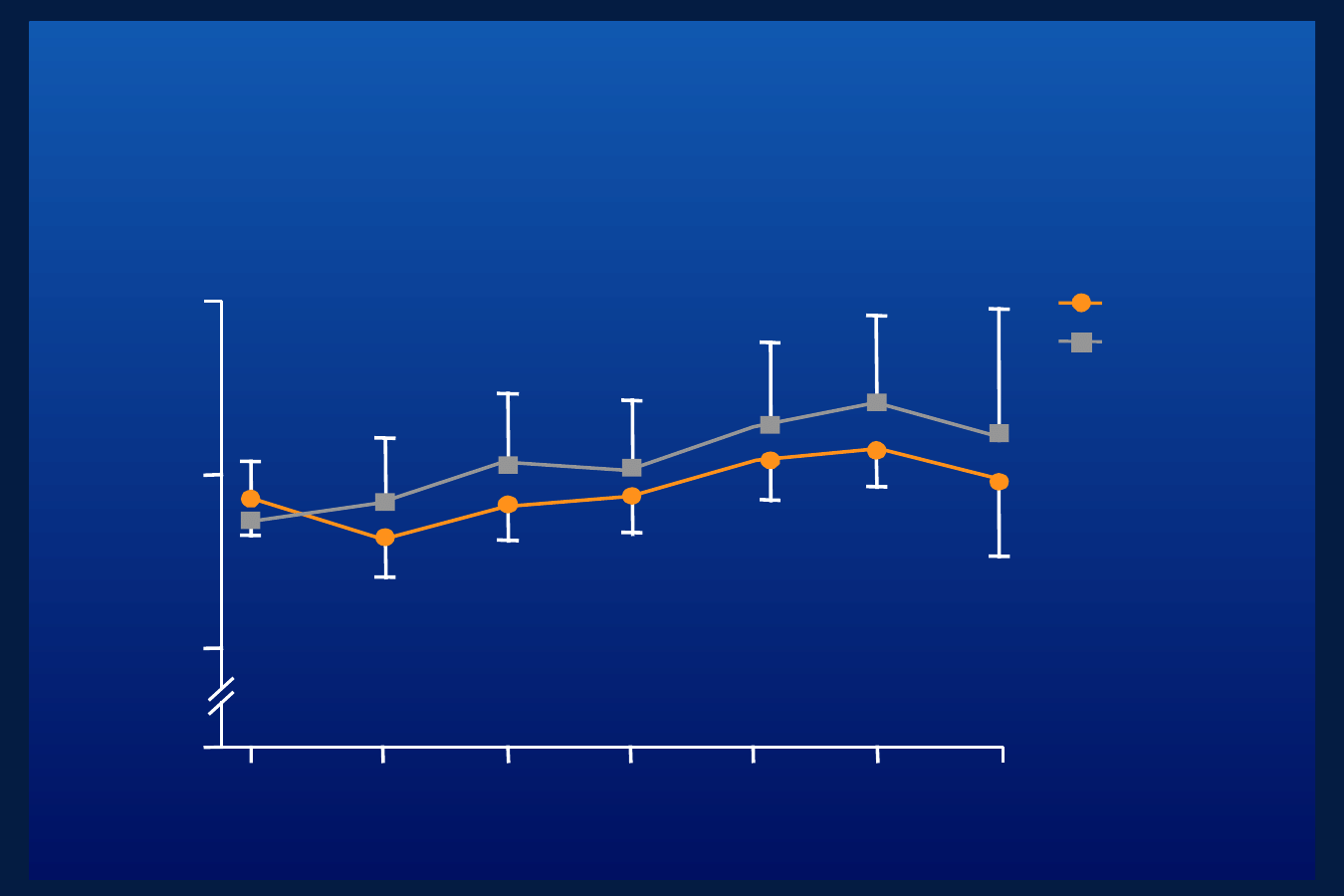
Długofalowa kontrola metaboliczna
cukrzycy podczas terapii insuliną Aspart w
porównaniu do insuliny ludzkiej
Insulina aspart
Insulina ludzka
8.5
8.0
7.5
0
H
b
A
1
c
(
%
)
Miesiące
0
6
12
18
24
30
36
Amiel et al. Diabetologia 2001;44(Suppl. 1):A209
n = 753
Różnica pomiędzy
grupami, p = 0.028
*
*

Porównanie aspart z insuliną ludzką u
322 kobiet w ciąży z cukrzycą typu 1.
•
cięcie cesarskie ze
wskazań nagłych -%
•
stan przedrzucawkowy -
%
•
poród przedwczesny -
%/żywe urodzenia
•
średnia waga ur.
•
liczba epizodów
hipoglikemii noworodków
wymagającej leczenia
/żywe urodzenia
Badana grupa – kobiety w ciąży z DM t.1 , wiek 19 – 43 l., z
HbA1c <=8%
12,7
15,9
8,3
6,7
20
3
0
46/98
52/98
Aspart - 157
Insulina-165
3467
355
5
Ryzyko ciężkich hipoglikemii u matki - w grupie aspart obserwowano tendencję
do niższych wartości glikemii zwł. w nocy, niż w grupie leczonej insuliną ludzką.
Heller S. i wsp./Kaaja R. i wsp., EASD
2006

Analogi insuliny długodziałające
Uzyskuje się przez dwa rodzaje modyfikacji:
•
zmianę punktu izoelektrycznego z pH 5,4 na bardziej
obojętne (pH 6,0 do 7,0). W ten sposób zwiększa się
precypitacja w miejscu wstrzyknięcia i opóźnia się
czas absorpcji
Insulina glargina (LANTUS)
•
zmianę struktury ułatwiającą wiązanie z albuminami,
co wydłuża okres półtrwania
Insulina detemir (Levemir)
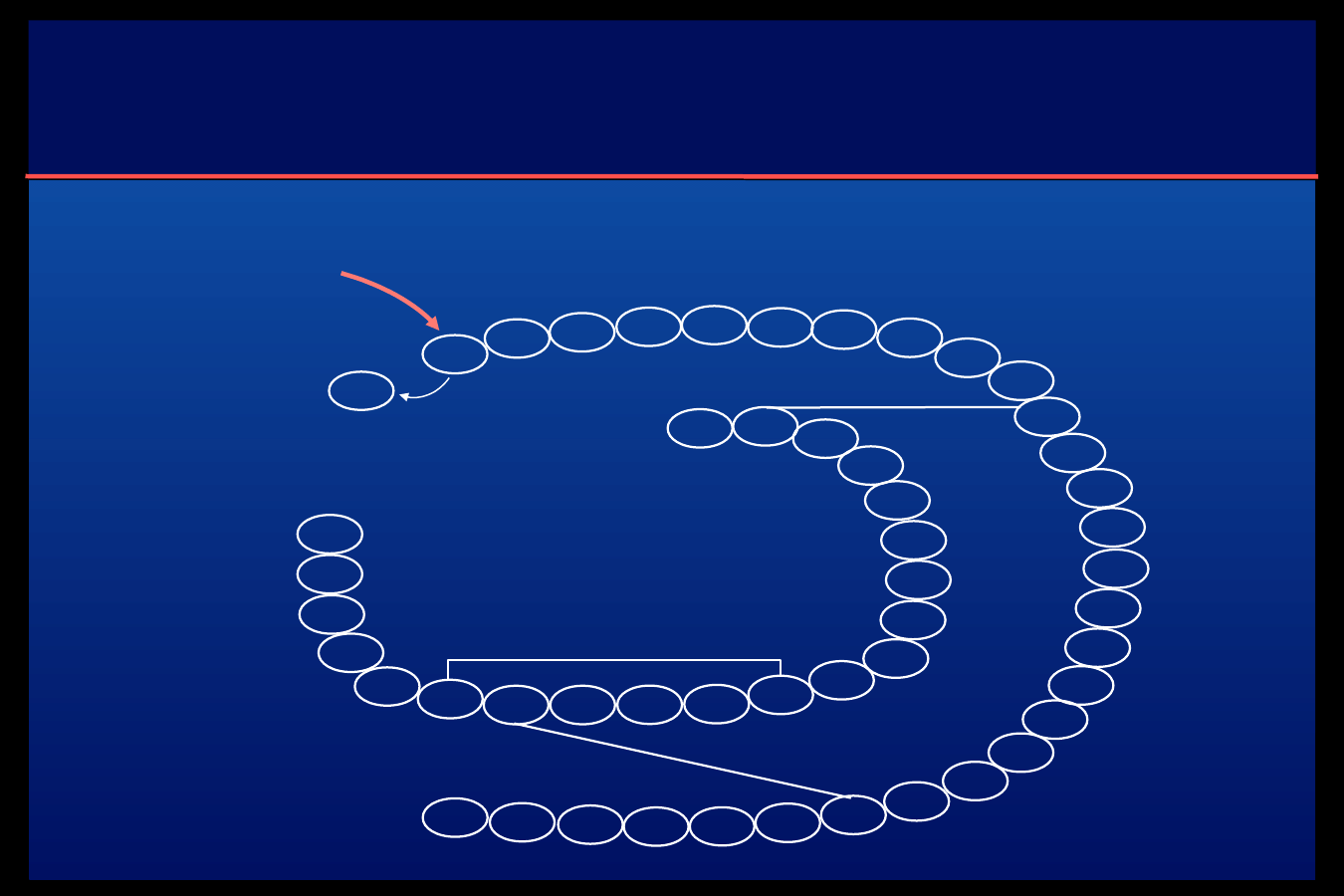
Insulina Detemir
C14
łańcuch kwasu
tłuszczowego
(kwas mirystynowy)
Thr
Lys
Pro Thr Tyr Phe
Gly Arg
Glu
Gly
Cys
Val
Leu
Tyr
Leu
Ala
Glu
Val
His
Ser
Gly
Cys
Leu
His
Gln
Asn
Val
Phe
Gly
Ile
Val
Glu
Gln Cys Cys Thr Ser Ile Cys Ser
Leu
Tyr
Gln
Leu
Glu
Asn
Tyr
Cys
Asn
Leu
Łańcuch B
Łańcuch A
A21
B29
Phe
1
1

Detemir – długodziałający analog
insuliny
Po podaniu detemiru w tkance
podskórnej powstaje równowaga
pomiędzy heksamerami i
diheksamerami, co wydłuża czas
pozostawania detemiru w tkance
podskórnej – absorpcji ulegają
wyłącznie monomery powstałe z
heksamerów.
Obecność kwasu mirystynowego oraz
wiązanie się detemiru z albuminami
już w miejscu wstrzyknięcia opóźnia
wchłanianie detemiru z tkanki
podskórnej.
Detemir wiąże się w osoczu z
albuminami w 98%.
Detemir otrzymuje się
metodą
rekombinacji
DNA
przy
użyciu
drożdży
Saccharomyces
cerevisiae.

Farmakokinetyka preparatów insuliny
stosowanych jako insulina bazalna
Profil działania (godziny)
Preparat
Początek
0,8 - 1,0
2,0 - 4,0
1,2 - 1,8
NPH
Detemir
Glargina
Szczyt
Czas
4,0 -
10,0
6,0 -
12,0
brak
14,0 - 17,0
ok. 20
ok. 24
Lepore M. et al. Diabetes 2000: 49 Pieber et al. Diabetes 2002; 51
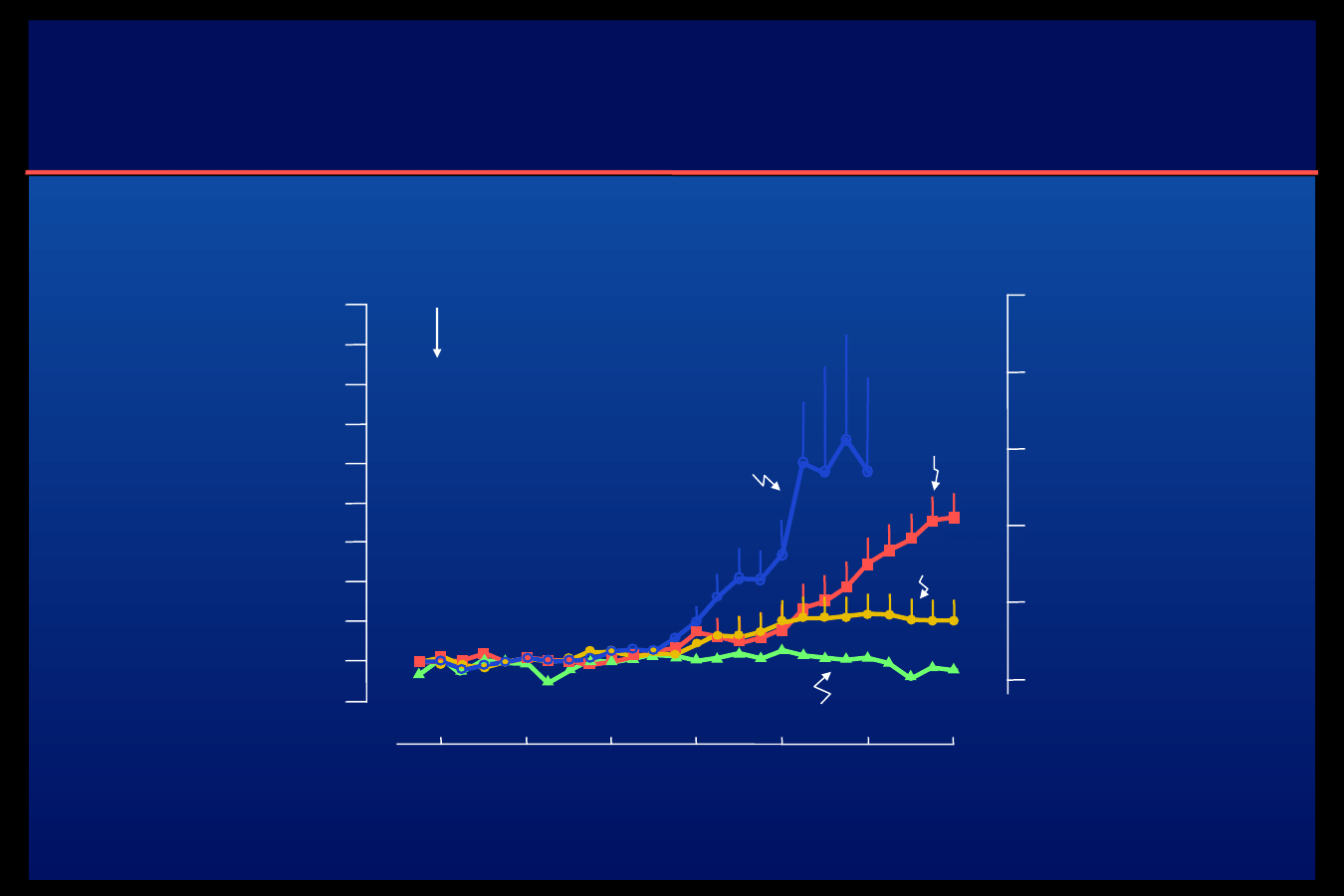
Stężenie glukozy w osoczu po podskórnym wstrzyknięciu
insuliny glarginy, NPH i ultralente oraz insuliny lispro
podawanej w ciągłej infuzji za pomocą pompy insulinowej
Lepore M. et al. Diabetes 2000: 49 , 2142-2148
220
200
180
160
140
120
0
4
8
12
16
20
24
7
8
9
10
11
12
Czas (godziny)
m
m
o
l/
l
m
g
/d
l
Insulina
NPH
CSII
Glargina
Ultralente
Insulina (sc)
N=20 pacjentów z cukrzycą typu 1
Zależność między porą podawania insuliny
glarginy
a kontrolą glikemii u osób z cukrzycą typu 1
Hamann A., i wsp. Diabetes Care. 2003, 26; 1738-1744.
7
6
8
A
1
c
(
%
)
7,6
7,6
7,6
7,4
7,4
7,5
Przed śniadaniem
G r u p y b a d a n e
Przed obiadem
Przed snem
Na początku badania
Na zakończenie badania
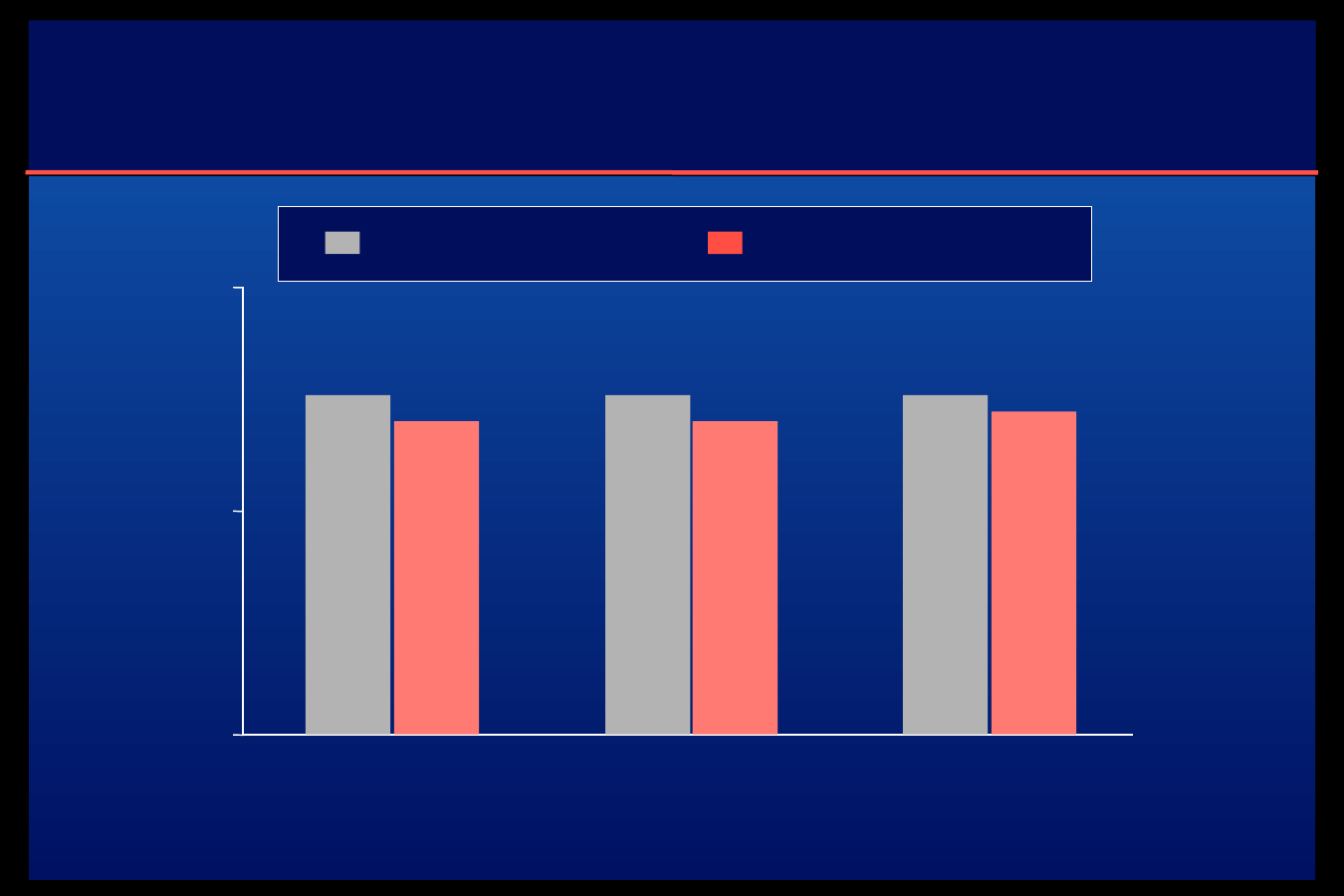
Insulina glargina w leczeniu cukrzycy
typu 2
Schreiber S.A. i wsp. (Abstr. 614 EASD, 2004)
U 6 576 pacjentów leczonych przez lekarzy opieki podstawowej,
z cukrzycą typu 2 źle kontrolowaną za pomocą doustnych leków p-cukrzycowych
dołączono leczenie glarginą przez 9 miesięcy
A. Zmiany w stężeniu
HbA
1c
B. Zmiany w stężeniu glukozy na
czczo
12
10
9
8
7
6
5
A
1
c
(%
)
0
3
9
8,7
7,2
7,0
Cel: A1c 7%
300
250
200
150
100
50
0
FB
G
(
m
g
/d
l)
0
3
9
202,5
133,1
131,4
16,7
13,9
11,1
8,8
5,6
2,8
0,0
FB
G
(
m
m
o
l/
l)
Czas (miesiące)
Czas (miesiące)
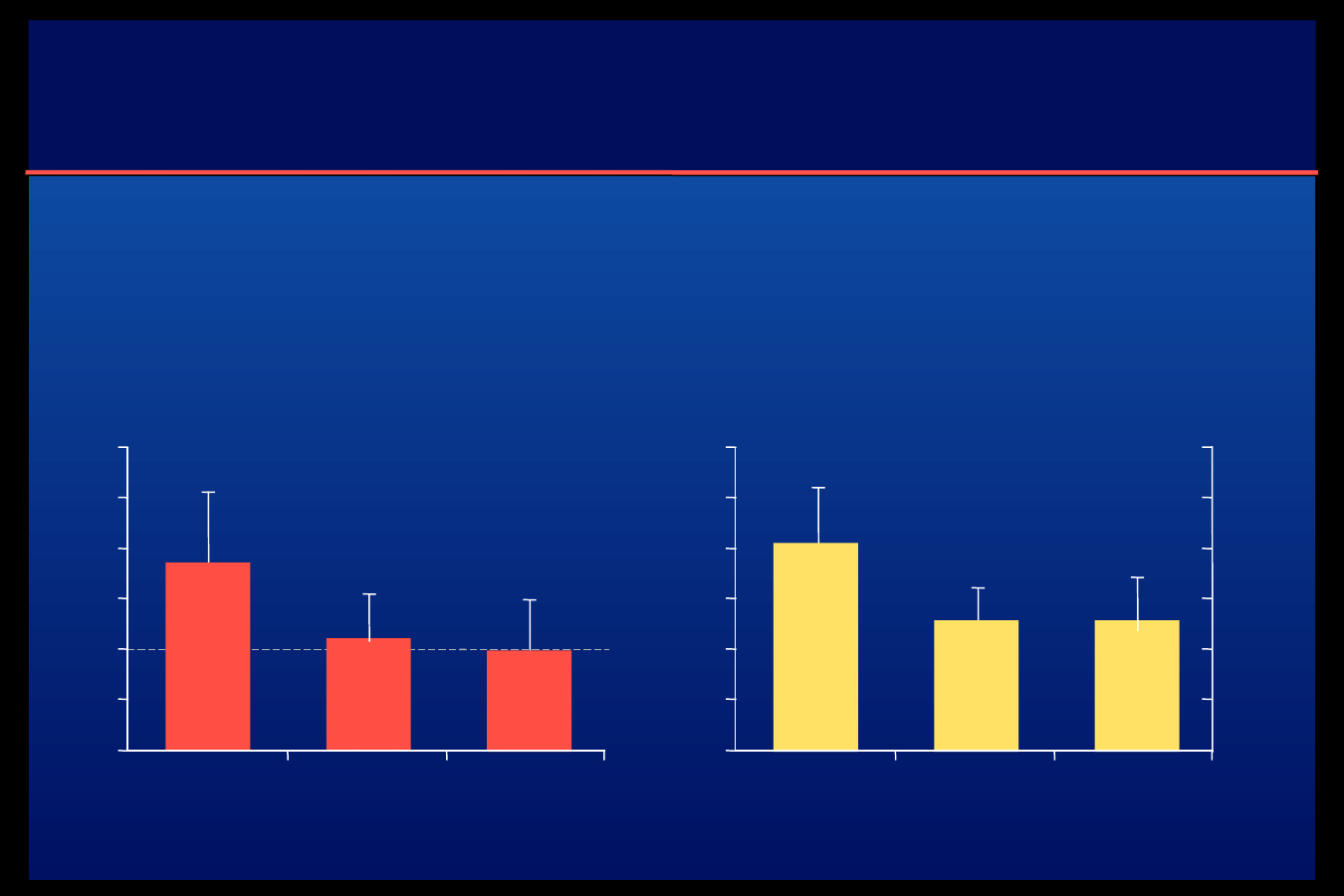
Ocena wahań glikemii za pomocą CGMS
przy zastosowaniu detemiru w
porównaniu do NPH
•
glikemia na czczo po 6 mc
•
zmiana HbA1c po 6 mc
•
zmienność glikemii
poposiłkowej w
samokontroli (SD)
•
MAGE – mean amplitude
of glycaemic excursions
Badana grupa – DM t.1 trwająca min. 1 rok, wiek chorych >=18 l.; leczenie
lewemir lub NPH przed snem + insulina w roztworze; czas badania – 6 mcy
-1,30 6,56
(NS)
-1,97 6,37
-0,13 0,88% (NS)
-0,12 1,19%
(NS)
2,8
4,1
-1,08 0,43
Zmienność glikemii
podczas CGSM była
znacząco mniejsza
podczas terapii
detemirem, niż NPH
Detemir
NPH
Jones D.R.. i wsp., EASD 2006

Korzyści ze stosowania analogów
szybkodziałających
•
Wykazują fizjologiczny profil działania
•
Mogą być wstrzykiwane bezpośrednio przed posiłkiem (wygoda
dla pacjenta); niekiedy po posiłku (osoby z otępieniem, z
gastroparezą, dzieci)
•
Można stosować w ciągłym podskórnym wlewie za pomocą
osobistej pompy insulinowej
•
Mogą być podawane w ciąży i w okresie karmienia (aspart)
•
Lepsza kontrola glikemii poposiłkowej
•
Możliwość opuszczenia przekąsek
•
Mniejsze ryzyko hipoglikemii

Korzyści ze stosowania analogów
długodziałających
•
Możliwość uzyskania stałego, podstawowego stężenia insuliny
•
Mniejsze ryzyko hipoglikemii, zwłaszcza nocnych
•
Lepsza kontrola glikemii na czczo
•
Mniejszy przyrost masy ciała
Mieszanki analogowe
NovoMix 30
•
dwufazowa insulina, w skład
której wchodzi insulina aspart i
protaminowa insulina aspart (o
pośrednim czasie działania)
•
początek działania po około 10 –
20 min; działanie maksymalne
po 1- 4 godz.; całkowity czas
działania wynosi 24 godziny
•
Droga podania – s.c., do 10 min
przed posiłkiem lub po posiłku;
1x lub 2x/dobę
HumalogMix25
HumalogMix50
•
Mieszaniny insuliny lispro i
zawiesiny protaminowej insuliny
lispro (analog insuliny ludzkiej o
pośrednim czasie działania)
•
Okres działania zawiesiny
protaminowej insuliny lispro
(NPL) jest zbliżony do insuliny
NPH
•
początek działania - w ciągu 15
min; działanie maksymalne po 40
– 60 min.; całkowity czas
działania wynosi do 15 godzin
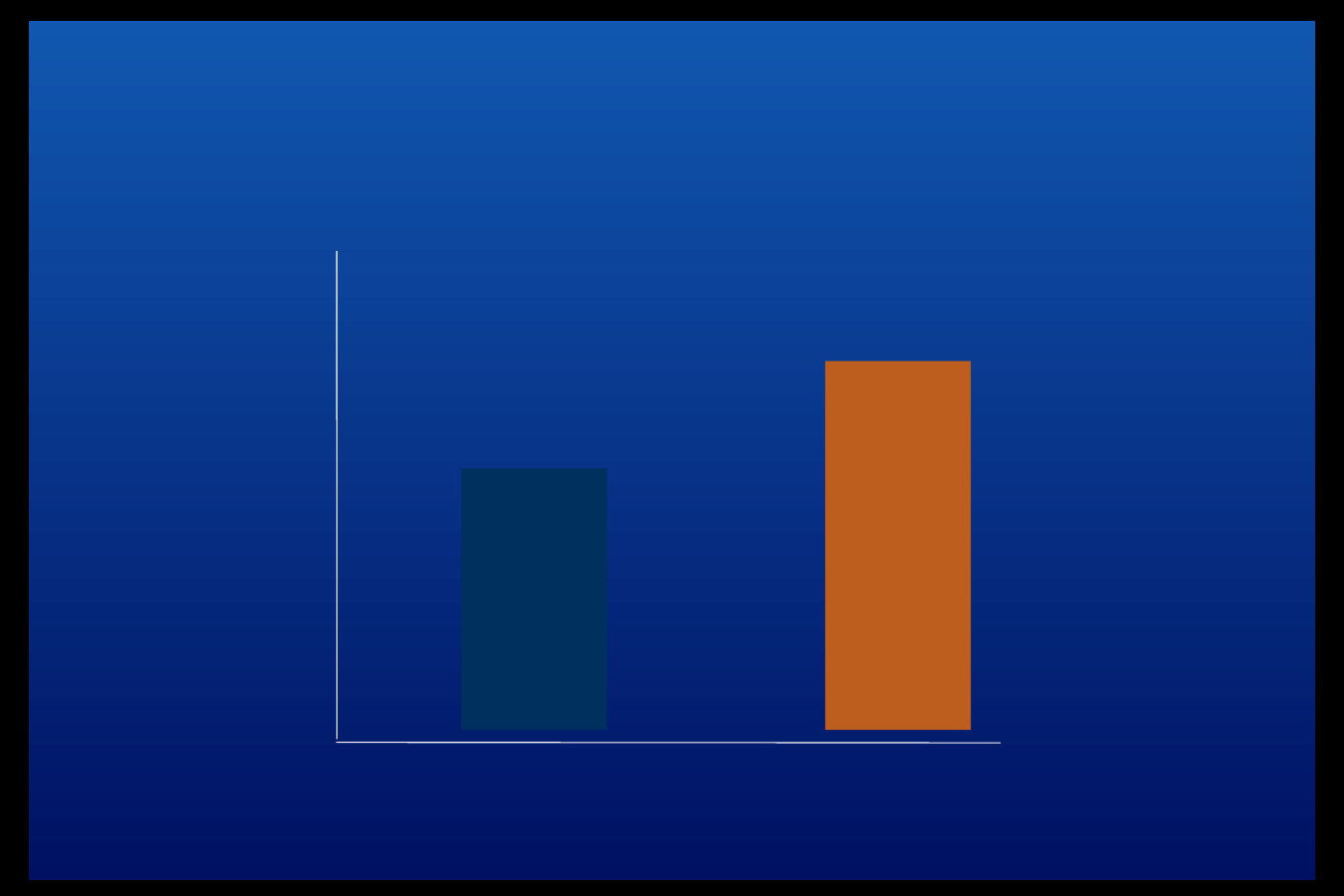
Boehm B et al. Diabet Med 2002;19(5):393–399
0
0.5
1
1.5
2
2.5
3
NovoMix
®
30
BHI 30
Ś
re
d
n
i
p
rz
y
ro
s
t
p
o
s
ił
k
o
w
y
g
li
k
e
m
ii
(
m
m
o
l/
l)
p < 0.02 pomiędzy grupami
(n = 128)
(n = 141)
Porównanie wielkości przyrostu glikemii przy
zastosowaniu NovoMix30 i dwufazowej insuliny
ludzkiej

Wskazania do leczenia analogami
insuliny
•
Chwiejny przebieg cukrzycy
•
Skłonność do hiperglikemii poposiłkowej
•
Skłonność do hipoglikemii, szczególnie nocnych
•
Hiperglikemia o brzasku
•
Aktywny, nieregularny tryb życia
Cukrzyca typu 1
•
Wtórna nieskuteczność pochodnych SM u młodych chorych na
cukrzycę
•
Cukrzyca skojarzona z otyłością i dużym zapotrzebowaniem na
insulinę
Cukrzyca typu 2

Algorytmy leczenia za
pomocą analogów insuliny
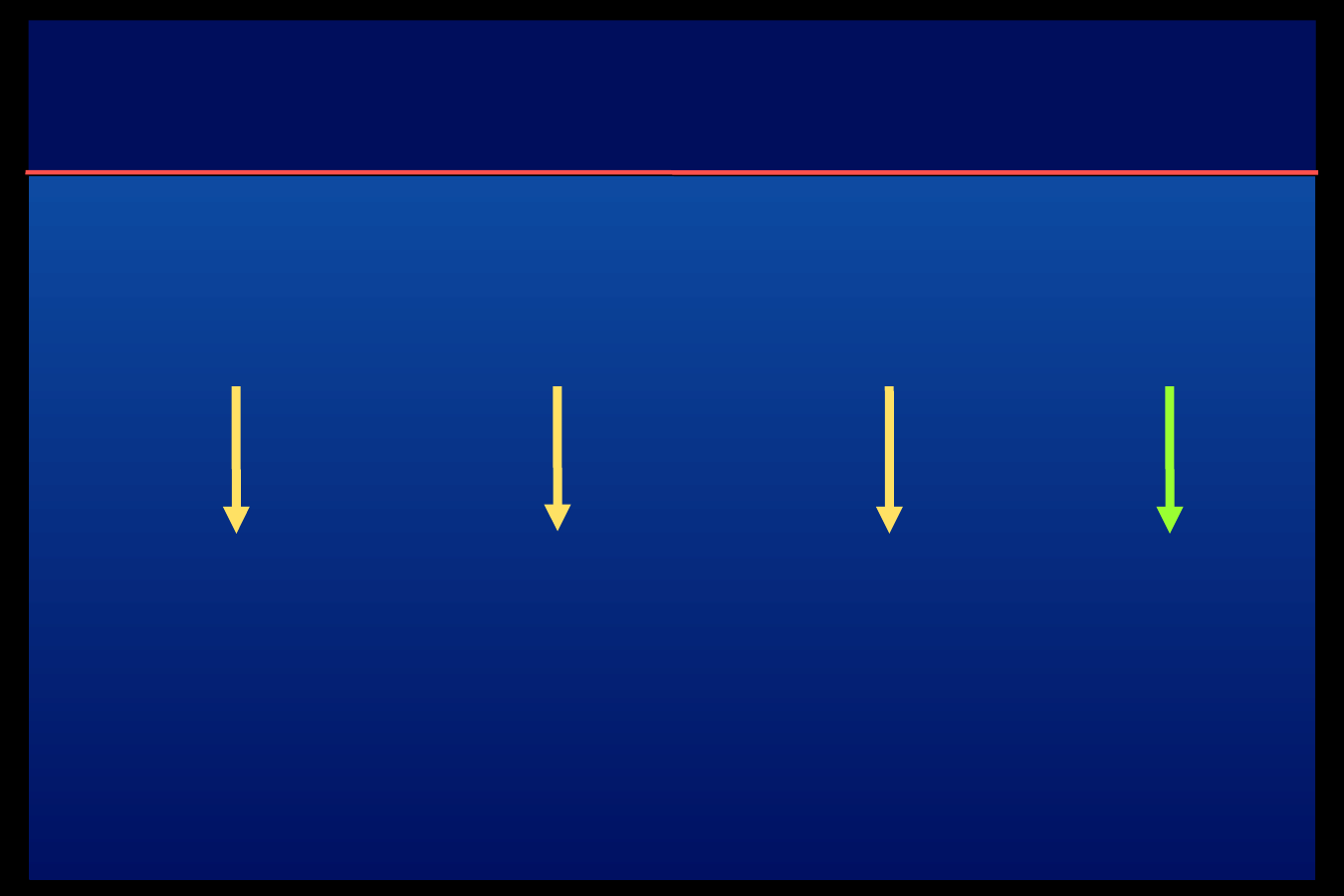
Algorytm jednego wstrzyknięcia - terapia
skojarzona
Pochodna SU
Meglitinid
Metformina
Meglitinid
Metformina
Pochodna SU
Meglitinid
Metformina
Glargina
lub
Detemir
Śniadanie
Obiad
Kolacja
godzin
a20:00

Obiadokolacj
a
Algorytm 2 wstrzyknięć
Mieszanka
analogowa
25/75 lub
30/70 lub
50/50
Śniadanie
Mieszanka analogowa
25/75 lub
30/70 lub
50/50
ew.
posiłek
południow
y

Kolacja
Algorytm 3 wstrzyknięć – schemat 1
Analog szybki
+ NPH lub Detemir
Śniadanie
Analog
szybki
Analog szybki
+ NPH lub Detemir
Obiad

Kolacja
Algorytm 3 wstrzyknięć – schemat 2
Mieszanka
analogowa
25/75 lub
30/70 lub
50/50
Śniadanie
Analog
szybki
Mieszanka analogowa
25/75 lub
30/70 lub
50/50
Obiad

Kolacja
Algorytm 3 wstrzyknięć – schemat 3
Mieszanka analogowa
50/50
Śniadanie
Mieszanka analogowa
50/50
Mieszanka analogowa
50/50
Obiad
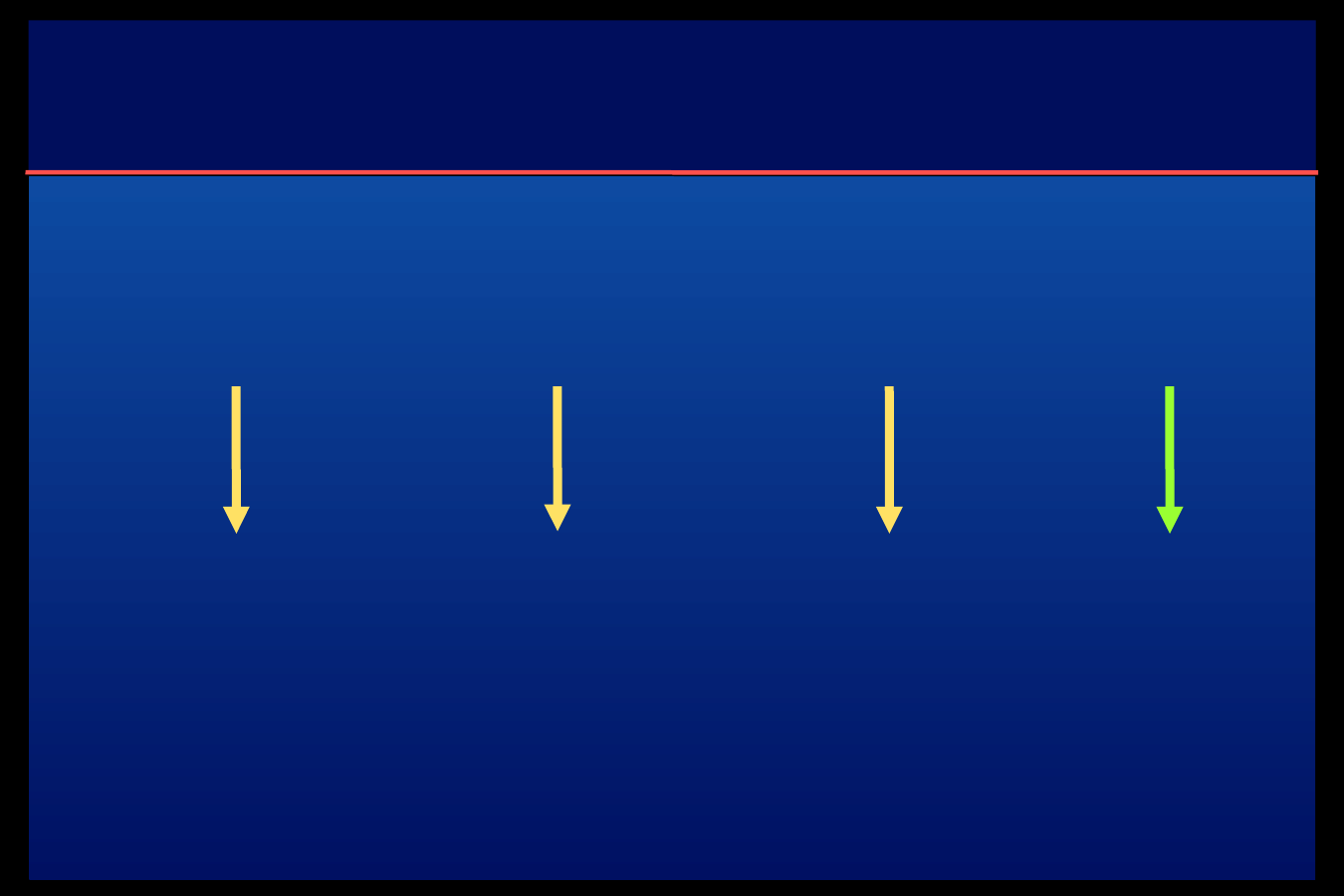
Algorytm 4 wstrzyknięć – schemat 1
Analog
szybki
Analog
szybki
Analog
szybki
Glargina
lub Detemir
Śniadanie
Obiad
Kolacja
21:00 – 22.00
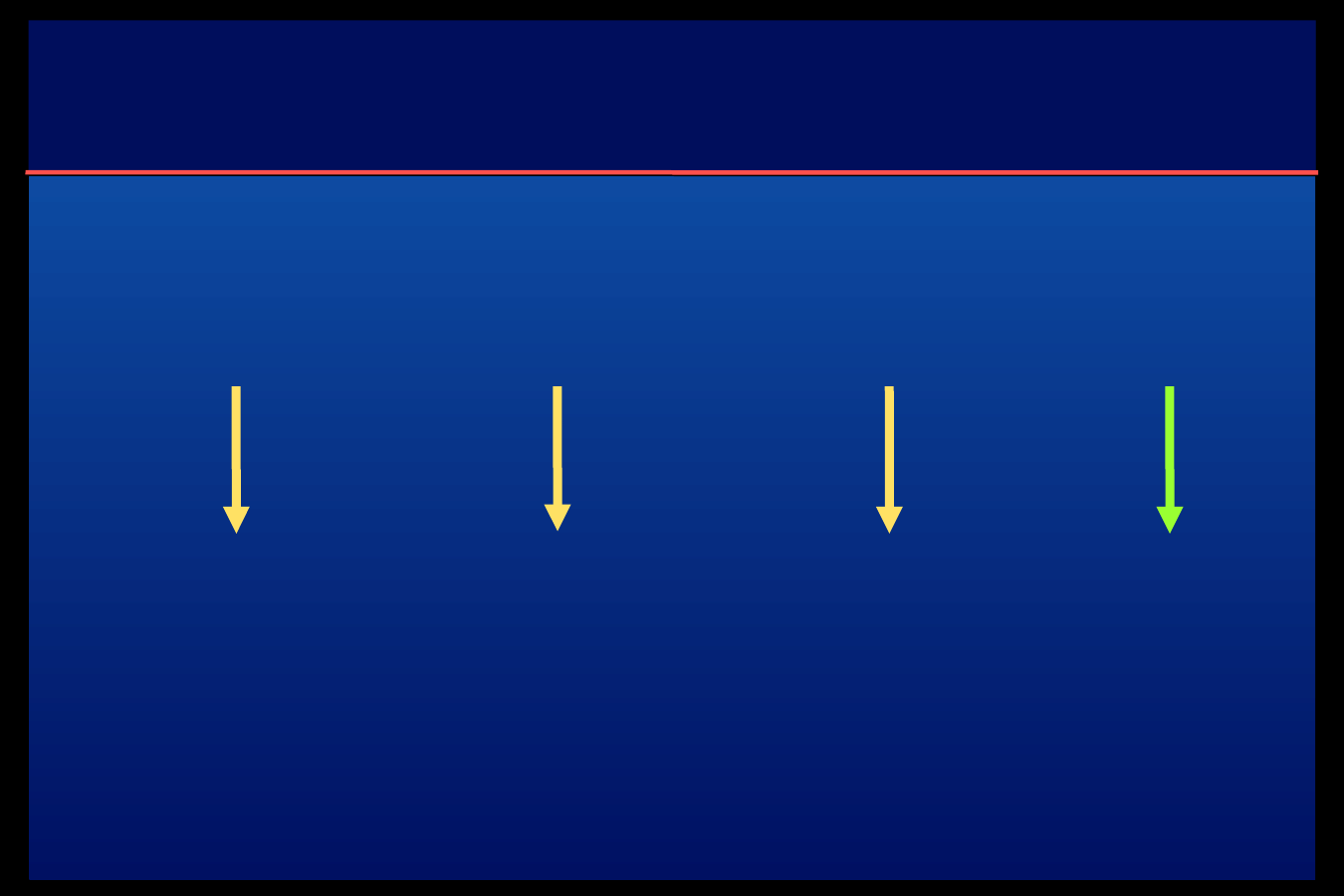
Algorytm 4 wstrzyknięć – schemat 1 a
Analog
szybki
Analog
szybki
Analog
szybki
Glargina
lub Detemir
+ analog
szybki
Śniadanie
Obiad
Kolacja
Przed drugą
kolacja
np. o 21.00
Algorytm 4 wstrzyknięć – schemat 2
Analog szybki
+ insulina NPH lub
Detemir
Analog
szybki
Analog
szybki
Insulina
NPH
lub Detemir
Śniadanie
Obiad
Kolacja
21:00 – 22.00
Algorytm 4 wstrzyknięć – schemat 2 a
Analog szybki
+ insulina NPH lub
Detemir
Analog
szybki
Analog
szybki
Analog
szybki
+ insulina
NPH lub
Detemir
Śniadanie
Obiad
Kolacja
Przed drugą
kolacja
np. o 21.00

Modyfikacje dotyczące dawkowania
analogów długodziałających
•
U osób rozpoczynających
insulinoterapię
początkowa dawka analogu nie
powinna przekraczać 10 j./dobę
•
Przy zamianie insuliny NPH
podawanej przed snem, należy
zastosować równoważną dawkę
analogu
•
Przy zamianie insuliny NPH
stosowanej 2 x/dobę podaje się
równoważną dawkę lewemiru,
natomiast dawka glarginy
odpowiada dobowej dawce NPH
obniżonej o 20%
•
modyfikacje dawki dokonuje
się w oparciu o glikemie
poranne
•
na każde 30 mg/dl powyżej
100 mg/dl na czczo należy
zwiększyć dawkę analogu o 1
- 2 j.
•
modyfikację dawki należy
przeprowadzić nie wcześniej,
niż 3 dni od wdrożenia
długodziałającego analogu
•
ustalenie właściwej dawki
może wymagać min 5 – 7 dni

Modyfikacje dotyczące dawkowania
analogów szybkodziałających
•
ustalenie dobowego zapotrzebowania na insulinę 0,5 –
0,7 j./kg m.c. (insulina NPH /ub analog długodziałający
stanowi 40-50% dob. zapotrzebowania na insulinę)
•
modyfikacje dawki mają na celu obniżenie glikemii
poposiłkowej < 135 mg/dl (samokontrola)
•
modyfikacje dawki w oparciu o zawartość wymienników
węglowodanowych i białkowo-tłuszczowych w posiłku (1-
1,5 j. insuliny /1WW lub 100 kcal pochodzących z białka i
tłuszczu)

Wady ? ...... analogów insuliny
wyższy koszt w
porównaniu do
insulin
konwencjonalnych
brak długofalowej
oceny
bezpieczeństwa
stosowania
(mitogenność?)
nie odtwarzają w
idealny sposób
dobowych zmian
sekrecji insuliny
ryzyko hipoglikemii przy
wydłużeniu odstępu
czasowego pomiędzy
podaniem analogu a
posiłkiem
możliwość wystąpienia
miejscowych lub
uogólnionych reakcji
alergicznych
ANALOGI
INSULINY
brak danych
dotyczących analogów
długodziałających w
ciąży

Algorytm leczenia zewnętrznymi
osobistymi pompami insulinowymi
•
Niemożność spełnienia kryteriów dobrego wyrównania
cukrzycy za pomocą wielokrotnych wstrzyknięć
•
Nawracające nieprzewidywalne epizody hipoglikemii
•
Nieświadomość hipoglikemii
•
Nieregularny tryb życia i nieregularne spożywanie
posilków

Algorytm leczenia zewnętrznymi
osobistymi pompami insulinowymi
•
Zasady:
•
Redukcja dotychczasowej dawki o 20-25%
•
Wlew podstawowy - 50% dawki dobowej
•
50% bolusy – dawka podzielona na bolusy okołoposilkowe

BOLUSY
• Bolus normalny
• Bolus przedłużony
• Bolus złożony
• Bolus korekcyjny
• Zależą od – poziomu glukozy, WW, WBT, wysiłku
fizycznego.

Edukacja
Obejmuje:
• Obsługę pompy
• Mocowanie zestawu infuzyjnego
• Szkolenie dietetyczne
• Adaptacje dawki podstawowej i bolusów do problemów
życia codziennego - wysiłek fizyczny, przyjęcie, zmiana
stref czasowych, wakacje, sytuacje intymne, kąpiel.
• Szczególne sytuacje - ciąża, kwasica , hipoglikemia,
hiperglikemia, dodatkowa choroba, zabieg operacyjny

Niebezpieczeństwa
Bezpieczeństwo leczenia pompami zależy od
stanu technicznego pompy, umiejętności
i motywacji chorego oraz lekarza
Techniczne
Chory używając pompy musi kontrolować
urządzenie, sprawdzając:
sygnały pracy silnika, sygnały stanu napięcia
baterii, ilość insuliny w strzykawce, połączenie
cewnika
z pompa i igłą.

Niebezpieczeństwa cd.
Medyczne
a. Ketoza
b. Hipoglikemia
c. Odczyny w miejscu wstrzyknięcia
d. Niewystarczająca kontrola glikemii
e. Brak psychospołecznej akceptacji
pompy

Samokontrola
Podczas szkolenia:
• przed śniadaniem
• 1-2 h po śniadaniu
• przed obiadem
• 1-2 h po obiedzie
• przed kolacją
• 1-2 h po kolacji
• przed snem
• 2.00 - 3.00 w nocy
• W życiu codziennym:
• przed śniadaniem
• przed obiadem
• przed kolacją
• przed snem
• 2.00 - 3.00 w nocy co 2
tyg.

Cele samokontroli glikemii
Ocena glikemii we krwi włośniczkowej na
glukometrze
• ocena wahań dobowych glikemii
• wykrycie zagrożenia hipoglikemią
polekową
• modyfikacje dawek leków
hipoglikemizujących, insuliny (5-10%
dawki)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
Wyszukiwarka
Podobne podstrony:
LECZENIE STANÓW NAGLĄCYCH W DIABETOLOGII WYNIKAJĄCYCH Z NIEDOBORU INSULINY
Insulinoterapia funkcjonalna
ZYWIENIE OSOB STARSZYCH Z CUKRZYCA INSULINOZALEZNA I INSULINONIEZALEZNA, Dietetyka
Insulinooporność 2010
Głowne metaboliczne efekty działania insuliny, farmacja, cukrzyca
2008 zaburz dzial insuliny a starzenie sie czl PHMD
Insulinooporność w endokrynopatiach
Nowe ujęcie insulinoterapii w cukrzycy typu 2
5 insulinoterapia id 40155 Nieznany
INSULINA, Biologia, fizjologia zwierząt
fizjologia-referat insulina
zasady insulinoterapii
Insulin
leczenie niedobory insuliny
Ambulatoryjne leczenie insuliną
Miejsca podania insuliny
więcej podobnych podstron