
Obejmuje
badania
efektów
energetycznych
towarzyszącym
reakcjom
chemicznym
i procesom fizykochemicznym
CIEPŁO – Q
PRACA – W
Termodynamika
Termodynamika
chemiczna
chemiczna
We
wszystkich
procesach
energia
jest
uwalniana lub zużywana.
1
•
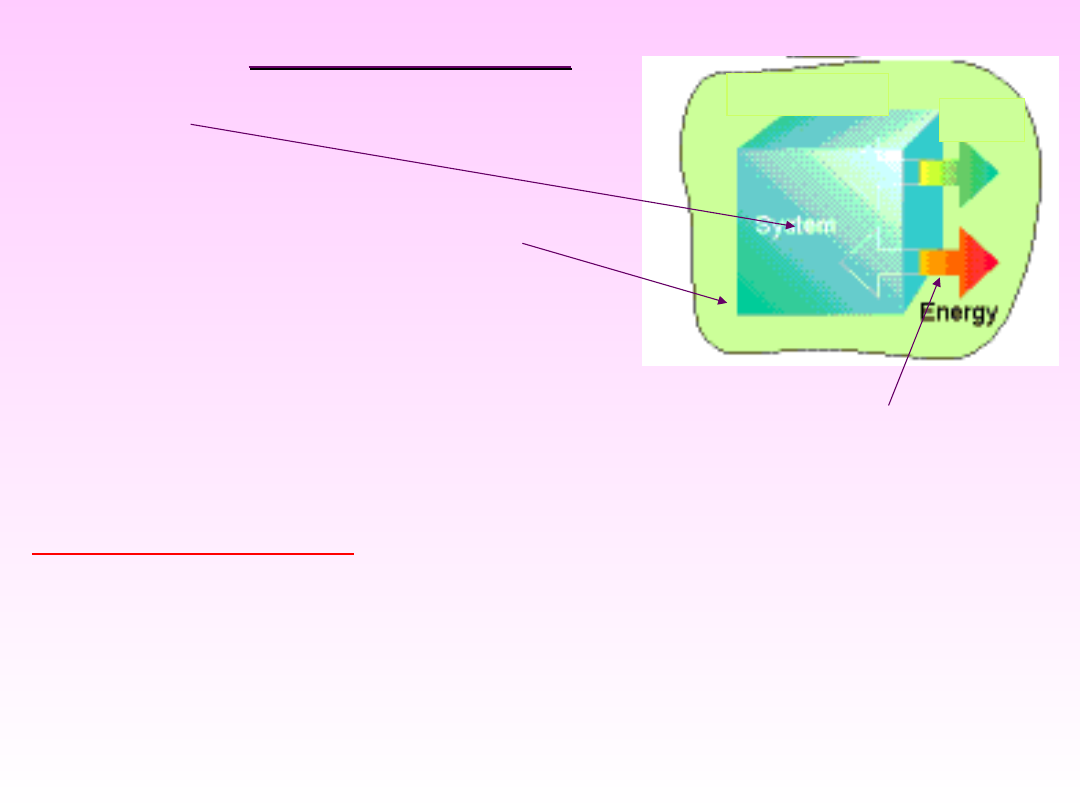
OTOCZENIE UKŁADU
–
miejsce, z którego układ
poddajemy obserwacji,
•
UKŁAD
– ciało lub zespół
ciał, które poddajemy
obserwacji
Między układem a otoczeniem może dochodzić
Między układem a otoczeniem może dochodzić
do wymiany masy i/lub energii
do wymiany masy i/lub energii
Przykłady układów,
które mogą być obiektami rozważań:
wszechświat, Układ Słoneczny, Ziemia, ocean, akwen,
atmosfera, chmura, kropla deszczu,
otoczenie fabryki przemysłowej, zawartość bioreaktora, jakim
jest komora napowietrzania w biologicznej oczyszczalni
ścieków,
kolumna absorpcyjna do oczyszczania gazów odlotowych w
procesie przem.,
zawartość probówki czy zlewki w laboratorium.
otoczenie
Masa
Pojęcia wstępne
Pojęcia wstępne
2
UKŁADY
UKŁADY
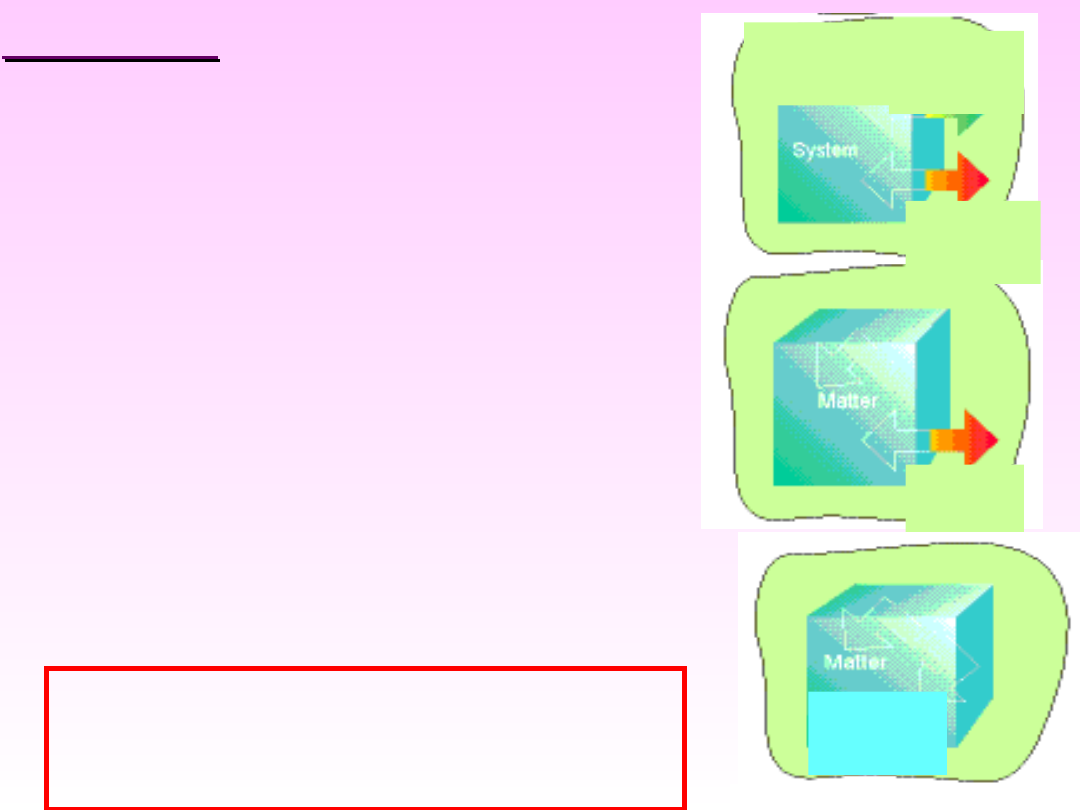
2.
ZAMKNIĘTY
(Półotwarty)
– wymiana tylko energii z
otoczeniem
3.
IZOLOWANY
– brak
wymiany materii i energii
z otoczeniem
energ
ia
ukła
d
materia
układ
otoczen
ie
energi
a
materia
otoczen
ie
1.
OTWARTY
–
wymiana materii i
energii z
otoczeniem
otoczen
ie
materi
a
energi
a
układ
Układy wyodrębniane ze
środowiska naturalnego są
układami otwartymi.
3
Termodynamika
Termodynamika
chemiczna
chemiczna
Opis termodynamiczny układu – parametry układu
PARAMETRY STANU:
objętość układu - V
ciśnienie – P
temp. układu – T
Inne parametry układu:
ilość faz
masa
skład chemiczny
stężenie
gęstość
funkcje termodynamiczne (stanu) zmienne
zależne:
energia wewnętrzna, entalpia, entropia,
4
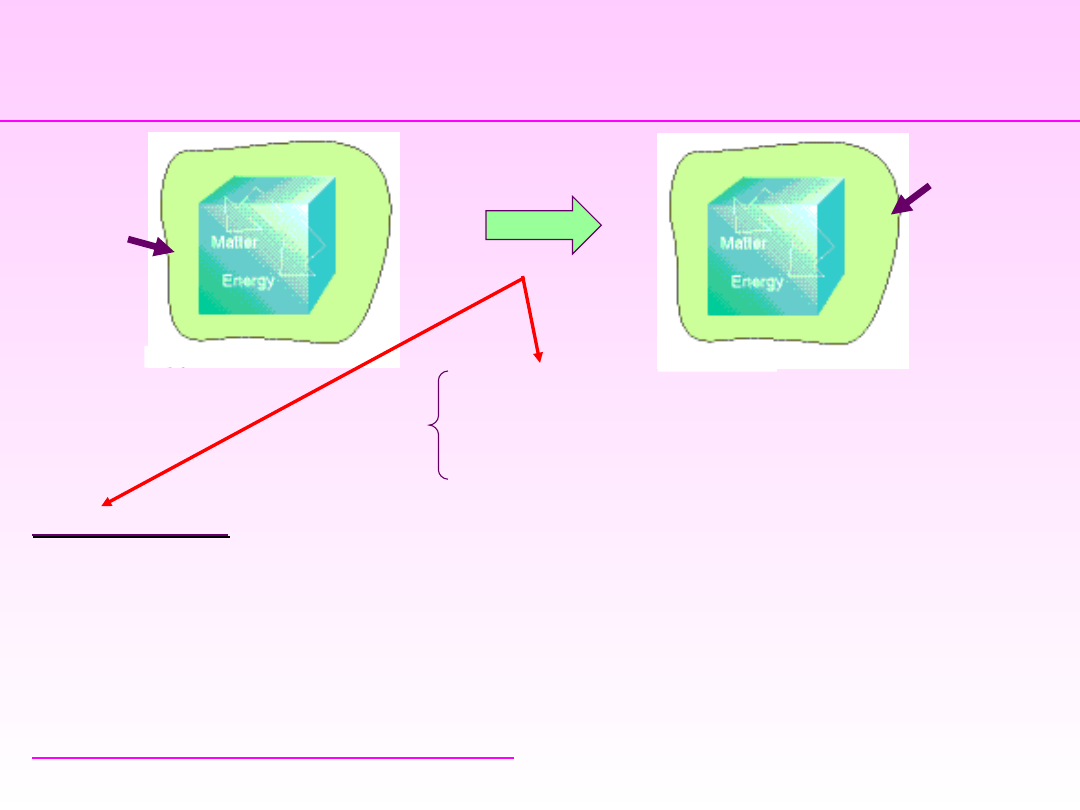
Stan pocz
ątkowy
RÓWNOWAGA UKŁADU
– brak przepływu energii i
materii. Parametry układu są stałe.
STAN UKŁADU – parametry zachowują określoną wartość
Termodynamika
Termodynamika
chemiczna
chemiczna
W procesie następuje więc przejście od stanu
początkowego do końcowego, poprzez przejście przez
szereg stanów pośrednich - droga przemiany.
Procesem
Procesem nazywa się każdą zmianę parametrów
stanu lub funkcji stanu, a więc każdą zmianę
chociażby jednej właściwości układu.
PROCES
P
UKŁAD
Stan ko
ńcowy
K
UKŁAD
Otocze
nie
układu
Otocze
nie
układu
5
•chemiczny - reakcja chemiczna
•fizyczny – przepływ ciepła
•fizykochemiczny – np.
przemiany fazowe

Termodynamika
Termodynamika
chemiczna
chemiczna
Podstawowym pojęciem termodynamiki jest
praca.
W tym przypadku mamy na myśli zdolność układu
do wykonywania pracy.
W czasie przebiegów procesów chemicznych i
fizykochemicznych układ z otoczeniem wymienia:
1. energię na sposób
CIEPŁA
– Q
2. energię na sposób
PRACY
– W
W = |pV|
–
praca zmiany
objętości
V = V
2
– V
1
V
1
– obj. w stanie
początkowym
V
2
– obj. w stanie końcowym
W = pV – praca jest
wykonywana na układzie
W = -pV – praca jest
wykony-wana przez układ
np. zwiększanie objętości
przeciwko ciśnieniu
zewnętrznemu)
Energia może być dostarczana do układu lub wydalana
do otoczenia.
6
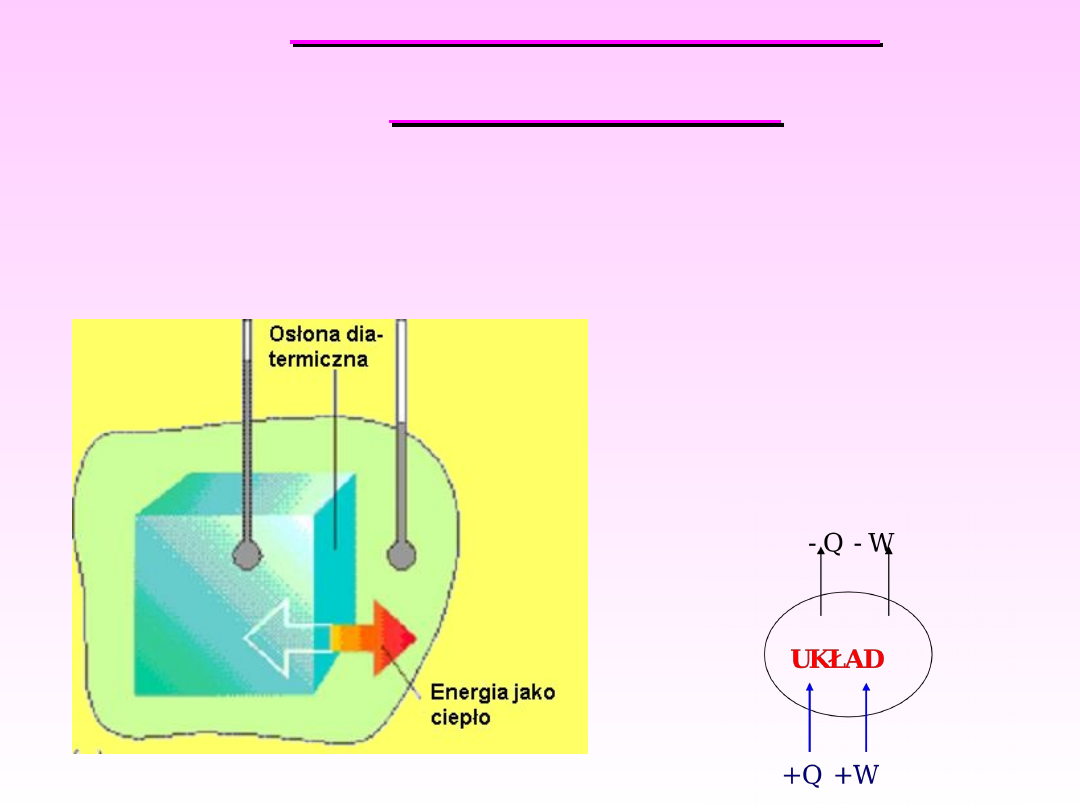
Jeżeli zmiana energii następuje w wyniku różnicy
temperatur pomiędzy układem a otoczeniem,
mówimy że energia została przekazana jako
ciepło.
Ciepło jest zatem formą przekazywania energii.
Termodynamika
Termodynamika
chemiczna
chemiczna
Przyjmuje się
konwencję, że Q>0,
ciepło przypływa do
układu, natomiast gdy
Q<0, układ traci
energię.
7
Proces
Przemiana
PRZEMIANA
PRZEMIANA
IZOCHORYCZNA
IZOCHORYCZNA
Ponieważ V = const. to V = 0
Ponieważ W = pV to W = 0
Cechą charakterystyczną przemian izochorycznych
jest fakt, że układ z otoczeniem nie wymienia energii
na sposób pracy.
V = constans
V = constans
Q
Stan
początkowy
(p
1
, T
1
)
Biorąc pod uwagę zmianę parametrów stanu są dwie
podstawowe przemiany zachodzące w układzie:
•
przemiana izochoryczna
• przemiana izobaryczna
które mogą mieć charakter chemiczny czy też fizyczny.
8
Stan
końcowy (p
2
,
T
2
)
PRZEMIANA IZOBARYCZNA
PRZEMIANA IZOBARYCZNA
Ponieważ V 0 to W = -pV 0 V = V
2
– V
1
Cechą charakterystyczną przemian izobarycznych
jest fakt, że w trakcie ich przebiegu układ
wykonuje pracę
związaną ze zmianą objętości.
układ
wykonuje pracę
Proces
Przemiana
Q
Stan
początkowy
(V
1
, T
1
)
Stan
końcowy (V
2
,
T
2
)
-W
p =
p =
constans
constans
9

Po doprowadzeniu ciepła do układu w trakcie
przemiany izochorycznej lub izobarycznej:
- wzrosła temperatura układu
- wzrosło ciśnienie lub objętość
Podniosła się więc:
ENERGIA WEWNĘTRZNA
ENERGIA WEWNĘTRZNA
UKŁADU (U)
UKŁADU (U)
Energia wewnętrzna układu:
1.energia kinetyczna cząsteczek, atomów,
jonów;
2.energia oscylacji i rotacji cząsteczek,
atomów, jonów;
3.energia elektronów;
4.energia wiązań chemicznych;
5.energia wiązań międzycząsteczkowych, itp.
Energia wewnętrzna
Energia wewnętrzna
układu
układu
Energia wewnętrzna (U) - (w termodynamice) -
część energii układu zależna tylko od jego stanu
wewnętrznego, stanowi ona sumę energii oddziaływań
międzycząsteczkowych i wewnątrz-cząsteczkowych
układu oraz energii ruchu cieplnego cząsteczek.
10
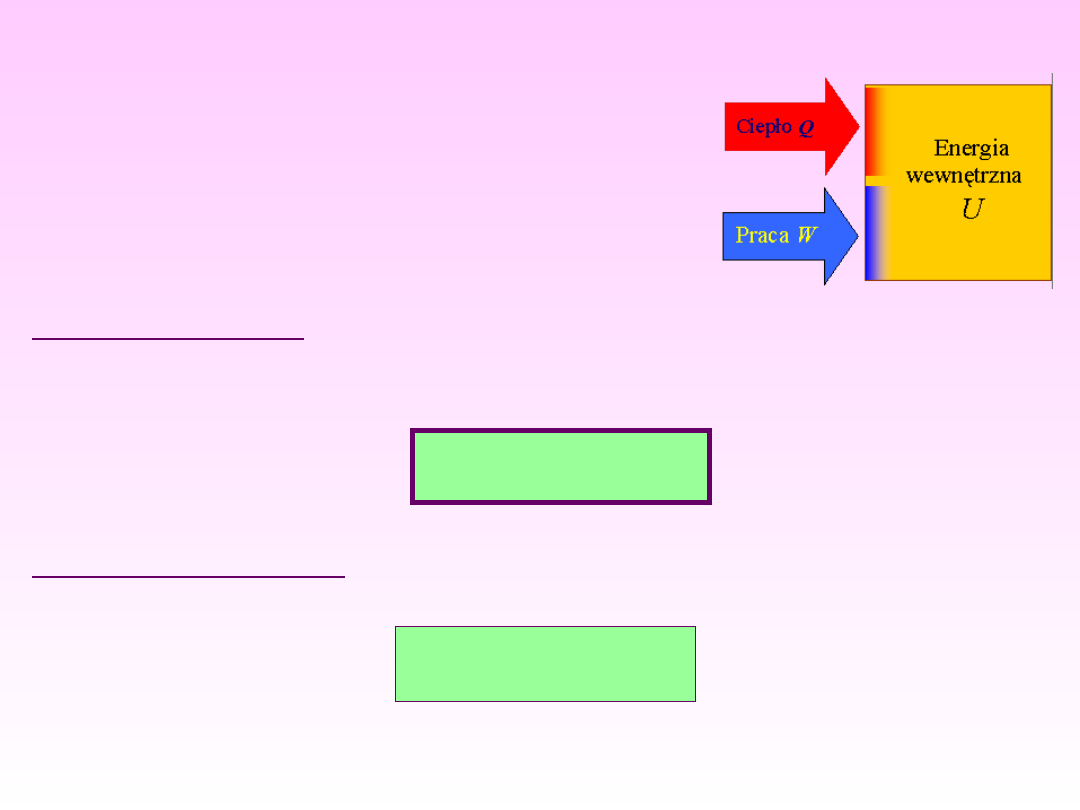
I ZASADA
I ZASADA
TERMODYNAMIKI
TERMODYNAMIKI
U = Q + W
Układ otwarty:
ZMIANA ENERGII WEWNĘTRZNEJ UKŁADU (U)
ODBYWA SIĘ ALBO NA SPOSÓB CIEPŁA (Q),
ALBO NA SPOSÓB PRACY (W):
Doświadczalnie stwierdzono, że
energię
wewnętrzną
układu można zmieniać albo
przez wykonanie na nim pracy, albo
poprzez jego ogrzanie. Są to równoważne
drogi zmiany energii wewnętrznej układu.
Układ izolowany:
ENERGIA WEWNĘTRZNA UKŁADU NIE ULEGA
ZMIANIE
U = constans
11

TERMOCHEMIA
TERMOCHEMIA
Zajmuje się efektami cieplnymi
towarzyszącymi reakcjom chemicznym oraz
określa wpływ parametrów fizycznych na
wielkość tych efektów cieplnych.
CIEPŁO REAKCJI CHEMICZNEJ
– ilość
energii wymienianej na sposób ciepła między
układem, w którym biegnie reakcja a
otoczeniem.
REAKCJA EGZOTERMICZNA
– układ
przekazuje ciepło otoczeniu
REAKCJA ENDOTERMICZNA
– ciepło jest
pobierane przez układ z otoczenia
12

TERMOCHEMIA
TERMOCHEMIA
rodzaj substancji reagujących
stężenie substratów i produktów
stan skupienia reagentów
temperatura
ciśnienie
warunki prowadzenia reakcji (w stałej
objętości lub pod stałym ciśnieniem)
Od czego zależy ciepło reakcji
chemicznej?
13
Ciepło reakcji chemicznej w
Ciepło reakcji chemicznej w
stałej objętości
stałej objętości
gdy V = const. to W = 0 gdyż V
= 0
więc:
Q
v
= U
gdzie: Q
v
– ciepło reakcji w danej objętości
Ciepłem reakcji w stałej objętości
nazywamy
ilość energii wymienionej na sposób ciepła między
układem a otoczeniem w stałej temperaturze i w
stałej objętości, gdy nie zostanie wymieniona inna
forma energii oprócz energii na sposób ciepła.
Energia wewnętrzna jest funkcją stanu, więc dla
dowolnej reakcji:
Q
Q
v
v
=
=
U =
U =
U produkty -
U produkty -
U substraty
U substraty
I zasada termodynamiki: U = Q + W
U = Q + W Q =
U - W
14
Ciepło reakcji chemicznej pod stałym
Ciepło reakcji chemicznej pod stałym
ciśnieniem
ciśnieniem
Wprowadzamy
pojęcie
nowej
funkcji
termodynamicznej,
entalpia
entalpia
H
H
, której zmiana wyraża
ilość dostarczonego do układu ciepła.
Definicja: ENTALPIA: H = U + pV
Q
Q
p
p
=
=
H =
H =
U + p
U + p
V
V
By
Q
p
nie była równa
wielomianowi.
Zmiana entalpii układu równa jest ilości energii
wymienionej na sposób ciepła Q
p
, gdy proces
przebiega w stałej temperaturze i pod stałym
ciśnieniem.
Jeżeli p = const. to W = -pV jeżeli układ rozszerza
się
(wykonuje pracę)
Stąd: ogólnie Q
p
= U + pV czyli U<Q
I zasada termodynamiki: U = Q + W Q = U –
W
W tych warunkach zmiana energii wewnętrznej
układu nie jest równa ciepłu dostarczonemu do
układu, jeżeli on zmienia objętość.
Dla dowolnej reakcji otrzymamy:
H° reakcji = H° produkty - H°
substraty
15

Zależność między Q
v
i
Q
p
Dla reakcji, w której już nie biorą udziału reagenty
w stanie gazowym można założyć, że:
V = 0
stąd: H = U
i
Q
p
= Q
v
Dla reakcji, w której biorą udział gazy:
H = U + pV dla gazów doskonałych:
pV = nRT
więc: H = U + nRT
n = n produktów - n substratów
n – ilość moli
Q
v
= U
V=const.
Q
p
= H
p=const.
H = U + pV
16
PRAWO HESSA
PRAWO HESSA
“Ciepło
reakcji
chemicznej
(w
warunkach
izochorycznych i izobarycznych) nie zależy od
drogi, którą biegnie reakcja a jedynie od stanu
początkowego i końcowego”.
2C +
O
2
2CO
CO
2
+
C
H
1
H
2
H
3
Dwie drogi
tworzenia CO z
pierwiastków:
W obu przypadkach:
H
1
= H
2
+ H
3
Prawo Hessa pozwala obliczyć ciepło reakcji na
Prawo Hessa pozwala obliczyć ciepło reakcji na
podstawie danych termochemicznych
podstawie danych termochemicznych
uzyskanych z innych reakcji:
uzyskanych z innych reakcji:
i
i(subs.)
i
i
i(prod.)
i
1
2
p
i
i(subs.)
i
i
i(prod.)
i
1
2
v
H
n
H
n
H
H
ΔH
Q
U
n
U
n
U
U
ΔU
Q
1. – znane
H (lub
U)
produktów i
substratów:
17

[A]:
CO + 0,5 O
2
= CO
2
Q
x
[B]:
C + O
2
= CO
2
Q
1
[C]:
C + 0,5 O
2
= CO
Q
2
Jeżeli [B] – [C] =[A] to również:
Q
Q
x
x
= Q
= Q
1
1
– Q
– Q
2
2
2. – znane
H
(lub
U)
reakcji pośrednich:
Ogólnie:
r
H
3
=
r
H
1
+
r
H
2
Przykład 1:
[A]:
C + 2S = CS
2
H
x
[B]:
C + O
2
= CO
2
H
B
[C]:
S + O
2
= SO
2
H
C
[D]:
2SO
2
+ CO
2
= CS
2
+3O
2
H
D
Jeżeli [B] + 2[C] + [D] = [A] to: H
x
= H
B
+
2H
C
+ H
D
Przykład 2:
18
Wpływ temperatury na ciepło
Wpływ temperatury na ciepło
reakcji
reakcji
chemicznej-
chemicznej-
RÓWNANIA
KIRCHHOFFA – Q = f(T)
d(
d(
U) =
U) =
C
C
v
v
dT –
dT – forma różniczkowa I równania
Kirchhoffa
Po scałkowaniu w granicach T
1
÷ T
2
:
U
U
2
2
=
=
U
U
1
1
-
-
C
C
v
v
(T
(T
2
2
– T
– T
1
1
)
)
I równanie
Kirchhoffa
U
1
, U
2
– ciepło reakcji w temperaturze T
2
i T
1
d(H) = C
p
dT – forma różniczkowa II równania
Kirchhoffa
Po scałkowaniu w granicach T
1
÷ T
2
:
H
H
2
2
=
=
H
H
1
1
-
-
C
C
p
p
(T
(T
2
2
–
–
T
T
1
1
)
)
II równanie Kirchhoffa
H
1
, H
2
– ciepło reakcji w temperaturze T
2
i T
1
Ciepło molowe pod stałym
ciśnieniem
dT
dH
dT
dQ
C
p
p
Ciepło molowe w stałej
objętości
dT
dU
dT
dQv
C
v
19
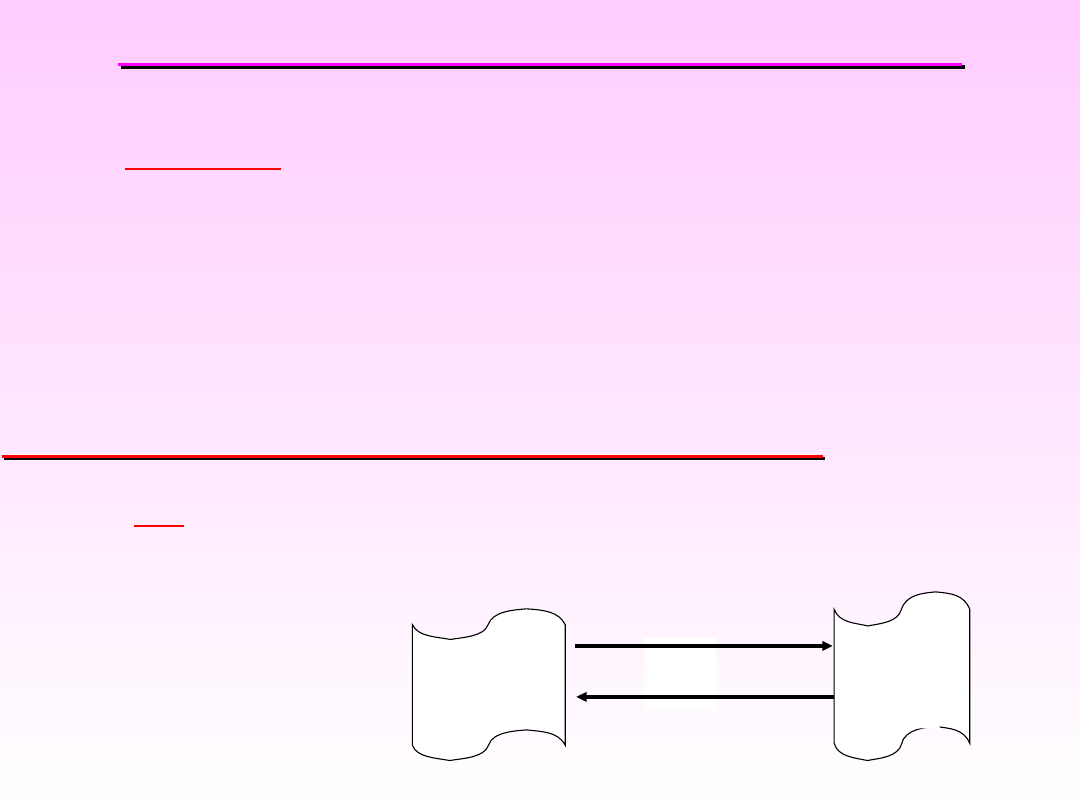
II ZASADA TERMODYNAMIKI
II ZASADA TERMODYNAMIKI
T
1
>T
2
– warunek
1.
Przechodzenie ciepła z ciała o temp.
wyższej do
ciała o temp. niższej
Przykłady procesów samorzutnych:
Przykłady procesów samorzutnych:
Pewne procesy przebiegają w sposób naturalny,
inne zaś nie.
Procesy:
•
Samorzutne
Samorzutne
wykazują dążność do zachodzenia
bez konieczności wykonywania pracy na układzie.
•Wymuszone (
niesamorzutne
) – nie wykazuje
dążności do zachodzenia; energia jest doprowadzana
z zewnątrz np. w postaci pracy.
Q
T
1
T
2
Proces
samorzutny
Proces
niesamorzutny
20
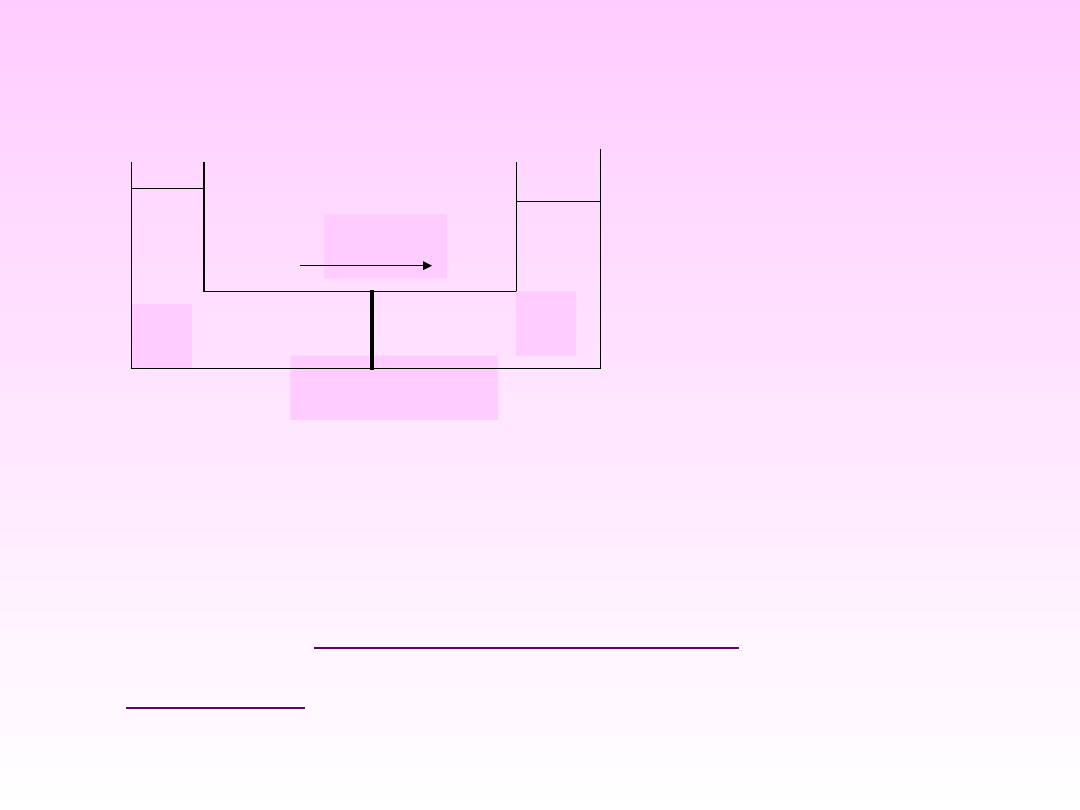
2.
Osmoza
Osmoza – samorzutna dyfuzja
rozpuszczalnika z roztworu o stężeniu
mniejszym do roztworu o stężeniu większym
przez półprzepuszczalną membranę
Wniosek:
Procesy samorzutne cechuje
określona kierunkowość.
3.
Reakcja redox
Reakcja redox: Zn + CuSO
4
ZnSO
4
+ Cu
2
2
Cu/Cu
Zn/Zn
U
U
potencjał normalny w szeregu napięciowym metali
Warunek
:
membra
na
mas
a
C
1
C
2
C
1
< C
2
-
warunek
Proces
samorzutny
21

3. Procesy samorzutne są
nieodwracalne
nieodwracalne
(nie mogą
przebiegać samorzutnie w dwóch przeciwnych
kierunkach).
Cechy procesów samorzutnych:
1. Wszystkim procesom samorzutnym może
towarzyszyć
wykonanie pracy
wykonanie pracy
, jeżeli będą
prowadzone w określonych warunkach, np. reakcja
Zn + CuSO
4
ZnSO
4
+ Cu w ogniwie galwanicznym,
2. Wszystkie procesy samorzutne zmierzają do
pewnego
stanu równowagi
stanu równowagi
, np. przechodzenie
ciepła aż do stanu T
1
= T
2
lub osmoza do stanu c
1
=
c
2,
II ZASADA TERMODYNAMIKI
II ZASADA TERMODYNAMIKI
sformułowanie Kelvina:
WSZYSTKIE ZJAWISKA, JAKIE ZACHODZĄ
SAMORZUTNIE W PRZYRODZIE SĄ
ZJAWISKAMI NIEODWRACALNYMI.
22
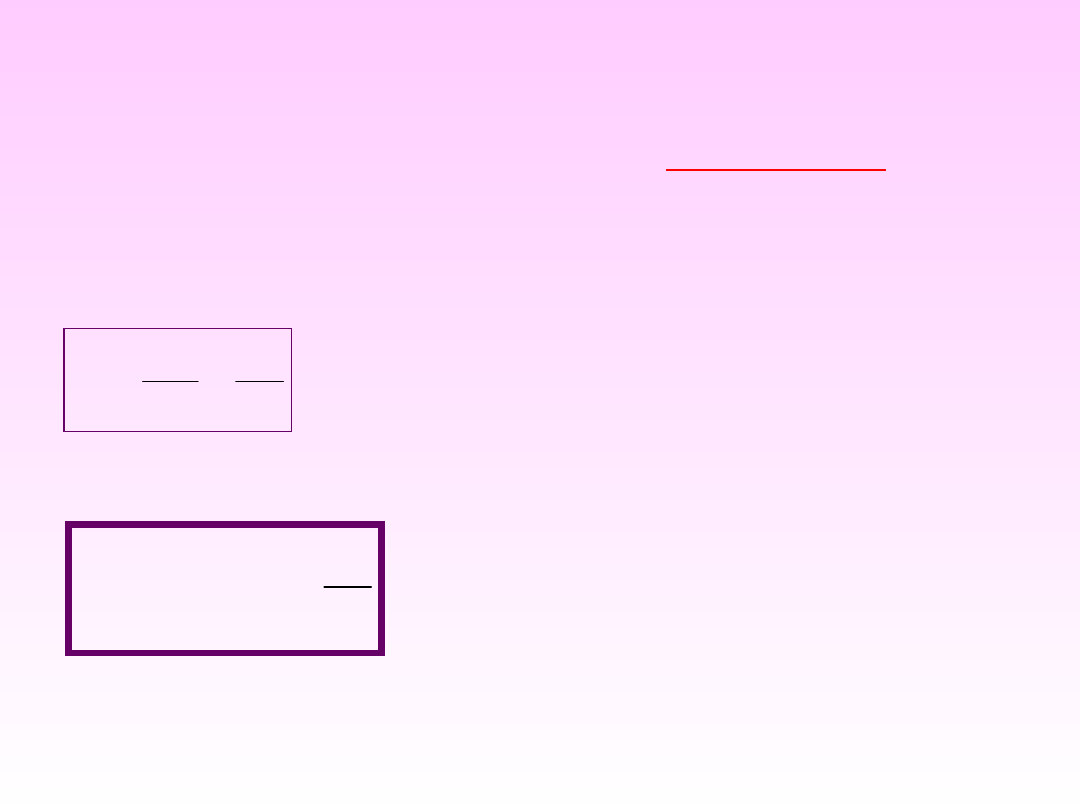
Do ilościowego opisu procesów samorzutnych
służy funkcja termodynamiczna –
ENTROPIA
– S
Po scałkowaniu powyższego równania w granicach T
1
÷T
2
:
2
1
T
T
1
2
T
dQ
S
S
S
S
T1
– entropia w
temp. T
1
S
T2
– entropia w
temp. T
2
T
dQ
T
Q
dS
el
Q
el
– elementarna ilość ciepła
wymieniona w procesie odwracalnym
T – temp. procesu.
ENTROPIA
– funkcja, której nieskończenie
mały przyrost określony jest wyrażeniem:
II ZASADA TERMODYNAMIKI
II ZASADA TERMODYNAMIKI
23

II zasada termodynamiki
II zasada termodynamiki
S > 0
– matematyczny wyraz II zasady
termodynamiki
SAMORZUTNIE MOGĄ PRZEBIEGAĆ
TYLKO TE PROCESY, KTÓRYM
TOWARZYSZY WZROST ENTROPII
Inne sformułowanie II zasady termodynamiki:
Samorzutnie
i
nieodwracalnie
przebiegającym
procesie
fizycznym lub chemicznym
będzie następował wzrost
entropii.
2
1
S
S
,
0
S
równowaga i proces
odwracalny
24
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
TERMODYNAMIKA I TERMOCHEMIA
07 Termodynamika i termochemia
I zasada termodynamiki i termochemia
TERMODYNAMIKA CHEMICZNA I TERMOCHEMIA
termochemia i termodynamika
TERMODYNAMIKA CHEMICZNA I TERMOCHEMIA 3 12 (6 12)
Termodynamika 2
TERMODYNAMIKA
podstawy termodynamiki(1)
Termodynamika2
LAMBDA termochemia spalania paliwa
fizyka termodynamika pr klucz
14 Termodynamika fenomenologiczna B
CW 3 Termochemia
I zasada T
więcej podobnych podstron