
Miareczkowanie
precypitometryczn
e

Metody analityczne
wykorzystują cztery grupy
reakcji chemicznych:
Reakcje kwas-zasada
(alkacymetria)
Reakcje redoks (redoksymetria)
Reakcje strącania osadów
(precypitometria)
Reakcje kompleksowania
(kompleksometria)

Precypitometria
A
+
+ B
-
→AB
Powstały osad musi być bardzo trudno
rozpuszczalny gdyż wprowadzamy ilość
stechiometryczną titranta.
Źródła błędów:
-rozpuszczalność osadu
-adsorpcja
-okluzja
-osady koloidowe
Miareczkujemy
energicznie,
stale mieszając ‼

Argentometria
Najczęściej stosowaną metodą
miareczkowania strąceniowego jest
argentometria,
w której roztworem
mianowanym jest azotan (V) srebra.
Inne roztwory mianowane:
azotan (V) rtęci (I)-
merkurometria
,
heksacyjanożelazian (II) potasu.

Krzywa miareczkowania
precypitometrycznego
Krzywa miareczkowania ma szczególne punkty
opisane poniższymi zależnościami:
w punkcie wyjściowym:
Cl
-
+ Ag
+
→AgCl
Ag
+
+CrO
42-
→Ag
2
CrO
4
(brunatno-czerwony)
-log[Cl
-
]=pCl
Przed PR
[Cl
-
]=(c
1
v
1
–c
2
v
2
/v
1
+v
2
)

Krzywa miareczkowania
precypitometrycznego
W PR (osad AgCl w roztworze z
nadmiarem jonów chlorkowych)
AgCl↔Ag
+
+ Cl
-
[Ag
+
]=[Cl
-
]
K
so
=[Ag
+
] [Cl
-
]
[Cl
-
]
2
=K
so
→ [Cl
-
]
=
√K
so

Krzywa miareczkowania
precypitometrycznego
Po przekroczeniu PR:
AgCl↔Ag
+
+ Cl
-
[Ag
+
] > [Cl
-
]
K
so
=[Ag
+
] [Cl
-
]→[Cl
-
]=K
so
/ [Ag
+
]
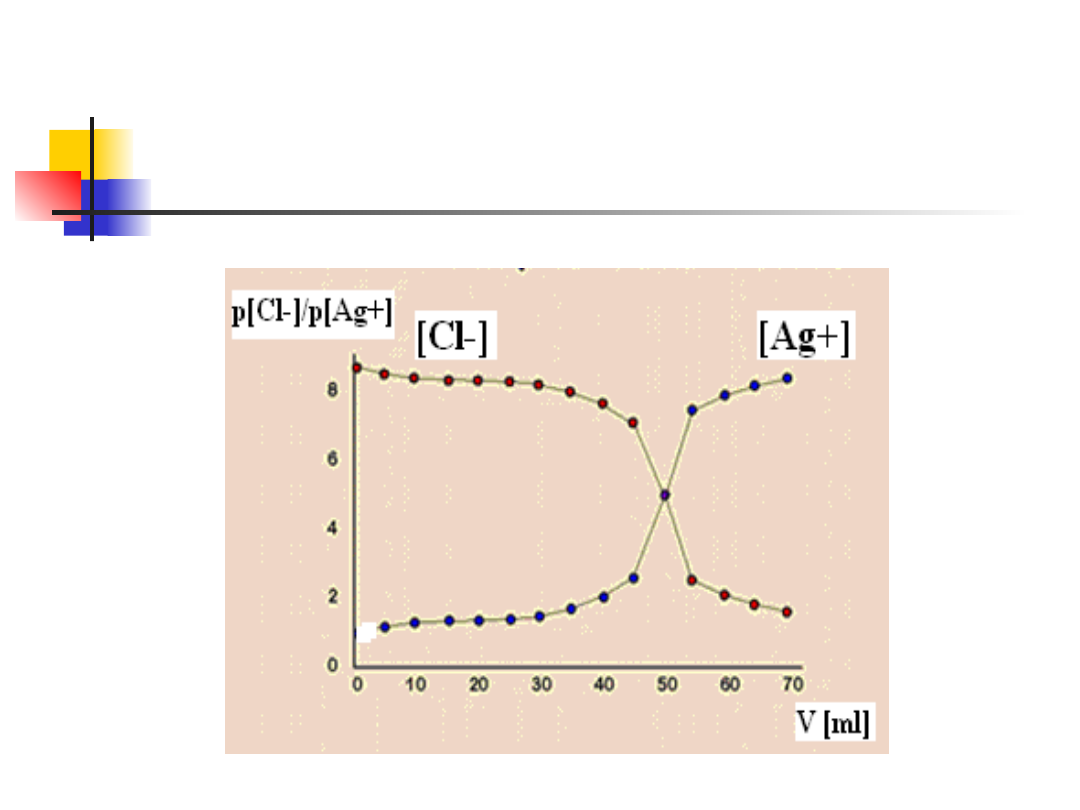
Krzywa miareczkowania
precypitometrycznego

Krzywa miareczkowania
precypitometrycznego
Skok krzywej miareczkowania zależy od :
-stężeń titranta i roztworu
miareczkowanego
-rozpuszczalności wytrącanego osadu
pK
so AgCl
=10
pK
so AgBr
=12.4
pK
so AgI
=16
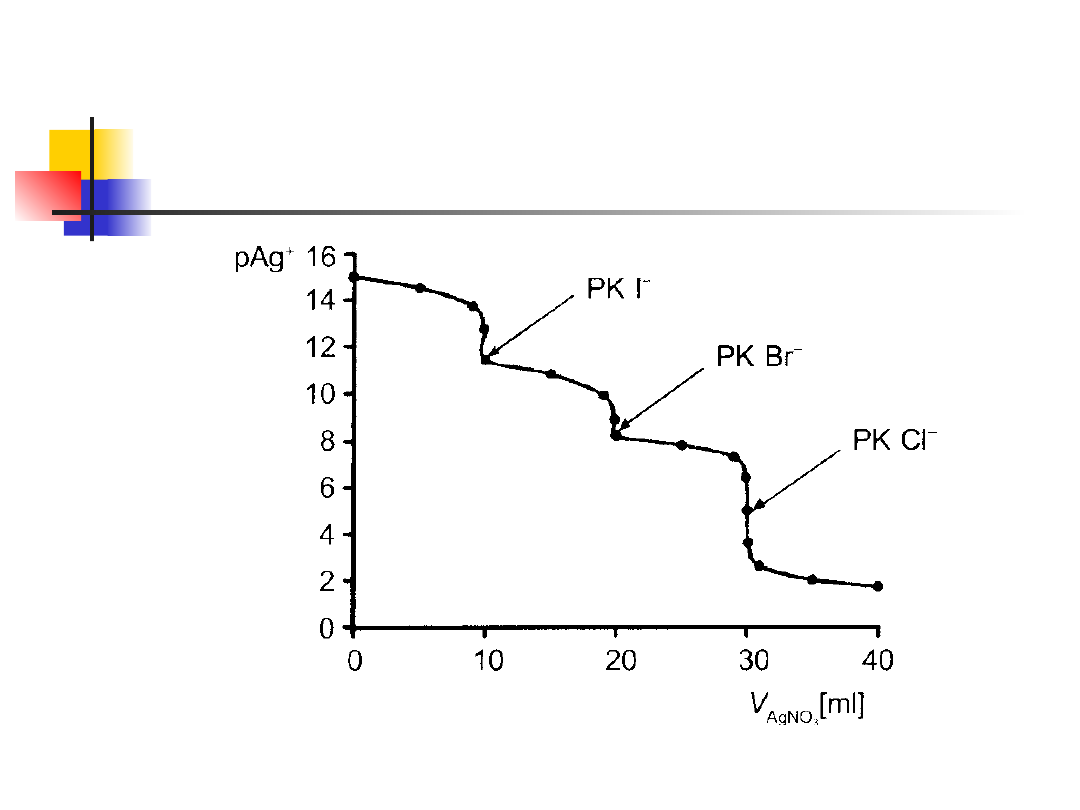
Oznaczanie anionów w
mieszaninie
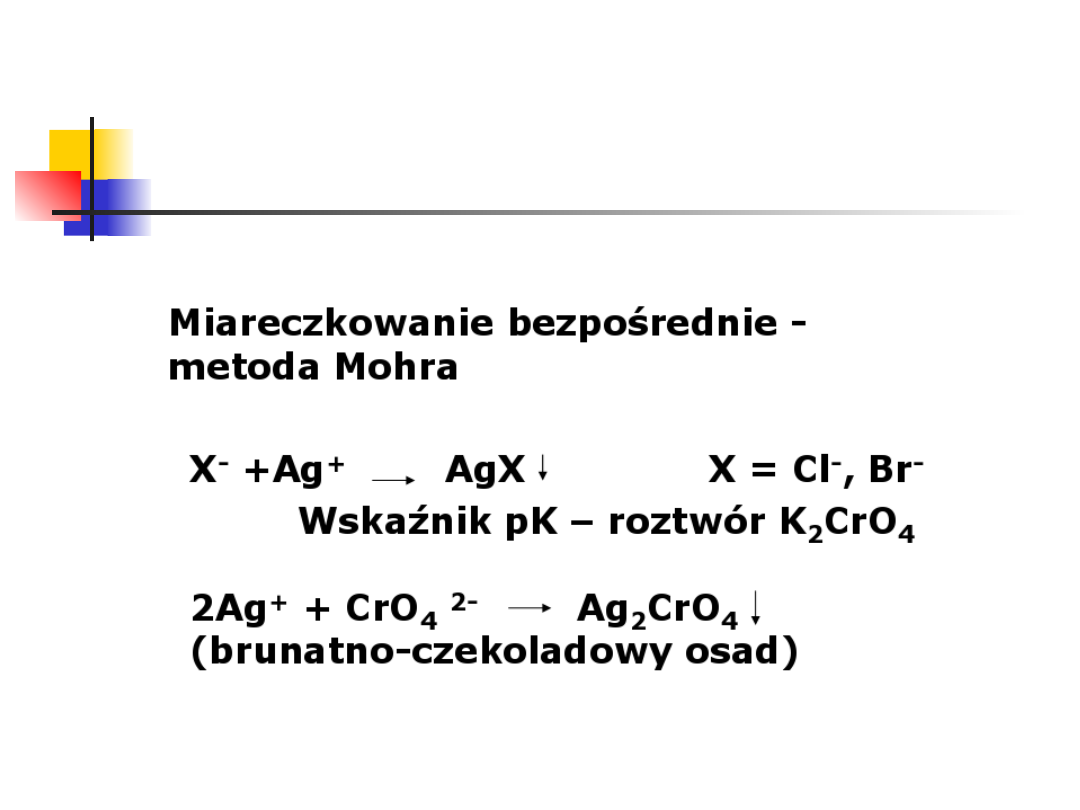
Metoda Mohra oznaczania
chlorków (Cl
-
)

Charakterystyka metody
Mohra

Charakterystyka metody
Mohra

Błąd metody Mohra
Różna rozpuszczalność osadów
. Chromian
(VI) srebra jest łatwiej rozpuszczalny a
więc popełniamy błąd dodatni
miareczkowania.
K
so
,AgCl = 1.8.10
-10
K
so
,Ag
2
CrO
4
= 1.1.10
-12
Ślepa próba
- konieczna, żeby sprawdzić, o
ile musimy przemiareczkować próbkę do
zauważenia punktu końcowego, a także
ile chromianu trzeba dodać, aby w ogóle
zauważyć punkt końcowy.

Metoda Volharda
oznaczania chlorków.

Metoda Volharda
oznaczania chlorków.

Oznaczanie chlorków
metoda Fajansa-Hassela
Wskaźniki adsorpcyjne

Wskaźniki adsorpcyjne
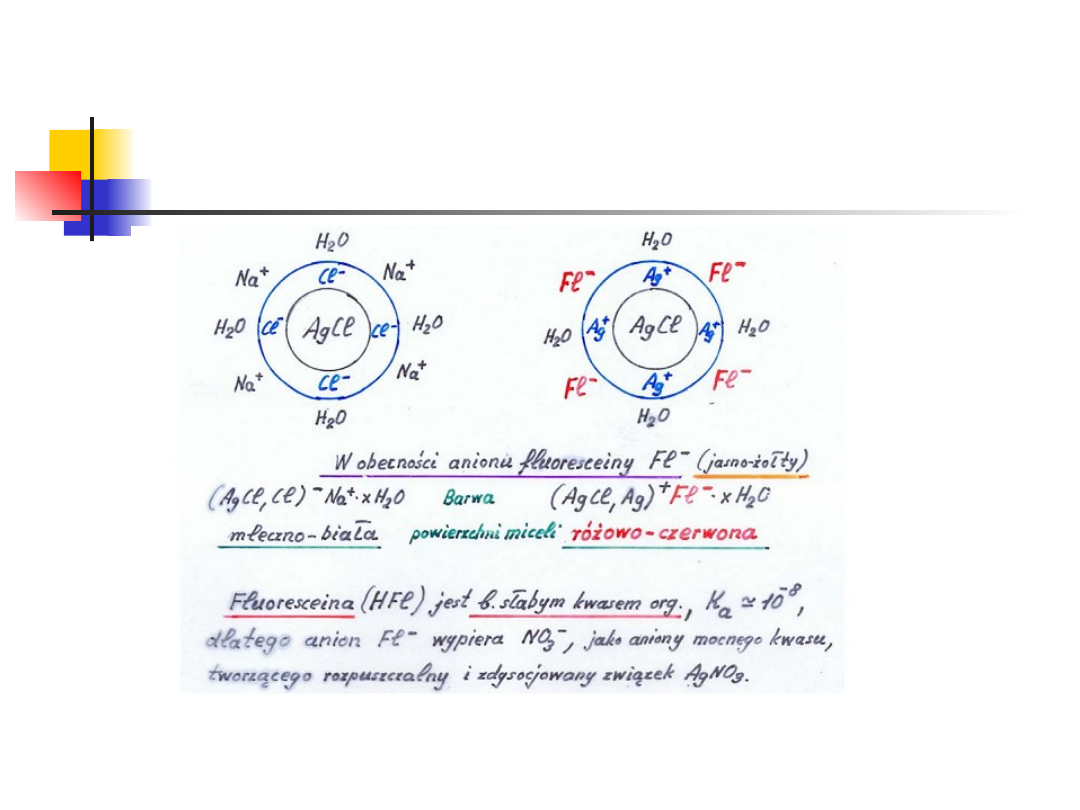
Wskaźniki adsorpcyjne

Oznaczenia
precypitometryczne
(przykłady)
‼
Oznaczanie manganu (II)
Oznaczanie cynku
Oznaczanie cyjanków


Oznaczanie jonów Mn


Kompleksometria

Kompleksometria

Powtórzenie wiadomości o
kompleksach
Budowa kompleksu:
kompleks składa się z atomu centralnego i ligandów
atom centralny jest akceptorem, a ligand donorem elektronów
cecha charakterystyczna kompleksów sa wiązania
koordynacyjne, w których wiążąca para elektronowa pochodzi
od liganda
atomem centralnym nazywa się atom lub jon będący ośrodkiem
koordynacji, najczęściej jest to jon metalu z grupy metali
przejściowych
ligandy są to jony lub cząsteczki połączone bezpośrednio
wiązaniem koordynacyjnym z atomem centralnym
atom centralny wraz z ligandami tworzy wewnętrzną sferę
koordynacji
zewnętrzna sfera koordynacji stanowią jony znajdujące się
poza wewnętrzną sfera koordynacji, zobojętniające ładunek jonu
kompleksowego
liczba koordynacji jest to liczba wiązań koordynacyjnych
utworzonych przez atom centralny, czyli liczba ligandów, które
są zgrupowane w kompleksie prostym, dookoła atomu
centralnego

Powtórzenie wiadomości o
kompleksach
Rodzaje kompleksów:
ze względu na rodzaj ligandów wyróżnia się kompleksy:
proste – kompleksy utworzone z ligandów jednofunkcyjnych, czyli takich,
które zajmują w wewnętrznej sferze koordynacyjnej atomu centralnego tylko
jedno miejsce, np. [Fe(SCN)]2+, rozpuszczają się w wodzie
chylatowe – kompleksy utworzone z ligandów wielofunkcyjnych, czyli
takich, które zajmują w wewnętrznej sferze koordynacyjnej atomu
centralnego dwa lub więcej miejsc, rozpuszczają się w nie polarnych
rozpuszczalnikach organicznych np. tetra-chlorek węgla
ze względu na ilość atomów centralnych wyróżnia się kompleksy:
jednordzeniowe – takie, które zawierają jeden atom centralny
wielordzeniowe – takie, które zawierają dwa lub więcej atomów
centralnych
ze względu na szybkość tworzenia się i dysocjowania kompleksów
wyróżnia się kompleksy:
labilne – czyli takie, w których równowaga pomiędzy składnikami
kompleksów a utworzonym kompleksem ustala się bardzo szybko, Np.
kompleksy niklu (II) z jonem cyjankowym
bierne – czyli, takie w których ustalanie to przebiega bardzo wolno i stan
równowagi zostaje osiągnięty nieraz w ciągu wielu godzin, np. kompleksy
chromu (III) z EDTA

Kompleksometria
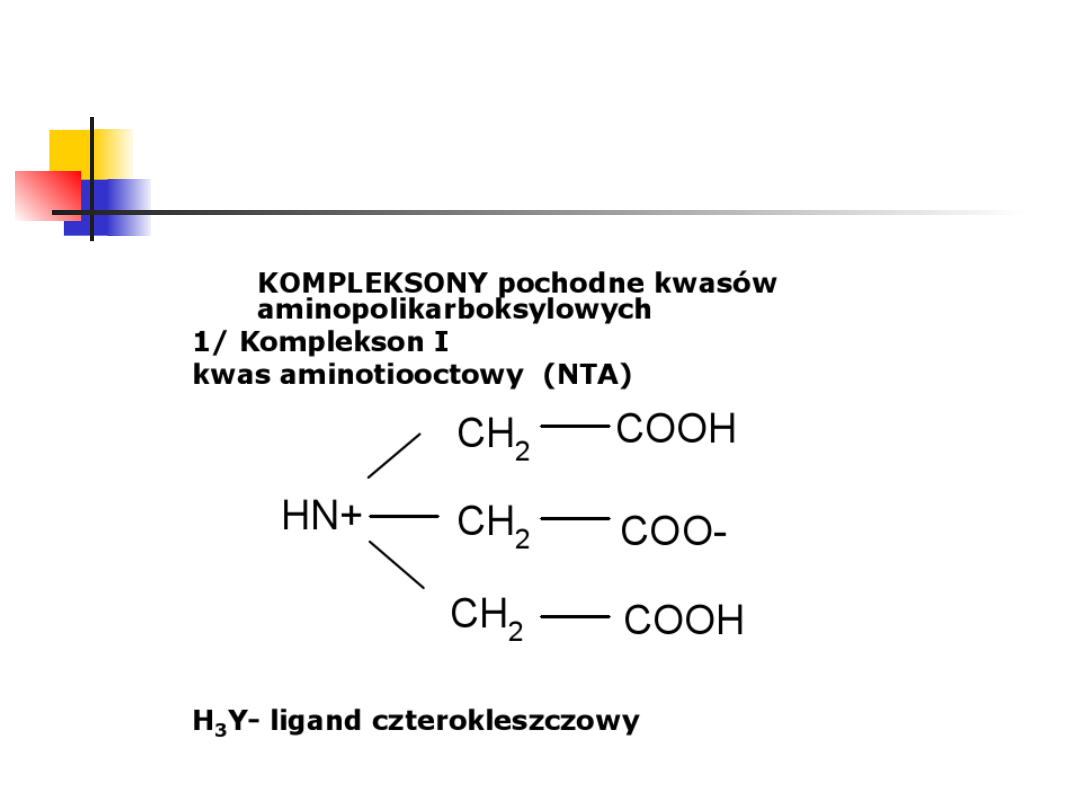
Kompleksony.
kompleksony – grupa kwasów amino-poli-karboksylowych, pochodne
kwasu imino-dioctowego
kompleksony tworzą bardzo trwale związki kompleksowe niemal ze
wszystkimi kationami wielowartościowymi
najbardziej znane kompleksony to:
komplekson I czyli kwas nitrylo-trioctowy (NTA)
komplekson II czyli kwas etyleno-diaminotetraoctowy (EDTA), nazwa
handlowa kwas wersenowy;
komplekson III czyli sol dwusodowa EDTA – Na2H2Y ; ma największe
znaczenie ze wszystkich kompleksonów, w porównaniu z
kompleksonem II oznacza się on większą rozpuszczalnością w wodzie
komplekson IV czyli CDTA, który tworzy trwalsze kompleksy niż
komplekson III
czynniki wpływające na trwałość kompleksów metali z EDTA:
komplekson II tworzy w zwykłych warunkach z większością kationów
kompleksy w stosunku
trwałość kompleksów EDTA zależy także od pH roztworu,
zmniejszanie się pH powoduje zmniejszanie trwałości kompleksu

Typy miareczkowań
kompleksonometrycznych
bezpośrednie – polega na stopniowym dodawaniu mianowanego
roztworu EDTA do roztworu o odpowiednim pH zawierającego
oznaczany kation i wskaźnik, np. oznaczanie niklu wobec mureksydu
odwrotne – polega na dodaniu do roztworu zawierającego dany
kation nadmiaru mianowanego roztworu EDTA, który następnie
odmiareczkowuje się mianowanym roztworem MgSO4 lub ZnSO4.;
metodę tą stosuje się wówczas, gdy trwałość kompleksu kationu
użytego do odmiareczkowania jest mniejsza niż trwałość kompleksu
pierwiastków oznaczanych, przykład: oznaczanie siarczanów –
siarczany wytraca się mianowanym roztworem chlorku baru, którego
nadmiar miareczkuje się za pomocą EDTA wobec czerni
eriochromowej
podstawieniowe – polega na miareczkowaniu kationu wypartego z
kompleksu, głównie stosuje się taki rodzaj miareczkowania dla
kationow tworzących trwalsze kompleksy z EDTA niż magnez czy
cynk; np. oznaczanie jonow wapnia wobec czerni eriochromowej;
wapn tworzy z czernia kompleks zbyt malo trwaly, aby można było
miareczkowac go bezposrednio wobec tego wskaznika
Pośrednie dotyczy oznaczania anionów np.. Szczawianowych.

Wskaźniki
kompleksonometryczne
I wskaźniki redoks
Blekit wariaminowy, 3,3’ dimetylonaftydyna
oznacznie kompleksometryczne wobec wskaznikow redoks
polega na zmianie potencjalu ukladu na skutek zwiazania
kationu w trwaly kompleks, np. miareczkowanie Fe3+ lub
Cu2+ roztworem EDTA wobec blekitu wariaminowego
prowadzi się do zmiany niebieskofioletowego zabarwienia
roztworu, odbarwienie roztworu nastepuje na skutek
gwaltownego zmniejszenia potencjalu redoks ukladu
Fe3+/Fe2+ lub Cu2+/Cu+; postac zredukowana blekitu jest
bezbarwna
Odczynniik Browna Hayesa: Fe(CN)
64-
/ Fe(CN)
63-

II Metalowskaźniki
Wskazniki metalochromowe, sa to barwniki
organiczne zdolne do tworzenia kompleksow z
metalami, przy czym reakcji towarzyszy zmiana
zabarwienia, przyklady: mureksyd, czern
eriochromowa T, kalces
M-Ind + EDTA→M-EDTA + Ind
(barwa I) (barwa II)
np.
Mg-Ind + EDTA→Mg-EDTA + Ind(czerń
eriochromowa
(
barwa czerwona
) (
barwa niebieska
)
Zasady stosowania
wskaźników
metalochromowych
M-Ind + EDTA→M-EDTA + Ind
(barwa I) (barwa II)
Czuła, selektywna,
trwałość <od kompleksu z EDTA,
barwa różna od wolnego wskaźnika
Roztwór rzeczywisty,
Wpływ czynników
zewnętrznych znikomy
Wskaźniki
kompleksonometryczne
Powinny one:
współzawodniczyć z EDTA o jon metalu, ale
być słabszym ligandem od titranta;
wykazywać wyraźną różnicę między formą wolną i związaną w
kompleks.
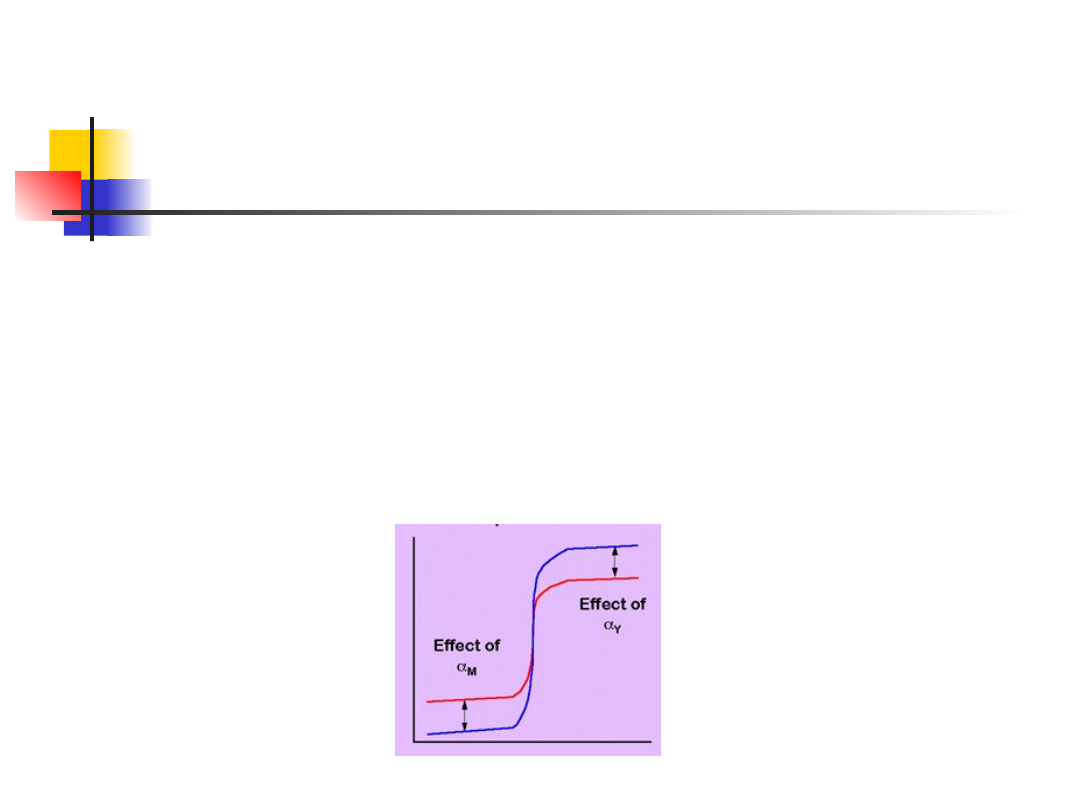
M-Ind + Y M-Y + Ind
W obecności wskaźnika reakcja przebiega w ten sposób, że najpierw
titrant kompleksuje metal niezwiązany, a gdy go zabraknie, wypiera
wskaźnik z wcześniej przezeń utwo rzonych kompleksów.
Konkurencja wskaźnika (effect of aY) obniża jednak efektywny skok
miareczkowania, podobnie jak zmniejszenie wyjściowego stężenia
metalu (effect of aM):

Podział wskaźników
metalochromowych
1.
orto, orto’-dihydroksyazowe: czerń
eriochromowa, granat eriochromowy,
kalces, kalmagit.
2.
orto, orto’-dipodstawione azowe: PAN
3.
Ftaleiny, sulfoftaleiny: fluorekson, oranz
ksylenowy, błekit metylotymolowy,
fiolet pirokatechinowy
4.
Inna budowa: mureksyd

grupa III sa to zwiazki praktycznie
bezbarwne, np. kwas salicylowy i
sulfosalicylowy czy jodek potasu lub
tiomocznik; zwiazki te reaguja z
kationami tworzac barwne kompleksy, np.
kwas salicylowy reagujac z jonami żelaza
(III) tworzy kompleksy, których barwa
zalezy od pH; w srodowisku bardzo
kwasnym powstaje fioletowy kompleks,
przy pH 4 pomaranczowoczerwony, a
przy pH 9 jasnozolty
III grupa pozostałe wskaźniki

Kompleksonometria
Kompleksony
(Kompleksonometria)
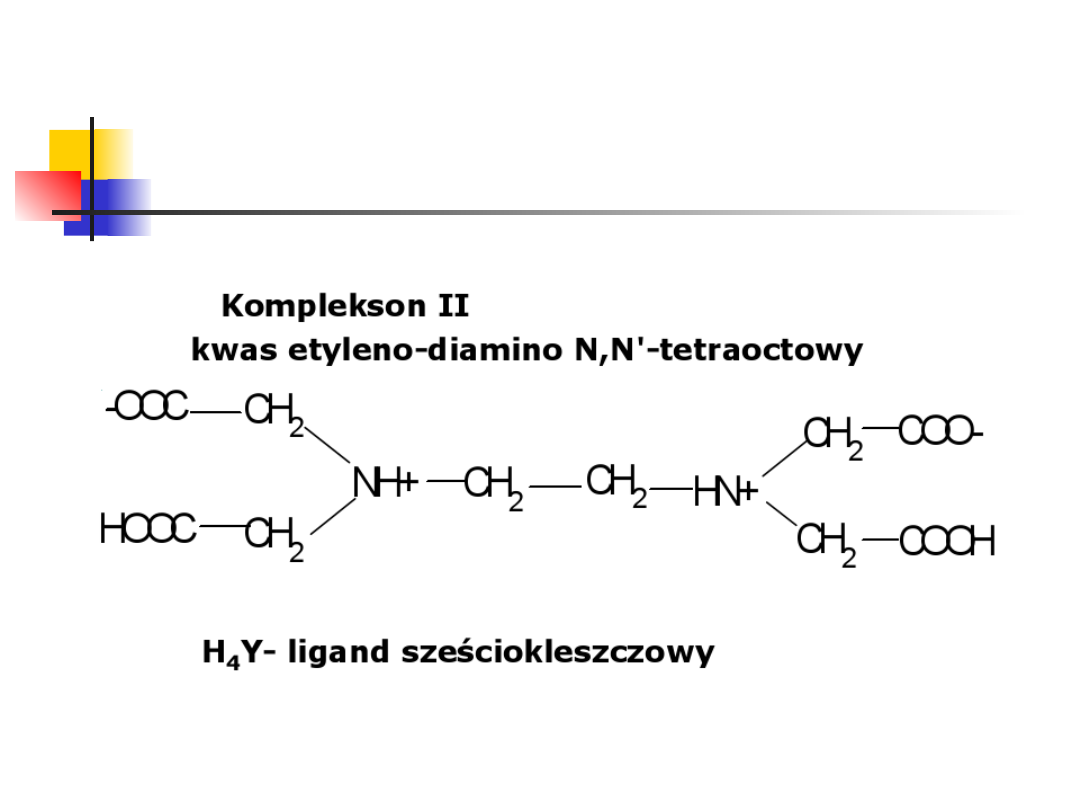
Kompleksony

Kompleksony (EDTA)
EDTA (kwas etylenodiaminotetraoctowy, kwas wersenowy,
komplekson II) – organiczny związek chemiczny z grupy
amin.
Zazwyczaj stosowany w postaci soli disodowej ze względu na
jej większą rozpuszczalność w wodzie (komplekson III).

EDTA
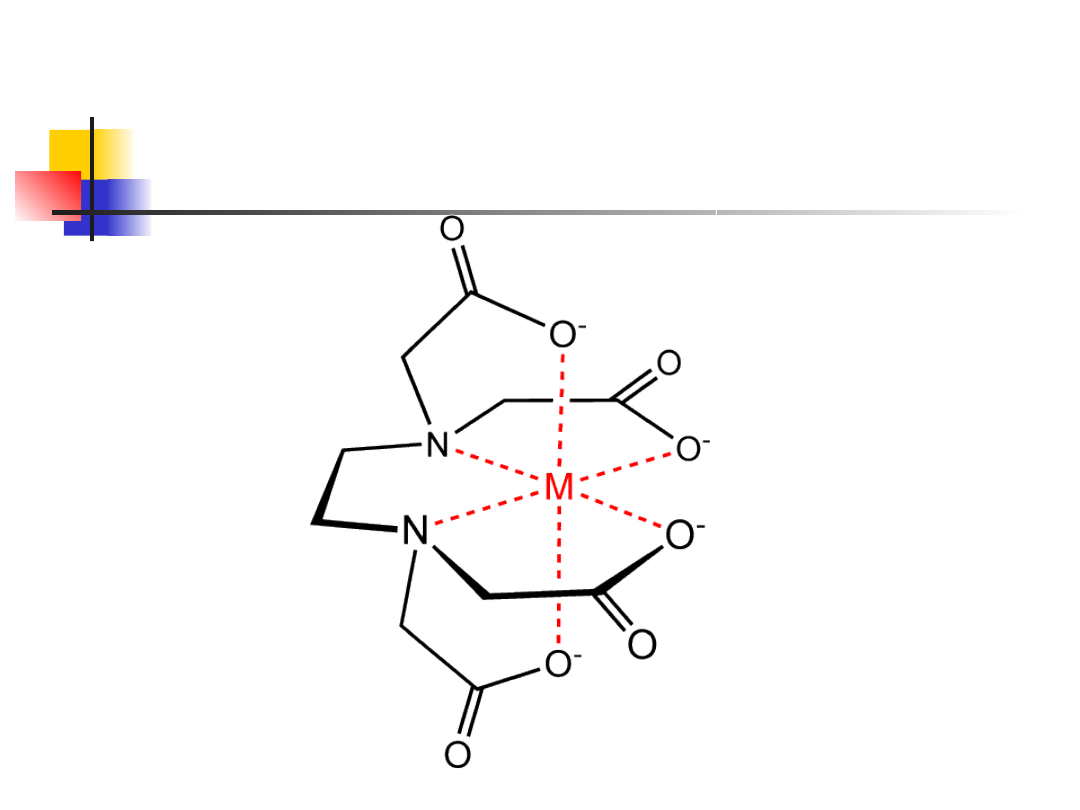
Kompleksy EDTA z
metalami

Cechy charakterystyczne
kompleksonu III

Cechy charakterystyczne
kompleksonu III

Przykłady reakcji
kompleksonometrycznych
Mg2+ + H2Y2- MgY2- + 2H+
Fe3+ + H2Y2- FeY- + 2H+

Zastosowanie EDTA
Trwałość związków
kompleksowych
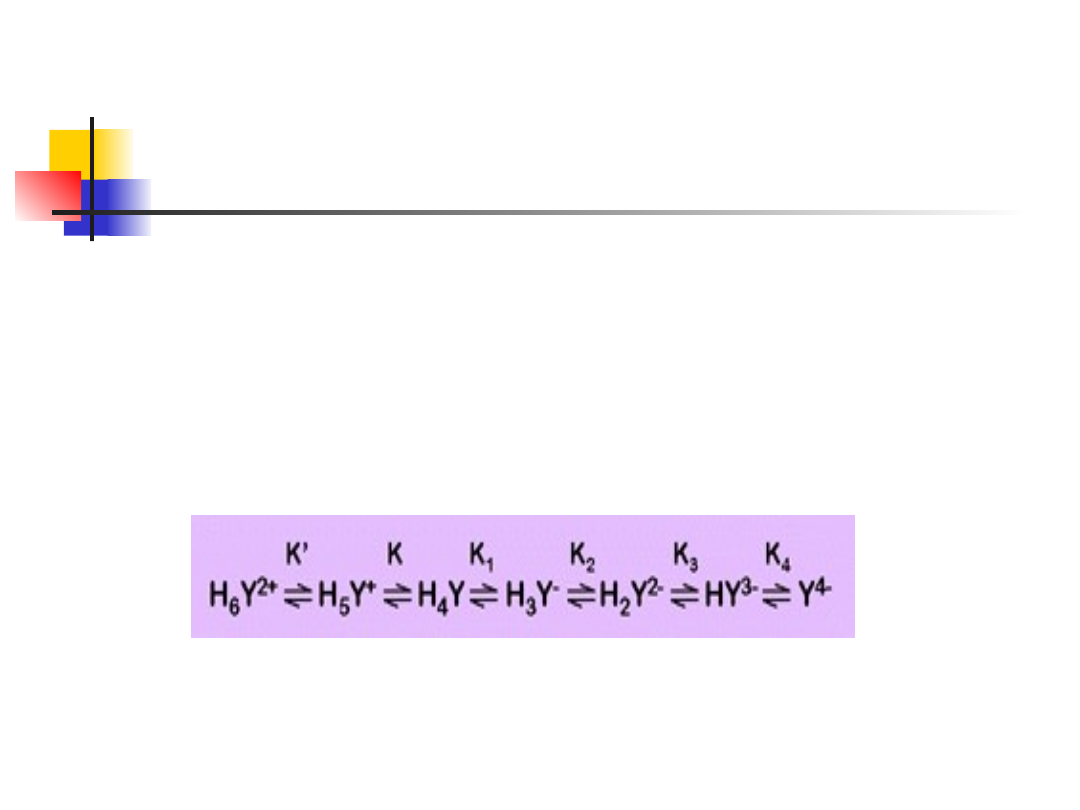
EDTA wpływ pH
Trwałość kompleksów z EDTA zależy od pH:
Mg2+ + H2Y2- MgY2- + 2H+
Skoro ligandem jest jon Y4+, wszystko co nań
wpływa ma także wpływ na proces
miareczkowania. Najważniejsze jest pH.
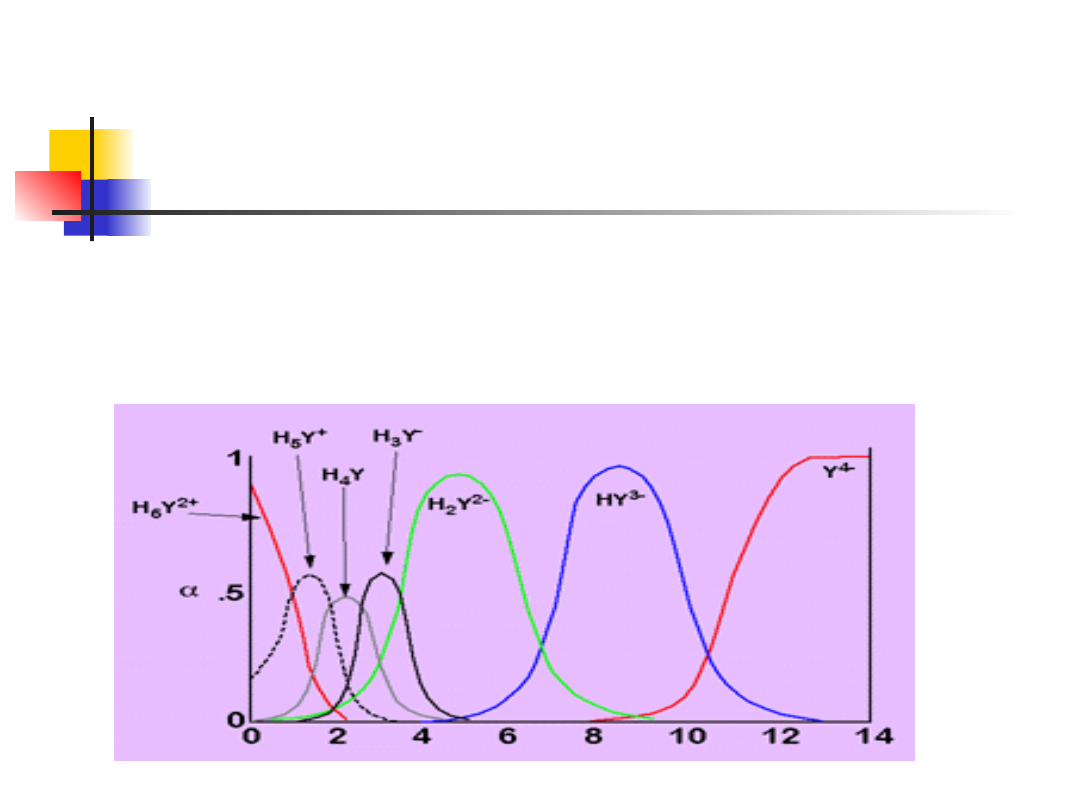
EDTA wpływ pH
Ten proces komplikuje fakt, że grupy aminowe mogą być
protonowane oraz równowagi nie są rozdzielone (przy
pewnych pH mogą obok siebie istnieć, w podobnych
ilościach, więcej niż dwie różne formy).
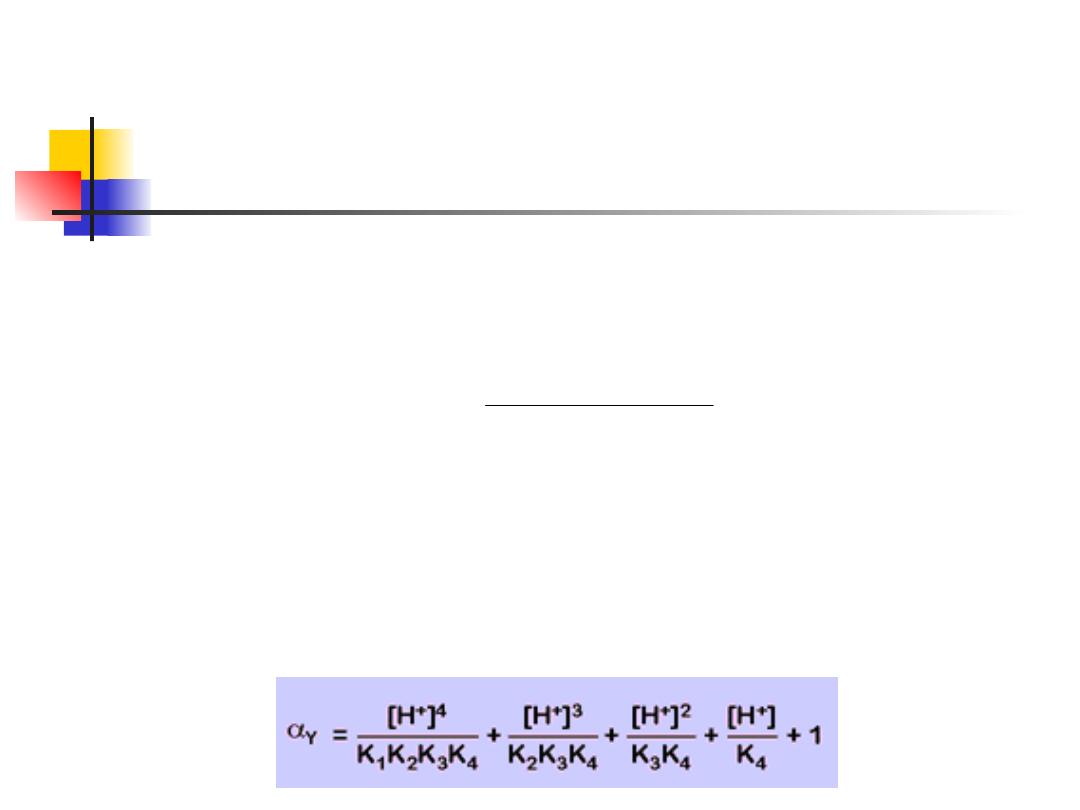
EDTA wpływ pH
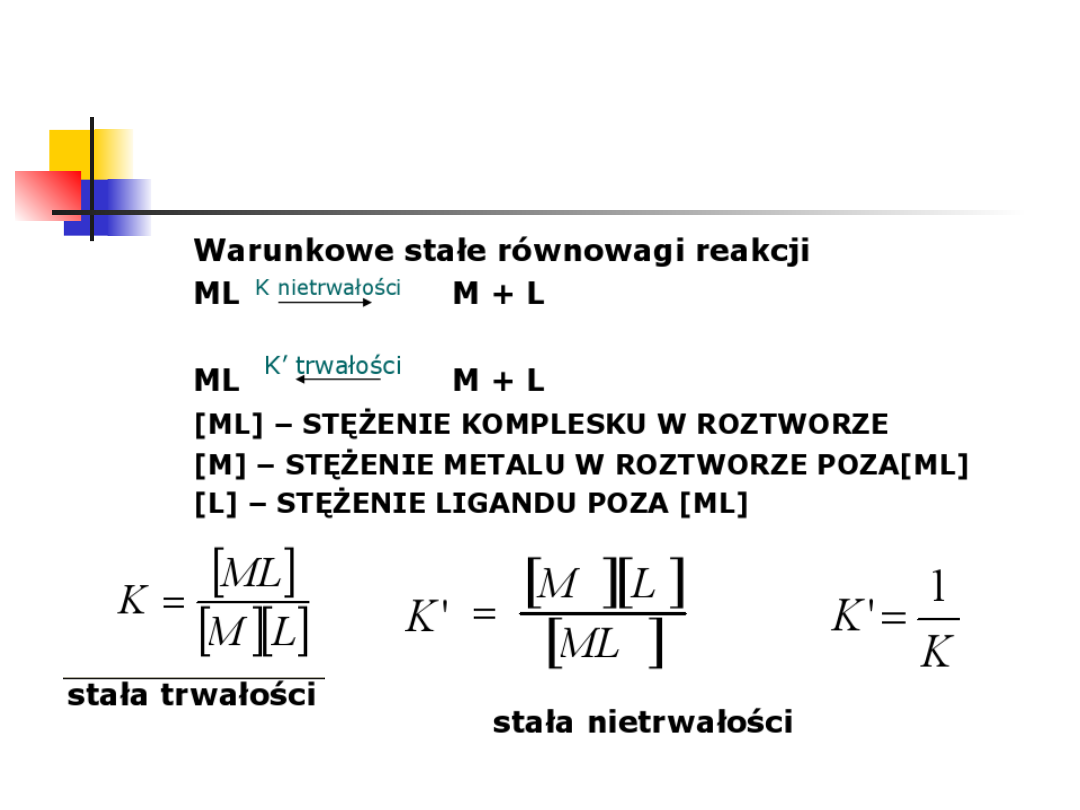
Aby uwzględnić wpływ pH, zamiast
"zwykłej" stałej trwałości:
wprowadza się warunkową stałą
trwałości:
K
MY
M Y
MY
[
]
[
][
]
4
4
Y
MY
MY
K
K
/
'

Krzywa miareczkowania
kompleksonometrycznego
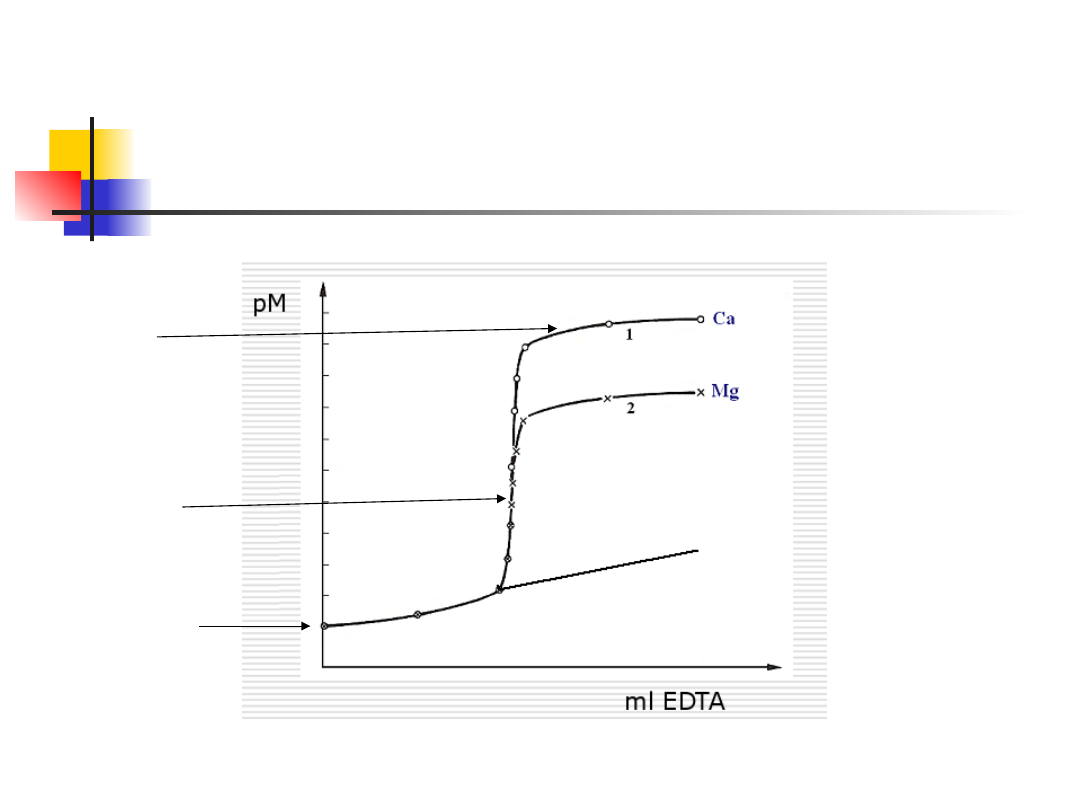
Krzywa miareczkowania
kompleksonometrycznego
K=10
10
K=10
8
K=10
6
pM=-log[M]
pM=1/2lg(2K’
MY
/c
M)
pM=lgK’+lg(V-V
o
/V
o)

Analizy
kompleksonometryczne
Oznaczanie srebra (met. Liebiga)
2CN
-
+Ag
+
→Ag(CN)
2-
// Ag
+
+ Ag(CN)
2-
→2AgCN
Oznaczanie wapnia obok magnezu
I próbka (pH=10) Ca+Mg (czerń
eriochromowa :czerwona→niebieska)
II próbka (pH=12 Mg(OH)
2
(kalces,
fluorekson)

Twardość wody
nietrwałą zwaną też przemijającą, węglanową – która jest generowana
przez sole kwaśne kwasu węglowego – wodorowęglany
Nazwa "twardość nietrwała" wynika z faktu, że wodorowęglany są nietrwałe
termicznie i podczas ogrzewania przekształcają się do nierozpuszczalnych w
wodzie węglanów, które wytrącają się z roztworu (jest to proces odwrotny
do rozpuszczania w wodzie skał węglanowych w obecności CO
2
), np.:
Ca(HCO
3
)
2
--> CaCO
3
+ H
2
O + CO
2
Mg(HCO
3
)
2
--> MgCO
3
+ H
2
O + CO
2
trwałą – która jest generowana przez sole innych kwasów, głównie chlorki,
ale też siarczany, azotany i inne, które pozostają również po przegotowaniu
wody.
Twardość ogólna jest sumą twardości węglanowej i niewęglanowej

Stopnie niemieckie
1 Stopień niemiecki odpowiada
zawartości
10 mg CaO w litrze wody

Stopnie twardości
Typowa twardość wody użytkowej (kranowej) wynosi ok. 10 °n. Woda
poniżej 3 °n jest uważana za miękką, zaś woda powyżej 30 °n jest
uważana za twardą:
bardzo miękka: <75 mg CaCO
3
/dm
3
miękka: 75–150 mg CaCO
3
/dm
3
średnio twarda: 150–300 mg CaCO
3
/dm
3
twarda: 300–500 mg CaCO
3
/dm
3
bardzo twarda: >500 mg CaCO
3
/dm
3
Twardość wody pitnej wg norm polskich powinna wynosić 60–500 mg
CaCO
3
/dm
3

Egzamin końcowy
Wymień i scharakteryzuj rodzaje błędów występujących w ilościowej analizie
chemicznej.
Podstawowe wskaźniki alkacymetryczne i ich charakterystyka.
Jakie titranty były używane na pracowni analizy ilościowej. Napisz reakcje nastawiania
ich miana oraz stosowany wskaźnik.
Narysuj krzywą miareczkowania kwasu octowego na pomocą NaOH. Wyprowadź wzory
na pH w strategicznych punktach.
Wymień i omów na przykładach typy miareczkowań stosowanych w klasycznej
analizie ilościowej.
Zadania:
Oblicz rozpuszczalność CaC2O4 w roztworze 0.015 M Na2C2O4 w ppm uwzględniając
siłę jonową roztworu. Kso Ca2C2O4=2.3 x 10-7.
1 gram zanieczyszczonego Al2O3 rozpuszczono w kwasie HCl i przeniesiono do kolby
miarowej i rozcieńczono do objętości 200mL. Do 20 ml roztworu dodano 50 ml EDTA o
stężeniu 0.0512 M oraz buforu urotropinowego a następnie nadmiar odmiareczkowano
wobec oranżu ksylenowego zużywając 14,3 ml roztworu azotanu (V) ołowiu (II) o
stężeniu 0,05007 M. Ile procent zanieczyszczeń zawierała próbka tlenku glinu?
Ile mg cynku zawierała analiza o objętości 250 ml, jeżeli na miareczkowanie próbki o
objętości 20 ml tego roztworu zużyto 14,5 ml roztworu K4[Fe(CN)6] o stężeniu 0,1113
M?
Oblicz miano racjonalne roztwory Na2S2O3 wobec K2Cr2O7, jeżeli na miareczkowanie
wydzielonego jodu z tej próbki zużyto 21,8 ml 0,0986 M Na2S2O3.
Na miareczkowanie 5 cm3 częściowo rozłożonej wody utlenionej zużyto 25 ml 0,02 M
KMnO4. Oblicz procentową zawartość H2O2 w wodzie utlenionej.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
Wyszukiwarka
Podobne podstrony:
10 analiza ilościowa miareczkowanie precypitometryczne
W19 kompleksonometria, wska«niki i krzywe miareczkowania kompleks i
MIARECZKOWANIE 4 id 298319 Nieznany
ANALIZA MIARECZKOWA
sprawozdanie z miareczkowania, UP Wrocław, IŚ I SEM, Chemia
Analiza Instrumentalna Miareczkowanie spektrofotometryczne Sprawozdanie 3 x
miareczkownie, NAUKA, chemia, lab
miareczkowanie kulometryczne
Miareczkowanie wykres
Sprawozdanie miareczkowanie
Notatki precypitometria ikompleksonometria
miareczkowanie suszu z owoców, 2 rok, OGÓLNA TECHNOLOGIA ŻYWNOŚCI, cw, pytania
13. Miareczkowanie amperometryczne, Technologia Chemiczna, Rok III, Semestr II, Instrumentalne metod
Miareczkowanie konduktometryczne kwasu solnego, Studia - IŚ - materiały, Semestr 05, Ochrona powietr
Sprawozdanie miareczkowanie
Sprawozdanie Konduktometryczne miareczkowanie surowca?rmaceutycznego
Miareczkowanie strąceniowe,
podstawy miareczkowania
więcej podobnych podstron