
Zespół hemolityczno -
mocznicowy
Magdalena Silska
Klinika Kardiologii i Nefrologii Dziecięcej
Uniwersytet im. K. Marcinkowskiego w Poznaniu

Zespół hemolityczno-mocznicowy
(ang. haemolytic-uraemic syndrome,
HUS)
wielonarządowy zespół chorobowy –
mikroangiopatia zakrzepowa
występowanie - głównie
niemowlęta i małe dzieci
klasyczna triada objawów:
niedokrwistość hemolityczna
mikroangiopatyczna
trombocytopenia
ostra niewydolność nerek
–
najczęstsza
przyczyna ONN u dzieci <3r.ż.
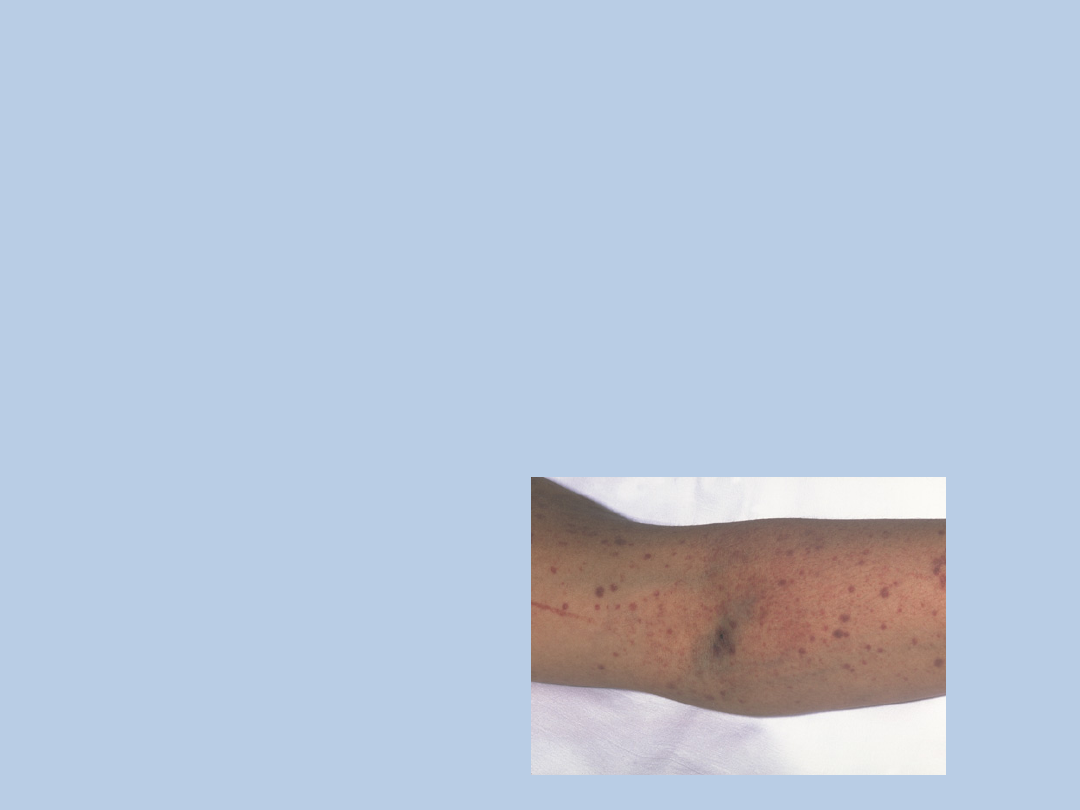
HUS – mikroangiopatia zakrzepowa
mikrozakrzepy z fibryny, trombocytów i
czynnika von Willebranda – uszkodzenie
śródbłonków drobnych naczyń
tętniczych
Różnicowanie z TTP (thrombotic
thrombocytopenic purpura, zakrzepowa
plamica małopłytkowa):
zwykle osoby dorosłe
zajęcie ośrodkowego
układu nerwowego
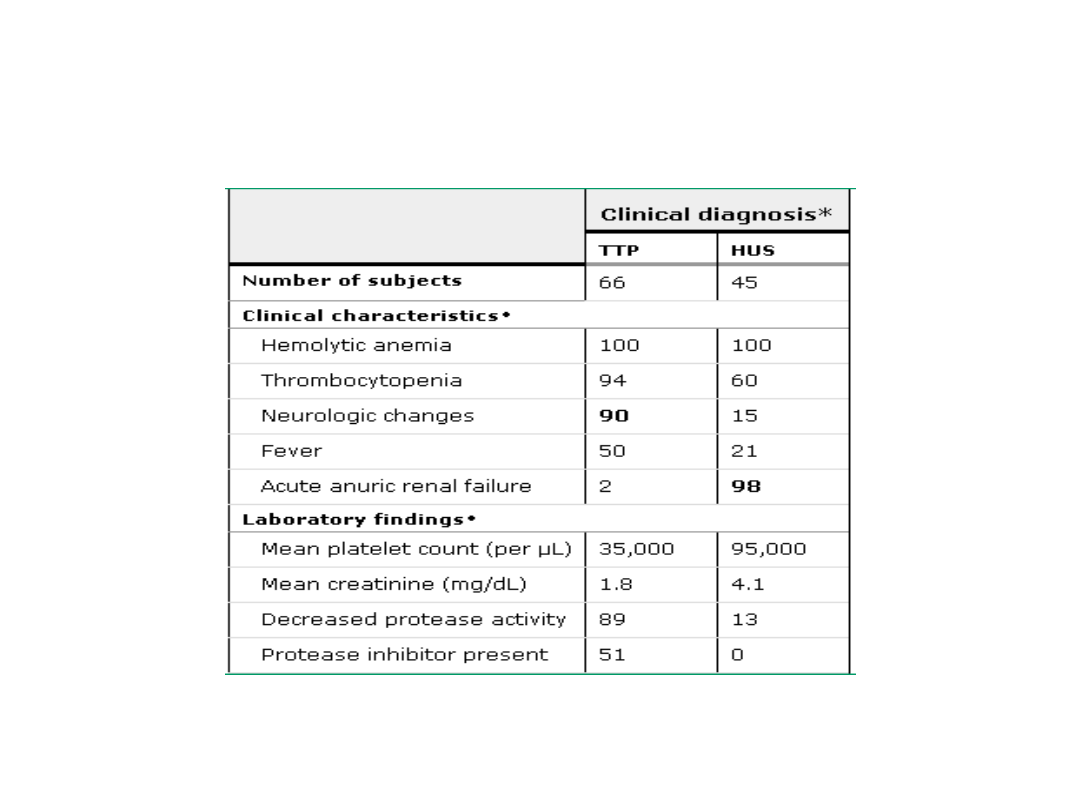
HUS/TTP - Różnicowanie
Veyradier, A, 2001, Blood 98:1765-1772.

Podział
Postać typowa D „+” (ang. diarrhoea
plus )
poprzedzona biegunką infekcyjną
ponad 90% przypadków HUS u dzieci
głównie < 3 r.ż.
Postać atypowa D „-” (ang. diarrhoea
minus)
5-10% przypadków HUS
w każdym wieku, dominuje u dzieci > 3
r.ż. i młodzieży
Postać wtórna

Etiologia
Postać typowa indukowana infekcją bakteryjną:
Escherichia coli serotyp O157:H7, rzadziej inne
serotypy (O111:H8, O103:H2, O121, O145, O26,
0113)
Inne bakterie Gram-ujemne (Schigella, Salmonella,
Campylobacter, Yersinia, Bartonella, Clostridium)
Mechanizm oparty na produkcji toksyn Shiga-
podobnych (Stx, werotoksyna) – 90% przypadków
HUS u dzieci
Egzotoksyna cytotoksyczna wobec
hodowli komórek linii Vero,
zależna od lizogennego zakażenia
bakteriofagiem

Patogenna E.coli
naturalny rezerwuar – bydło domowe (ok. 1%)
transmisja zakażenia:
droga pokarmowa (surowe, niedogotowane
mięso, niepasteryzowane mleko, skażone
owoce i warzywa)
rzadko bezpośredni kontakt ze zwierzętami,
skażone akweny wodne
tzw. choroba brudnych rąk
ok. 15% pacjentów z biegunką krwotoczną
wywołaną
patogenną E. coli rozwija objawy HUS
Objawy alarmowe: bladość, żółtaczka,
wybroczyny, krwawienia, pogorszenie stanu
ogólnego pacjenta, spadek diurezy,
nadciśnienie tętnicze, obrzęki
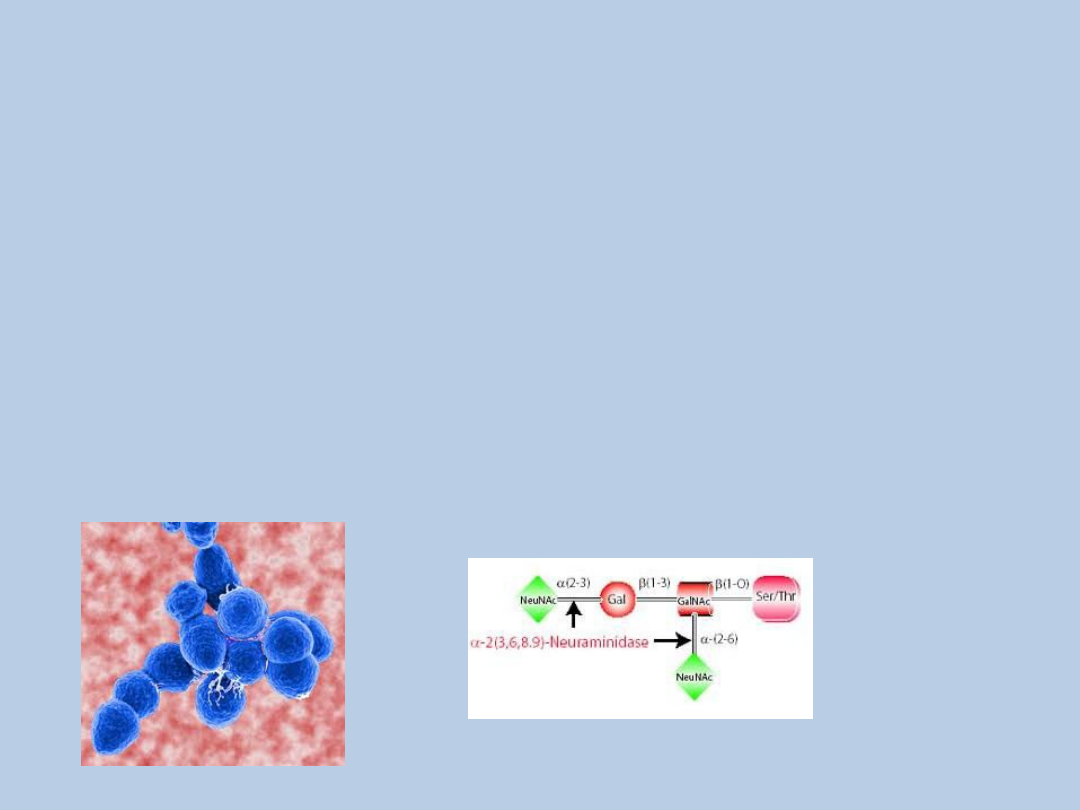
Inne czynniki infekcyjne –
atypowy HUS
Streptococcus pneumoniae –
neuraminidaza ( odsłania antygen
Thomsen-Friedenreich(T)
VZV, ECHO, Coxackie A i B, CMV, HIV
Cochran, JB, 2004, Pediatr Nephrol 19:317-321.

Patomechanizm
połączenie podjednostki B Shiga-toksyny z
receptorem Gb3 błony komórki docelowej
(naczynia kłębuszków i cewek nerkowych)
wniknięcie podjednostki A Shiga-toksyny do
wnętrza komórki
uszkodzenie rybosomalnego RNA –
zahamowanie translacji – śmierć komórki
śródbłonka
agregacja płytek krwi – zwężenie światła
małych naczyń – fragmentacja erytrocytów
Stx uwrażliwia komórki śródbłonka na
toksyczne działanie hemu
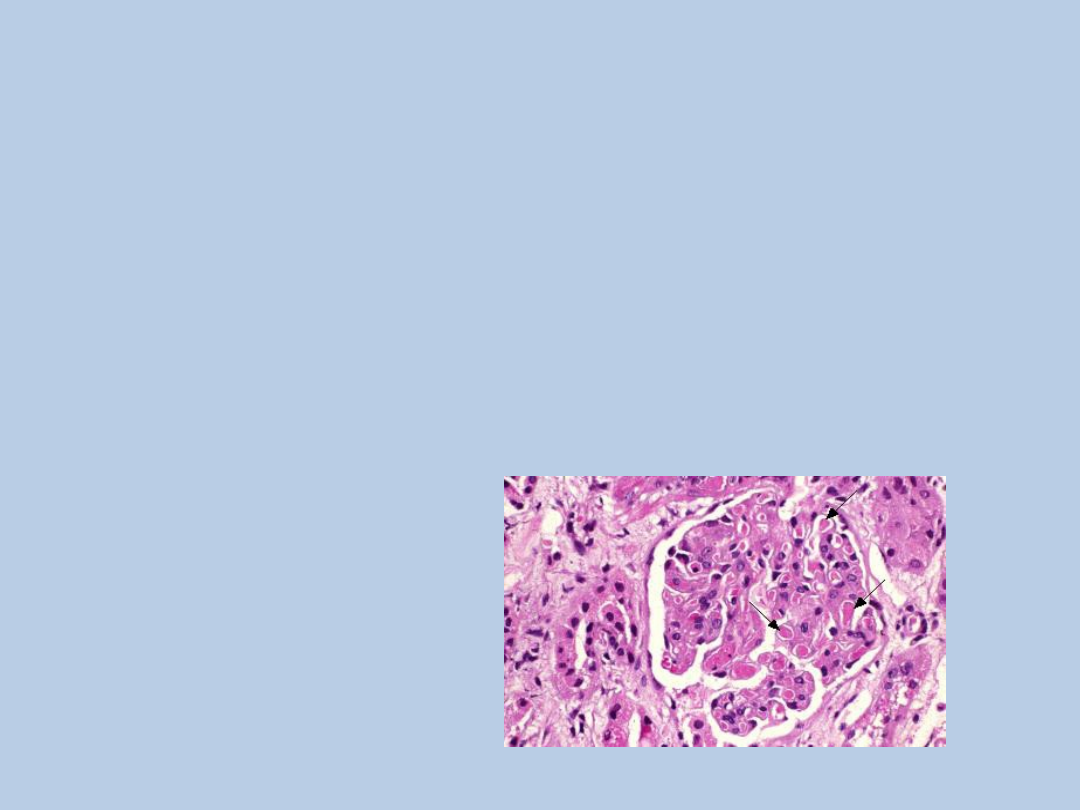
HUS - D „+”
Charakterystyka laboratoryjna:
rozmaz krwi obwodowej – schizocyty („skorupki”)
↑LDH
↓haptoglobina
↑ kreatynina
małopłytkowość(wyraźniej zaznaczona w zakrzepowej plamicy
małopłytkowej niż w zespole hemolityczno-mocznicowym)
Powikłania:
30-50% - rozwój przewlekłej choroby nerek
3-5% - śmiertelność
uszkodzenie mózgu
(udar i/lub obrzęk mózgu)
uszkodzenie serca
uszkodzenie płuc
martwica lub perforacja jelit
niewydolność wielonarządowa
Zakrzep w kapilarach nerkowych
Etiologia
Postać atypowa:
Zaburzenia w obrębie układu dopełniacza:
• Genetycznie uwarunkowane ( utrata funkcji - czynnik H, I, MCP,
Trombomodulina, Białko wiążące C4b; wzmocnienie funkcji –
czynnik B, C3)
• Nabyte, np. przeciwciało przeciwko czynnikowi H
Niedobór proteazy czynnika von Willebranda (vWF-CP):
• Mutacja genu ADAMTS13
• Nabyty niedobór vWF-CP:
zaburzenia autoimmunologiczne
polekowe
Defekt metabolizmu kobalaminy
Walport M. N Engl J Med
2001;344:1058-1066
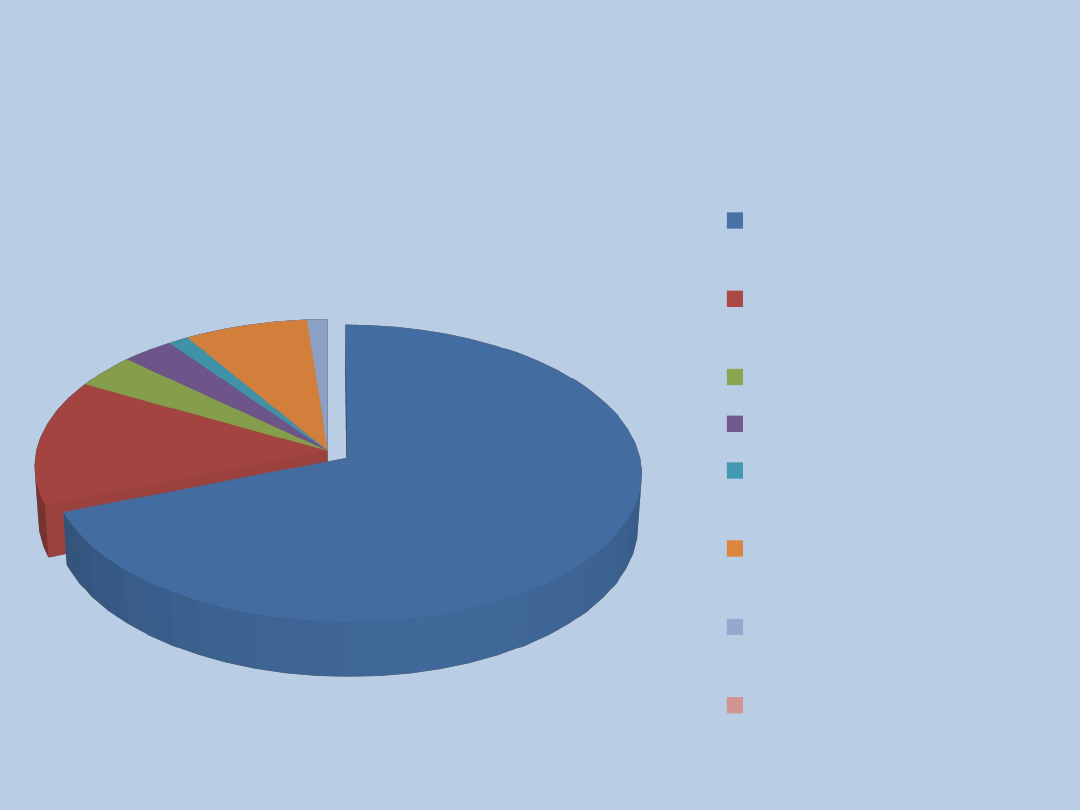
The European Paediatric
Research Group For D(-) HUS
Etiologia nieznana
(110)
Mutacja/niedobór
czynnika H (22)
Mutacja czynnika I (6)
Mutacja MCP (5)
Przeciwciało przeciwko
czynnikowi H (2)
Niedobór protezy vWF
(12)
Posocznica
pneumokokowa (12)
Mutacja FH i nidobór
proteazy (2)
167 pacjentów
Badanie w latach 2000-2004r.
Besbas e.al. , KI
2006
.
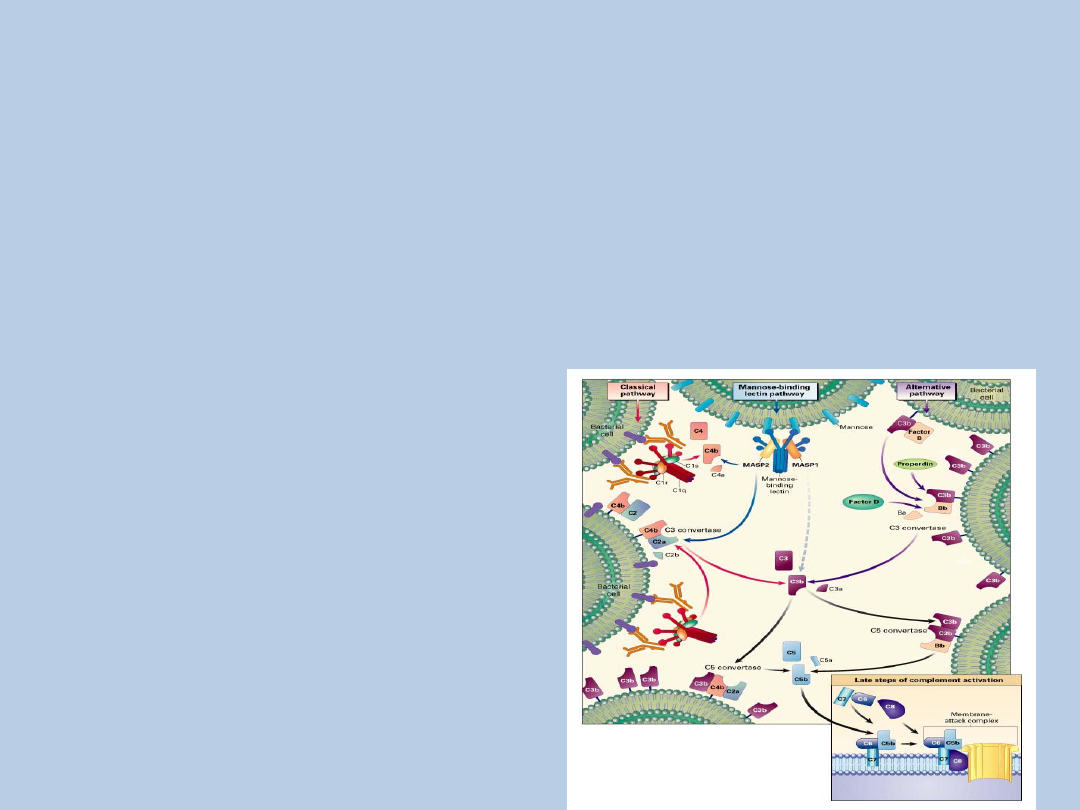
Aktywacja układu dopełniacza
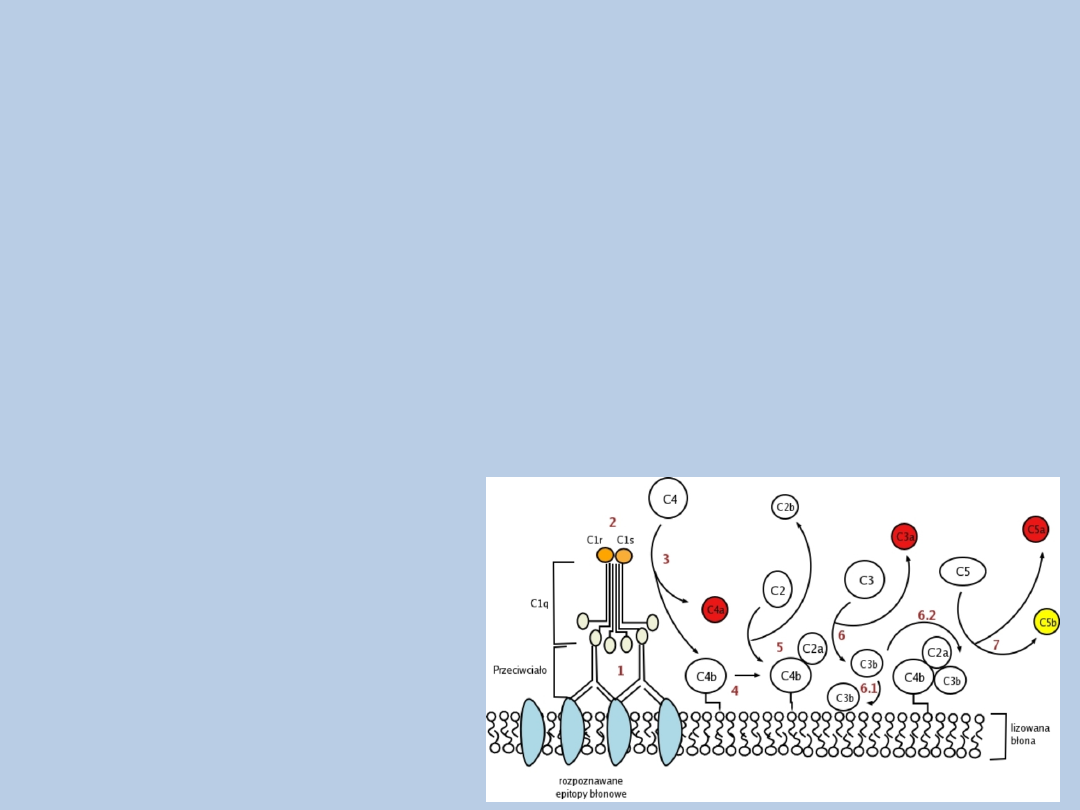
Droga klasyczna
1. Przyłączenie się cząsteczki C1q do przeciwciał związanych z antygenem –
zmiana konformacji
2. Wzbudzenie proteazy serynowej C1r – aktywacja proteazy C1s
3. Aktywowana C1s - rozkład białek C4 i C2
4. Fragment C4a uwalniany do osocza, C4b związany z błoną komórkową
5. Kompleks C4b2a – konwertaza C3 drogi klasycznej
6. Konwertaza C3 – rozkład białka C3
7. C3b – możliwość wiązania do błony komórkowej patogenu (opsonina)
lub konwertazy C3 (konwertaza C5)
8. Konwertaza C5- rozkład białka C5 –
powstawanie MAC
Aktywacja układu dopełniacza
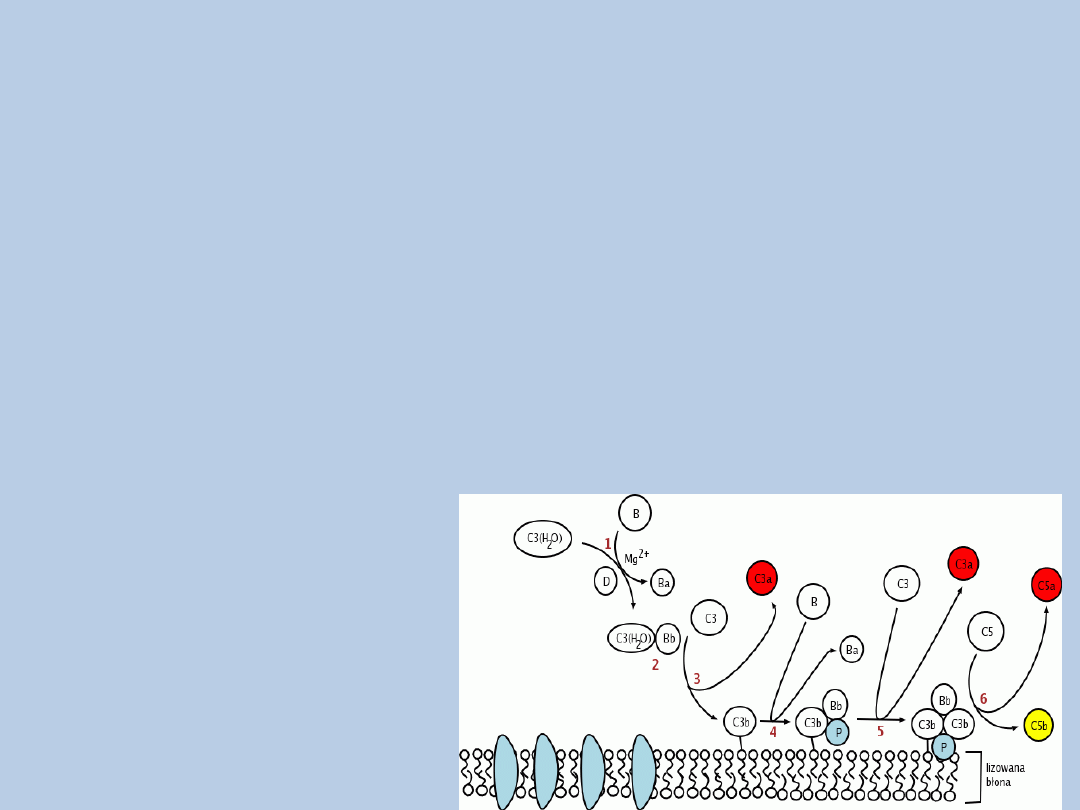
Droga alternatywna
1. Pobudzona forma C3(H2O) - związanie czynnika B
2. Rozkład czynnika B w obecności jonów magnezu i czynnika D
3. Kompleks C3(H2O) i fragment Bb – rozpuszczalna konwertaza C3 drogi alternatywnej
4. Konwertaza C3 – rozkład białka C3
5. Kompleks C3b i czynnik B – rozkład czynnika B
6. Powstanie błonowej konwertazy C3 drogi alternatywnej, a następnie konwertazy C5
7. Czynnik P (properdyna) – stabilizacja błonowej konwertazy C3
8. C5b – tworzenie MAC
C3b - czynnik łączący drogę
klasyczną i alternatywną

Aktywacja układu dopełniacza
Droga lektynowa
1. Zbliżona do drogi klasycznej – odmienne pierwsze etapy aktywacji
2. Swoista reakcja antygen – przeciwciało zastąpiona nieswoistą
reakcją z udziałem kolektyn
3. Kolektyny – białka surfaktantu płucnego A i D oraz
osoczowa lektyna wiążąca mannozę (MBL)
4. MBL - główny czynnik zapoczątkowujący drogę lektynową
5. Kompleks MBL – antygen –zmiana konformacji – aktywacja
proteazy serynowej MASP-1
6. aMAPS-1 – aktywacja MAPS-2
7. aMAPS-2 – rozkład białek C2 i C4
8. Droga lektynowa może zapoczątkować reakcję obronną
bezpośrednio po wniknięciu patogenu do organizmu

Regulacja układu dopełniacza
Czynniki osoczowe
Czynnik H:
• wiąże składową dopełniacza C3b
• wspomaga czynnik I w hamowaniu konwertazy C3 drogi
alternatywnej
Czynnik I:
• rozkłada formy wolne i związane w konwertazach C3b i C4b
• powoduje rozpad konwertaz
Inhibitor C1:
• hamuje aktywne proteazy C1r i C1s
Białko wiążące C4:
• wiąże C4b
• wspomaga czynnik I w hamowaniu konwertazy C3 drogi klasycznej
Białko S
• blokuje C5b67
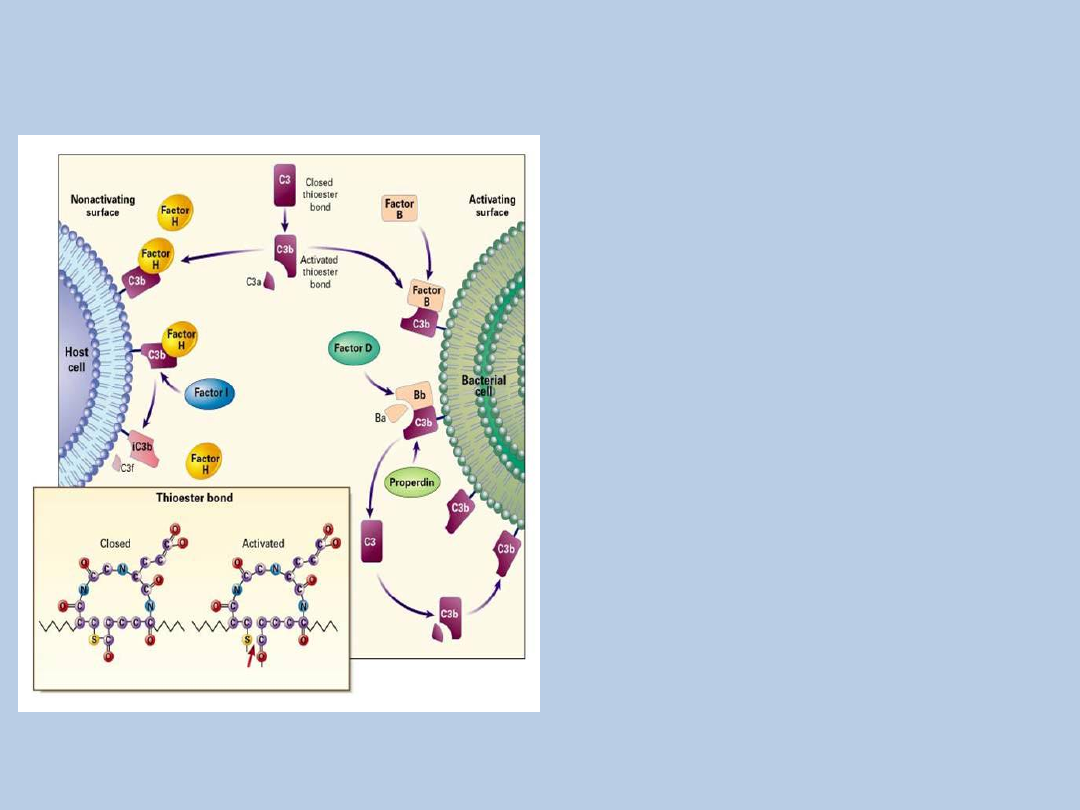
Regulacja rozkładu
Układ dopełniacza
Walport M. N Engl J Med
2001;344:1058-1066
C3 przez czynnik H
oraz czynnik I

Niedobór czynnika H
czynnik H - glikoproteina osoczowa (150kDa), produkowana głównie w wątrobie
przyczyna 10-22% przypadków atypowego HUS
postaci sporadyczne i rodzinne
okres niemowlęcy lub wczesne dzieciństwo
sporadycznie osoby dorosłe
poziomy FH, C3, FB i CH
50
:
homozygoty – niskie
Heterozygoty (najczęstsza postać mutacji) –
wartości od niskich do normalnych
nabyty niedobór C3 lub końca C’
Obniżenie C3 w 30-67%
infekcja meningokokowa
niedobór FH i C2 (np. SLE)
Dragon-Durey, M-A, et al, 2004, J Am Soc Nephrol 15:787-795.
Autoprzeciwciała przeciwko
czynnikowi H
5-10% pacjentów z postacią atypową HUS
homozygotyczna delecja FHR1 i FHR3
poziom FHR1 i FHR2 w osoczu – niski lub
niewykrywalny
młody wiek zachorowania

Niedobór czynnika I
sporadyczne przypadki atypowego HUS ( 5-10%)
najczęściej mutacje heterozygotyczne
bez zwiększonej podatności na infekcje
homozygotyczność niedoboru FI
zwiększona podatność na infekcje
bakterie bezotoczkowe
(meningococcus, pneumococcus, hemophilus)
różnorodność penetracji i ekspresji
wartość C3 może być niska lub normalna
nabyty niedobór C3 spowodowany nadmiernym zużyciem
Dragon-Durey, M-A, et al, 2005, Springer Semin Immun
27:359-374.
Kavanagh, D, et al, 2005, J Am Soc Nephrol 16:2150-2155.


Regulacja układu dopełniacza
Czynniki komórkowe
receptor dla dopełniacza (CR1):
• rozkład C3b i C4b
• inaktywacja konwertazy
błonowy kofaktor białkowy (ang. Membrane Cofactor Protein, MCP, CD46)
• wiązanie C3b i C4b
• obecny na wszystkich komórkach jądrzastych organizmu
czynnik przyspieszający rozkład (ang. Decay Accelerating Factor, DAF)
• skraca okres półtrwania konwertaz
czynniki restrykcji homologicznej(ang. Homologous Restriction Factor, HRF,
CD59)
• wiązanie C8 i C9
• hamowanie tworzenia MAC
MIRL (ang. Membrane Inhibitor of Reactive Lysis)
• blokuje przyłączenie C9 i tworzenie MAC.
BŁONOWY KOFAKTOR BIAŁKOWY
(MCP = CD46)
~65 kD glikoproteina przezbłonowa
obecny na większości komórek z wyjątkiem RBC (leukocytach, płytkach krwi,
komórkach endotelialnych i epitelialnych, fibroblastach, w nerkach)
kofaktor czynnika osoczowego czynnika I
receptor dla patogenów:
wirus odry
Adenowirusy
HHV-6
dwoinki i streptokoki grupy A
dominują mutacje heterozygotyczne
poziom C3 normalny lub obniżony
10-15% przypadków atypowego HUS
http://www.biochem.ucl.ac.uk/~becky/FH//proteinInfo.php?protein=MCP

Patogeneza-atypowy HUS
infekcja/stan zapalny – wzrost liczby C3b
aktywacja kaskady dopełniacza oraz C3a/C5a
C3a/C5a:
migracja leukocytów
produkcja TNF i IL-8
cytokiny powodują uszkodzenie śródbłonka co prowadzi do ekspozycji macierzy
pozakomórkowej
dalszy wzrost składowej C3b i aktywacja dopełniacza
Niedobór czynnika H, czynnika I lub MCP jest
przyczyną 50% przypadków atypowego HUS
http://www.biochem.ucl.ac.uk/~becky/FH/proteinInfo.php?protein=FH

Inne zaburzenia w układzie
dopełniacza
Trombomodulina
białko błonowe
mutacja heterozygotyczna ze zmienną penetracją
5% przypadków atypowego HUS
obniżenie składowej C3 w ok. 50% przypadków
Białko wiążące C4b
białko osoczowe
kontrola reakcji pośredniczonych przez składową C4b (droga klasyczna i
lektynowa)
kofaktor czynnika I w reakcji inaktywacji C3b
często towarzyszy innym mutacjom (MCP, C3, FI) lub autoprzeciwciałom FH
dobre rokowanie
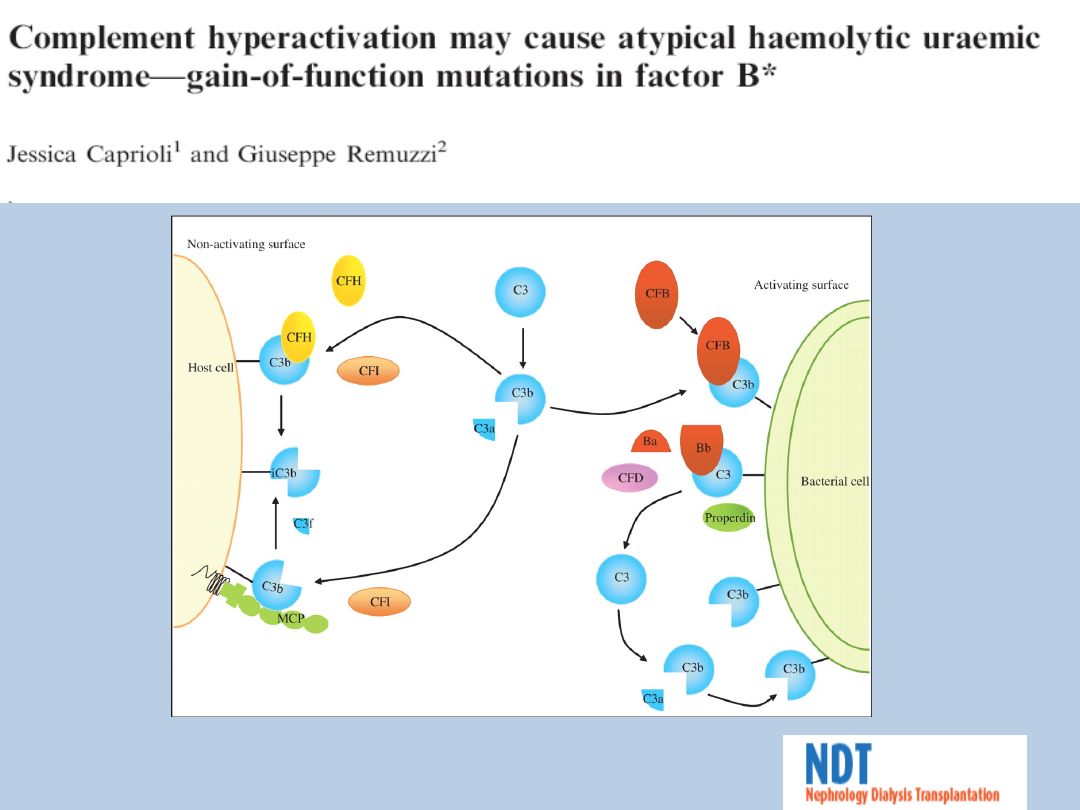
Patogeneza-atypowy HUS
Caprioli, J. et al. Nephrol. Dial. Transplant. 2007 22:2452-2454; doi:
10.1093/ndt/gfm193

Inne postaci atypowego HUS
Czynnik B
kompleks C3bBb - miejsce katalityczne konwertazy C3
mutacje wzmocnienia funkcji
1-2% przypadków atypowego HUS
mutacje heterozygotyczne ze zmienną penetracją genów
proces chorobowy w nerce – złe rokowanie
C3
5-10% przypadków atypowego HUS
mutacje wzmocnienia funkcji
mutacje heterozygotyczne o niskiej penetracji genów
niski poziom C3
nawroty w 40-50% przypadków

ZABURZENIA FUNKCJI DOPEŁNIACZA
niedobory czynnika H, czynnika I oraz MCP mają
niepełną penetrację
Modyfikacja przebiegu choroby lub rola innych czynników:
czynniki środowiskowe
Infekcje, poprzedzające
• 70% przypadków z mutacją FH
• 60% z mutacją FI
• 100% przypadków HUS z mutacją MCP
Ciąża
czynnik wyzwalający w 4% przypadków FH-HUS
40% z FI-HUS
Richards, A, 2007, Mol
Immunol 44:111-122
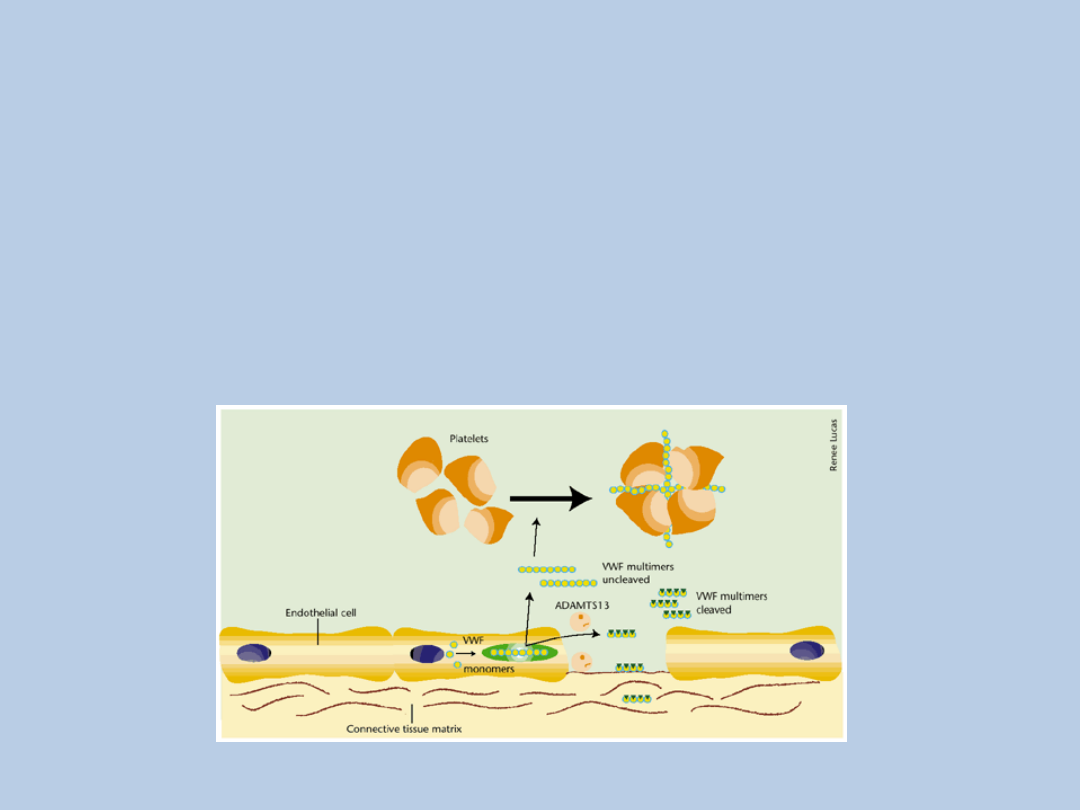
Niedobór proteazy vWF
wrodzony niedobór mieloproteinazy ADAMTS-13,
odpowiedzialnej za rozkład olbrzymich
multimerów czynnika von Willebranda (ULvWF - ultra
large von Willebrand factor multimers)
wiązanie ULvWF z antygenami
powierzchniowymi trombocytów
agregacja płytek krwi
zmiany zakrzepowe w drobnych naczyniach
tętniczych i włosowatych
Brass, L, 2001, Nature Med7:1177-1178.
Niedobór proteazy vWF
wrodzony niedobór ADAMTS-13 dziedziczony autosomalnie recesywnie –
Zespół Upshawa – Shulmana
ujawnia się po urodzeniu –
niedokrwistość hemolityczna i małopłytkowość
zajęcie nerek pojawia się w późniejszym okresie
przebieg przewlekły
nawracające epizody TTP
nabyty niedobór ADAMTS-13 - przeciwciało anty-ADAMTS-13
(59-100% chorych z nabytym niedoborem)
początek ostry, mogą towarzyszyć: silne bóle głowy, brzucha i mięśni,
zaburzenia
neurologiczne, hepato-,splenomegalia, żółtaczka
Brass, L, 2001, Nature Med7:1177-1178.

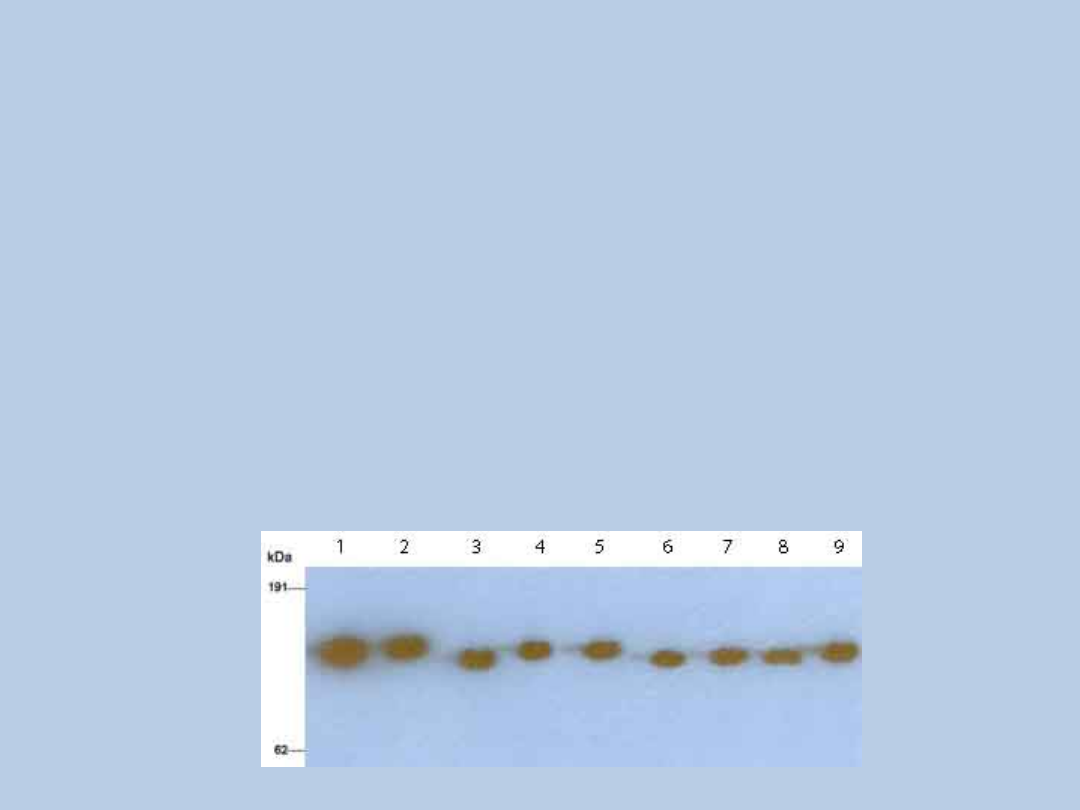
Assay of vWF degradation by vWF-cleaving protease. Dilutions (1:20) of normal
human plasma (NHP) were incubated for 24 h at 37°C with purified vWF, and the
polymeric size of the digestedvWF was analyzed by electrophoresis in sodium dodecyl
sulfate-1.4% agarose gel followed by immunoblotting. Incubation
mixtures were applied to the top of the gel. The 1:20 dilution of NHP was denoted as
100% activity
Mother Brother 1 Brother 2
Patient NHP
D.M.W.M. te Loo · E. Levtchenko · M. Furlan
G.P.M. Roosendaal · L.P.W.J. van den Heuvel
Autosomal recessive inheritance
of von Willebrand factor-cleaving protease
deficiency
Pediatr Nephrol (2000) 14:762–765 © IPNA
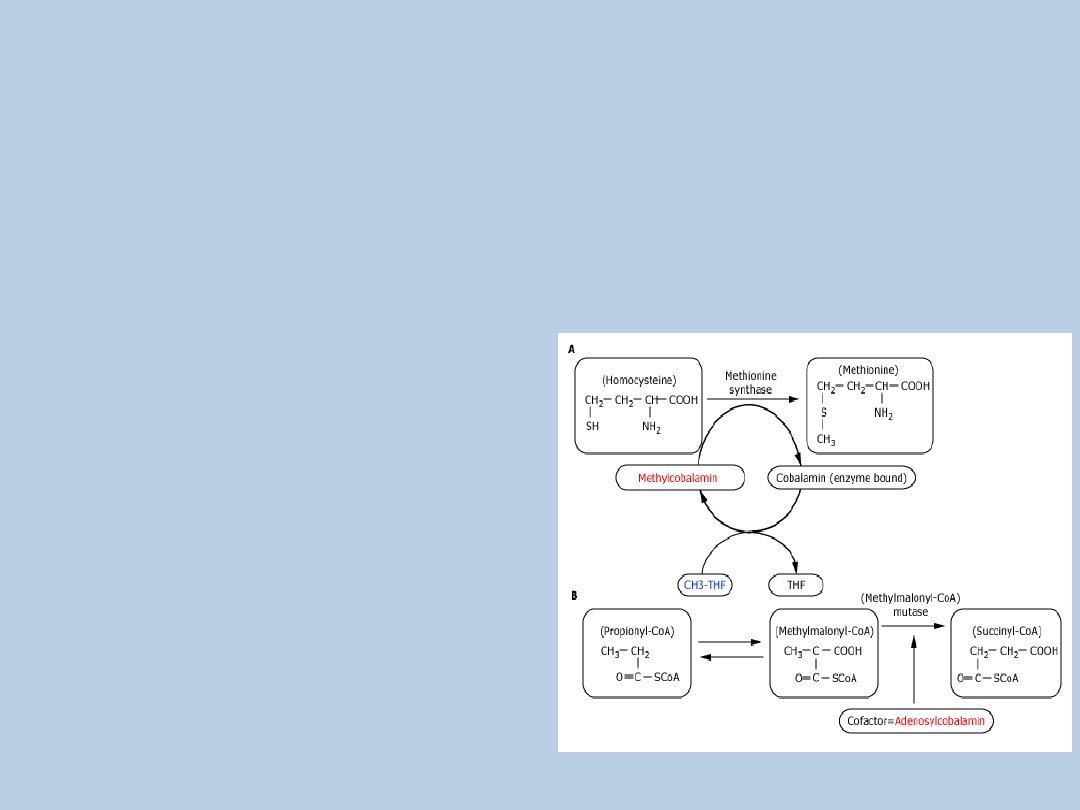
NIEDOBÓR KOBALAMINY-C
zaburzenie metabolizmu witaminyB12(kobalaminy)
hiperhomocysteiemia
kwasica metylomalonowa
klinicznie - atypowyHUS + objawy neurologiczne!!!
drgawki
hipotonia, zaburzenia karmienia, apatia
opóźnienie rozwoju
retinopatia
odchylenia w badaniach laboratoryjnych:
niedokrwistość makrocytarna
leukopenia, neutropenia
tylko krwiomocz!!!
• Tefferi, A, et al, 1994, Mayo Clin Proc69:181-186.

Rokowanie
ZABURZENIA FUNKCJI DOPEŁNIACZA
Powikłania atypowego HUS:
ponad 50% pacjentów rozwinęło SNN
25% śmiertelność w fazie ostrej choroby
schyłkowa niewydolność nerek:
• 70% z niedoborem FH rozwinęło SNN lub zmarło
• >60% z niedoborem FI rozwinęło SNN
• 86% pacjentów z niedoborem MCP nie
wymagało dializ
u 70% nastąpił nawrót HUS
Richards, A, 2007, Mol Immunol44:111-122.

Rokowanie
ZABURZENIA FUNKCJI DOPEŁNIACZA
Leczenie:
wymiany i przetoczenia osocza świeżo
mrożonego(FFP)
32 pacjentów z niedoborem FH było leczonych FFP
67% pozostaje w remisji
podobne wyniki u pacjentów z niedoborem FI
HUS z niedoborem MCP nie poddawał się leczeniu
polegającym na przetoczeniu osocza czy
plazmaferezach
przeszczepienie nerki
Richards, A, 2007, Mol Immunol 44:111-122.

Rokowanie
ZABURZENIE FUNKCJI DOPEŁNIACZA
przeszczepienie nerki
30 pacjentów z niedoborem FH poddało się
przeszczepieniu nerki
• u 80% wystąpił nawrót choroby
6 pacjentów z niedoborem FI poddało się przeszczepieniu
nerki
• u 100% wystąpił nawrót choroby
pacjenci z niedoborem MCP
• 10 pacjentów po przeszczepieniu nerki
• u 1 nawrót choroby
niskie wartości C3 i czynnika B –czynniki modyfikujące
chorobę?
Richards, A, 2007, Mol Immunol 44:111-122.

Wtórny HUS - Etiologia
Choroby nowotworowe (prostata, żołądek, trzustka) – zatory nowotworowe
Chemioterapia, radioterapia
Przeszczep szpiku – reakcja „przeszczep przeciw gospodarzowi GvHD”
Choroby autoimmunologiczne o przebiegu układowym (np. SLE, zespół antyfosfolipidowy,
sklerodermia)
Glomerulopatie
Zespół hipereozynofilowy
Ciąża ( powikłanie stanu przedrzucawkowego, zespół HELLP )
W przebiegu zakażenia wirusem HIV
Hantawirus, gorączka Q
W przebiegu infekcji górnych dróg oddechowych: Streptococcus pneumoniae,
Mycoplasma pneumoniae, Legionella, Staphylococcus aureus, wirusy Coxackie A i B, CMV,
Wirus grypy, Parwowirus B19
Szczepienia ochronne
Choroba Castelmana
HUS – postać polekowa
leki immunomodulujące –
Cyklosporyna A, Takrolimus, OKT3, IFN
Tiklopidyna, Klopidogrel (przeciwciała anty-ADAMTS
13)
Walcyklowir, Acyklowir
Cytostatyki - Mitomycyna (toksyczność dawki
kumulacyjnej), Cisplatyna, Bleomycyna, Gemcytabina
doustne środki antykoncepcyjne
chinolony, sulfonamidy,
Penicylina
Statyny
Chinina
Heroina
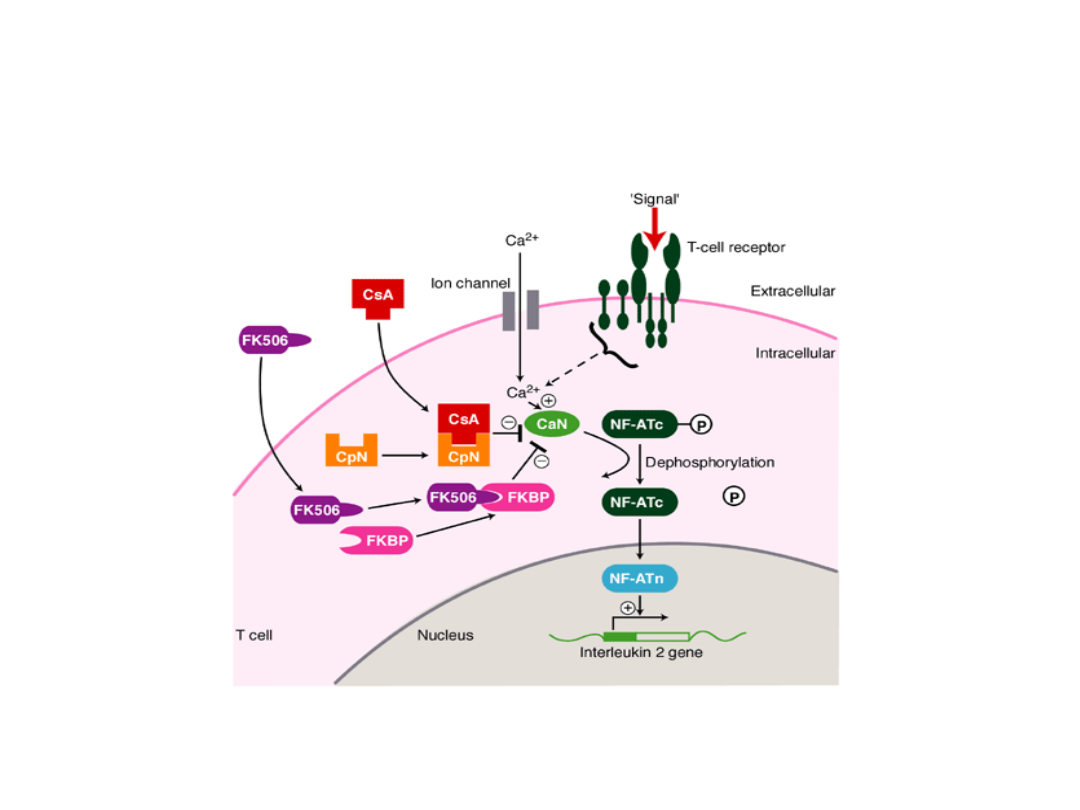
HUS – Cyklosporyna/Takrolimus
Stepkowski, SM, 2000, Exp Rev Mol Med fig002ssh, fig003ssh
.
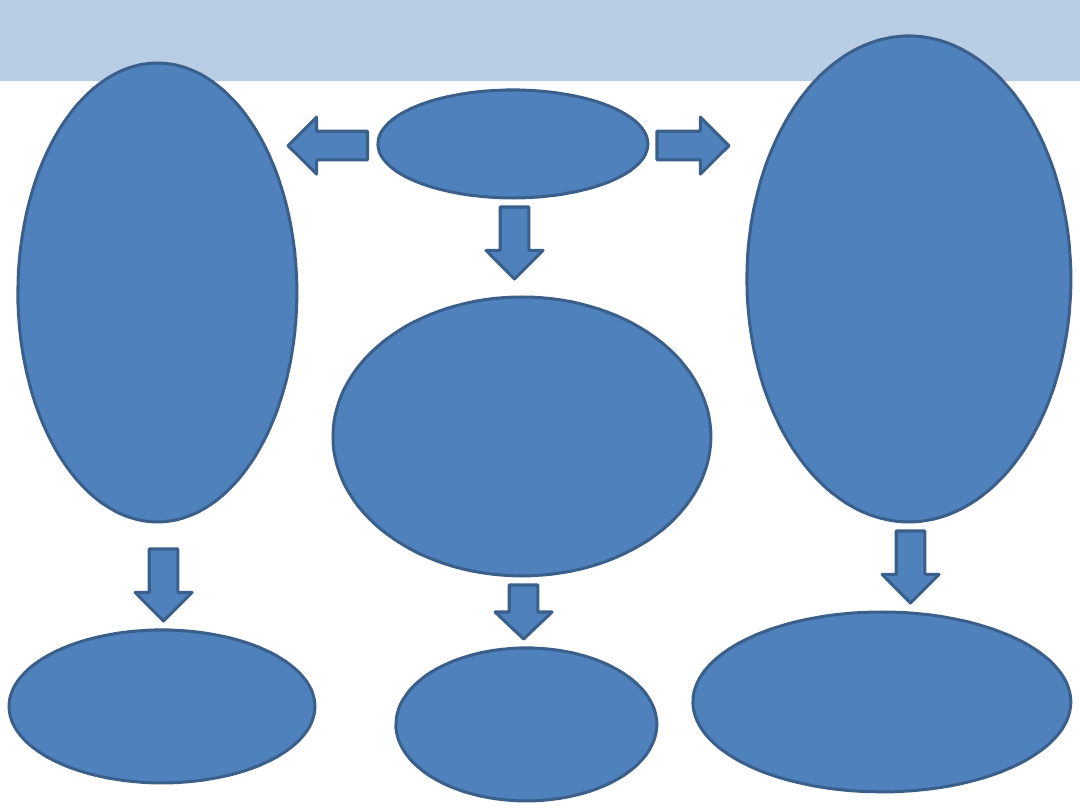
Rozpoznanie
Rozpozna
nie HUS
biegunka lub
krwista
biegunka w
okresie 2
tygodni
poprzedzający
ch
rozpoznanie
HUS
i
wiek
>6miesięcy
i
region
endemiczny
dla
a)EHEC
b) Shigella
dysenteriae
prawdopodobna
przyczyna:
infekcja
szczepami
EHEC lub
Shigella
dysenteriae
brak biegunki
lub
obecna+ jedno z
n/w:
a) wiek < 6 m.
ż.
b) podstępny
początek
c) nawrót HUS
d) podejrzewany
HUS w
wywiadzie
e) HUS po
transplantacji
f) dodatni
wywiad
rodzinny
obowiązkowo pełna
diagnostyka
alternatywnych
przyczyn HUS +
rutynowa kontrola w
kierunku EHEC
potwierdzenie/
podejrzenie infekcji
Streptococcus
pneumoniae:
zap. płuc, zap. opon
m-rdz., posocznica,
szczególnie w
przypadku
zlokalizowanych
ognisk jak ropniak
przyczyna:
infekcja
Streptococcu
s
(ekspozycja
antygenu T)
Postępowanie terapeutyczne

Zapobieganie nawrotom HUS
w niedoborze czynników I/H
Przewlekłe plazmaferezy (J.C. Davin)
Suplementacja czynnika H
Rituximab

Eculizumab
humanizowane monoklonalne przeciwciało anty C5
zatwierdzony przez FDA w 03.07r. i EMEA w 06.07r.
w leczeniu napadowej nocnej hemoglobinurii
alternatywna terapia HUS 0d 07.09r.
okres półtrwania 11,3 dni (u dorosłych)
dobra tolerancja ogólna
działania niepożądane:
bóle głowy (53%)
stany zapalne nosogardła (32%)
bóle pleców
nudności
męczliwość
szczepienie przeciwko meningokokom
Schubert, BJH,2008

Gruppo
NEJM
18 miesięcy
wrodzony aHUS
oporny na
leczenie osoczem
I:300mg/7d 3x
M: 600mg/14d
remisja
(>4m+)
Walden
Personal comm.
1,5 r. ż.
aHUS
I: 600mg &
300mg
po 1 tygodniu
remisja
(od
25.05.2010r.)
Fremont
Poster
(PUB715)
ASN 2009
4 r.ż.
aHUS
dodatni wywiad
rodzinny w
kierunku
mutacji FH
częściowa
odpowiedź na PE
I: 300mg/7d 4x
M: 600mg/14d
remisja
(10tyg+)
Häffner
Abstract HUS
conference Ibk
4 r.ż.
aHUS
mutacja FH
częste nawroty
częściowa
odpowiedź na
leczenie osoczem
I: 600mg &
300mg
M: 300mg/14d-
21d
remisja
(1r+)
Lapeyraque
Abstract HUS
conference Ibk
7 r.ż.
aHUS
mutacja FH
oporny na
leczenie osoczem
I:600mg/7d
M: 600mg/14d
Remisja
(>6m+)
Eculizumab -
aHUS
Magdalena Riedl, Johannes Hofer, Lothar
Bernd Zimmerhackl,
Medical University Innsbruck, Austria

Davin
AmJ of
kidney
diseases
17 r.ż.
aHUS
mutacja FH
po 3. RTx
reakcja
alergiczna na
transfuzję
osocza
osoczozależn
y
I: 900mg/7d
4x
remisja
(15m+)
Walden
Personal
comm.
6 r.ż.
aHUS
mutacja FH
nawrót 2
miesiące po
1. RTx
oporny na
leczenie
osoczem
600mg
remisja
(3m+)
Zimmerhackl
NEJM
11 r.ż.
aHUS
mutacja FH
Profilaktyka
1. RTx
I: 600mg/7d
2x
M:
600mg/14d
remisja
(1,5 r)
Eculizumab – aHUS + RTx
u dzieci
Magdalena Riedl, Johannes Hofer, Lothar
Bernd Zimmerhackl,
Medical University Innsbruck, Austria
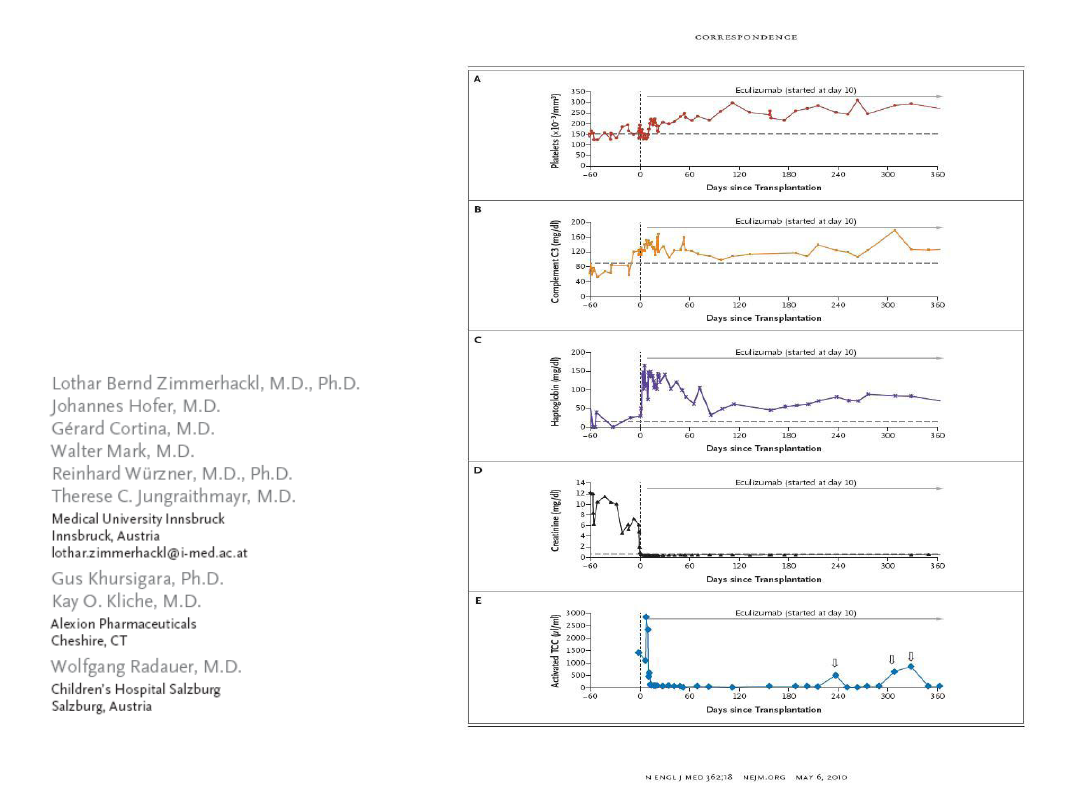
The New England Journal of Medicine
1746 n engl j med 362;18 nejm.org may 6, 2010
Prophylactic Eculizumab
after Renal Transplantation
in Atypical Hemolytic–Uremic Syndrome

Eculizumab - podsumowanie
Dobra odpowiedź na leczenie w
aktualnych doniesieniach
Istotne odpowiednio wczesne podanie
leku
Wystarczająca pojedyncza dawka leku
Nowa opcja w MPGN/AMR/CAPS
RTx – działanie profilaktyczne i terapia w
przypadku nawrotu
TCC ELISA – dobra metoda
monitorowania inhibicji układu
dopełniacza w trakcie terapii

FH przeciwciała - terapia
Plazmaterapia:
odpowiednio wcześnie
leczenie pierwszego rzutu
Eculizumab:
dobra odpowiedź w przypadku aHUS +/─ RTx
w końcu 2010r. zamknięcie wyników badań klinicznych
Ocena obecności przeciwciał anty/FH u każdego
pacjenta:
dodatkowe opcje terapii
IgG, MMF, steroidy, cyklofosfamid, rituximab
RTx:
udany przeszczep nerki u pacjentów z profilaktyką-
Eculizumab
profilaktyka (Eculizumab) u pacjentów z grup wysokiego
ryzyka

dziękuję za uwagę
Document Outline
- Slide 1
- Slide 2
- HUS – mikroangiopatia zakrzepowa
- Slide 4
- Podział
- Etiologia
- Patogenna E.coli
- Inne czynniki infekcyjne – atypowy HUS
- Patomechanizm
- HUS - D „+”
- Etiologia
- The European Paediatric Research Group For D(-) HUS
- .
- Aktywacja układu dopełniacza Droga lektynowa
- Regulacja układu dopełniacza
- Regulacja rozkładu
- Niedobór czynnika H
- Autoprzeciwciała przeciwko czynnikowi H
- Niedobór czynnika I
- Slide 21
- Regulacja układu dopełniacza
- BŁONOWY KOFAKTOR BIAŁKOWY (MCP = CD46)
- Patogeneza-atypowy HUS
- Inne zaburzenia w układzie dopełniacza
- Patogeneza-atypowy HUS
- Inne postaci atypowego HUS
- ZABURZENIA FUNKCJI DOPEŁNIACZA
- Niedobór proteazy vWF
- Niedobór proteazy vWF
- Slide 31
- NIEDOBÓR KOBALAMINY-C
- Rokowanie
- Rokowanie
- Rokowanie
- Wtórny HUS - Etiologia
- HUS – postać polekowa
- Slide 38
- Rozpoznanie
- Slide 40
- Zapobieganie nawrotom HUS w niedoborze czynników I/H
- Slide 42
- Eculizumab
- Slide 44
- Slide 45
- Slide 46
- Eculizumab - podsumowanie
- FH przeciwciała - terapia
- Slide 49
Wyszukiwarka
Podobne podstrony:
Zespół hemolityczno mocznicowy
ZESPÓŁ HEMOLITYCZNO- MOCZNICOWY, Nefrologia(1)
Zespół hemolityczno mocznicowy (1)
Zespół nerczycowy
9 RF ZEspól 0 Środki trwałe
Choroba hemolityczna p odu na kurs
hemolityczne2006
Zespół kanału łokciowego i nerw pachowy (tryb edytowalny)
Zespoly paranowotworowe
Zespoly interdyscyplinarne
Teoria organizacji i kierowania w adm publ prezentacja czesc o konflikcie i zespolach dw1
zespoly otepienne
więcej podobnych podstron