
Degradacja aminokwasów
egzogennych

Ciągła degradacja i synteza białek
występuje we wszystkich organizmach
U człowieka dziennie wymianie ulega 1-
2% całkowitego białka, głównie mięśni
Szybka degradacja w tkankach
podlegających strukturalnym
przekształceniom np. w szyjce macicy
podczas ciąży
Prawie 75% uwolnionych aa jest
ponownie wykorzystywanych, z
nadmiaru N tworzy się mocznik

Degradacja białek
Podatność białka na degradację wyraża
okres połowicznego rozpadu t
1/2
T
1/2
białek wątroby – od mniej niż 0,5h
do ponad 150h
T
1/2
dla enzymów metabolizmu
podstawowego jest długi (>100h) a dla
enzymów regulatorowych krótki (0,5-
2h)
O T
1/2
decydują reszty aa na N-końcu –
(reguła końca N)

Reguła końca N
Reszty silnie
stabilizujące (t
1/2
>20h)
Reszty silnie
stabilizujące (t
1/2
>20h)
• Ala
• Cys
• Gly
• Met
• Pro
• Ser
• Thr
• Val
• Ala
• Cys
• Gly
• Met
• Pro
• Ser
• Thr
• Val
Reszty bezpośrednio
destabilizujące (t
1/2
=2
do 30 minut)
Reszty bezpośrednio
destabilizujące (t
1/2
=2
do 30 minut)
• Arg
• His
• Ile
• Leu
• Lys
• Phe
• Trp
• Tyr
• Arg
• His
• Ile
• Leu
• Lys
• Phe
• Trp
• Tyr
Reszty destabilizujące
po modyfikacji
chemicznej (t
1/2
=3 do
30 min)
Reszty destabilizujące
po modyfikacji
chemicznej (t
1/2
=3 do
30 min)
• Asn
• Asp
• Gln
• Glu
• Asn
• Asp
• Gln
• Glu
Inne sygnały degradacji:
• kaseta destrukcyjna (D-box)
• sekwencja PEST (Pro-Glu-Ser-Thr)
Enzymy
uczestniczące w
degradacji
białek
Enzymy
uczestniczące w
degradacji
białek
Proteazy
Proteazy
Endopeptydazy
Endopeptydazy
Egzopeptydazy
Egzopeptydazy
Aminopeptydazy
Aminopeptydazy
Karboksypeptydazy
Karboksypeptydazy

Degradacja krążących we
krwi peptydów
Np. hormony
Utrata cząsteczki kwasu sjalowego z
nieredukujących końców ich
oligosacharydowych łańcuchów
Internalizacja przez
asjaloglikoproteinowe receptory
hepatocytów
Degradacja przez katepsyny
(lizosomalne proteazy)

Degradacja białek
Pozakomórkowe i związane z błoną –
degradacja w lizosomach (niezależnie
od ATP)
Nieprawidłowe lub krótko żyjące białka
– degradacja w cytozolu (wymaga ATP i
ubikwityny)

Ubikwityna
Małe, konserwatywne
białko u
Eucaryota
8,5 kDa i 76 aa
Znacznik białek przeznaczonych do
degradacji
Kosztem energii pochodzącej z
hydrolizy ATP, łączy się kowalencyjnie
resztą glicyny z kilkoma grupami ε-
aminowymi lizyny białka

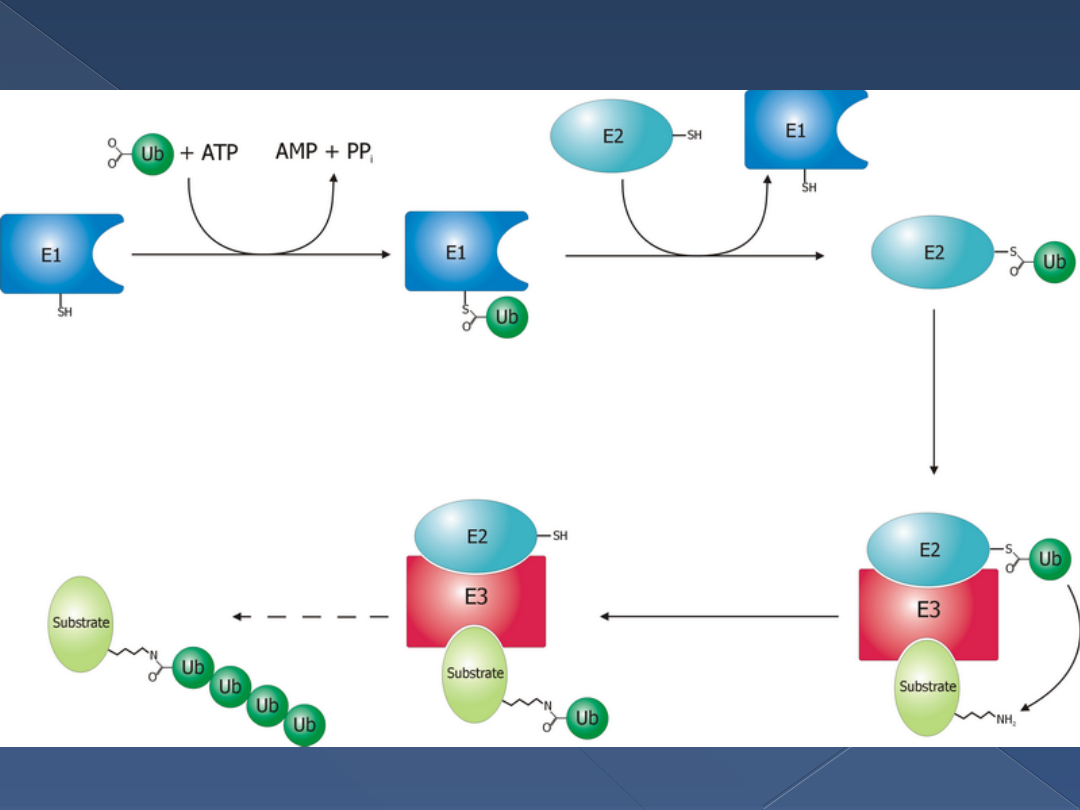
Ubikwitynacja
3 enzymy:
›
Enzym aktywujący ubikwitynę E1
›
Enzym koniugujący E2
›
Ligaza ubikwitynowo – białkowa E3
Etapy:
›
Utworzenie wiązania tioestrowego między
końcową –COOH Ub a grupa –SH E1 (kosztem
ATP)
›
Przeniesienie zaaktywowanej Ub na –SH E2
›
Przeniesienie Ub na ε – NH
2
białka docelowego

Ubikwitynacja
Jedna przyłączona Ub jest słabym
sygnałem degradacyjnym
Powstają łańcuchy poliubikwitynowe
poprzez przyłączanie kolejnych Ub do
Lys-48
Szczególnie wydajne są sygnały
złożone z 4 lub więcej Ub
O specyficzności substratowej procesu
decyduje E3

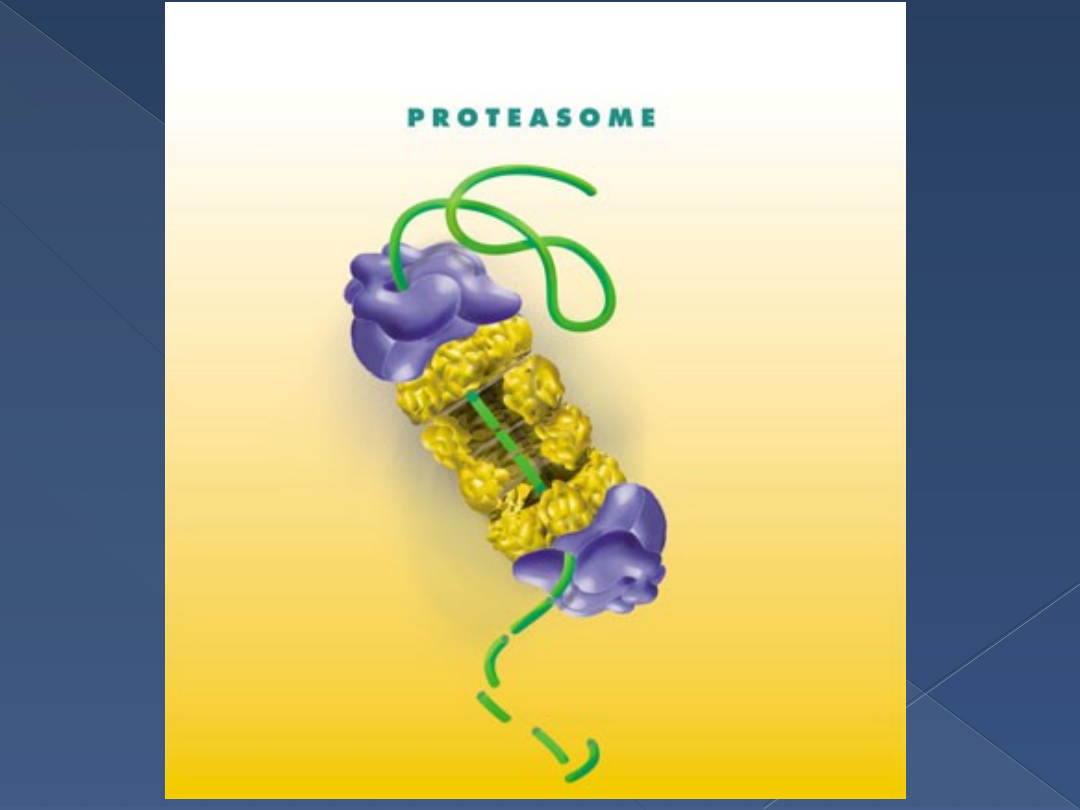
Proteasom
Tu degradacja ubikwitynowanych białek
Wielopodjednostkowa proteaza zależna
od ATP
Nie degraduje Ub ponownie
wykorzystywana
Kompleks białkowy 26S złożony z 2
części:
›
Proteasom 20S o aktywności katalitycznej
›
Podjednostka regulatorowa 19S

Kompleks 20 S
700 kDa
2 x 14 podjednostek
4 pierścienie, każdy z 7 podjednostek
Na końcach „beczułki” podjednostki α
Pierścienie wewnętrzne budują podjednostki β
Aktywne miejsca proteaz na N-końcach białek
podjednostek β, które mają tam Ser lub Thr
Dzięki strukturze kompleksu miescja aktywne są
wyizolowane od związków znajdujących się na zewnątrz
„beczułki”
Substraty stopniowo degradowane bez uwalniania
produktów pośrednich aż do peptydów o długości 7-10 aa


Podjednostka 19S
Funkcja regulatorowa, blokuje dostęp
do 20 S
700 kDa, 20 podjednostek, wiąże się po
obu stronach 20 S
Specyficznie wiąże się do łańcuchów
poliubikwitynowych
Najważniejsze jest 6 różnych ATPaz
Zawiera również izopeptydazę, która
odcina nienaruszone cząs. Ub
Document Outline
- Slide 1
- Slide 2
- Degradacja białek
- Reguła końca N
- Slide 5
- Degradacja krążących we krwi peptydów
- Degradacja białek
- Ubikwityna
- Ubikwitynacja
- Slide 10
- Ubikwitynacja
- Proteasom
- Kompleks 20 S
- Slide 14
- Podjednostka 19S
- Slide 16
Wyszukiwarka
Podobne podstrony:
aminokwasy egzogenne
Aminokwasy egzogenne
Aminokwasy egzogenne id 59124 Nieznany (2)
Prezentacja Degradacja Aminokwasów
PREZENTACJA BIOSYNTEZA AMINOKWASÓW EGZOGENNYCH
Białka proste i złożone, aminokwasy względnie egzogenne
aminokwasy
AMINOKWASY 7
11 Ch organiczna AMINOKWASY I BIAŁKAid 12388 ppt
8a Syntezy prostych aminokwasów
Wykład katabolizm azotu aminokwasów
aminokwasy 1
Metabolizm aminokwasów
Przemiany aminokwasów w biologicznie ważne, wyspecjalizowane produkty
cwiczenie 7 Aminokwasy id 125541
Degradable Polymers and Plastics in Landfill Sites
aminokwasy wersja IV
3 NOWY Aminokwasy II 2012 2013(1)
więcej podobnych podstron