
DIAGNOSTYKA
LABORATORYJNA
ZABURZEŃ
WĘGLOWODANOWYCH I ICH
POWIKŁAŃ
dr n. med. Kamila Olszowiec

ZESPÓŁ METABOLICZNY
Termin
zespół
metaboliczny
(MS)
określa
współwystępowanie powiązanych ze sobą czynników
ryzyka pochodzenia metabolicznego, sprzyjających
rozwojowi chorób sercowo-naczyniowych o podłożu
miażdżycowym oraz cukrzycy typu
2.
ZESPÓŁ METABOLICZNY
Do zespołu metabolicznego zalicza się:
insulinooporność,
hiperinsulinemię,
otyłość brzuszną,
upośledzoną tolerancję glukozy,
cukrzycę typu2,
albuminurię,
hipertrojglicerydemię,
obniżenie stężenia cholesterolu frakcji HDL,
nadciśnienie tętnicze,
stan prozapalny i prozakrzepowy.
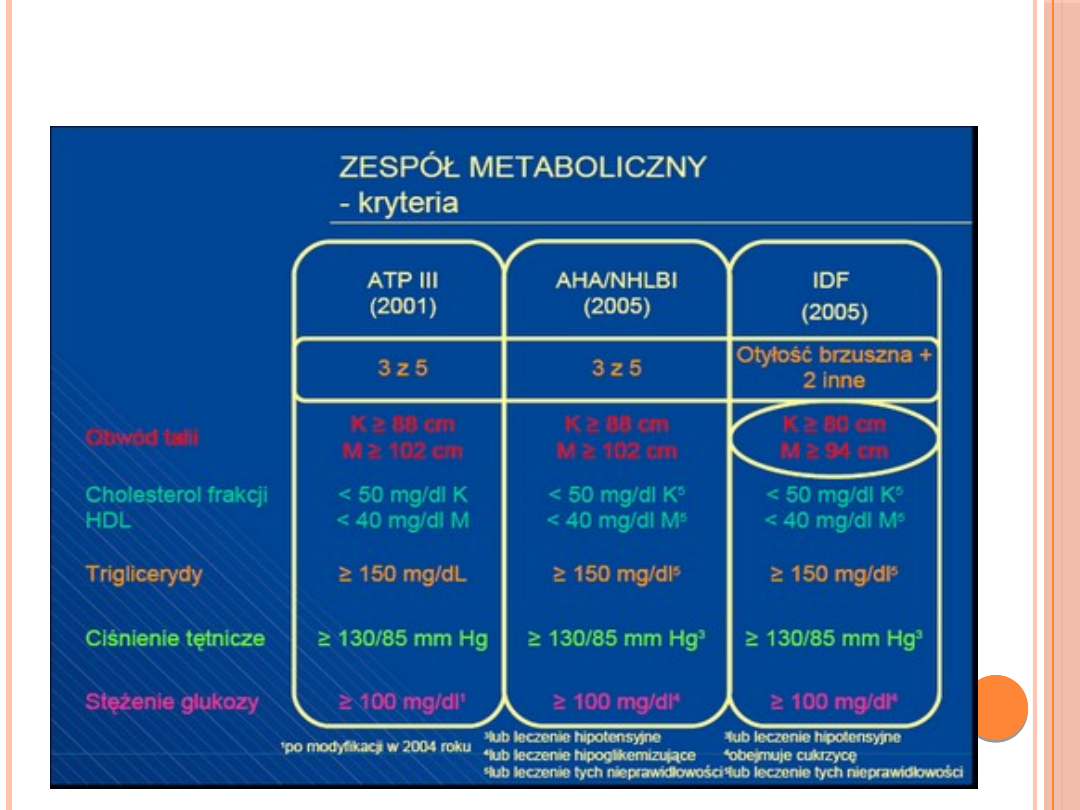
KRYTERIA ROZPOZNANIA ZESPOŁU METABOLICZNEGO
WEDŁUG ATP III (ZMODYFIKOWANE 2004) AHA/NHLBI 2004 I
IDF 2005

ZESPÓŁ METABOLICZNY
Zespołowi metabolicznemu może towarzyszyć szereg innych
zaburzeń:
hiperurikemia (kwas moczowy >387 μmol/l)
hipercholestrolemia (cholesterol >5,2 mmol/l)
zaburzenia w układzie hemostazy (hiperfibrynogenemia >300 mg/l, i
upośledzenie fibrynolizy: czynnika VIII, VII oraz inhibitora
aktywatora plazminogenu(PAI-I))
dysfunkcja śródbłonka (albuminuria, poziomu czynnika von
Willebranda)
stężenia białek ostrej fazy i cytokin (CRP, fibrynogen, IL-6, TNF-α)
stężenia testosteronu u mężczyzn i jego podwyższenie u kobiet
stężenia homocysteiny
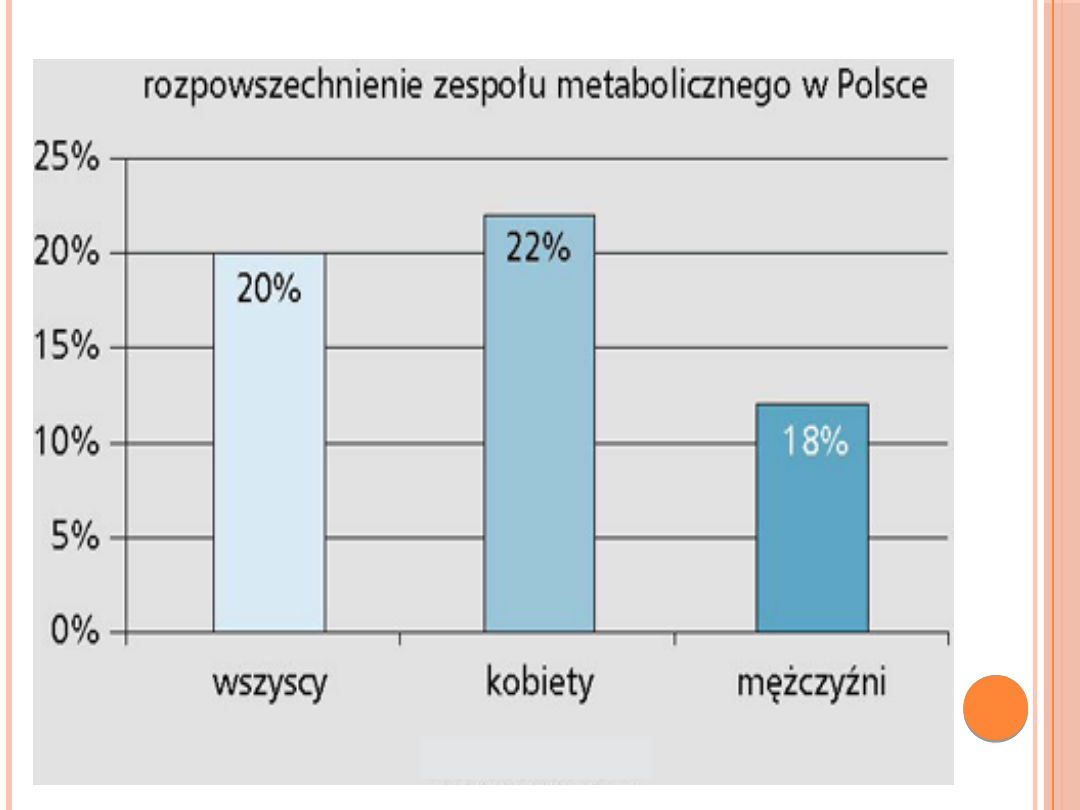
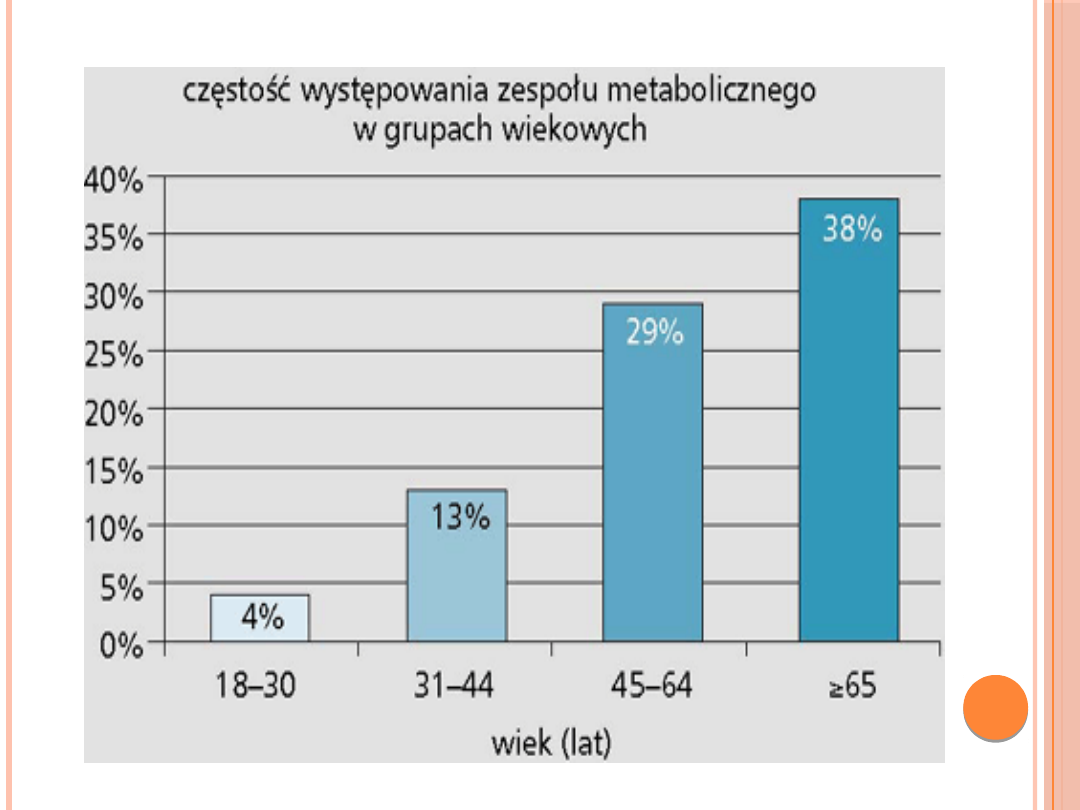
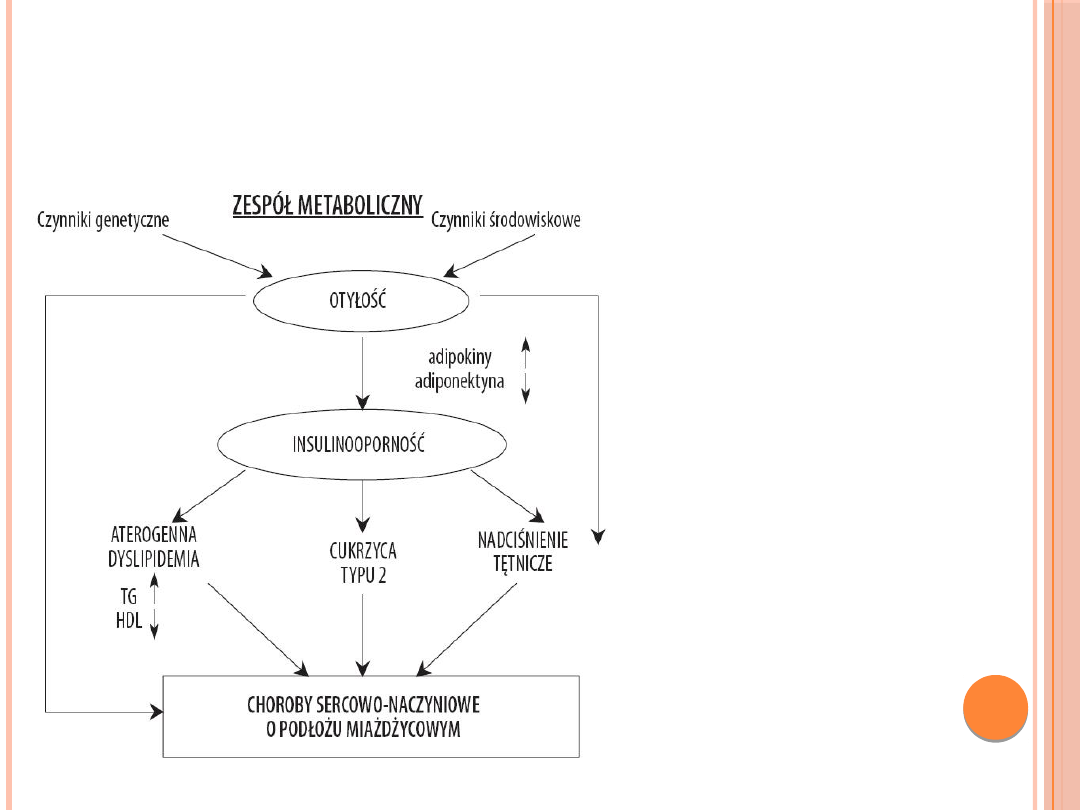
ZESPÓŁ METABOLICZNY
Obecność zespołu
metabolicznego może
wyprzedzać o 10 lat
wystąpienie jawnej
hiperglikemii. Nawet
jeżeli tolerancja glukozy
jest prawidłowa ryzyko
rozwoju cukrzycy w
przyszłości jak i
przyśpieszonej
miażdżycy wysokie.
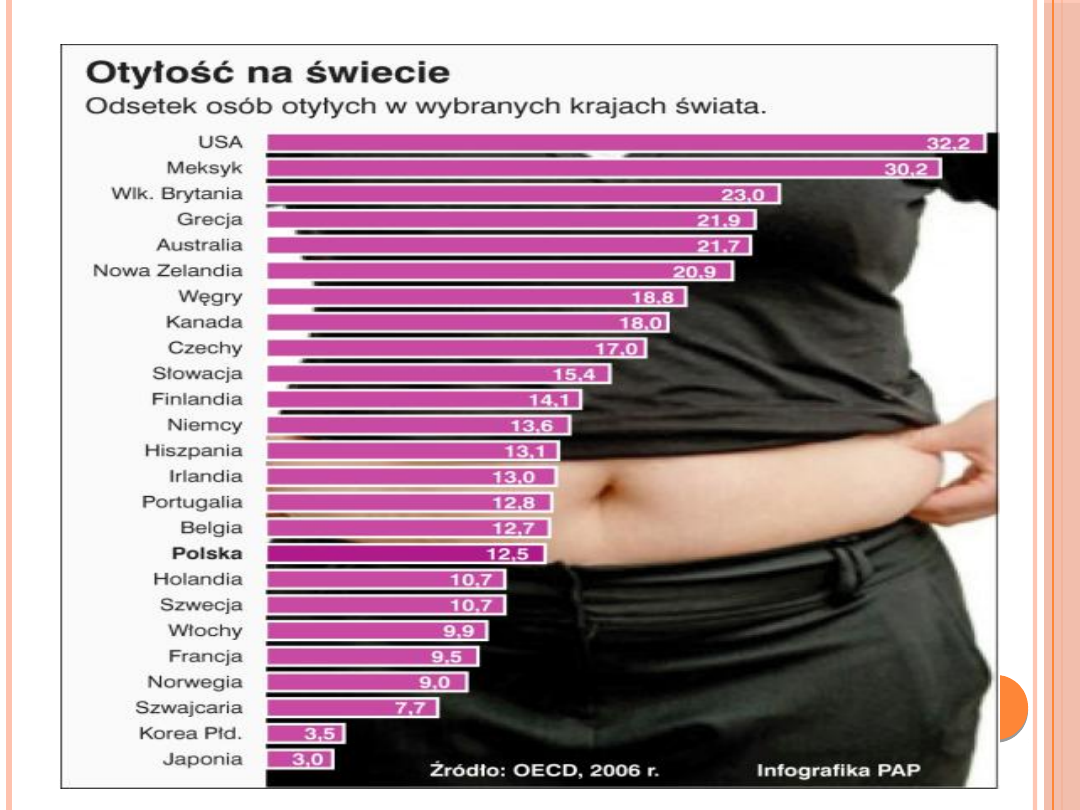
ZESPÓŁ METABOLICZNY

OTYŁOŚĆ
Otyłość jest przewlekłą chorobą spowodowana nadmierną
podażą energii zawartej w pokarmach w stosunku do
zapotrzebowania organizmu, skutkiem czego jest
magazynowanie nadmiaru w postaci tkanki tłuszczowej.
Otyłości towarzyszą liczne powikłania ze strony układu
sercowo-naczyniowego i innych narządów.
BMI (Body Mass Index) czyli Wskaźnik Masy Ciała
charakteryzuje relację pomiędzy masą ciała a wzrostem.
Obliczając BMI możemy określić ilość tkanki tłuszczowej w
organizmie. Liczne badania epidemiologiczne wykazały, że
BMI dobrze koreluje z masą tej tkanki oraz umożliwia ocenę
zagrożenia śmiertelnością i chorobowością.
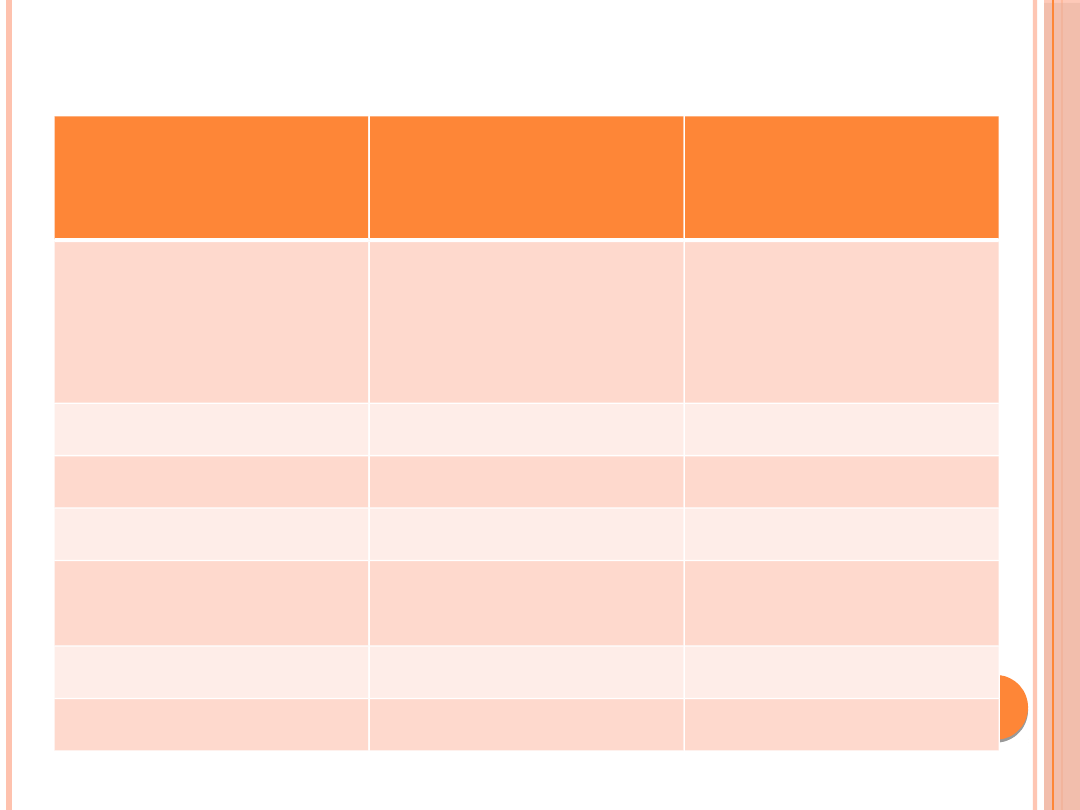
Klasyfikacja
zaburzeń
masy ciała
BMI (kg/m
2
)
Ryzyko chorób
towarzyszących
otyłości
Niedowaga
<18,5
Niskie (ale zwiększone
ryzyko innych
problemów
zdrowotnych)
Norma
18,5 - 24,9
Średnie
Nadwaga
>= 25
Okres przed otyłością
25,0-29,9
Podwyższone
I° otyłości
30,0-34,9
Umiarkowanie
podwyższone
II° otyłości
35,0-39,9
Wysokie
III° otyłości
>= 40,0
Bardzo wysokie

OTYŁOŚĆ
BMI nie jest wiarygodnym wskaźnikiem
zagrożenia chorobami dla poniższych
grup osób :
1.kobiety ciężarne
2. sportowcy oraz osoby o rozbudowanej
tkance mięśniowej
3.rosnące dzieci
4. osoby w starszym wieku, u których trudno
dokonać dokładnych pomiarów wzrostu

OTYŁOŚĆ
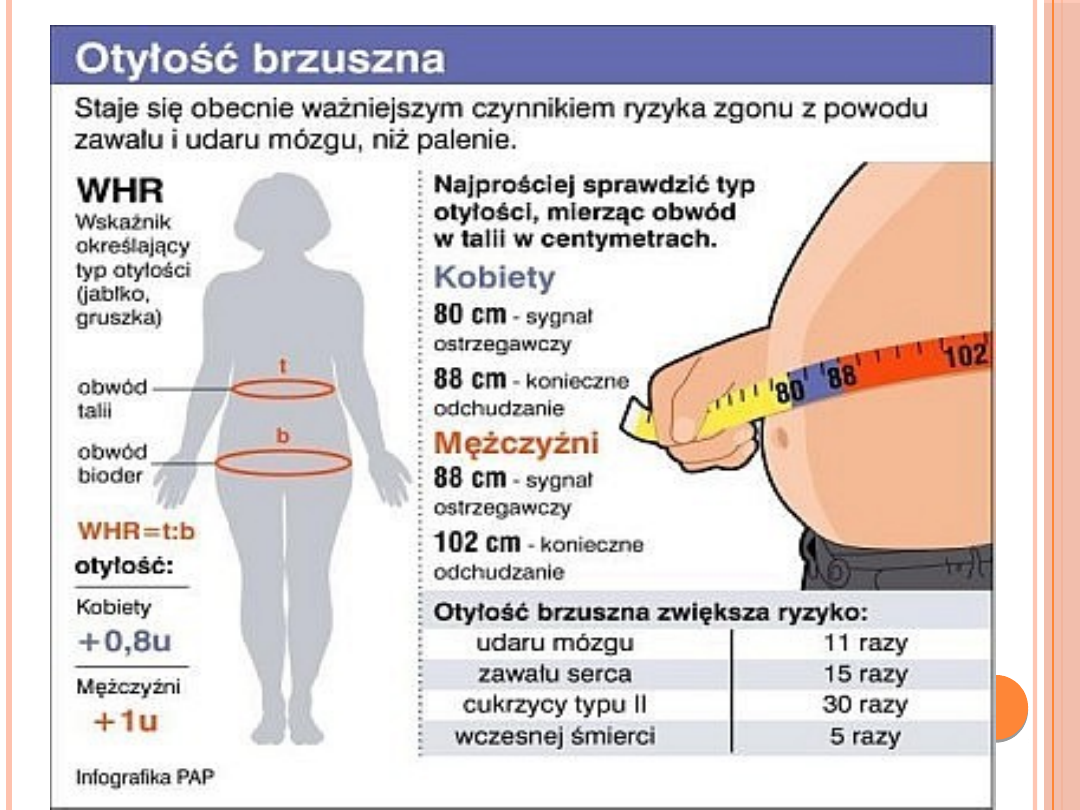
Obwód pasa stanowi także cenny wskaźnik stanu
zdrowia. Badania przeprowadzone w ostatnich latach
na grupie kilkunastu tysięcy dorosłych osób wykazały,
że wysokie ciśnienie tętnicze, zaburzenia oddychania,
wysoki poziom cholesterolu i cukrzyca występują
częściej
u mężczyzn z obwodem pasa powyżej 102 cm i u
kobiet
z obwodem pasa powyżej 88 cm, w porównaniu do
grupy osób szczupłych.

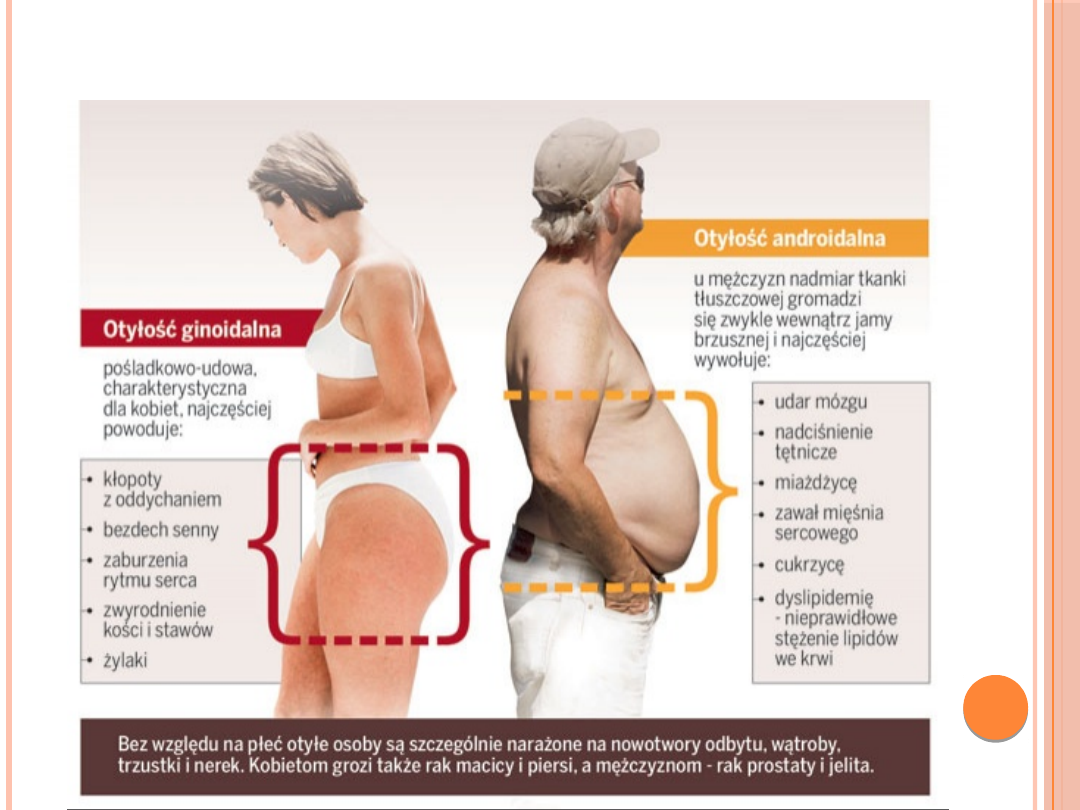
TYPY OTYŁOŚCI
Otyłość typu "jabłko" -
(inne określenia:
otyłość brzuszna,
wisceralna - tkanka
tłuszczowa
zlokalizowana jest
głównie wewnątrz jamy
brzusznej) częściej
dotyczy mężczyzn.
Otyłość typu
"gruszka" -
(udowo-
pośladkowa)
częściej występuje u
kobiet.

OTYŁOŚĆ
WHR (waist to hip ratio)
Otyłość wisceralną (typ jabłka) rozpoznajemy
gdy wskaźnik WHR jest równy lub wyższy od
0,8 u kobiet, a u mężczyzn - gdy WHR jest
równy lub wyższy od 1,0.
Wartości tego wskaźnika poniżej 0,8 kobiet, a
także niższa od 1,0 u mężczyzn, pozwalają
rozpoznać otyłość udowo-pośladkową.

PRZYCZYNY OTYŁOŚCI
Czynniki dziedziczne - skłonność do otyłości dotyczy
często całych rodzin, stwierdzono że istnieją ku temu
predyspozycje genetyczne. U 70% osób otyłych
przynajmniej jedno z rodziców było otyłe.
Czynniki fizjologiczne - fizjologicznie apetyt regulowany
jest wielkością posiłków, ich częstością, składem, smakiem
jak również jest pod kontrolą ośrodkowego układu
nerwowego (głównie podwzgórza)
Czynniki psychologiczne - otyłość można traktować jako
formę uzależnienia, utraty kontroli nad jedzeniem.
Styl życia - otyłość powstaje przede wszystkim w wyniku
spożywania nadmiaru tłuszczu oraz zbyt małej aktywności
fizycznej

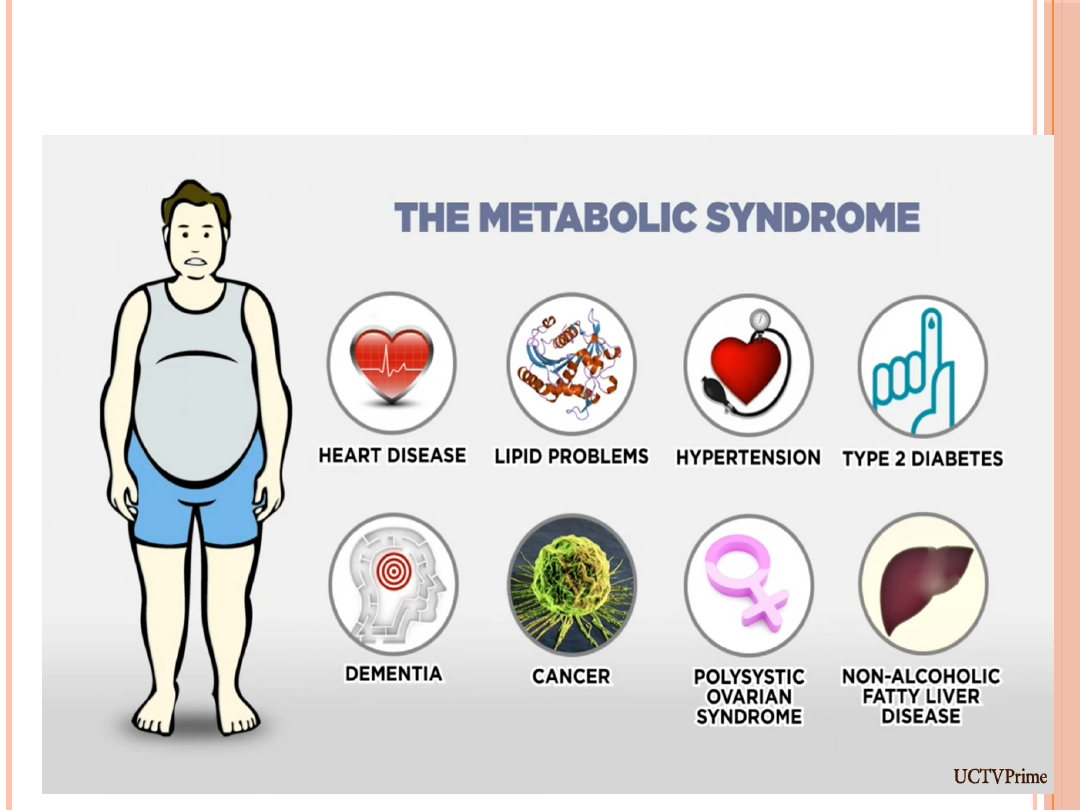
CHOROBY ZWIĄZANE Z OTYŁOŚCIĄ
Cukrzyca typu II
- stanowi 90% przypadków cukrzycy. 80-
90% pacjentów stanowią osoby otyłe. Spadek wagi - nawet o
5-10% prowadzi do obniżenia poziomu cukru we krwi i pozwala
zmniejszyć dawki leków przeciwcukrzycowych, w tym insuliny.
Nadciśnienie tętnicze
- wzrost masy ciała o 20% powoduje
ośmiokrotny wzrost częstości występowania nadciśnienia.
Hiperlipidemia
- czyli podwyższenie poziomu cholesterolu i
triglicerydów we krwi.
Udar mózgowy
- ryzyko jego wystąpienia u osób otyłych jest
dwukrotnie większe.
Niewydolność serca
- ryzyko tej choroby u otyłych jest
większe 1,9 razy.

CHOROBY ZWIĄZANE Z OTYŁOŚCIĄ
Choroba niedokrwienna serca (choroba wieńcowa) -
40%
przypadków tej choroby jest związane z BMI powyżej 25.
Prawdopodobieństwo, że osoba otyła będzie miała chorobę
wieńcową jest 1,5 raza większe niż u osoby z prawidłową wagą.
Otyłość pogarsza także przebieg rehabilitacji pozawałowej.
Kamica pęcherzyka żółciowego
- schorzenia pęcherzyka u
osób otyłych występują sześciokrotnie częściej niż u szczupłych
Zmiany zwyrodnieniowe stawów
- stawy podlegające
nadmiernym obciążeniom szybciej ulegają uszkodzeniu,
prowadzi to do zespołów bólowych, np. kręgosłupa, stawów
kolanowych.
Nowotwory
- u otyłych częściej niż u szczupłych występują
nowotwory macicy, sutka, pęcherzyka żółciowego, jelita
grubego, prostaty

CHOROBY ZWIĄZANE Z OTYŁOŚCIĄ
Zaburzenia oddychania w czasie snu
- objawiające
się m.in. zespołem hipowentylacji bądź bezdechu
sennego
Żylaki kończyn dolnych
- u osoby otyłej gorsze są
warunki odpływu krwi z kończyn dolnych. Prowadzi to
do nadmiernego wypełnienia krwią żył a w
konsekwencji - do powstawania żylaków.
Zaburzenia hormonalne i powikłania ciąży
-
częściej występują u otyłych kobiet.
Zespół metaboliczny

FRUKTOZEMIA
Wrodzona nietolerancja fruktozy (hereditary fructose intolerance,
HFI)
Występuje z częstotliwością 1 : 20 – 30 tys.
Fruktozemia jako choroba genetyczna
Fruktozemia jest chorobą genetyczną o dziedziczeniu
autosomalnym recesywnym wywołaną mutacjami w obrębie genu
ALDOB kodującego aldolazę B
Gen ten znajduje się na długim ramieniu chromosomu 9 a defekt w
tym miejscu wywołuje mutację
Najczęstszą mutacją w ALDOB w populacji Polski jest G->C
powodująca zmianę A w pozycji 149 białka ALDOB na P.

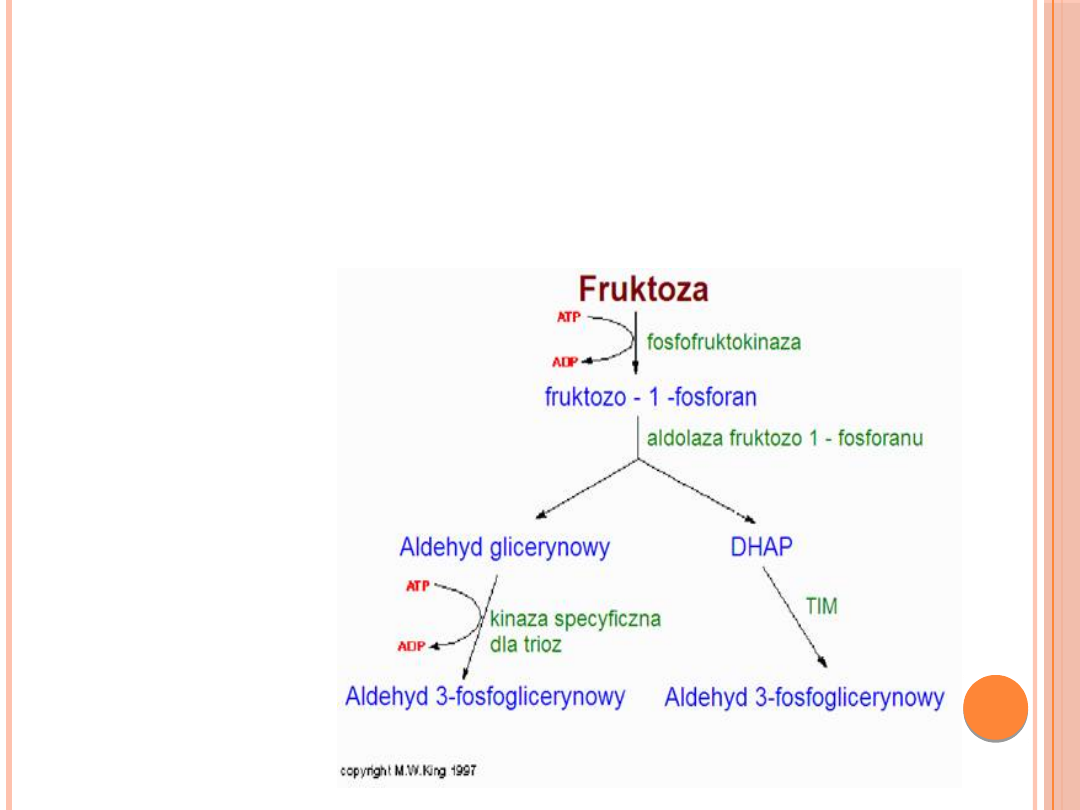
METABOLIZM FRUKTOZY
Przyczynami fruktozemii mogą być niedobory takich
biokatalizatorów jak:
• fruktozo-1,6-difosfatazy (na drodze
glukoneogenezy)
• fruktokinazy (samoistna fruktozemia
bezobjawowa, nie wymaga leczenia)
• aldolazy fruktozo-1-fosforanu (wrodzona
nietolerancja fruktozy). Gromadzące się w związku z
tym w komórkach pośrednie metabolity wywołują
objawy typowe dla fruktozemii
OBJAWY FRUKTOZEMII
U chorych po spożyciu fruktozy (a także cukrów i
produktów zawierających fruktozę – sacharozy lub
sorbitolu) występują:
•nudności
•wymioty
• biegunki
•niepokój
•senność
• drgawki

KONSEKWENCJE FRUKTOZEMII
• marskość wątroby
• żółtaczka
•uszkodzenie nerek i OUN
• zahamowania wzrostu
• Białkomocz
• Zwiększenie wydalania aminokwasów
• hipoglikemia prowadząca do śmierć.

FRUKTOZEMIA
Ujawnienie fruktozemii
•ujawnia się zwłaszcza u niemowląt żywionych
sztucznie (mieszankami słodzonymi
sacharozą)
•u niemowląt karmionych piersią bodźcem do
ujawnienia choroby jest próba wprowadzenia
soków owocowych.

FRUKTOZEMIA W BADANIACH
LABORATORYJNYCH
Krew:
•wzrost stężenia fruktozy
• wzrost stężenia glukozy
• patologiczna krzywa fruktozowa
Mocz:
• wzrost stężenia fruktozy
• hiperaminoacyduria

TERAPIA DIATĄ
• wykluczenie z diety fruktozy, sacharozy i
sorbitolu
•ograniczenie spożycia białka i tłuszczu.
•w przypadku niemowląt powinno się unikać
przedłużonych przerw w karmieniu.
•ponieważ objawem choroby jest często
hipoglikemia, należy podawać dożylnie 10%
glukozę w ilości 0,3 g/ kg m. c..

ROZPOZNANIE FRUKTOZEMII
Znaczna część przypadków fruktozemii zostaje rozpoznawana dopiero
w wieku dorosłym lub pozostaje bez ustalonego rozpoznania. Jest to
spowodowane tym, że dzieci szybko uczą się podświadomie unikać
szkodliwych pokarmów.
Wstępną HFI - opartą na ustąpienie objawów pod wpływem wycofania z diety
fruktozy należy zawsze potwierdzić. Zarówno test obciążenia fruktozą jak pomiar
aktywności aldolazy B w bioptacie wątroby są potencjalnie niebezpieczne.
U pacjentów bezobjawowych (unikających fruktozy) podjęcie decyzji o wykonaniu
tych badań jest kontrowersyjne z punktu widzenia etycznego.
Najpewniejszą i najbezpieczniejszą metodą potwierdzenia rozpoznania są badania
genetyczne, których dodatkowa zaletą jest możliwość wykrycia bezobjawowych
nosicieli choroby.
W celu diagnostyki HFI dla potrzeb klinicznych obejmuje analizę występowania
mutacji A149P
metodą bezpośredniego sekwencjonowania.

GALAKTOZEMIA
Galaktozemia jest rzadką wrodzoną chorobą metaboliczną
(należącą do zaburzeń przemiany węglowodanów),
wynikającą z braku zdolności organizmu do przetworzenia
galaktozy.
Kumulacja toksycznych metabolitów gromadzonych
powyżej bloku enzymatycznego oraz powstających wskutek
uruchomienia alternatywnych dróg przemiany galaktozy
prowadzi do uszkodzenia wątroby, nerek, soczewki oka i
układu nerwowego.
Dziedziczenie: autosomalne recesywne.
GALAKTOZEMIA
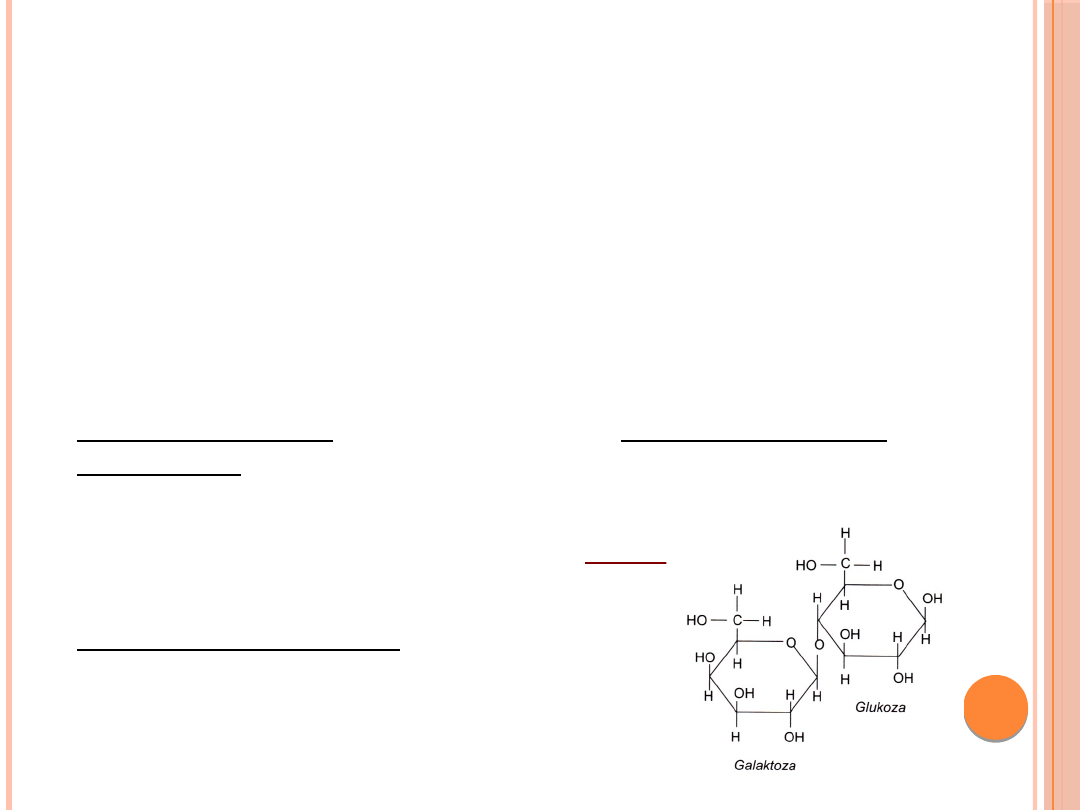
Galaktoza
- cukier prosty (jeden z trzech heksoz –
obok glukozy i fruktozy – wchłanianych w
przewodzie pokarmowym),szeroko
rozpowszechniony w przyrodzie, występujący w
stanie wolnym lub związanym w połączeniu z
innymi cukrami, białkami i tłuszczami.
Główne źródło dla człowieka: laktoza (cukier
mleczny)
LAKTOZA = glukoza +
galaktoza
Dodatkowe źródło: kazeina.
produkty roślinne – zboża, owoce,
warzywa.

GALAKTOZEMIA
Galaktozemia spowodowana
deficytem GALK
(galaktokinaza)
1965r Gitzelman –zaćma, (
↑
galaktozy
we krwi i galaktozuria), rzadko obrzęk
mózgu (
↑
galaktitol)
wykrywana na podstawie
noworodkowego testu przesiewowego
(opartego na oznaczaniu stężenia galaktozy
we krwi)
Klasyczna galaktozemia
– deficyt GALT
(urydylotransferaza
galaktozo –1 –
fosforanowa)
(
↑
galaktozy we krwi,
↑
gal-
1-P,
↑
galaktitol)
Galaktozemia spowodowana deficytem GALE
( 4’-epimeraza UDP-galaktozowa)
„obwodowa” – ↓aktywności enzymu
ograniczone do komórek krwi (erytrocytów,
leukocytów)- (Gitzelmann 1972r) łagodna,
rozpoznawana w neonatalnych testach
przesiewowych (stężenie galaktozy we krwi)
„uogólniona” – ↓aktywności enzymu dotyczy
wielu tkanek (m.in. wątroby, fibroblastów) ciężki
przebieg w okresie noworodkowym
GALAKTOZEMIA KLASYCZNA
Defekt enzymu
GALT
(urydylotransferazy galaktozo-1-fosforanu)
Galaktoza GAL1-P Glukoza
Dziedziczenie: autosomalne recesywne, gen GALT
Występowanie w Europie: 1:18 000 - 180 000 (1:
40 000)
GALT
OBJAWY KLINICZNE KLASYCZNEJ
GALAKTOZEMII
Kumulacja galaktozo -1 - fosforan (Gal-1-P)
GAL -1 –P toksyczny dla:
wątroby,
nerek,
mózgu
.
Szybko postępująca intoksykacja po wprowadzeniu u noworodka
posiłków mlecznych, zwykle w 3 lub 4 dniu życia
Dominują kliniczne cechy uszkodzenia komórki wątrobowej
poprzedzone lub współistniejące z mało charakterystycznymi
objawami uogólnionymi jak:
brak łaknienia, wymioty, biegunka,
senność lub nadpobudliwość,
zmniejszone napięcie mięśniowe,
brak przyrostu lub ubytek masy ciała,

ZABURZENIA CZYNNOŚCI WĄTROBY
W PRZEBIEGU GALATKOZEMII
patologiczna żółtaczka
pojawia się wcześniej niż fizjologiczna,
charakteryzuje się szybkim narastaniem stężenia bilirubiny
(często wymagającym wykonania przetaczania wymiennego
krwi)
zwykle z hepatomegalią i zwiększeniem aktywności
aminotransaminaz
utrzymuje się do 2 – 3 mies.ż.
może być nawracająca, z samoistnymi okresami
bezżółtaczkowymi (z brakiem łaknienia, brakiem przyrostów
masy ciała)
skaza krwotoczna
zaburzenia układu krzepnięcia z objawami krwawienia
zwiększona aktywność transaminaz
hipoalbuminemia, dysproteinemia
zwiększenie stężeń aminokwasów w osoczu
(główne
fenyloalaniny, tyrozyny i metioniny)
hipoglikemia
hiperamonemia
(rzadziej)
OBJAWY GALAKTOZEMII
Najbardziej typowy przebieg galaktozemii to
systematyczne narastanie objawów związane z podażą
mleka, a tym samym z postępującym uszkodzeniem
wątroby, które w ciągu kilku dni prowadzi do pełnoobjawowej
choroby – z żółtaczką, skazą krwotoczną, uogólnionymi
obrzękami, znacznym powiększeniem wątroby i bardzo
ciężkim stanem ogólnym.
Posocznica (E,coli) - powikłanie zakaźne, maskujące chorobę
zasadniczą (mała skuteczność leczenia przeciwbakteryjnego)
Zaburzenia funkcji nerek - tubulopatie: aminoacyduria,
glikozuria, galaktozuria i kwasica metaboliczna (może być
zwiększone wydalanie wapnia z moczem
-hiperechogeniczność piramid w badaniu USG)
Zmiany w obrębie soczewek u połowy noworodków z
galaktozemią (pełna zaćma lub zmętnienie soczewki)
Zgon z objawami niewydolności nerek i wątroby
Obrzęk mózgu (rzadko)

↑
Gal – 1 P – w krwinkach czerwonych
DIAGNOSTYKA LABORATORYJNA
DEFICYTU GALT
↑
Galaktoza
we krwi
↑
Galaktitol w moczu i
krwi

ROZPOZNANIE GALAKTOZEMII
Znaczącym badaniem jest oznaczenie
galaktozo - 1 fosforanu
(GAL-1-P)
w erytrocytach
,
którego stężenie może zwiększać się
nawet do 100 mg/dl
Norma stężenia galaktozo 1-
fosforanu
w erytrocytach: <0,3 mg/dl
UWAGA!!!
Koniecznie należy upewnić się, że odpowiednie
próbki krwi pobrano
przed rozpoczęciem diety
bezlaktozowej

WSKAZANIA DO LECZENIA
DIETETYCZNEGO
W GALAKTOZEMII
Postępowanie przy zwiększonym stężeniu
GAL-1-
P
(galaktozo – 1 – fosforanu)
0,5 – 2 mg/dl – ograniczenie laktozy
>2 mg/dl –
dieta bezlaktozowa
PODSTAWĄ ROZPOZNANIA
GALAKTOZEMII KLASYCZNEJ
JEST
Wykazanie niedoboru (brak lub deficyt)
galaktozo-1-urydylotransferazy (GALT)
a)
ilościowo - w krwinkach czerwonych
(patologiczny jeśli < 3,5 /gHb)
Wynik fałszywie dodatni (fałszywy brak aktywności GALT) uzyskuje
się w przypadku:
• hemolizy
(wyciskanie krwi podczas pobierania powoduje uszkodzenie
erytrocytów)
• suszenia bibułki / przechowywania w zbyt wysokiej temperaturze
(następuje denaturacja białka enzymatycznego
)
• zawilgocenia
(transport niedosuszonej bibułki w torebce plastikowej)
• zbyt długiego przechowywania bibułki po pobraniu
(spadek aktywności
enzymu)

ROZPOZNANIE GALAKTOZEMII
KLASYCZNEJ
Wykazanie niedoboru (brak lub deficyt)
galaktozo-1-urydylotransferazy (GALT)
b) Test Beutlera i Baludy- jakościowy
(brak fluorescencji po 2 godzinach inkubacji wskazuje na brak aktywnej
GALT)
UWAGA!!
Badanie aktywności enzymu urydylotranferazy galaktozo-1-
fosforanu u dzieci podejrzanych o galaktozemię, po uprzednim
przetoczeniu krwi, daje wynik niemiarodajny.
Badanie można wykonać dopiero po 3 miesiącach od daty zabiegu.
W celu wykonania testu Beutlera i Baludy krew należy pobrać przez
nakłucie pięty lub palca i nasączenie bibuły samoistnie spływającymi
kroplami (wyciskanie może spowodować hemolizę erytrocytów).
Bibułkę należy wysuszyć w temperaturze pokojowej i jak najszybciej
przesłać do ośrodka.

SKRINING NOWORODKOWY W GALAKTOZEMII
(TEST BIBUŁOWY) - AKTYWNOŚĆ GALT
Rozpoznanie klasycznej galaktozemii
jest możliwe także po rozpoczęciu diety przez pomiar
aktywności GALT.
Jeśli dziecko miało wykonaną transfuzję wymienną
krwi,
można zbadać aktywność GALT u rodziców.
Pomocna jest diagnostyka molekularna.
Zalety: brak wpływu diety na wynik
Wady: fałszywie dodatnie wyniki w
warunkach wysokiej temperatury i
wilgotności;
fałszywie ujemne wyniki po przetoczeniu
krwi
ROZPOZNANIE GALAKTOZEMII
(BADANIE MOLEKULARNE)
Analiza mutacji (analiza DNA)
gen strukturalny GALT zlokalizowany jest w obrębie 9
chromosomu w regionie 9p13
Znane mutacje:
W klasycznej galaktozemii
–homozygota (G/G) - dwa nieprawidłowe warianty
transferazy, tworzone na dwu zmutowanych
allelach genu GALT-
aktywność GALT w
erytrocytach mniejsza od 1% wartości
prawidłowej
–heterozygota (N/G) –jeden allel zmutowany-
ok.
50% aktywności GALT
wariant Duarte (D-2)
- w postaci homozygotycznej (D/D)
(powoduje
zmniejszenie aktywności
GALT do 50% wartości prawidłowej
- w postaci heterozygotycznej z
drugim prawidłowym allelem (D/N)
zmniejszenie aktywnosci GALT do 75%

LAKTOZEMIA
LAKTOZA – (C12H22O11, cukier mlekowy), dwucukier
zbudowany z D-galaktozy i D-glukozy
Bezbarwny lub biały, nieco słodki, rozpuszczalny w
wodzie, bezwonny proszek o temperaturze topnienia
225°C.
Występuje w mleku ssaków w stężeniu kilku procent.
Otrzymywana z serwatki, nie fermentuje pod wpływem
drożdży, bakterie w kwaśnym mleku przemieniają ją w
kwas mlekowy.
Stosowana w:
przemyśle farmaceutycznym (jako wypełniacz)
spożywczym (jako składnik mleka i żywności dla
niemowląt)
w pirotechnice
NIETOLERANCJA LAKTOZY
bardzo często mylona z alergią na mleko i inne produkty
‘nabiałowe’.
NIETOLERANCJA LATKOZY
– oznacza wystąpienie
klinicznych objawów dysproporcji między ilością spożytej
laktozy a możliwością jej strawienia i wchłonięcia po
spożyciu.
Do zaburzeń dochodzi w wyniku :
1.
zmniejszonego jej trawienia
2.
ograniczenia powierzchni wchłaniania
3.
mniejszego transportu przez błonę komórkową enterocyta
4.
oddziaływania patologiczne flory bakteryjnej.
Niedobór laktazy jest jedną z podstawowych przyczyn
nietolerancji
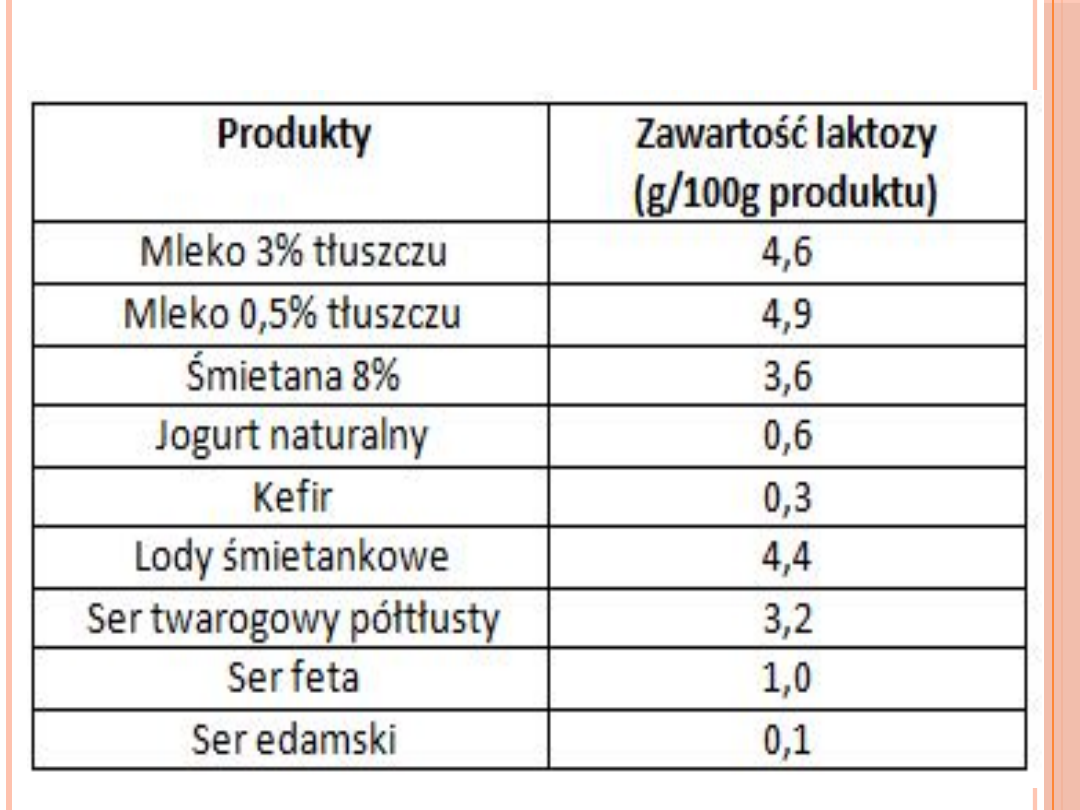

WRODZONY NIEDOBÓR LAKTAZY - ALAKTAZJA
niezwykle rzadka ale groźna, uwarunkowana
genetycznie choroba charakteryzująca się
całkowitym izolowanym niedoborem laktazy.
OBJAWY
– biegunki z wodnistymi, kwaśnymi
stolcami (zaraz po pierwszym podaniu mleka
matki lub modyfikowanego mleka
zawierającego laktozę noworodkowi),
tendencje do odparzenia pupy.
LECZENIE
– całe życie dieta bezlaktozowa

WTÓRNY NIEDOBÓR LAKTAZY
Towarzyszy chorobom przebiegającym z
uszkodzeniem szczytowej części kosmków jelitowych
(lokalizacja laktazy)
w przebiegu:
1.
ostrych zakażeń żołądkowo-jelitowych (rotawirusy,
bakterie, robaczyce, lamblioza)
2.
enteropatii
3.
czynników jatrogennych (antybiotyki. ASA, NLPZ,
chemioterapeutyki, alkohol promieniowanie jonizujące)
4.
inne : niedożywienie, mukowiscydoza, choroba
Leśniewskiego-Crohna, enteropatia cukrzycowa,
5.
rozległe resekcje jelita ( całkowitej puli laktazy)

WTÓRNY NIEDOBÓR LAKTAZY
OBJAWY
– biegunki, wzdęcia i bóle brzucha,
uczucie pełności, przelewania, nadmierna ilość
gazów.
Objawy mogą występować razem lub w różnych
kombinacjach: zazwyczaj od 0,5 h do 12 h od
spożycia pokarmów mlecznych lub innych
produktów zawierających laktozę.
LECZENIE –
eliminacja z diety czasowa +
usunięcie podstawowej przyczyny
PIERWOTNY
NIEDOBÓR LAKTAZY
najczęstszy typ związany z hipolaktazją typu dorosłych (ATH).
postępujący z wiekiem ubytek aktywności laktazy, która w
okresie wczesnego dzieciństwa jest prawidłowa
polimorfizm genu laktazy C/T w pozycji 13910 = zanik aktywności
laktazy
Każdy inny wariant alleliczny związany jest z jej zachowaniem
OBJAWY
: w okresie niemowlęctwa i wczesnego dzieciństwa – BRAK
: po 5 r.ż. zaczynają się dolegliwości żołądkowo-jelitowe
U większości ludzi aktywność laktazy fizjologicznie ulega
systematycznemu obniżaniu (nawet do 10% w stosunku do okresu
niemowlęcego)
Polska: 1,5 % niemowląt i dzieci
20-25% osób dorosłych

ROZPOZNANIE NIETOLERANCJI LAKTOZY I
HIPOLAKTAZII
metody bezpośrednie:
1.
pomiar aktywności laktazy w bioptacie jelita cienkiego
metody pośrednie:
1.
wodorowy test oddechowy
2.
test doustnego obciążenia laktozą
3.
próba eliminacyjna
4.
pH stolca
5.
badanie molekularne polimorfizmu genu laktazy
Badanie z zakresu genetyki jest diagnostyką
rozstrzygającą i niesie w sobie jednoznaczną
informację.
Bez pełni wiedzy na temat uwarunkowań genetycznych ani
Pacjent ani lekarz nie mają jednoznacznej wiedzy co do
rodzaju zmian. Zapewnienie komfortu życia jednoznacznie
wiąże się z dobrą diagnostyką.

ROZPOZNANIE NIETOLERANCJI LAKTOZY

Wskazania do wykonania badania genetycznego obejmują:
1.
diagnostyka przypadków przewlekłej lub nawracającej biegunki lub
wzdęć i bólów brzucha w wieku młodzieńczym lub dorosłym, zwłaszcza
związanych ze zwiększonym wydalaniem wodoru w powietrzu
wydychanym;
2.
diagnostyka przypadków osteoporozy w wieku dorosłym, zwłaszcza
związanych z niedokwasotą żołądka (samoistną lub po lekach
zobojętniających) lub okresowymi dolegliwościami jelitowymi lub
wyraźną nietolerancją mleka;
3.
diagnostyka różnicowa różnych postaci zaburzeń metabolizmu laktozy
(wrodzona lub nabyta nietolerancja laktozy) lub przypadków
przewlekłych dolegliwości jelitowych i zespołu złego wchłaniania,
zwłaszcza przy podejrzeniu alergii na białko krowie lub zbożowe,
wrzodziejącego zapalenia jelit, zespołu drażliwego jelita, nietolerancji
innych cukrów (np. fruktozy);
4.
badania rodzinne: wykrycie mutacji genu LCT u krewnego w rodzinach z
nawracającą biegunką, zespołem złego wchłaniania lub osteoporozą.

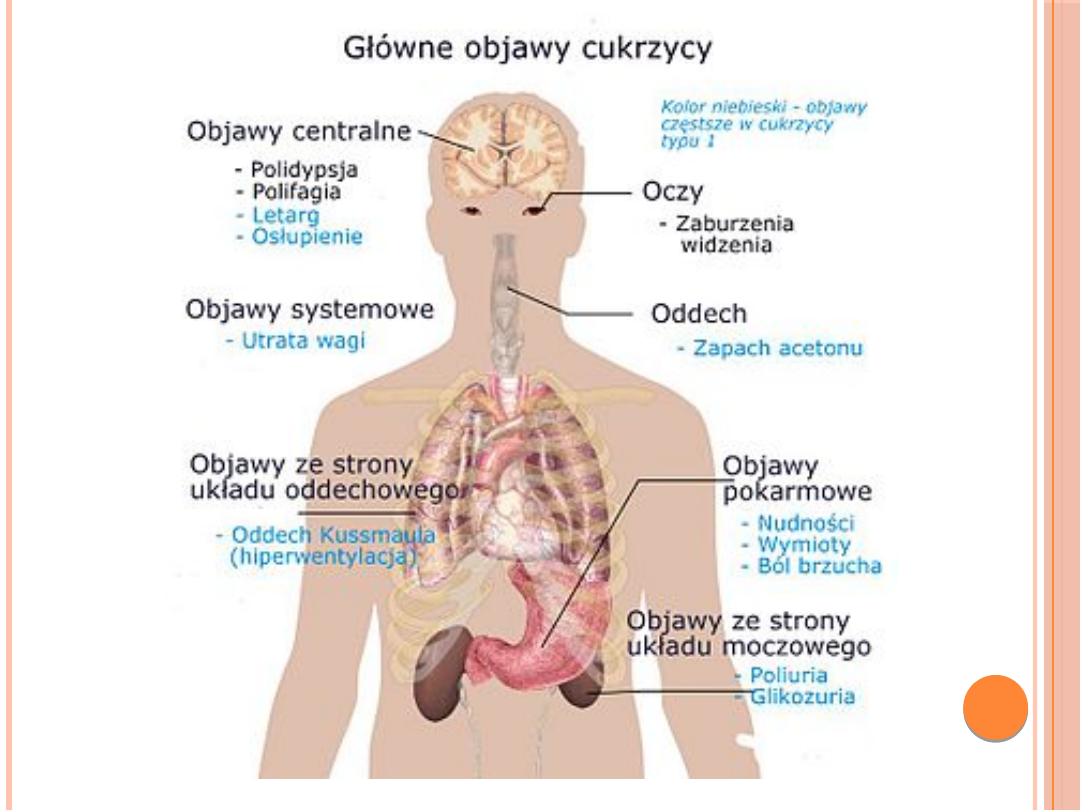
CUKRZYCA
Cukrzyca jest to grupa chorób
metabolicznych charakteryzująca się
hiperglikemią wynikającą z defektu
wydzielania i/lub działania insuliny.
Przewlekła hiperglikemia wiąże się z
uszkodzeniem, zaburzeniem czynności i
niewydolnością różnych narządów,
zwłaszcza oczu, nerek, nerwów, serca i
naczyń krwionośnych.
ZABURZENIA GLIKEMII
Hiperglikemia
•Nieprawidłowa
glikemia na czczo
(IFG)
•Upośledzona
tolerancja glukozy
(IGT)
•Cukrzyca typu 1
•Cukrzyca typu 2
•Cukrzyca
ciężarnych
Hipoglikemia < 55 mg/dl
(3,0 mmol/l)
•Hipoglikemia noworodków,
niemowląt
•Guz z komórek B trzustki
(insulinoma)
•Niedobory pokarmowe,
alkoholizm
•Przedawkowanie insuliny
•Niedobór hormonów
antagonistycznych do
insuliny (np. niedoczynność
tarczycy)
•Wrodzone bloki
metaboliczne
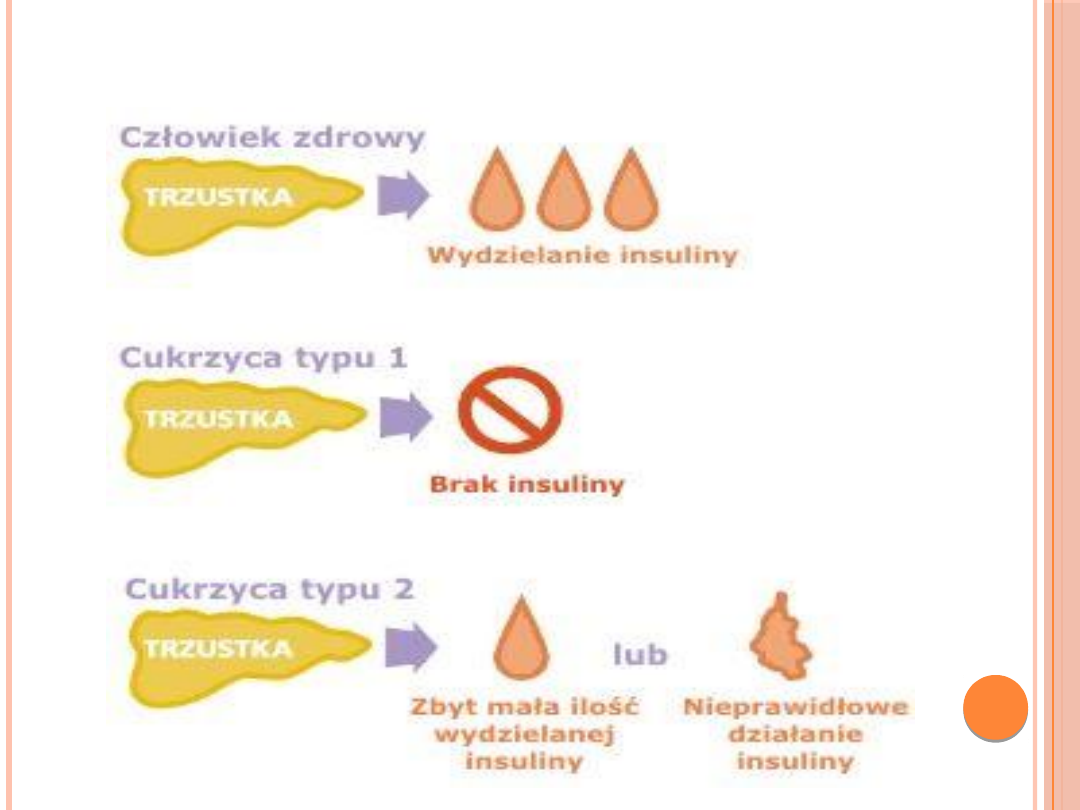
CUKRZYCA TYPU I
Autoprzeciwciała
Uszkodzenie kom. B
wysp trzustki
Cukrzyca typu 1
insulina
CUKRZYCA TYPU II
Wrażliwości na insulinę
Stężenia insuliny
Liczby receptorów insulinowych
Produkcji insuliny
Narastająca
insulinooporność
Cukrzyca typu 2
Wyczerpanie rezerw komórek
wysp trzustki

Nazewnictwo stanów hiperglikemicznych według
Światowej Organizacji Zdrowia (WHO, World Health
Organization):
— prawidłowa glikemia na czczo: 70–99 mg/dl (3,9––5,5 mmol/l);
— nieprawidłowa glikemia na czczo
(IFG, impaired fasting glucose):
100–125 mg/dl (5,6–6,9 mmol/l);
— nieprawidłowa tolerancja
glukozy (IGT, impaired glucose
tolerance):
w 120. minucie OGTT glikemia 140–199 mg/dl
(7,8–11 mmol/l);
— stan przedcukrzycowy — IFG i/lub IGT;
— cukrzyca — jedno z następujących kryteriów:
1. objawy hiperglikemii i glikemia przygodna
≥ 200 mg/dl (≥ 11,1 mmol/l),
2. 2-krotnie glikemia na czczo ≥ 126 mg/dl (≥ 7,0
mmol/l),
3. glikemia w 120. minucie OGTT ≥ 200 mg/dl
(≥ 11,1 mmol/l).

Niezależnie od wieku, oznaczenie glukozy należy wykonać co roku
u osób z następujących grup ryzyka:
— z nadwagą lub otyłością [BMI ≥ 25 kg/m2 i/lub obwód w talii > 80 cm
(kobiety); > 94 cm (mężczyźni)];
— z cukrzycą występującą w rodzinie (rodzice bądź rodzeństwo);
— mało aktywnych fizycznie;
— z grupy środowiskowej lub etnicznej częściej narażonej na cukrzycę;
— u których w poprzednim badaniu stwierdzono stan przedcukrzycowy;
— u kobiet z przebytą cukrzycą ciążową;
— u kobiet, które urodziły dziecko o masie ciała > 4 kg;
— z nadciśnieniem tętniczym (≥ 140/90 mm Hg);
— z dyslipidemią [stężenie cholesterolu frakcji HDL < 40 mg/dl (< 1,0
mmol/l) i/lub triglicerydów > 150 mg/dl (>1,7 mmol/l)];
— u kobiet z zespołem policystycznych jajników;
— z chorobą układu sercowo-naczyniowego.
ZASADY ROZPOZNAWANIA
ZABURZEŃ GOSPODARKI
WĘGLOWODANOWEJ
Glikemia przygodna —
oznaczona w próbce
krwi pobranej o dowolnej
porze dnia,
niezależnie od pory
ostatnio spożytego
posiłku
Glikemia na czczo —
oznaczona
w próbce krwi pobranej 8–
14 godzin
od ostatniego posiłku
Glikemia w 120. minucie
doustnego
testu tolerancji glukozy
(OGTT)
według WHO
≥ 200 mg/dl (11,1
mmol/l) cukrzyca*
(gdy występują
objawy hiperglikemii,
takie jak: wzmożone
pragnienie,
wielomocz,
osłabienie)
Stężenie glukozy w
osoczu krwi żylnej
70–99 mg/dl (3,9–5,5
mmol/l) prawidłowa
glikemia na czczo(NGT)
100–125 mg/dl (5,6–6,9
mmol/l) nieprawidłowa
glikemia na czczo (IFG)
≥ 126 mg/dl (7,0 mmol/l)
cukrzyca*
< 140 mg/dl (7,8
mmol/l) prawidłowa
tolerancja glukozy
(IGT)
140–199 mg/dl (7,8–
11,1 mmol/l)
nieprawidłowa
tolerancja glukozy
(IGT)
≥ 200 mg/dl (11,1
mmol/l) cukrzyca*
*Do rozpoznania cukrzycy konieczne jest stwierdzenie jednej z nieprawidłowości, z wyjątkiem glikemii na
czczo, gdy wymagane jest 2-krotne potwierdzenie zaburzeń; przy oznaczaniu glikemii należy uwzględnić
ewentualny wpływ czynników niezwiązanych z wykonywaniem badania (pora ostatnio spożytego posiłku,
wysiłek fizyczny, pora dnia)

OKREŚLENIE WARTOŚCI
DOCELOWYCH
W LECZENIU CUKRZYCY
Intensywność dążenia do wartości docelowych należy
indywidualizować.
W redukcji wskaźników glikemicznych należy uwzględnić stopień
ryzyka hipoglikemii, stopień edukacji pacjenta oraz relacje korzyści
i ryzyka uzyskania tych wartości.
U osób w starszym wieku i w sytuacji współistnienia chorób
towarzyszących, jeśli prognoza przeżycia nie osiąga 10 lat,
należy złagodzić kryteria wyrównania do stopnia,
który nie pogorszy jakości życia pacjenta.
MONITOROWANIE PRZEBIEGU
LECZENIA
I OCENA WYRÓWNANIA GLIKEMII
MONITOROWANIE ZABURZEŃ
WYRÓWNANIE
GLIKEMII
GASPODARKA
LIPIDOWA
GLUKOZA WE
KRWI
GLUKOMETRIA
GLUKOZA WE
KRWI
GLUKOMETRIA
BIAŁKA GLIKOWANE
BIAŁKA GLIKOWANE
GLUKOZA I
CIAŁA
KETONOWE W
MOCZU
GLUKOZA I
CIAŁA
KETONOWE W
MOCZU
HEMOGLOBINA
GLIKOWANA
FRUKTOZAMINA
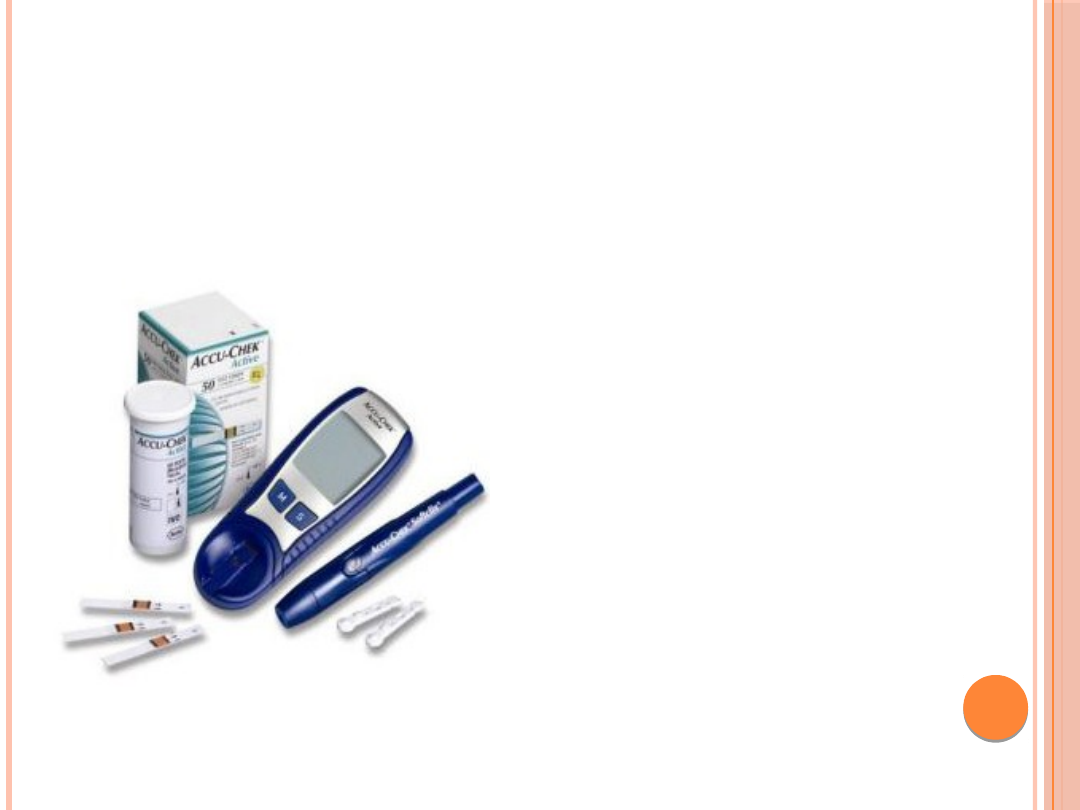
MONITOROWANIE PRZEBIEGU
LECZENIA
I OCENA WYRÓWNANIA GLIKEMII
SAMOKONTROLA
•Jest obligatoryjna u
wszystkich chorych
leczonych insuliną i
rekomendowana u
pozostałych
•Oznaczenia
przeprowadzane są
metodami suchej chemii
przy użyciu pasków
testowych i glukometrów
•Niektóre z nich mają
możliwość oznaczania
ketonów (specjalne paski)

MONITOROWANIE PRZEBIEGU
LECZENIA
I OCENA WYRÓWNANIA GLIKEMII
GLUKOMERTIA
Błąd oznaczenia zależy od konstrukcji glukometru i
od prawidłowego pobrania krwi i wykonania
oznaczenia
Dopuszczalna wielkość błędu wynosi od 5 do nawet
20% wg różnych rekomendacji
Edukacja chorych
Analityczna kontrola glukometrów – laboratorium
PTD zaleca kontrolę jakości oznaczeń co pół roku
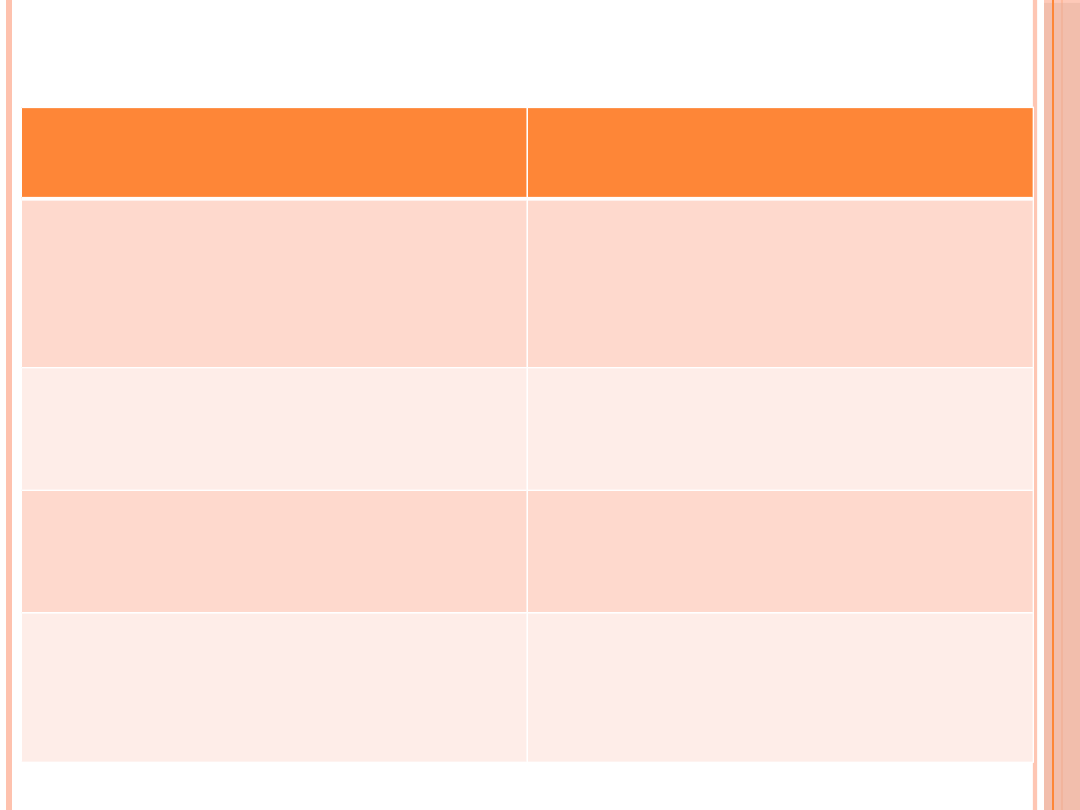
ZALECANA CZĘSTOŚĆ
SAMOKONTROLI GLIKEMII
Sposób leczenia cukrzycy
Częstość pomiarów glikemii
przy prowadzeniu samokontroli
Wielokrotne (tj. co najmniej 3 ×
dziennie) wstrzyknięcia insuliny
Intensywna funkcjonalna
insulinoterapia, niezależnie od typu
cukrzycy
Wielokrotne (tj. co najmniej 4 ×
dziennie) pomiary w ciągu doby według
ustalonych zasad leczenia oraz
potrzeb pacjenta
Chorzy leczeni wyłącznie dietą
Raz w miesiącu skrócony profil glikemii
(na czczo i po głównych posiłkach) oraz
raz w tygodniu o różnych porach dnia
Chorzy stosujący doustne leki
przeciwcukrzycowe i/lub analogi GLP
Raz w tygodniu skrócony profil glikemii
(na czczo i po głównych posiłkach),
codziennie 1 badanie o różnych porach
dnia
Chorzy na cukrzycę typu 2 leczeni
stałymi dawkami insuliny
Codziennie 1–2 pomiary glikemii,
dodatkowo raz w tygodniu skrócony
profil glikemii (na czczo i po głównych
posiłkach) oraz raz w miesiącu pełny
profil glikemii

DOBOWY PROFIL GLIKEMII
Badanie dobowego profilu glikemii stosuje się:
Aby ustalić prawidłowe leczenie i kontrolować jego
skuteczność
Dawniej miało znaczenie rozpoznawcze
Pacjent może wykonać to badanie przy pomocy
glukometru.
Schemat:
Rano na czczo
Przed głównymi posiłkami
2 godz. po posiłkach
Przed snem
Czasem dodatkowo o północy i między godz. 2.00
a 4.00

BIAŁKA GLIKOWANE
Glikacja białek jest powszechna w organizmie
Jest to proces nieenzymatyczny, powstają
trwałe formy ketoaminowe
Im wyższe stężenie glukozy – tym wyższe
stężenie białek glikowanych
Do retrospektywnej oceny glikemii jest
stosowane oznaczanie hemoglobiny
glikowanej i fruktozaminy

OZNACZENIE HEMOGLOBINY
GLIKOWANEJ
Hemoglobina glikowana jest produktem nieenzymatycznego
przyłączenia cząsteczki glukozy do wolnych grup aminowych
globiny.
Spośród licznych frakcji hemoglobiny glikowanej zastosowanie w
diagnostyce znajduje głównie
oznaczanie HbA
1c
(A
1c
),
powstającej
przez przyłączenie cząsteczki glukozy do N-końcowej grupy
aminowej łańcucha globiny.
Błona komórkowa erytrocytów jest przepuszczalna dla glukozy, zatem
ilość zawartej w nich HbA
1c
odzwierciedla stężenie glukozy we krwi
w ciągu poprzednich 120 dni (prawidłowy okres życia krwinek
czerwonych).
Hemoglobina glikowana jest retrospektywnym wskaźnikiem
glikemii oraz czynnikiem ryzyka rozwoju przewlekłych
powikłań cukrzycy.
OZNACZENIE HEMOGLOBINY
GLIKOWANEJ
Oznaczenia HbA
1c
u chorych na cukrzycę
powinno się wykonywać rutynowo co 3
miesiące.
U pacjentów ze stabilnym przebiegiem
choroby
i dobrym wyrównaniem metabolicznym
oznaczenia można wykonywać
co pół roku.

KRYTERIA WYRÓWNANIA GOSPODARKI
WĘGLOWODANOWEJ
Kryterium ogólne:
1. HbA1c ≤ 7% (≤ 53 mmol/mol)
Kryteria szczegółowe:
a) HbA1c ≤ 6,5% (≤ 48 mmol/mol):
— w odniesieniu do cukrzycy typu 1 [glikemia na czczo i przed
posiłkami, także w samokontroli: 70–110 mg/dl (3,9–6,1
mmol/l), a 2 godziny po posiłku w samokontroli < 140 mg/dl
(7,8 mmol/l)];
— w przypadku krótkotrwałej cukrzycy typu 2;
— u dzieci i młodzieży, niezależnie od typu choroby.
b) HbA1c ≤ 8,0% (≤ 64 mmol/mol):
— w przypadku chorych w wieku > 70 lat z wieloletnią cukrzycą
(> 20 lat), u których współistnieją istotne powikłania o
charakterze makroangiopatii (przebyty zawał serca i/lub udar
mózgu);
c) HbA1c ≤ 6,0% (≤ 42 mmol/mol) u kobiet planujących ciążę i
będących w ciąży.
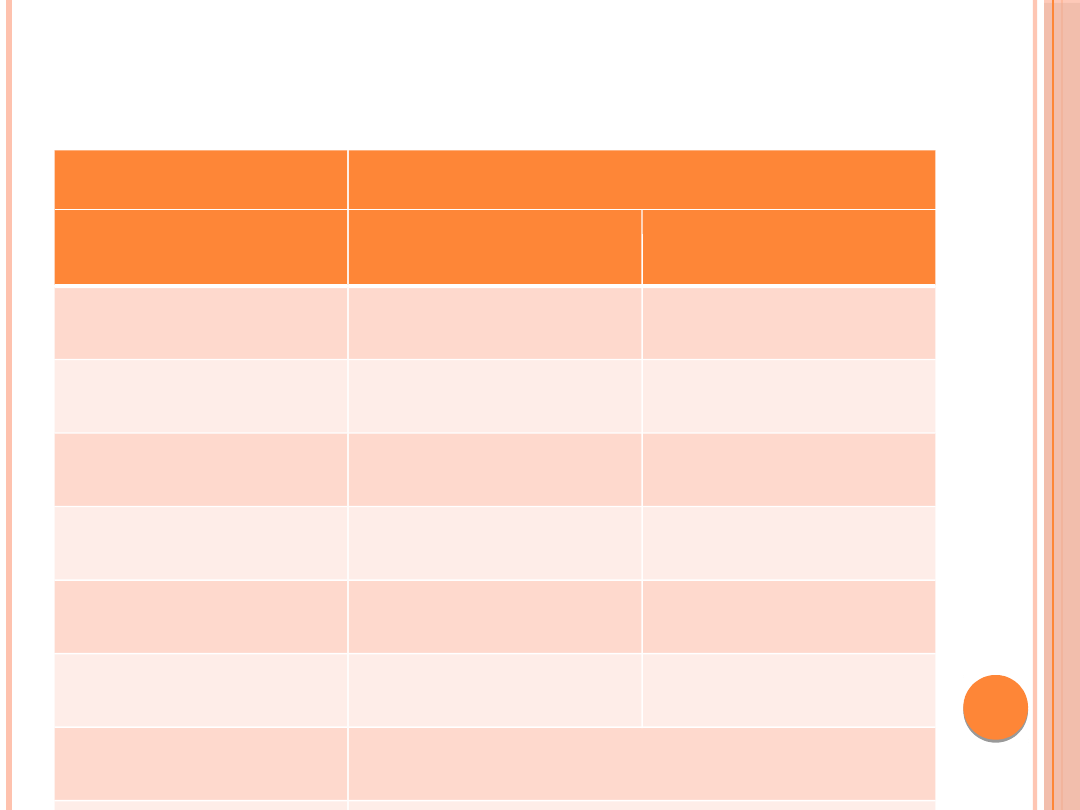
ZWIĄZEK MIĘDZY ODSETKIEM HBA1C A
ŚREDNIM
STĘŻENIEM GLUKOZY W OSOCZU
HbA1c
(%)
Średnie stężenie glukozy w osoczu
[mg/dl]
[mmol/l]
5
97 (76–120) 5,4 (4,2–
6,7)
6
126 (100–152) 7,0 (5,5–
8,5)
7
154 (123–185) 8,6 (6,8–
10,3)
8
183 (147–217) 10,2 (8,1–
12,1)
9
212 (170–249) 11,8 (9,4–
13,9)
10
240 (193–282) 13,4 (10,7–
15,7)
11
269 (217–314) 14,9 (12,0–
17,5)
12
298 (240–347) 16,5 (13,3–
19,3)

GLIKOWANA ALBUMINA -
FRUKTOZAMINA
Stężenie glikowanej postaci albuminy odzwierciedla
średnią glikemię w okresie ok. 2 tygodni przed
oznaczeniem
Wskazania do oznaczania:
- chorzy z chwiejnym przebiegiem choroby,
- konieczność uzyskania ścisłego wyrównania
metabolicznego np. u ciężarnych z cukrzycą.
Wadą tego parametru jest zmienność stężenia
albuminy pod wpływem wielu czynników
zewnętrznych

CIAŁA KETONOWE I GLUKOZA
W MOCZU
Glukozuria nie jest obecnie przydatna w
monitorowaniu leczenia
W dalszym ciągu istotną rolę odgrywa oznaczanie
ciał ketonowych do wykrywania ketozy i kwasicy
ketonowej
Świadczy ona o skrajnym niewyrównaniu glikemii
Ketonuria powinna być badana przy utrzymującej
się hiperglikemii i przy objawach kwasicy ketonowej
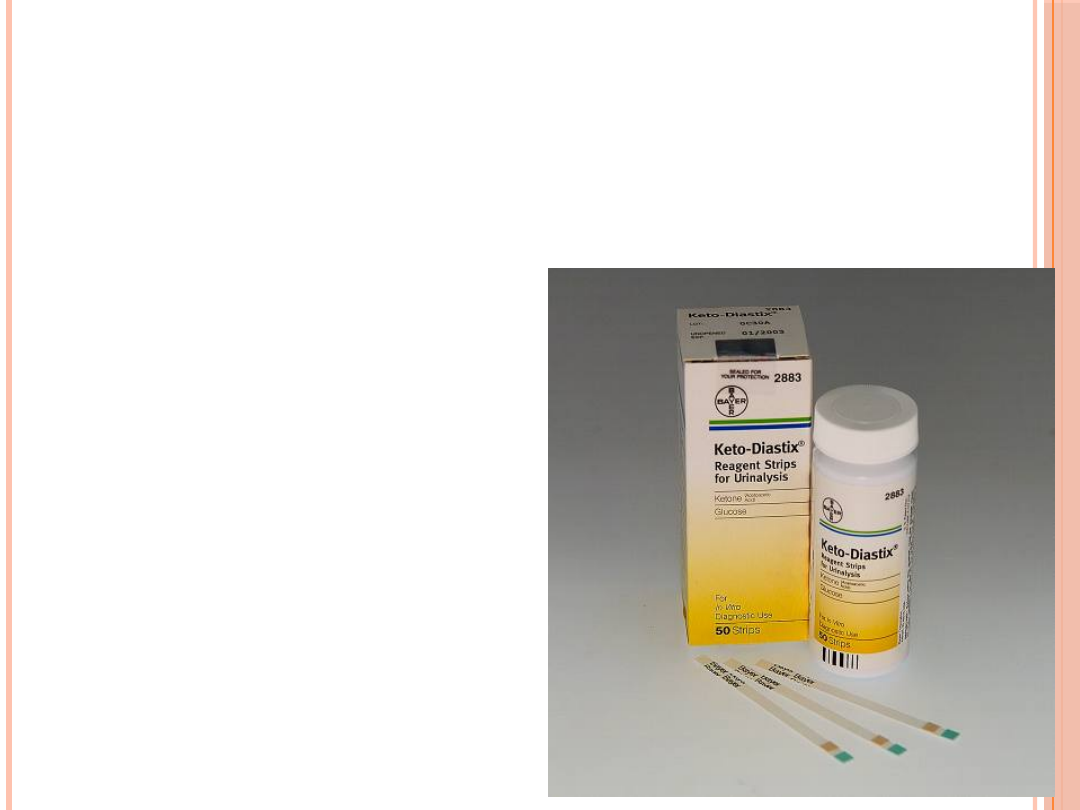
CIAŁA KETONOWE
Wykrywane często przy użyciu suchych testów
paskowych, w reakcji z nitroprusydkiem sodu
Przydatne i zalecane
jest ilościowe oznaczanie
β-hydroksymasłowy we krwi
w reakcji z dehydrogenazą
kwasu β-hydroksymasłowego
(β-HBDH)
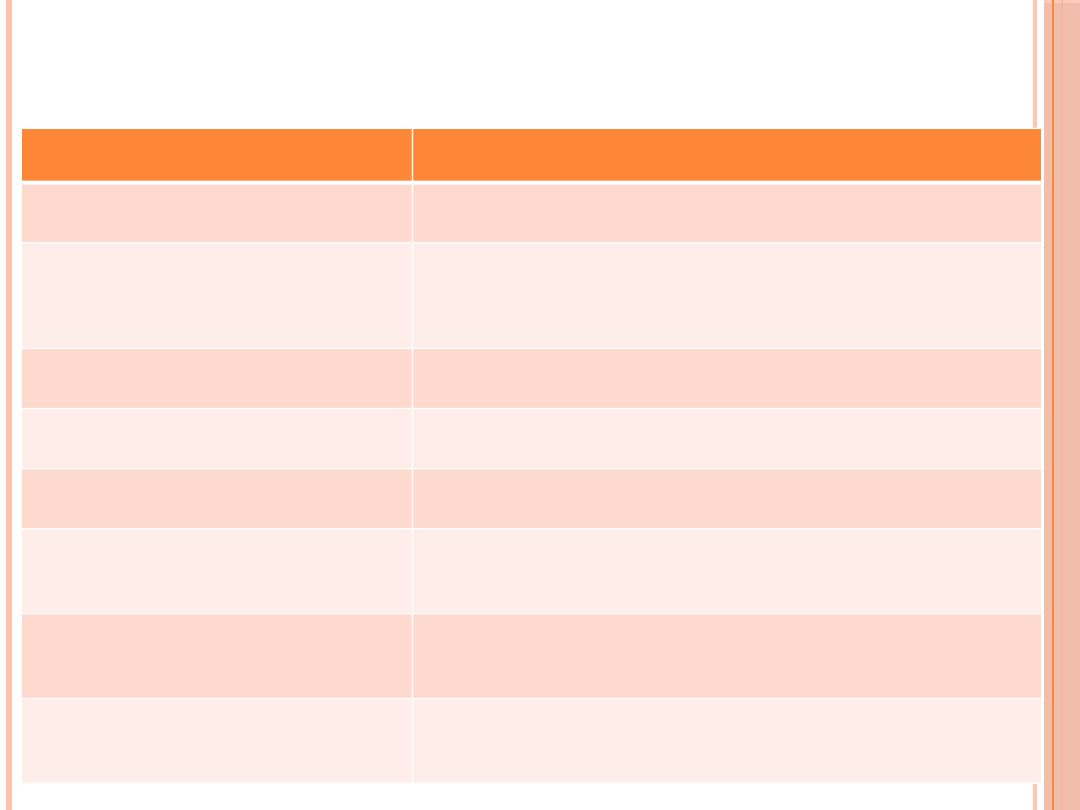
ZALECENIA DOTYCZĄCE MONITOROWANIA
DOROSŁYCH CHORYCH NA CUKRZYCĘ
Parametr
Uwagi
Edukacja dietetyczna i
terapeutyczna
Na każdej wizycie
HbA1c
Raz w roku, częściej w przypadku wątpliwości utrzymania
normoglikemii lub konieczności weryfikacji skuteczności
leczenia po jego modyfikacji
Cholesterol całkowity, HDL, LDL,
triglicerydy w surowicy krwi
Raz w roku, częściej w przypadku obecności dyslipidemii
Albuminuria
Raz w roku u chorych nieleczonych inhibitorami ACE lub
antagonistami receptora AT1
Badanie ogólne moczu z osadem
Raz w roku
Kreatynina w surowicy krwi i
wyliczanie eGFR
Raz w roku (w przypadku cukrzycy typu 1 po 5 latach
trwania choroby)
Kreatynina, Na+, K+, Ca2+, PO4
3– w surowicy krwi
Co pół roku u chorych z podwyższonym stężeniem
kreatyniny w surowicy krwi
Dno oka przy rozszerzonych
źrenicach
U chorych na cukrzycę typu 1 po 5 latach; u chorych na
cukrzycę typu 2 — od momentu rozpoznania choroby

HIPOGLIKEMIA
Definicja
Hipoglikemię rozpoznaje się przy obniżeniu stężenia
glukozy we krwi poniżej 70 mg/dl (3,9 mmol/l),
niezależnie od występowania objawów klinicznych,
które u części osób, zwłaszcza chorujących od wielu
lat na cukrzycę typu 1, mogą pojawiać się dopiero
przy niższych wartościach glikemii.
Objawy hipoglikemii mogą też wystąpić przy
wyższych wartościach glikemii (> 100 mg/dl),
wówczas gdy dochodzi do ich szybkiego obniżenia.
Nieświadomość hipoglikemii, określana jako
nieodczuwanie patologicznie niskich (< 70 mg/dl, tj.
< 3,9 mmol/l) wartości glikemii, jest istotnym
powikłaniem częstego występowania epizodów
hipoglikemii. Nieświadomość hipoglikemii może być
także spowodowana neuropatią autonomiczną.

ROZPOZNANIE HIPOGLIKEMII
– TRIADA WHIPPLE’A
Objawy
neuroglikopenii –
wzmożona
potliwość,
tachykardia,
niepokój, zaburzenia
świadomości,
śpiączka, drgawki
Stwierdzenie
niskiego stężenia
glukozy we krwi,
zwykle <36 mg/dl (2
mmol/l)
Ustąpienie objawów
po podaniu glukozy
i.v.

HIPOGLIKEMIA
Ciężka hipoglikemia jest epizodem
wymagającym pomocy innej osoby w celu
podania węglowodanów, glukagonu lub podjęcia
innych działań. Wartości glikemii podczas epizodu
mogą być niedostępne, jednak ustąpienie objawów
po powrocie glikemii do normy jest uznawane za
wystarczający dowód, że epizod był spowodowany
niskim stężeniem glukozy we krwi.
Nawracająca ciężka hipoglikemia: 2 i więcej
przypadków ciężkiej hipoglikemii w okresie
ostatnich 12 miesięcy

HIPOGLIKEMIA
Osoby chorej na cukrzycę nie można automatycznie
traktować jako zagrożonej hipoglikemią
Ryzyko wystąpienia hipoglikemii wzrasta w następujących
sytuacjach:
— stosowanie insuliny w monoterapii lub w skojarzeniu z
innymi lekami przeciwhiperglikemicznymi;
— stosowanie pochodnych sulfonylomocznika w monoterapaii
bądź w skojarzeniu z innymi lekami
przeciwhiperglikemicznymi;
— niewłaściwe dawkowanie wymienionych leków w sytuacji
wzmożonego wysiłku fizycznego, zmniejszonego dowozu
kalorii lub spożywania alkoholu;
— dążenie do szybkiej normalizacji wartości HbA1c.
Hipoglikemia w pewnych sytuacjach (starsi chorzy, osoby z
chorobą niedokrwienną mięśnia sercowego) może stanowić
bezpośrednie zagrożenie życia.

POSTĘPOWANIE W OSTRYCH POWIKŁANIACH CUKRZYCY
W PRZEBIEGU HIPERGLIKEMII
Podział ostrych powikłań w przebiegu hiperglikemii:
1. Cukrzycowa kwasica ketonowa (śmiertelność — ok. 5%).
2. Stan hiperglikemiczno-hipermolalny (śmiertelność — ok.15%).
3. Kwasica mleczanowa (śmiertelność — wg danych
historycznych
ok. 50%, ale w dużym stopniu zależy ona od doświadczenia
ośrodka prowadzącego leczenie, od zaawansowania choroby
podstawowej
i współistnienia chorób towarzyszących).
KWASICA KETONOWA
Przyczyny kwasicy i śpiączki ketonowej:
— przerwanie lub błędy insulinoterapii (częsta
przyczyna
— nadużywanie alkoholu);
— zbyt późne rozpoznanie cukrzycy typu 1;
— ostre stany zapalne (np. zakażenia bakteryjne,
wirusowe, grzybicze);
— ciąża;
— inne.

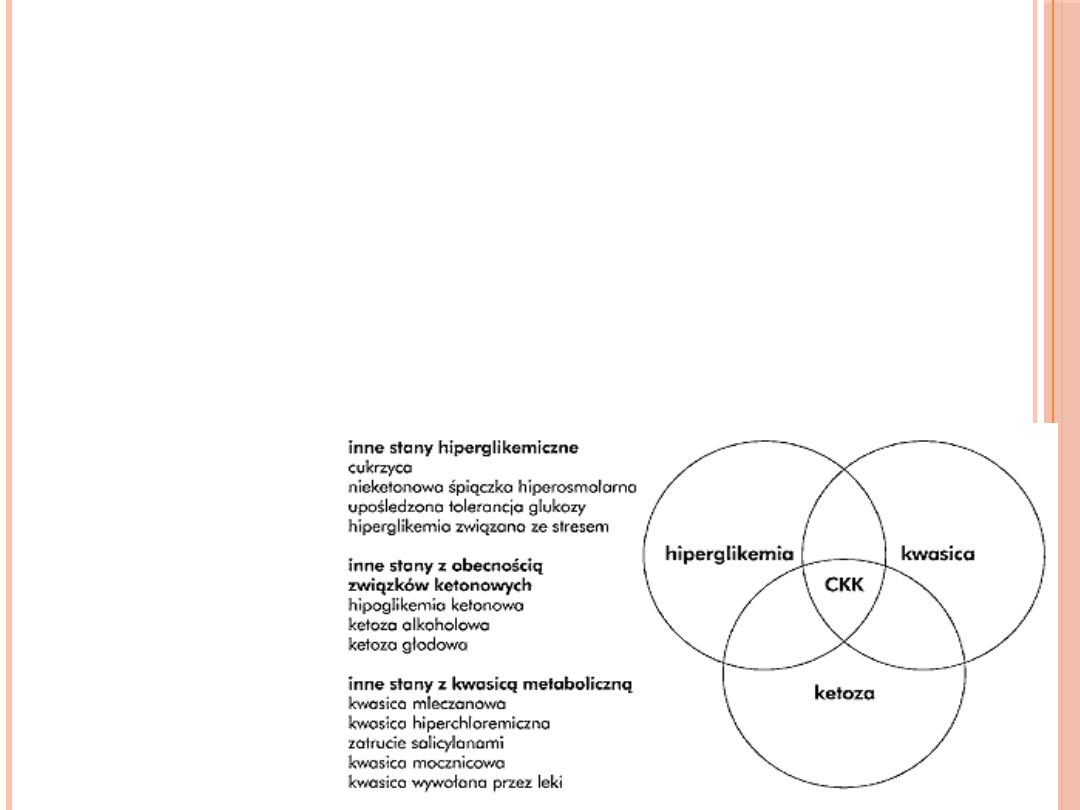
W CKK WSPÓŁISTNIEJĄ:
Znaczna hiperglikemia
z glukozurią
Kwasica metaboliczna
ze zwiększoną luką
anionową
Odwodnienie
hipertoniczne z
zaburzeniamin
elektrolitowymi
Hiperglikemia
Kwasica
ketonowa
Odwodnienie,
dyselektrolitemia
CKK

OBJAWY CKK
Wzmożone
pragnienie,
wielomocz, osłabienie,
nudności, wymioty,
bóle brzucha
Objawy odwodnienia
(sucha skóra i
śluzówki), niskie CTK,
tachykardia, oddech
Kussmaula,
zaburzenia
świadomości

KWASICA KETONOWA
Rozpoznawanie:
Laboratoryjne kryteria diagnostyki kwasicy ketonowej:
— glikemia zazwyczaj > 250 mg/dl (> 13,9 mmol/l);
— pH krwi < 7,3;
— stężenie wodorowęglanów w surowicy < 18 mmol/l;
— ciała ketonowe obecne w moczu lub w surowicy (metoda z
użyciem nitroprusydku);
— luka anionowa: Na+(mmol/l) – [Cl– (mmol/l)+HCO3– (mmol/l)]
>12
(w tym wzorze stosuje się wartość zmierzoną Na, a nie
skorygowaną).

ROZPOZNANIE CKK – BADANIA
LABORATORYJNE
Glikemia , glukozuria
Ketonemia/ketonuria (++++)
pH, HCO
3
-
, pCO
2
, pO
2
N/
Luka anionowa
Osmolalność surowicy
Na
+
, K
+
/N/; Pi
Kreatynina, BUN N/
Leukocytoza
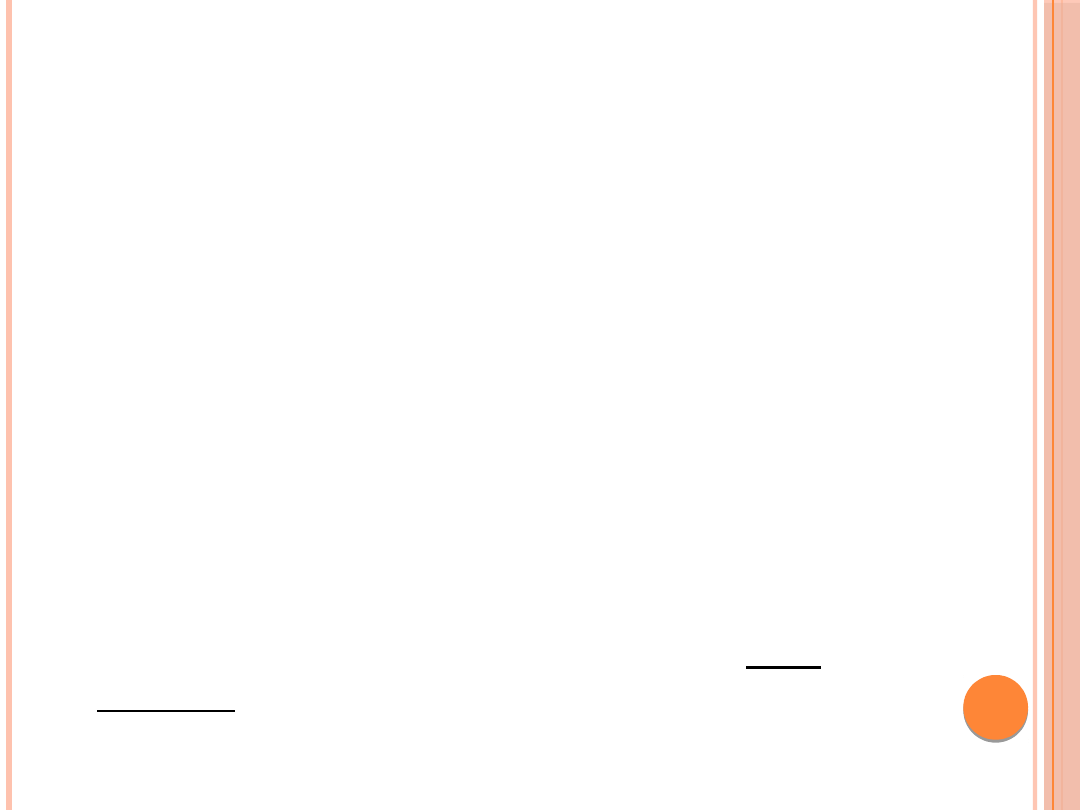
KOREKTA STĘŻENIA SODU W
SUROWICY
Stężenie sodu jest zmniejszone o 1.6
mmol/l na każde 100 mg/dl stężenia
glukozy powyżej 100 mg/dl
Np. przy Na
+
130 mml/l i glikemii 540
mg/dl: 540 mg/dl – 100 mg/dl = 440
mg/dl
1.6 X 4.4 = 7.04
Skorygowane [Na
+
]= 130 +7 = 137
mmol/l

OSZACOWANIE STĘŻENIA POTASU W
SUROWICY PRZY PRAWIDŁOWYM PH
Stężenie potasu będzie się zmniejszać o
0.6 mmol/l na każdy wzrost pH o 0.1
Np. przy [K
+
] 4,0 mmol/l i pH 7,4:
7.4 – 7.2 = 0.2
0.2 x 0.6 mmo/l = 1.2 mmol/l
4.0 mmol/l – 1.2 mmol/l = 2.8 mmol/l –
oczekiwane [K
+
] przy prawidłowym pH

OSMOLALNOŚĆ SUROWICY
Koreluje ze stanem świadomości
Oznaczana przy pomocy osmometru
Wyliczana z wyników badań:
OSM = 1,8 x [Na
+
] + [Glu] + [BUN] +
9
(mOsm/kg H
2
O)

OZNACZANIE CIAŁ
KETONOWYCH
Ciała ketonowe w moczu oznacza się przy
użyciu suchych testów paskowych metodą
opartą o reakcję z nitroprusydkiem sodu i
glicyną w środowisku alkalicznym. Metoda ta
oznacza tylko kwas acetooctowy nie
pozwalając na wykrywanie kwasu -
hydroksymasłowego.
Ilościowe oznaczanie stężenia kwasu β-
hydroksymasłowego w osoczu lub w pełnej
krwi włośniczkowej jest przydatne w
monitorowaniu leczenia cukrzycowej kwasicy
ketonowej.

Monitorowanie kwasicy ketonowej:
— ocena ciśnienia tętniczego, częstości tętna, liczby oddechów, stopnia
świadomości: co 1–2 godziny;
— bilans płynów: co 1–2 godziny;
— ocena ciepłoty ciała: co 8 godzin;
— oznaczenie glikemii: co 1 godzinę;
— oznaczenie stężenia sodu i potasu w surowicy co 4 godziny [należy
wyliczyć skorygowane stężeniesodu w surowicy wg wzoru: na każde
100 mg/dl (5,6 mmol/l) wartości glikemii wyższej od 100 mg/dl
(5,6 mmol/l) do aktualnego wyniku Na+ w surowicy należy dodać
1,6 mmol/l];
— w przypadku hiperkalemii > 5,5 mmol/l, gdy nie uzupełnia się potasu:
kontrola potasu po 2 godzinach, a po normalizacji — co 4 godziny;
— ocena gazometrii: co 4 godziny. W przypadku ciężkiej kwasicy
ketonowej (pH < 7,0) konieczna jest ocena gazometrii w krwi tętniczej
lub arterializowanej krwi włośniczkowej. Jeżeli istnieją wskazania do
podania wodorowęglanów (pH krwi tętniczej < 6,9)
— ponowna kontrola gazometrii po 1 godzinie;
— wyjściowe oznaczenie ketonów we krwi i/lub w moczu.
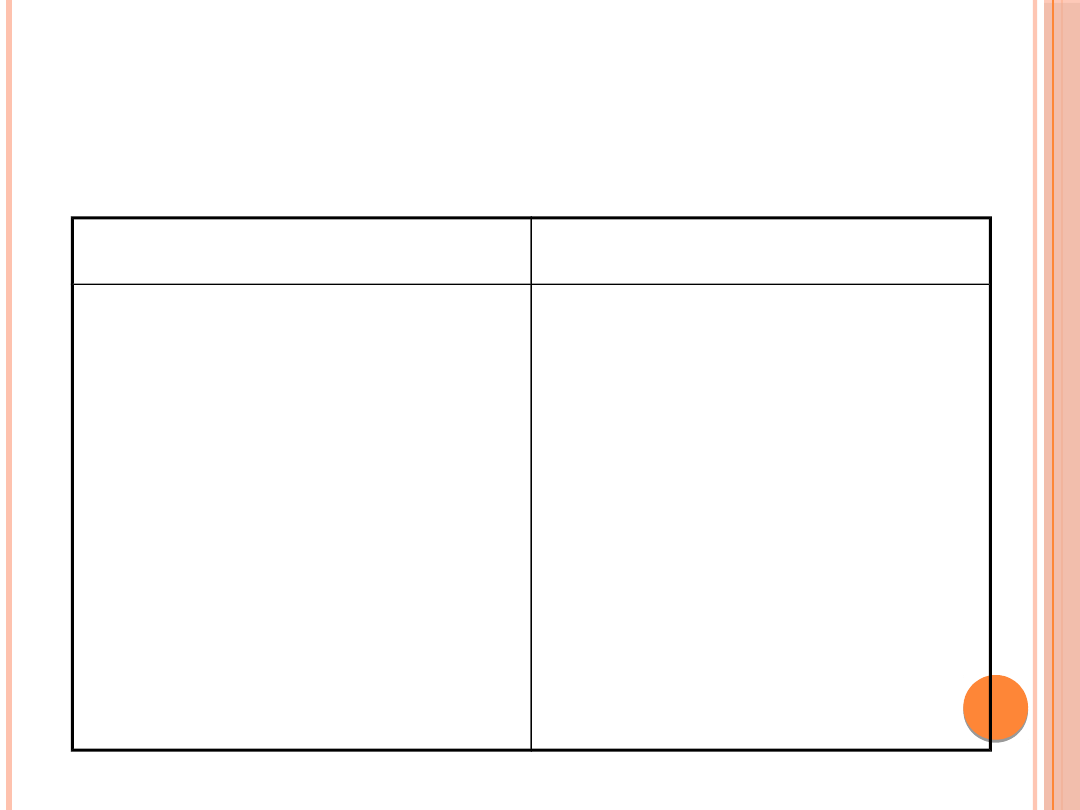
MONITOROWANIE LECZENIA
CKK
Leczenie
Monitorowanie
Obniżanie glikemii
(insulina i.v.)
Nawodnienie i
uzupełnienie
niedoboru
elektrolitów
Wyrównywanie
kwasicy (NaHCO
3
)
Glikemia,
ketonemia/ketonuria,
gazometria
Na
+
, K
+
, Cl
-
, Pi,
osmolalność,
mocznik, kreatynina
Gazometria

MONITOROWANIE LECZENIA
CKK
Badania przyłóżkowe: glikemia,
ketonemia/ketonuria
Badania w laboratorium/POCT:
gazometria, Na
+
, K
+
, Cl
-
, Pi,
osmolalność, mocznik, kreatynina,
morfologia
Częstość wykonywania badań:
30 min. – 6 godzin

Leczenie:
A. Nawodnienie chorego
B. Zmniejszanie hiperglikemii:
— insulinoterapia dożylna
C. Wyrównanie zaburzeń elektrolitowych:
— deficyt potasu u osoby z kwasicą ketonową wynosi
3–5 mmol/kg mc.;
— suplementacja potasu
D. Stosowanie wodorowęglanów — rozważyć tylko
w przypadku stwierdzenia pH < 6,9 w krwi tętniczej
(w małych dawkach, nie więcej niż 1 mmol/kg mc.)

Powikłania kwasicy ketonowej:
— wstrząs hipowolemiczny;
— ostra niewydolność nerek;
— obrzęk mózgu, częściej
występujący u dzieci.

STAN HIPERGLIKEMICZNO-
HIPERMOLALNY
Przyczyny:
— najczęściej w następstwie opóźnionego rozpoznania lub
nieadekwatnego leczenia cukrzycy typu 2, udaru mózgu lub
zawału serca, po spożyciu dużej ilości alkoholu, w wyniku
stosowania niektórych leków moczopędnych, u chorych na
przewlekłą niewydolność nerek, z chorobami psychicznymi i
objawami zakażenia.

Rozpoznanie
Laboratoryjne kryteria diagnostyczne zespołu
hiperglikemiczno-
hipermolalnego:
— glikemia > 600 mg/dl (> 33,3 mmol/l);
— pH > 7,30;
— stężenie wodorowęglanów w surowicy > 15,0 mmol/l;
— hipernatremia skorygowana (wyliczona wg wzoru)≥ 150
mmol/l;
— ciała ketonowe w surowicy: brak/ślad;
— efektywna osmolalność > 320 mOsm/kg H2O.
Molalność efektywna (mOsm/kg H2O) =
= 2 [Na+ (mmol/l)] + glikemia (mmol/l)
{2 [zmierzony Na (mEq/l)] + [glikemia (mg/dl)]/18}
Prawidłowa molalność osocza wynosi 280–300 mOsm/kg H2O.

ROZPOZNANIE NHZH – BADANIA
LABORATORYJNE
Glikemia , glukozuria
Gazometria prawidłowa
(bez ONN)
Luka anionowa N
Osmolalność surowicy
Na
+
, K
+
/N/
Kreatynina, BUN N/

Różnicowanie:
— śpiączka ketonowa;
— stany śpiączkowe w przebiegu chorób ośrodkowego układu
nerwowego;
— śpiączka mocznicowa;
— śpiączki w przebiegu zatruć.
Leczenie:
Zasady leczenia są zbliżone do terapii kwasicy ketonowej, z
wyjątkiem podawania wodorowęglanów:
— obniżenie glikemii
— normalizacja molalności osocza — stopniowe zmniejszanie
osmolalności
— podskórne podanie niskocząsteczkowej heparyny;
— wyrównanie niedoborów wody i elektrolitów
— stosowanie roztworu hipotonicznego
— monitorowanie glikemii i elektrolitów.
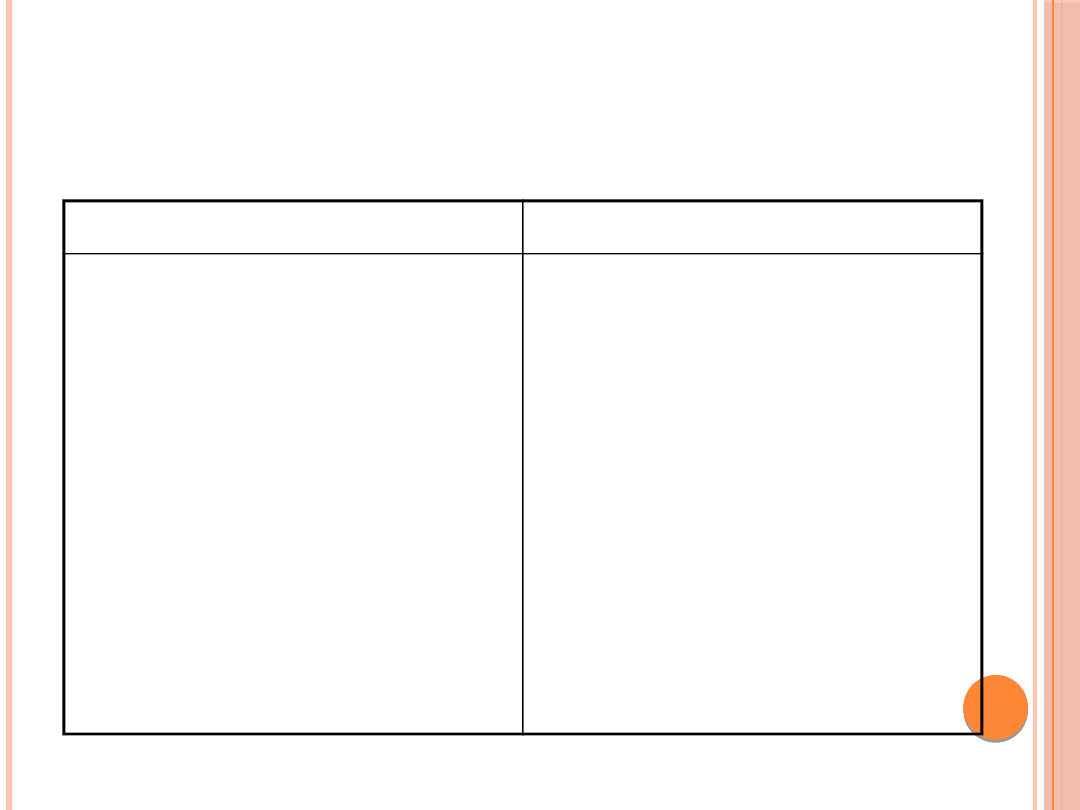
MONITOROWANIE LECZENIA
NHZH
Leczenie
Monitorowanie
Obniżanie glikemii
(insulina i.v.)
Nawodnienie i
uzupełnienie
niedoboru
elektrolitów
Glikemia
Na
+
, K
+
, Cl
-
, Pi,
osmolalność,
mocznik, kreatynina
KWASICA MLECZANOWA
Przyczyny:
— typ A powstaje w następstwie wstrząsu kardiogennego,
ciężkiego krwawienia, wstrząsu septycznego, ostrej i
przewlekłej niewydolności oddechowej (nie jest
charakterystyczny dla cukrzycy), ale 3/4 chorych na cukrzycę
umiera z powodu przyczyn sercowo-naczyniowych; zespół ten
może się zdarzyć u chorych na cukrzycę;
— typ B kwasicy występuje z innych przyczyn niż niedotlenienie.
Występuje u pacjentów chorych na cukrzycę, ze schorzeniami
wątroby, chorobami rozrostowymi, po zażyciu alkoholu
etylowego, biguanidów, salicylanów i alkoholu metylowego.

Laboratoryjne kryteria diagnostyczne:
— glikemia umiarkowanie podwyższona, ale może być
prawidłowa;
— obniżone pH krwi (< 7,30), stężenie
wodorowęglanów
< 10 mmol/l, luka anionowa > 16 mmol/l;
— stężenie mleczanów > 7 mmol/l;
— nie zmienia się stężenie sodu w surowicy krwi
(u alkoholików może być obniżone);
— zwykle zwiększenie stężenia potasu w surowicy krwi.

Leczenie:
— obejmuje następujące działania:
• przeciwdziałanie wstrząsowi (wyrównanie stanu
odwodnienia i hipowolemii, umiarkowane podawanie leków
obkurczających naczynia obwodowe);
• przeciwdziałanie hipoksemii i hipoksji;
• przeciwdziałanie nadmiernemu powstawaniu kwasu
mlekowego (wlew glukozy i insuliny pod kontrolą glikemii);
• alkalizacja poprzez podawanie wodorowęglanu sodu
(zapotrzebowanie: BE × 0,3 × masa ciała [w kg]);
• w uzasadnionych przypadkach (wskazania biochemiczne
i/lub kliniczne) konieczne jest leczenie nerkozastępcze.


DYSLIPIDEMIA ATEROGENNA –
ZASADY LECZENIA
LECZENIE
ZASADY OGÓLNE:
dążenie do uzyskowania docelowego stężenia LDL-C
wartości pożądane stężeń TG <1,7 mmol/l (150mg/dl),
HDL-C >1,0 mmol/l (40mg/dl) u mężczyzn i 1,3 mmol/l
(50 mg/dl) u kobiet.
w leczeniu podstawowe znaczenie mają metody
niefarmakologiczne (dieta, wysiłek fizyczny) i redukcja
masy ciała.

109
I. Rozpoznanie zaburzeń lipidowych
Wywiad obejmuje:
— ocenę sposobu odżywiania, spożywanie alkoholu;
— ocenę aktywności fizycznej — jej rodzaj, czas trwania;
— obecność chorób układu sercowo-naczyniowego:
choroby niedokrwiennej serca, chorób naczyń mózgowych
i obwodowych;
— ocenę występowania chorób tarczycy, wątroby, nerek — w
celu wykluczenia wtórnych postaci hiperlipidemii;
— występowanie u krewnych I stopnia zaburzeń lipidowych,
chorób
układu sercowo-naczyniowego, nadciśnienia
tętniczego,
cukrzycy;
— stosowanie leków mogących podwyższać stężenie lipidów.
DYSLIPIDEMIA ATEROGENNA –
ZASADY LECZENIA

110
parametr
Stęż. w surowicy
[mg/dl]
Stęż. w surowicy
[mmol/l]
TChol
< 175
< 4,5
HDL-Chol
> 40 (M) i > 50 (K)
> 1,0 (M) i > 1,3
(K)
LDL-Chol
< 100
cukrzyca + CSN <
70
< 2,6
< 1,9
TG
< 150
< 1,7
Chol
„nieHDL”
< 130
< 3,4
POŻĄDANE WARTOŚCI PARAMETRÓW
LIPIDOWYCH
DYSLIPIDEMIA ATEROGENNA –
ZASADY LECZENIA

DYSLIPIDEMIA ATEROGENNA –
ZASADY LECZENIA
Jeżeli pacjent leczony statynami nie uzyska
wartości docelowych,
stosując maksymalne,
tolerowane dawki statyn, alternatywnym
celem
terapeutycznym
jest
redukcja
stężenia
cholesterolu frakcji LDL o 50%
w stosunku do
wartości wyjściowej.
Stężenie cholesterolu frakcji LDL (LDL-C) można
obliczyć
ze wzoru Friedewalda, jeśli stężenie TG
w surowicy krwi wynosi poniżej
399 mg/dl
(< 4,5 mmol/l) i nie ma możliwości
bezpośredniego oznaczania stężenia LDL-C:
LDL-C
[mmol/l]
=
TC
[mmol/l]
–
HDL-C
[mmol/l]
–
TG/2,2
[mmol/l].

112
Kontrola i monitorowanie stężenia
lipidów
1. Cukrzyca typu 2:
—
oznaczenie lipidów
należy wykonać
w momencie
rozpoznania
cukrzycy,
a następnie
kontrola stężenia
lipidów powinna się odbywać raz w roku lub częściej,
w
zależności od ich wartości;
—
jeśli stężenia lipidów znajdują się powyżej normy,
zaleca się
kontrolę ich wartości co 8–12 tygodni,
od
momentu rozpoczęcia terapii, aż do osiągnięcia zalecanych
stężeń;
— jeżeli stężenia lipidów mieszą się
w zakresie pożądanych
wartości, badania kontrolne należy wykonywać raz w
roku;
— kontrola co 2 lata u osób charakteryzujących się
małym ryzykiem
rozwoju chorób układu sercowo-
naczyniowego
[
pacjenci ze stężeniami pożądanymi:
LDL-C < 2,6 mmol/l (< 100 mg/dl),
HDL-C > 1,0 mmol/l (> 40 mg/dl) u mężczyzn i > 1,3 mmol/l (> 50 mg/dl) u
kobiet, TG < 1,7 mmol/l (< 150 mg/dl) ].
Zasady leczenia dyslipidemii

113
Gdy stężenia lipidów świadczą o małym
ryzyku, zaleca się kontrolę stężenia
lipidów co 2–5 lat, zależnie od obecności
innych czynników ryzyka rozwoju chorób
układu sercowo-naczyniowego.
Zasady leczenia dyslipidemii
Cukrzyca typu 1
Kontrola i monitorowanie stężenia lipidów

DIAGNOSTYKA LABORATORYJNA
NEFROPATII CUKRZYCOWEJ
1. U chorych na cukrzycę w celu wykrycia lub
oceny stopnia zaawansowania nefropatii
cukrzycowej należy określić:
wydalanie albuminy z moczem,
stężenie kreatyniny w surowicy krwi
szacowaną wartość przesączania kłębuszkowego
(eGFR).
Albuminuria i eGFR stanowią niezależne
predyktory ryzyka sercowo-naczyniowego
oraz nerkowego u chorych na cukrzycę.

DIAGNOSTYKA LABORATORYJNA
NEFROPATII CUKRZYCOWEJ
2. Badanie przesiewowe polegające na
oznaczeniu albuminurii należy wykonywać w
następujący sposób:
— raz w roku; u chorych na cukrzycę typu 1 od 5.
roku trwania choroby; u chorych na cukrzycę typu
2 od momentu rozpoznania;
— poprzedza się je badaniem ogólnym moczu w
celu wykrycia/wykluczenia jawnego białkomoczu
lub zakażenia dróg moczowych; w przypadku
stwierdzenia jawnego białkomoczu oznaczanie
wydalania albumin nie jest konieczne.

DIAGNOSTYKA LABORATORYJNA
NEFROPATII CUKRZYCOWEJ
W celu oceny albuminurii należy:
— określić wskaźnik albumina/kreatynina (ACR,
albumin/ creatinine ratio) na podstawie wyników
ilościowych oznaczeń w jednorazowo pobranej
próbce moczu (optymalnie porannego)
lub
— wykonać badanie wydalania albuminy (AER,
albumin excretion rate,) na podstawie ilościowego
oznaczenia stężenia albuminy w próbce moczu ze
zbiórki 24-godzinnej lub nocnej.
Po uzyskaniu dodatniego wyniku badania AER należy je
powtórzyć 2-krotnie w ciągu 3–6 miesięcy. Uzyskanie 2
dodatnich wyników spośród 3 badań AER jest podstawą
rozpoznania albuminurii.
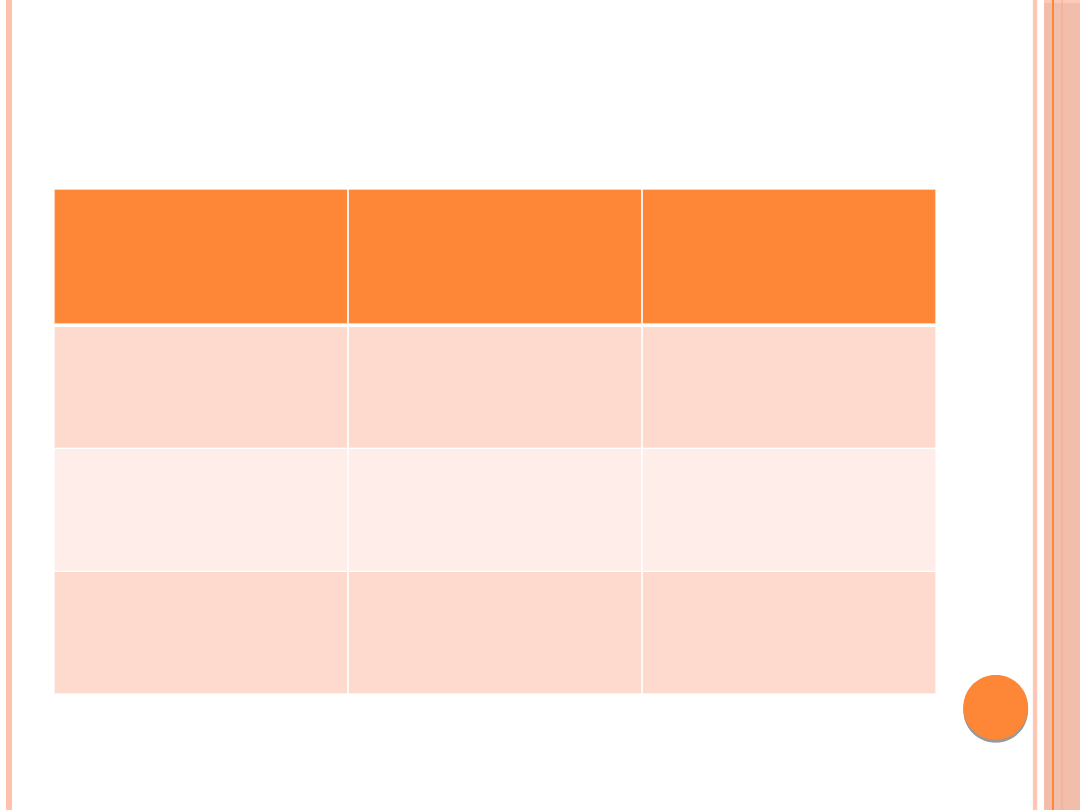
DEFINICJA NIEPRAWIDŁOWEGO
WYDALANIA ALBUMINY Z
MOCZEM
Kategoria
ACR (przygodna
próbka moczu)
[μg/mg lub mg/g
kreatyniny]*
Wydalanie
albuminy
[μg/min] —
zbiórka moczu
Prawidłowa
albuminuria
<30
<20
Zwiększona
albuminuria
30-299
20-200
Jawny białkomocz
≥ 300
≥ 200
*Ilość albuminy wydalanej z moczem w przeliczeniu na 1 g kreatyniny odpowiada w
przybliżeniu dobowej albuminurii, pozwalając jednocześnie na uniknięcie błędów związanych z
24-godzinną zbiórką moczu

PREWENCJA, DIAGNOSTYKA I
LECZENIE NEFROPATII CUKRZYCOWEJ
4. Stężenie kreatyniny we krwi należy
określić u chorych na cukrzycę
przynajmniej raz w roku, i to
niezależnie od wielkości wydalania
albuminy z moczem. Stężenie
kreatyniny należy wykorzystać do
określenia wartości eGFR

DIAGNOSTYKA LABORATORYJNA
NEFROPATII CUKRZYCOWEJ
5.Do określenia wartości filtracji kłębuszkowej należy
zastosować wzór MDRD:
— dla stężenia kreatyniny we krwi (Ckr) w mg/dl:
eGFR [ml/min/1,73 m2] = 186 × [Ckr]–1,154 × (wiek)–0,203 ×0,742
(dla kobiet)
eGFR [ml/min/1,73 m2] = 186 × [Ckr]–1,154 × (wiek)–0,203
(dla mężczyzn)
— dla stężenia kreatyniny we krwi (Ckr) w μmol/l:
eGFR [ml/min/1,73 m2] = 186 × [Ckr/88,4]–1,154 × (wiek)–0,203 × 0,742
(dla kobiet)
eGFR [ml/min/1,73 m2] = 186 × [Ckr/88,4]–1,154 × (wiek)–0,203
(dla mężczyzn)
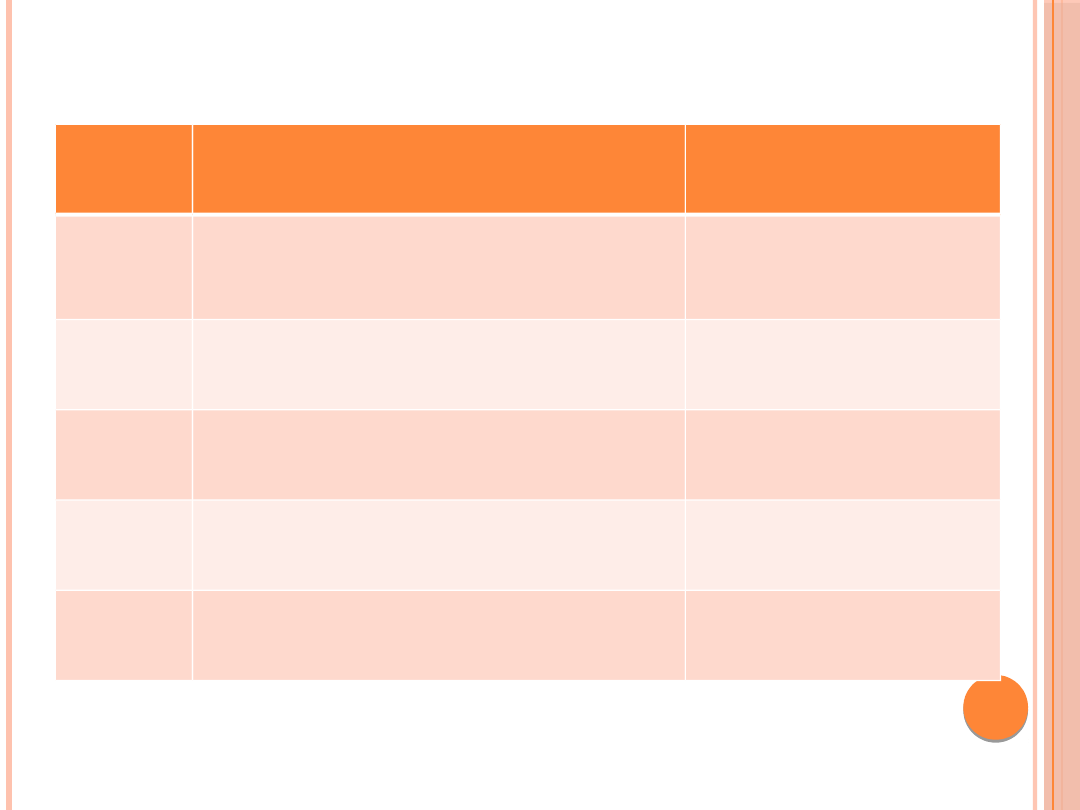
STADIA ZAAWANSOWANIA
PRZEWLEKŁEGO
USZKODZENIA NEREK
Stadiu
m
Opis
eGFR [ml/min/1,73
m2]
1
Uszkodzenie nerek* z
prawidłowym
lub podwyższonym eGFR
≥ 90
2
Uszkodzenie nerek* z łagodnie
obniżonym eGFR
60–89
3
Umiarkowane obniżenie eGFR
30–59
4
Znaczne obniżenie eGFR
15–29
5
Niewydolność krańcowa nerek
< 15
O uszkodzeniu nerek mówi się, jeżeli występują nieprawidłowości w składzie
biochemicznym i/lub osadzie moczu i/lub nieprawidłowe wartości wskaźników
uszkodzenia nerek we krwi i/lub w badaniach obrazowych nerek albo dróg moczowych

DIAGNOSTYKA LABORATORYJNA
NEFROPATII CUKRZYCOWEJ
6. Zaleca się coroczną ocenę albuminurii u chorychn z
rozpoznanym zwiększonym wydalaniem albumin.
7. Jeśli eGFR obniży się do wartości < 60 ml/min/1,73m2
lub wystąpią trudności dotyczące leczenianadciśnienia
tętniczego, należy rozważyć skierowaniechorego na
konsultację nefrologiczną. Jeśli eGFR zmniejszy się do
wartości < 30 ml/min/1,73 m2, konsultacja
nefrologiczna jest obowiązkowa.
U chorych z krótkim czasem trwania cukrzycy typu 2 oraz bez
zmian na dnie oka należy rozważyć diagnostykę nefrologiczną
białkomoczu
.
CUKRZYCOWA CHOROBA OCZU
Najczęściej występującą i najcięższą, bo
zagrażającą utratą wzroku, jest retinopatia
cukrzycowa.
Spośród pozasiatkówkowych powikłań
cukrzycowych
największe znaczenie kliniczne mają :
zaćma cukrzycowa,
jaskra wtórna (krwotoczna)
neuropatia w układzie wzrokowym.

CUKRZYCOWA CHOROBA OCZU
Czynniki ryzyka rozwoju i progresji retinopatii cukrzycowej
1. Czas trwania cukrzycy — najsilniejszy czynnik prognostyczny
rozwoju i progresji retinopatii cukrzycowej
2. Niewyrównanie metaboliczne cukrzycy:
— intensywne leczenie zmniejsza ryzyko rozwoju i progresji
retinopatii u chorych na cukrzycę typu 1;
— intensywne leczenie cukrzycy typu 2 zmniejsza częstość
powikłań o charakterze mikroangiopatii, a obniżenie odsetka
HbA1c o 1% powoduje znaczną redukcję ryzyka rozwoju
mikroangiopatii.
3. Nadciśnienie tętnicze
4. Zaburzenia gospodarki lipidowej
5. Nefropatia cukrzycowa
6. Okres ciąży u kobiet chorujących na cukrzycę
7. Okres dojrzewania
8. Operacja zaćmy

NEUROPATIA CUKRZYCOWA
Neuropatia cukrzycowa jest przyczyną
silnych dolegliwości, znacząco pogarsza
jakość życia chorych i jest uznanym
czynnikiem ryzyka rozwoju między innymi
zespołu stopy cukrzycowej oraz nagłego
zgonu.
Kliniczny podział neuropatii:
— uogólnione symetryczne polineuropatie
— ogniskowe i wieloogniskowe neuropatie

NEUROPATIA CUKRZYCOWA
Zasady wykonywania badań w kierunku
neuropatii:
o
częstość wykonywania badań:
cukrzyca typu 1 — po 5 latach od momentu
zachorowania, o ile wcześniej nie występują objawy
sugerujące występowanie neuropatii,
cukrzyca typu 2 — w momencie rozpoznania choroby,
ocena występowania objawów neuropatii cukrzycowej
— co najmniej raz w roku;
o
należy wykluczyć inną, niecukrzycową etiologię
uszkodzenia obwodowego układu nerwowego (po
konsultacji neurologicznej).

DIAGNOSTYKA I LECZENIE ZESPOŁU
STOPY CUKRZYCOWEJ (ZSC)
Definicja
Stopa cukrzycowa to zakażenie i/lub owrzodzenie
i/lub destrukcja tkanek głębokich stopy (np. kości)
spowodowane uszkodzeniem nerwów obwodowych
i/lub naczyń stopy o różnym stopniu zaawansowania.
Z definicji tej wynika podział na stopę cukrzycową:
neuropatyczną,
naczyniową
mieszaną.

DIAGNOSTYKA I LECZENIE ZESPOŁU
STOPY CUKRZYCOWEJ (ZSC)
Diagnostyka zespołu stopy cukrzycowej
obejmuje:
ocenę występowania polineuropatii obwodowej,
zaburzeń ukrwienia kończyn dolnych,
zmian deformacyjnych
innych czynników ryzyka uszkodzenia stopy.
Wskazane jest oglądanie stóp chorego przez lekarza
w trakcie każdej wizyty

DIAGNOSTYKA I LECZENIE ZESPOŁU
STOPY CUKRZYCOWEJ (ZSC)
Infekcje w przebiegu stopy cukrzycowej
1. Rozpoznanie zakażenia opiera się przede wszystkim na obrazie
klinicznym, a nie jedynie na wyniku badania mikrobiologicznego.
2. Ocena ciężkości infekcji
3. Badanie mikrobiologiczne (wraz z antybiogramem) i jego
interpretacja (kolonizacja, kontaminacja, zakażenie):
— wskazane pobieranie po oczyszczeniu rany fragmentu tkanek,
aspiratu, wyskrobin na posiew;
— wskazane w przypadku obecności klinicznie zakażonej rany;
— interpretacja posiewu w ocenie infekcji jest trudna, zaleca się
przede wszystkim uwzględnienie obrazu klinicznego;
— posiew krwi zalecany jest wyłącznie w przypadku występowania
objawów ogólnych zakażenia
— w przypadku obecności ran klinicznie niezakażonych lub z
zakażeniem o niewielkim nasileniu, jeżeli nie stosowano wcześniej
antybiotyków — dopuszcza się możliwość niewykonywania posiewu.

DIAGNOSTYKA I LECZENIE ZESPOŁU
STOPY CUKRZYCOWEJ (ZSC)
Badania laboratoryjne w kierunku zapalenia kości
(należy wykonać w każdym przypadku zakażonego
owrzodzenia, zwłaszcza o długim czasie trwania):
— wartość OB > 70 mm/godz. zwiększa
prawdopodobieństwo występowania zapalenia kości;
niższe poziomy oznaczają mniejsze ryzyko.
— pomocne może być również oznaczania CRP i
leukocytozy
Prawidłowe wyniki badań laboratoryjnych nie wykluczają w
pełni możliwości istnienia stanu zapalnego kości.

CUKRZYCA A CIĄŻA
Cukrzyca w ciąży może występować jako:
1. Cukrzyca przedciążowa (PGDM, pregestational diabetes
mellitus) — gdy w ciążę zachodzi kobieta chorująca już na
cukrzycę (niezależnie od typu choroby).
2. Hiperglikemia po raz pierwszy rozpoznana w trakcie ciąży.
Czynniki ryzyka hiperglikemii w ciąży
— ciąża po 35. roku życia
— w wywiadzie porody dzieci o dużej masie ciała (> 4000 g)
— urodzenie noworodka z wadą rozwojową
— zgony wewnątrzmaciczne w wywiadzie
— nadciśnienie tętnicze
— nadwaga lub otyłość
— rodzinny wywiad w kierunku cukrzycy typu 2
— rozpoznanie cukrzycy ciążowej w poprzednich ciążach
— wielorództwo
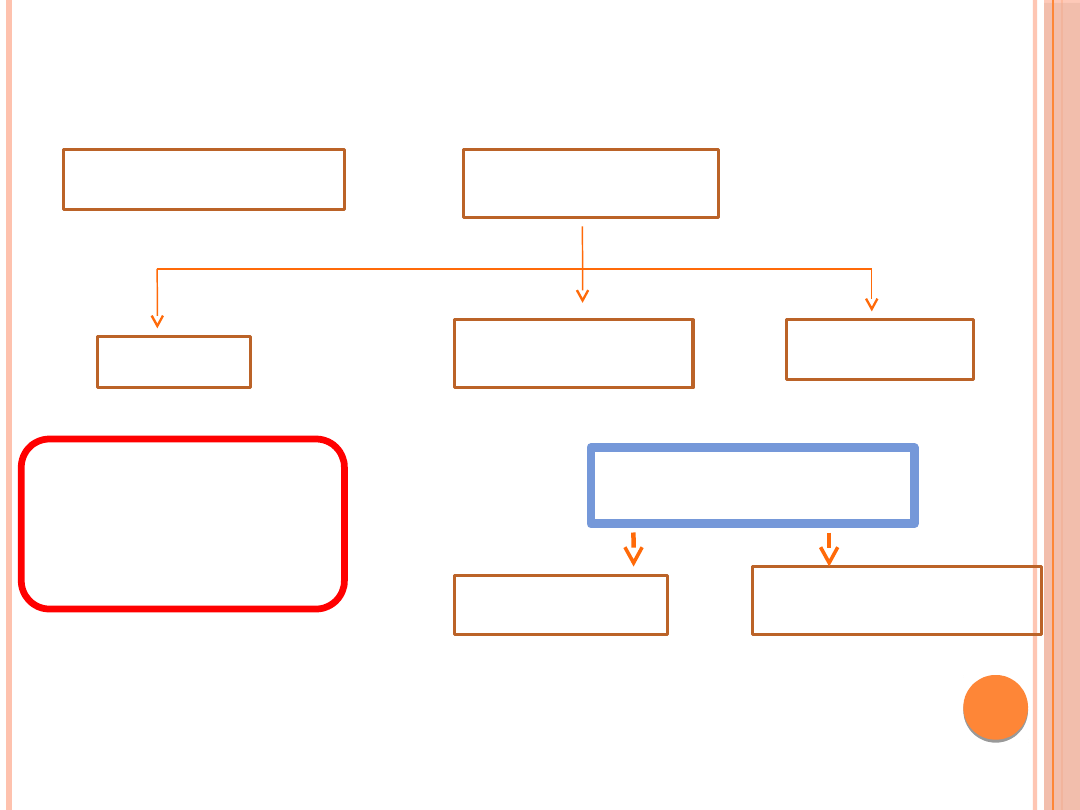
WYKRYWANIE CUKRZYCY U KOBIET W CIĄŻY
Pierwsza wizyta
u ginekologa podczas
ciąży
Wstępne
oznaczenie
glukozy na czczo
< 92
mg/dl
92–125
mg/dl
> 125
mg/dl
•Zaplanować diagnostykę
w 24.–28. tygodniu ciąży
•Grupa ryzyka — jak
najszybciej
wykonać 75 g OGTT.
Jeżeli wynik testu prawidłowy
— diagnostyka w 24.–28.
tygodniu ciąży
Wynik
nieprawidłowy
Pilnie wykonać
75 g OGTT
Pilnie powtórzyć
oznaczenie glikemii na
czczo
W razie potwierdzenia nieprawidłowych wartości
glikemii skierować pacjentkę do ośrodka leczącego
cukrzyce wikłająca ciąże

KRYTERIA ROZPOZNANIA CUKRZYCY CIĄŻOWEJ NA
PODSTAWIE WYNIKÓW 75 G OGTT WEDŁUG IADPSG 2010 I
WHO 2013
Hiperglikemia po raz pierwszy rozpoznana w trakcie
ciąży powinna być rozpoznawana i klasyfikowana
według zaleceń WHO (2013):
— Cukrzyca w ciąży — gdy spełnione są warunki ogólne
rozpoznania cukrzycy, to znaczy:
• glikemia na czczo ≥ 7,0 mmol/l (126 mg/dl)
• lub glikemia w 2. godz. 75 g OGTT ≥ 11,1 mmol/l (200 mg/dl),
• lub glikemia przygodna ≥ 12,5 mmol/l (200 mg/dl) i towarzyszą
jej objawy kliniczne hiperglikemii.
— Cukrzyca ciążowa (GDM, gestational diabetes mellitus) — gdy
spełnione jest przynajmniej jedno z kryteriów wymienionych

CUKRZYCA A CIĄŻA
Kobiety w ciąży powinny wykonywać pomiary glikemii
samodzielnie, po odpowiednim przeszkoleniu przez
pielęgniarkę posiadającą doświadczenie w opiece nad
chorymi na cukrzycę.
Stężenie HbA1c u kobiet z cukrzycą przedciążową należy
oznaczać co 6 tygodni i dążyć do wartości < 6,0%.
Brak dowodów na użyteczność HbA1c jako
narzędzia monitorowania kontroli metabolicznej w
cukrzycy ciężarnych.
Document Outline
- Slide 1
- ZESPÓŁ METABOLICZNY
- ZESPÓŁ METABOLICZNY
- Slide 4
- ZESPÓŁ METABOLICZNY
- Slide 6
- Slide 7
- ZESPÓŁ METABOLICZNY
- ZESPÓŁ METABOLICZNY
- OTYŁOŚĆ
- Slide 11
- Slide 12
- OTYŁOŚĆ
- OTYŁOŚĆ
- TYPY OTYŁOŚCI
- OTYŁOŚĆ
- Slide 17
- PRZYCZYNY OTYŁOŚCI
- choroby związane z otyłością
- choroby związane z otyłością
- choroby związane z otyłością
- Slide 22
- FRUKTOZEMIA
- METABOLIZM FRUKTOZY
- OBJAWY FRUKTOZEMII
- KONSEKWENCJE FRUKTOZEMII
- FRUKTOZEMIA
- FRUKTOZEMIA W BADANIACH LABORATORYJNYCH
- TERAPIA DIATĄ
- ROZPOZNANIE FRUKTOZEMII
- GALAKTOZEMIA
- GALAKTOZEMIA
- Galaktozemia
- GALAKTOZEMIA KLASYCZNA
- OBJAWY KLINICZNE KLASYCZNEJ GALAKTOZEMII
- ZABURZENIA CZYNNOŚCI WĄTROBY W PRZEBIEGU GALATKOZEMII
- OBJAWY GALAKTOZEMII
- Diagnostyka laboratoryjna deficytu GALT
- Rozpoznanie galaktozemii
- Wskazania do leczenia dietetycznego w galaktozemii
- Podstawą rozpoznania galaktozemii klasycznej jest
- Rozpoznanie galaktozemii klasycznej
- Slide 43
- Rozpoznanie galaktozemii (badanie molekularne)
- laktozemia
- NIETOLERANCJA LAKTOZY
- Slide 47
- WRODZONY NIEDOBÓR LAKTAZY - ALAKTAZJA
- wtórny niedobór laktazy
- wtórny niedobór laktazy
- PIERWOTNY niedobór laktazy
- ROZPOZNANIE NIETOLERANCJI LAKTOZY I HIPOLAKTAZII
- ROZPOZNANIE NIETOLERANCJI LAKTOZY
- Slide 54
- CUKRZYCA
- Slide 56
- zaburzenia glikemii
- cukrzyca typu i
- cukrzyca typu ii
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Zasady rozpoznawania zaburzeń gospodarki węglowodanowej
- określenie wartości docelowych w leczeniu cukrzycy
- Monitorowanie przebiegu leczenia i ocena wyrównania glikemii
- Monitorowanie przebiegu leczenia i ocena wyrównania glikemii
- Monitorowanie przebiegu leczenia i ocena wyrównania glikemii
- Zalecana częstość samokontroli glikemii
- DOBOWY PROFIL GLIKEMII
- BIAŁKA GLIKOWANE
- oznaczenie hemoglobiny glikowanej
- oznaczenie hemoglobiny glikowanej
- Kryteria wyrównania gospodarki węglowodanowej
- Slide 75
- GLIKOWANA ALBUMINA - FRUKTOZAMINA
- CIAŁA KETONOWE I GLUKOZA W MOCZU
- CIAŁA KETONOWE
- Zalecenia dotyczące monitorowania dorosłych chorych na cukrzycę
- Hipoglikemia
- ROZPOZNANIE HIPOGLIKEMII – TRIADA WHIPPLE’A
- Hipoglikemia
- Hipoglikemia
- Slide 84
- Kwasica ketonowa
- W CKK WSPÓŁISTNIEJĄ:
- OBJAWY CKK
- Kwasica ketonowa
- ROZPOZNANIE CKK – BADANIA LABORATORYJNE
- KOREKTA STĘŻENIA SODU W SUROWICY
- Oszacowanie stężenia potasu w surowicy przy prawidłowym pH
- OSMOLALNOŚĆ SUROWICY
- Oznaczanie ciał ketonowych
- Slide 94
- MONITOROWANIE LECZENIA CKK
- MONITOROWANIE LECZENIA CKK
- Slide 97
- Slide 98
- Stan hiperglikemiczno-hipermolalny
- Slide 100
- ROZPOZNANIE NHZH – BADANIA LABORATORYJNE
- Slide 102
- MONITOROWANIE LECZENIA NHZH
- Kwasica mleczanowa
- Slide 105
- Slide 106
- Slide 107
- DYSLIPIDEMIA ATEROGENNA – ZASADY LECZENIA
- Slide 109
- Slide 110
- DYSLIPIDEMIA ATEROGENNA – ZASADY LECZENIA
- Slide 112
- Slide 113
- diagnostyka laboratoryjna nefropatii cukrzycowej
- diagnostyka laboratoryjna nefropatii cukrzycowej
- diagnostyka laboratoryjna nefropatii cukrzycowej
- Definicja nieprawidłowego wydalania albuminy z moczem
- Prewencja, diagnostyka i leczenie nefropatii cukrzycowej
- diagnostyka laboratoryjna nefropatii cukrzycowej
- Stadia zaawansowania przewlekłego uszkodzenia nerek
- diagnostyka laboratoryjna nefropatii cukrzycowej
- Cukrzycowa choroba oczu
- Cukrzycowa choroba oczu
- neuropatia cukrzycowa
- neuropatia cukrzycowa
- Diagnostyka i leczenie zespołu stopy cukrzycowej (ZSC)
- Diagnostyka i leczenie zespołu stopy cukrzycowej (ZSC)
- Diagnostyka i leczenie zespołu stopy cukrzycowej (ZSC)
- Diagnostyka i leczenie zespołu stopy cukrzycowej (ZSC)
- Cukrzyca a ciąża
- Wykrywanie cukrzycy u kobiet w ciąży
- Slide 132
- Cukrzyca a ciąża
Wyszukiwarka
Podobne podstrony:
Diagnostyka laboratoryjna zaburzen gospodarki lek 2010
Diagnostyka laboratoryjna zaburzen gospodarki lek 2010
zaburzenia erytropoezy, wydział lekarski - materiały, Diagnostyka laboratoryjna
Weglowodany konspekt, MEDYCZNA DIAGNOSTYKA LABORATORYJNA
Diagnostyka laboratoryjna chorób serca i mięśni poprzecz (2)
Naturalne źródła węglowodorów i ich pochodne
DIAGNOSTYKA I TERAPIA ZABURZEŃ PSYCHOSOMATYCZNYCH 2
Diagnostyka laboratoryjna w toku modernizacji
diagnostyka laboratoryjna stwardnienia rozsianego
Diagnostyka Laboratoryjna hemostaza
3dgn pokarmowy, Medycyna, Diagnostyka Laboratoryjna (pajro)
Wyklad 8, III rok, Diagnostyka laboratoryjna, Wykłady diagnostyka
diagnostyka, Medycyna, Diagnostyka Laboratoryjna (pajro)
koło1-materiał, BIO, Diagnostyka Laboratoryjna, Immunologia, Immunohematologia
nerka-materialy, III rok, Diagnostyka laboratoryjna, Koło 1
więcej podobnych podstron