
Inhibitory
enzymów
stosowane w
leczeniu
Agata Chudzik
Gr. I

Inhibicja - zahamowanie lub
opóźnienie jakiegoś procesu w
wyniku zastosowania inhibitora,
czyli substancji hamującej
przebieg danej reakcji.
Inhibitor
kompetyc
yjny
Inhibitor
kompetyc
yjny
Inhibitor
niekompety
cyjny
Inhibitor
niekompety
cyjny

Inhibicja allosteryczna
Polega na odwracalnej zmianie kinetyki
reakcji enzymatycznej pod wpływem
związku (ligandu), który może przyłączać
się do enzymu w miejscu innym niż
substrat, nazwanym
centrum
allosterycznym
; ligand taki powoduje
zmiany konformacyjne enzymu
podlegającego regulacji, która może
polegać na inhibicji lub indukcji (aktywność
enzymu wzrasta po przyłączeniu ligandu
do centrum allosterycznego).

Karbamoilotransweraza
asparaginianowa
1. Katalizuje pierwszy etap syntezy nukleotydów
pirymidynowych, polegający na wiązaniu
karbamoilofosforanu z asparaginianem
2. Powstaje produkt końcowy, nukleotyd
trifosforanowy-
cytydynotrifosforan (CTP)
– efektor allosteryczny ujemny,
hamuje aktywnośc karbamoilotransferazy asparaginianowej
3. Adenozynotrifosforan (ATP) jest aktywatorem
allosterycznym, zwiększa powinowactwo enzymów do
substratów
4. Karbamoilotransferaza asparaginianowa składa się z 3
podjednostek katalitycznych i 3 regulacyjnych (postac T-
mało aktywna, postac R- bardziej aktywna)
5. Efektory allosteryczne oddziałują na podjednostki
regulacyjne.

Enzymy mogą ulegać inhibicji
przez specyficzne cząsteczki
Inhibicja aktywności enzymatycznej
przez cząsteczki lub jony służy jako:
główny mechanizm kontroli w
układach biologicznych
narzędzie badawcze, służące do
wyjaśnienia mechanizmu działania
enzymu
identyfikacja reszt kluczowych dla
katalizy
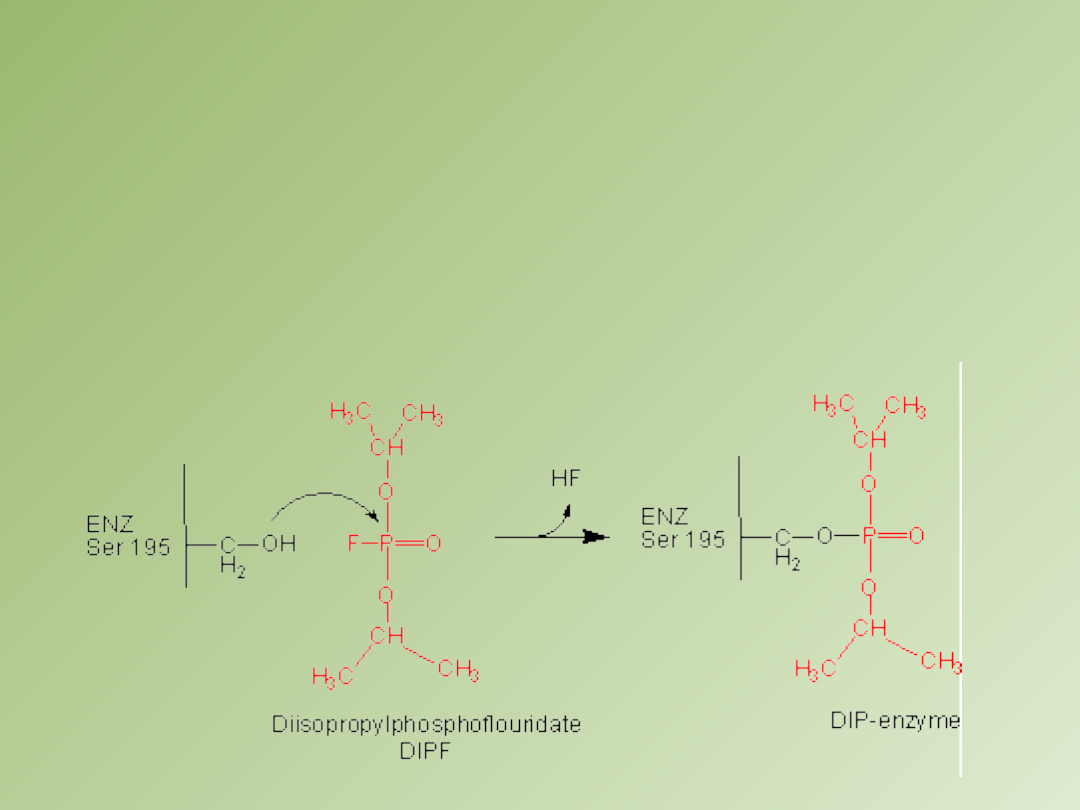
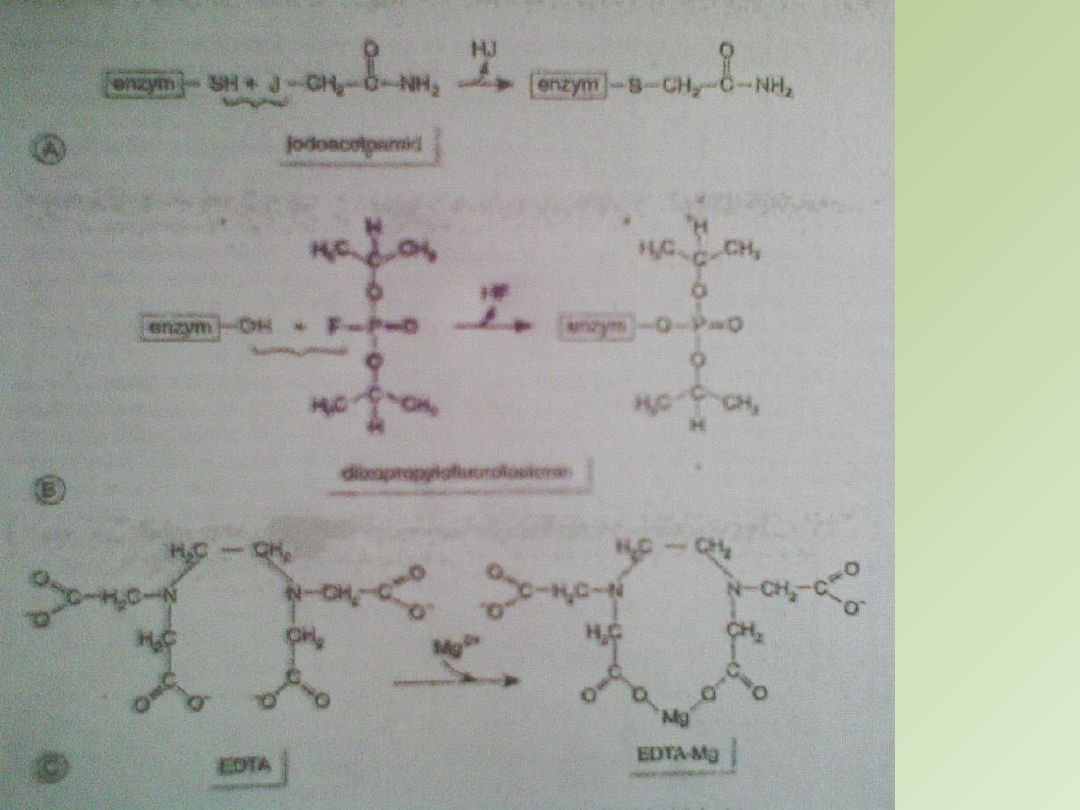
Inhibicja nieodwracalna
– inhibitor łączy się kowalencyjnie z enzymem lub wiąże się z nim tak
silnie, ze jego dysocjacja jest bardzo powolna, np. działanie gazów paraliżujących układ nerwowy
polega na zatruciu acetylocholinoesterazy, diizopropylofluorofosforan reaguje z resztą seryny w
miejscu aktywnym enzymu tworząc nieaktywną diizopropylofosforylową pochodną enzymu

Inhibicja odwracalna –
charakteryzuje ją
szybka
dysocjacja
kompleksu enzym-inhibitor; polega na
współzawodnictwie, inhibitora
strukturalnie podobnego do substratu
z cząsteczkami substratu o wiązanie
się z miejscem aktywnym enzymu
(kompetycyjna) albo na wiązaniu się
inhibitora niekompetycyjnego z
miejscami innymi niż miejsce aktywne,
co zmniejsza szybkość katalityczną
enzymu przez zmianę konformacyjną
jego cząsteczki (niekompetycyjna,
allosteryczna).

Inhibitor kompetycyjny
strukturalnie podobny do substratu (
analogi
substratu
)
wiąże się z enzymem w jego
miejscu
aktywnym
obniża powinowactwo enzymu do substratu
odwracalna
poprzez zwiększenie stężenia
substratu
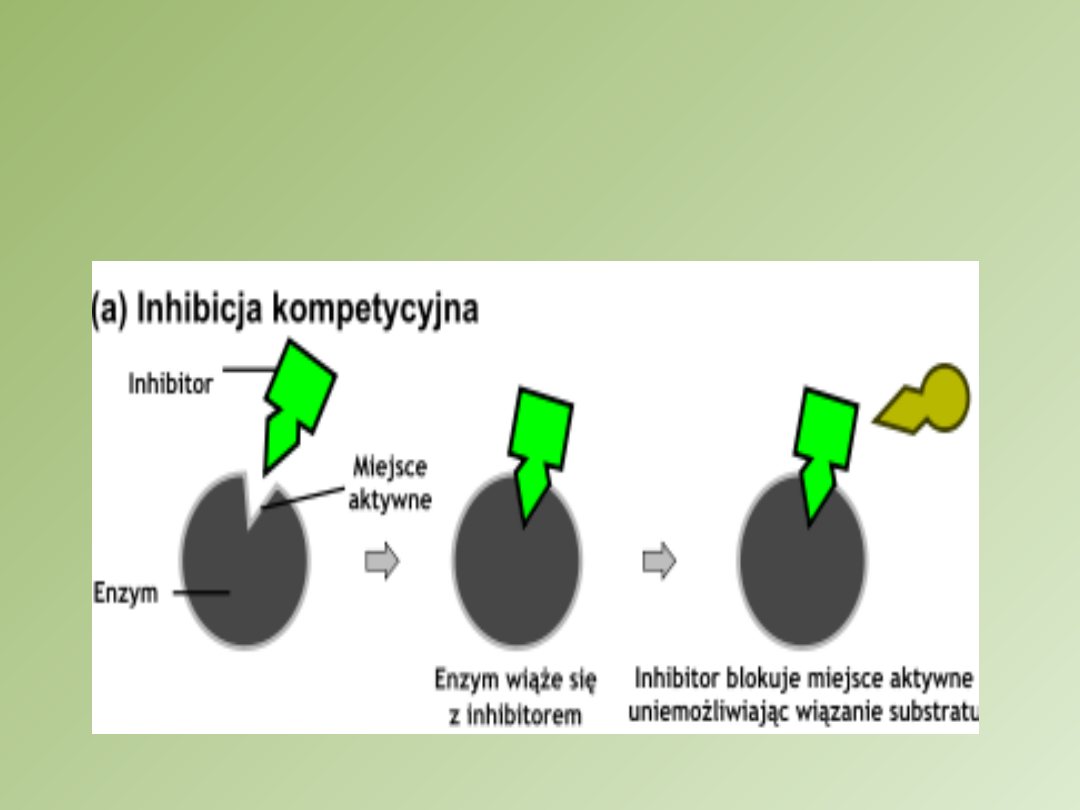
Inhibitor kompetycyjny

Hamowanie aktywności
dehydrogenazy bursztynianowej
1. Inhibitor =
malonian
2. Malonian utlenia bursztynian do fumaranu
3. Zarówna bursztynian jak i malonian mogą przyłączyć się do
miejsca aktywnego dehydrogenazy bursztynianowej tworząc
odpowiednio kompleks, ES lub EI
4. Dehydrogenaza bursztynianowa katalizuje usunięcie po
jednym atomie wodoru z każdego z dwóch atomów węgla
grup metylenowych bursztynianu
5. Malonian nie podlega odwodornieniu, ponieważ zawiera jedna
grupę metylenową
6. Inhibitotem wobec dehydrogenazy bursztynianowej może być
również szczawian lub szczawiooctan
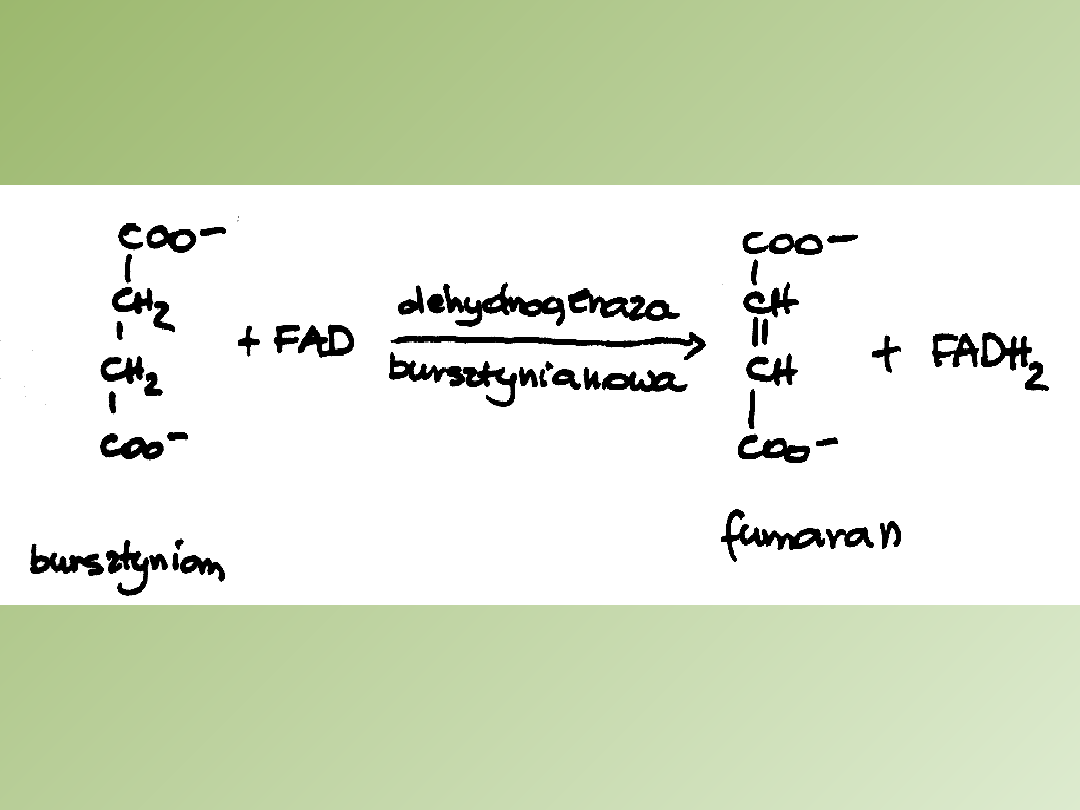

W obecności zarówno inhibitora jak i substratu
następuje
zjawisko konkurencji
o miejsce
aktywne enzymu.
Zwiększenie stężenia substratu w układzie
reagującym prowadzi do wypiernia inhibitora
kompetycyjnego z miejsca aktywnego enzymu.
Reakcja osiąga prędkośc maksymalną, taką jak w
układzie bez inhibitora, ale przy wyższym stężeniu
substratu.
Stężenie substratu odpowiednie do całkowitego
zniesienia hamowania zależy od stężenia obecnego
inhibitora, jego powinowactwa do enzymu.

Inhibitor
niekompetycyjny
1. Nie jest podobny do substratu
2. Wiąże się z enzymem poza jego miejscem
aktywnym
3. Zniekształca cząsteczkę białka enzymatycznego
w sposób zmniejszający jego aktywność
katalityczną
4. Nie zmienia powinowactwa enzymu do substratu
5. Obniża prędkość maksymalną reakcji
6. Nieodwracalna przez zwiększenie stężenia
substratu
7. Powstaje kompleks trójskładnikowy: enzym,
substrat, inhibitor niekompetycyjny
8. Substrat jest wiązany, ale jego przekształcenie
zostaje spowolnione
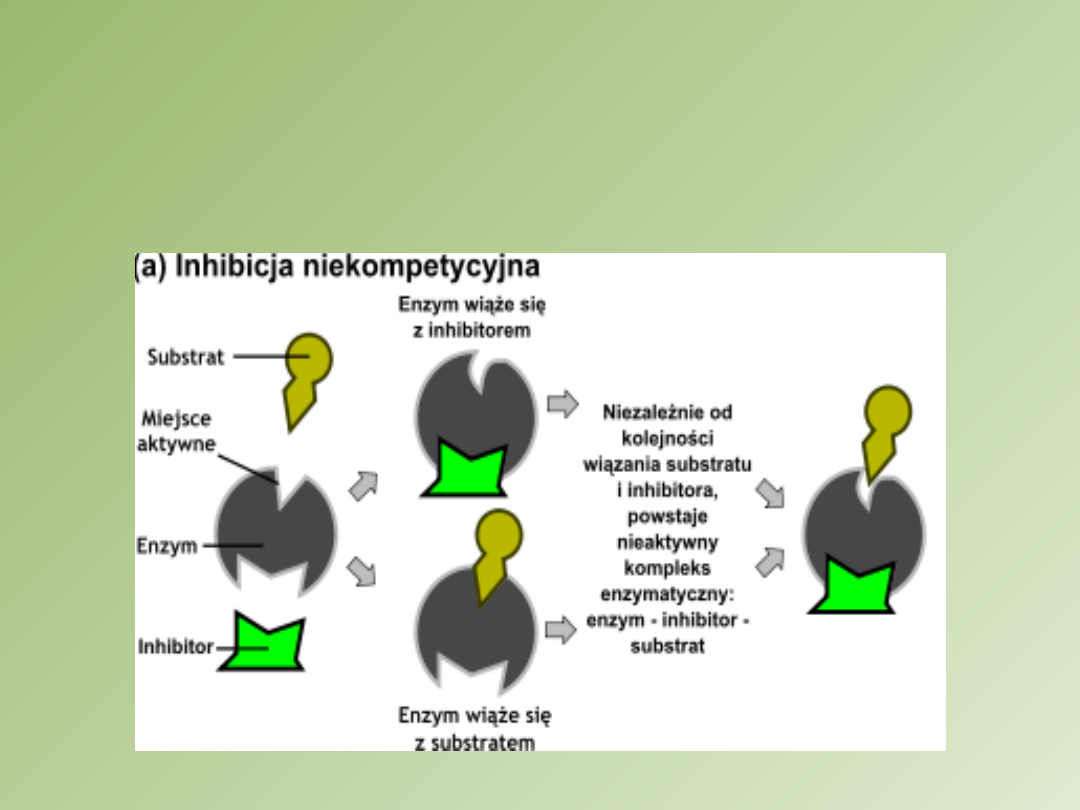
Inhibicja
niekompetycyjna

Najczęstrzymi inhibitorami są:
A
-
jodoacetoamid
– reaguje z grupami –SH reszt cysteinylowych
B
-
diizopropylofluorofosforan
– reaguje z gr. –OH reszt
serylowych białek enzymatycznych
C
- kationy metali ciężkich – wiązanie jonów Mg przez
etylenodiaminotetraoctan (EDTA)

Analogi stanu przejściowego są
silnymi inhibitorami enzymów
Związek przypominający stan przejściowy
katalizowanej reakcji jest efektywnym inhibitorem
enzymu; przykładem jest hamowanie racemazy
prolinowej.
Analogi stanu przejściowego pozwalają na wgląd
w mechanizmy katalityczne, mogą służyć jako
specyficzne inhibitory enzymów oraz jako
immunogeny do wytwarzania nowych
katalizatorów.
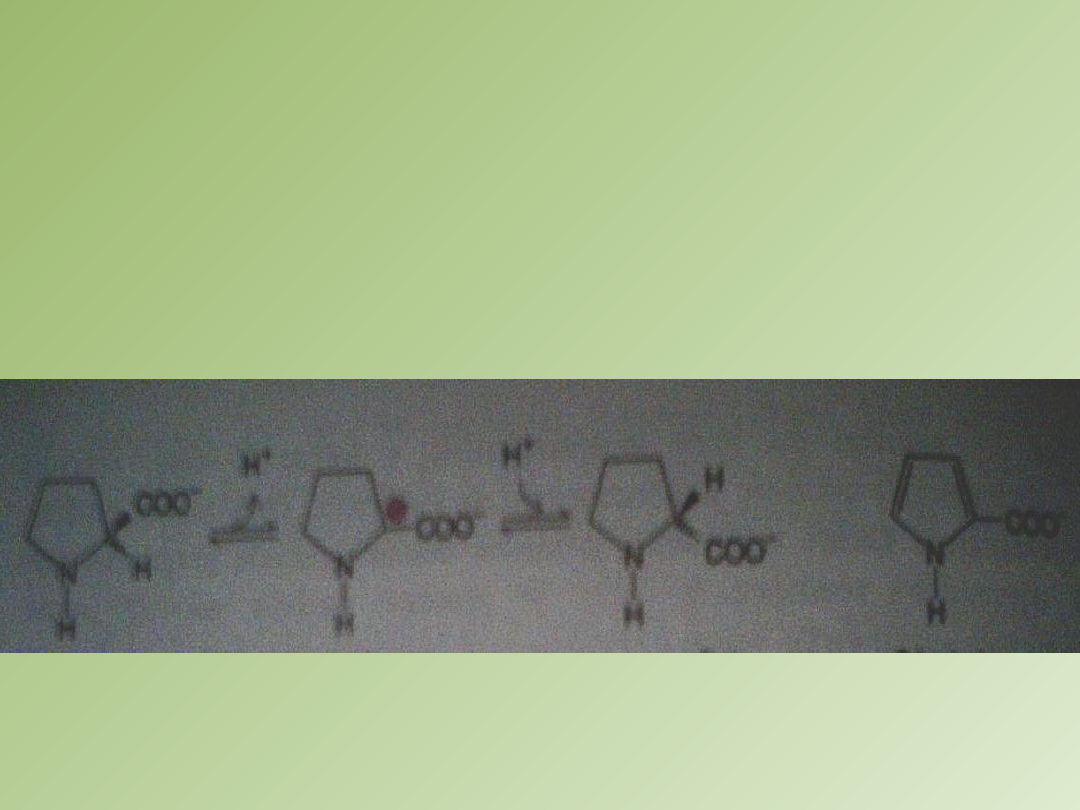
Racemizacja proliny zachodzi poprzez stan przejściowy, w którym
tetraedralny atom C alfa przez utratę protonu staje się trygonalny.
W tej formie wszystkie wiązania leżą w jednej płaszczyźnie.
Węgiel alfa niesie ujemny ładunek [karboanion].
Karboanion może zpstac ponownie uprotonowany po jednej stronie
dając L izomer lub po obu stronach dając D izomer.
2-karboksypirol wiąże się z racemazą 160 razy silniej niż prolina
.
L-prolina
Polarny stan
przejściowy
D-prolina
2-karboksypirol

Regulacja przez naturalne
inhibitory
1. Aktywacja trypsynogenu do trypsyny polega na
hydrolitycznym odłączeniu fragmentu jego
cząsteczki; proces nieodwracalny
2. Unieczynnienie tego enzymu zachodzi poprzez
tworzenie kompleksu z trzustkowym inhibitorem
trypsyny (wiąże się on trwale z miejscem
aktywnym enzymu)
3. Antyelastaza –inhibitor unieczynniający proteazy
osoczowe, przede wszystkim elastazę
4. Niedobór lub uszkodzenie tego inhibitora sprzyja
rozkładowi elastyny w tkance płucnej i prowadzi
do rozedmy płuc

Praktyczne znaczenie
inhibitorów enzymatycznych
1. Gazy bojowe (iperyt, luizyt, tabun, sarin)
2. Inhibitory o właściwościach bakteriobójczych,
owadobójczych, chwastobójczych, grzybobójczych,
umożliwiło zmniejszenie rozprzestrzeniania się
niektórych chorób roznoszonych przez owady i
pajęczaki, np. dur plamisty, odkleszczowe
zapalenie mózgu i opon mózgowo-rdzeniowych,
boreliozy, malarii, żółtej gorączki, śpiączki
afrykańskiej
3. Zmalało występowanie chorób przenoszonych
przez gryzonie, np. dżuma, leptospiroza
4. Inhibitory o właściwościach owadobójczych
niszczą stonkę ziemniaczaną, szarańczę, mszyce
5. Inhibitory to też leki o działaniu
przeciwbakteryjnym, przeciwgrzybiczym,
przeciwwirusowym, przeciwzakrzepowym,
przeciwzapalnym i przeciwnowotworowym
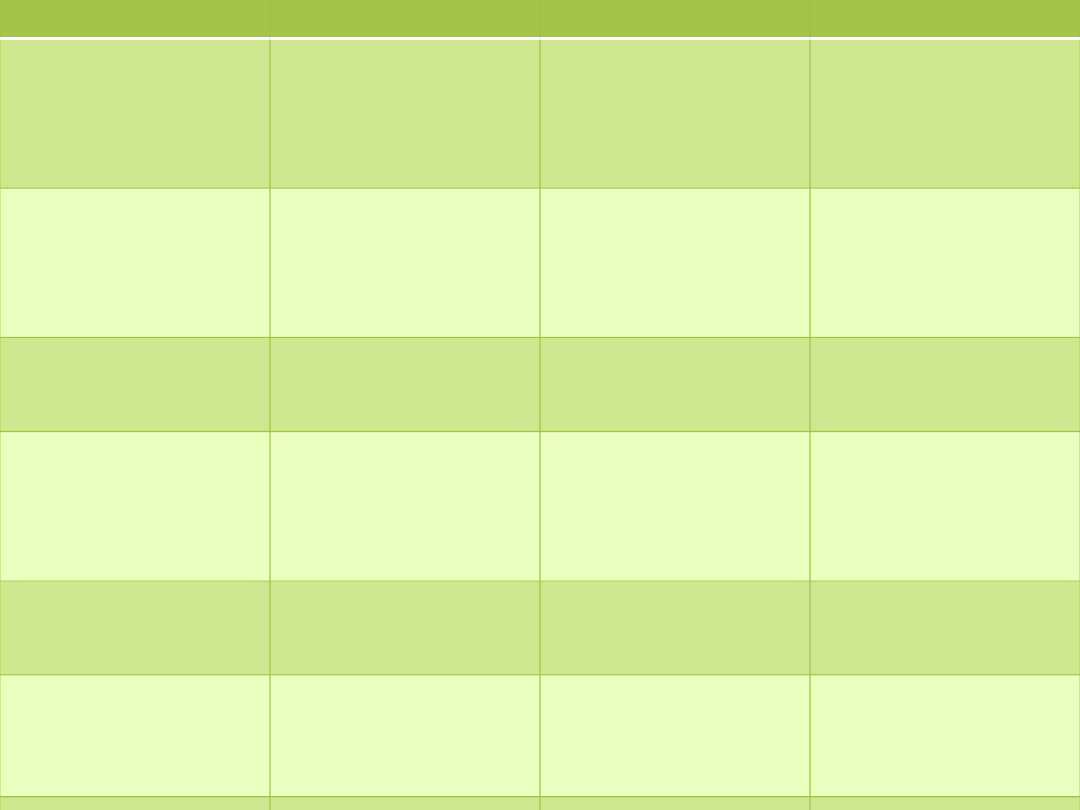
Enzym
Inhibitor
Efekt
Zastosowanie
Acetylocholinoester
aza
Prostygmina
Wzrost stężenia
aceylocholiny,
wzmożone napięcie
układu
przywspółczulnego
Lek pobudzający
kurczliwość jelit
Monoaminooksydaz
a
Selegilina
Wzrost stężenia
dopaminy w mózgu,
wzmożone napięcie
układu
przywspółczulnego
Lek przeciw
chorobie Parkinsona
fosfodiesteraza
Teofilina
Wzrost stężenia
cylicznego 3’5’AMP
w komórce
Lek rozszerzający
oskrzela
Anhydraza
węglanowa
acetazolamid
Wzmożone
wydalanie
wodorowęglanu i
fosforanów przez
nerki
Lek moczopędny
Oksydaza
moczanowa
allopurinol
Zmniejszenie
wytwarzania kwasu
moczowego
Lek przeciw dnie
moczanowej
Czynnik krzepnięcia
krwi IXa i Xa
cytrynian
Wiązanie jonów Ca
2+
Hamowanie
krzepnięcia krwi
przeznaczonej do
transfuzji
Cyklooksygenaza
Kwas
acetylosalicylowy
Hamowanie
biosyntezy
prostaglandyn i
tromboksanów
Lek o działaniu
przeciwzapalnym i
przeciwzakrzepowy
m

B
ibliografia
Edward Bańkowki, Biochemia. Podręcznik
dla studentów uczelni medycznych,
Wydawnictwo Medyczne, Urban&Partner,
Wrocław 2004
Robert K. Murray, Biochemia Harpera, wyd.
IV, Wydawnictwo lekarskie PZWL, Warszawa
Lubert Stryer, Biochemia, Wydawnictwo
Naukowe PWN, Warszawa 1997

Pytania
1. Co to jest inhibicja?
2. Rodzaje inhibitorów
3. Jaki rodzaj inhibitorów jest analogiem substratów?
4. W którym miejscu wiąże się inhibitor kompetycyjny z enzymem?
5. Czy inhibicja kompetycyjna jest odwracalna? Jeśli tak to w jaki sposób?
6. Podąć przykład inhibicji kompetycyjnej
7. Jakie związki mogą być inhibitorem dla dehydrogenazy
bursztynianowej?
8. Podać 4 cechy inhibitorów niekompetycyjnych
9. Jakie znasz inhibitory niekompetycyjne?
10. W jaki sposób można praktycznie wykorzystac inhibitory
enzymatyczne?
11. Wymień 2 inhibitory stosowane jako leki i krótko je opisz.

Dziękuję za uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Inhibitor kompetycyjny
- Hamowanie aktywności dehydrogenazy bursztynianowej
- Slide 11
- Slide 12
- Slide 13
- Inhibicja niekompetycyjna
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Praktyczne znaczenie inhibitorów enzymatycznych
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
Inhibitory enzymów jako leki, materiały medycyna SUM, biochemia, Kolokwium II
Leki stosowane w leczeniu gruźlicy
Leki stosowane w leczeniu gruźlicy2
INHIBICJA ENZYMÓW, Biochemia
Inhibicja enzymow id 214405 Nieznany
(28) Leki stosowane w leczeniu zaburzeń funkcyjności przekaźnikowej układu pozapiramidowego
leki stosowne w leczeniu astmy oskrzelowej
Leki biologiczne stosowane w leczeniu RZS
LEKI STOSOWANE W LECZENIU CUKRZYCY, MEDYCYNA ═══════════════
Leki stosowane w leczeniu astmy okrzelowej, Studia - ratownictwo medyczne, 3 rok, Zawansowane proced
Leki stosowane w leczeniu padaczki
Leki stosowane w leczeniu ostrych stanów w alergologii
Leki stosowane w leczeniu padaczki
Leki stosowane w leczeniu chorób reumatycznych, farmakologia
Przegląd leków stosowanych w leczeniu zakażeń układu moczowego
Leki stosowane w leczeniu cukrzycy
WYKLAD 6 Leki roslinne stosowane w leczeniu chorob zoladka, jelit
WYKŁAD 8 Środki stosowanew leczeniu otyłości
WYKŁAD 6 Leki roślinne stosowane w leczeniu chorób żołądka, jelit
więcej podobnych podstron