Wydział: BiNoŻ
Kierunek: TŻ
Grupa: 1.
Semestr: 5.
Termin zajęć: 27.11.2009 r. (piątek)
Godzina zajęć: 8-12
Ćwiczenie Nr 6
Kinetyka reakcji enzymatycznych (część II)
1. Cel ćwiczenia
Celem ćwiczenia jest poznanie wpływu stężenia substratu i enzymu na szybkość reakcji oraz wyznaczenie początkowej szybkości reakcji.
2. Część teoretyczna
Kinetyka reakcji chemicznych zajmuje się badaniem szybkości przebiegu reakcji w
zależności od różnych czynników (stężenia reagentów, temperatury, obecności
katalizatorów). Zadaniem kinetyki jest ustalenie charakteru reakcji i matematyczne ujęcie
zależności pomiędzy szybkością reakcji a czasem jej trwania, co pozwala na podanie
szybkości reakcji w dowolnym czasie i przy dowolnym stężeniu substratu.
Podstawą katalitycznej reakcji enzymatycznej jest odwracalne wzajemne
oddziaływanie substratu z enzymem , przy którym powstaje nietrwały kompleks, który następnie rozpada się na enzym i produkt reakcji.
Schemat reakcji enzymatycznej można przedstawić równaniem:
Gdzie: E - wolny enzym
S - substrat
ES - kompleks enzym - substrat
P - produkt
K1, k2, k3
Wpływ stężenia substratu na szybkość reakcji enzymatycznej.
Ze wzrostem stężenia substratu, szybkość katalizy rośnie liniowo, następnie przy większych stężeniach substratu ulega zwolnieniu i osiąga wartość maksymalną.
Charakterystyczna dla każdego układu enzym-substrat wielkość zwana stałą Michaelisa (KM) jest stężenie substratu, dla którego szybkość reakcji enzymatycznej osiąga połowę szybkości maksymalnej.
Stała Michaelisa jest to, więc takie stężenie substratu, przy którym połowa cząsteczek enzymu obecnych w układzie jest związana w kompleks z cząsteczkami substratu.
Hydroliza sacharozy.
Sacharoza jest dwucukrem zbudowanym z cząsteczki D-glukopiranozy i D-
fruktofuranozy. Wiązanie łączące glukozę z fruktozą ulega hydrolizie i to zarówno pod
wpływem kwasów mineralnych, jak i enzymu zwanego inwertazą. Z tą reakcją związane
jest zjawisko zwane inwersją sacharozy, polegające na zmianie znaku skręcalności
roztworu sacharozy (+), gdyż w powstałej równomolowej mieszaninie cukrów fruktoza
silniej skręca płaszczyznę polaryzacji w kierunku (-) niż glukoza (+) i cały roztwór
przyjmuje skręcalność ujemną, czyli po reakcji znak skręcalności roztworu zmienia się na
przeciwny (inwersja). Otrzymywany produkt, który jest mieszaniną D-glukozy i D-
fruktozy nazywany jest cukrem inwertowanym.
Zasada oznaczenia aktywności β-fruktofuranozydazy.
Aktywność enzymu oznacza się mierząc przyrost cukrów redukujących uwolnionych w czasie reakcji hydrolizy sacharozy katalizowanej przez β-fruktofuranozydazę, przebiegającej w przyjętych warunkach temperatury i pH. Cukry te oznacza się ilościowo stosując alkaliczny roztwór kwasu 3',5'-dinitrosalicylowego (DNS). DNS umożliwia oznaczenie stężenia cukrów redukujących oraz pełni role inaktywatora enzymu, hamując katalizowaną przez niego reakcję. W środowisku alkalicznym i w temperaturze 100oC DNS ulega redukcji pod działaniem cukrów redukujących, dając pochodna aminową, która w środowisku zasadowym ma pomarańczową barwę. Natężenie barwy o maksimum absorbancji przy 540 nm, jest proporcjonalne do stężenia cukrów redukujących w badanym roztworze.
3. Cześć doświadczalna.
3.1. Wyznaczanie krzywej progresji reakcji i obliczanie początkowej szybkości reakcji.
3.1.1.Spsób wykonania doświadczenia.
Na początku przygotowano próby właściwe. Do 6 ponumerowanych próbówek odmierzono po 0,5 ml 250 mM roztworu sacharozy. Następnie dodano w równych odstępach czasu (co 15 sekund) po 0,5 ml roztworu enzymu (inwertazy) i przygotowane w ten sposób mieszaniny inkubowano w temperaturze pokojowej w ciągu 5, 10 i 20 minut ( po dwie próby dla każdego z wymienionych czasów). Po upływie kolejnych czasów reakcji hydrolizę sacharozy przerwano dodając po 1 ml roztworu DNS (każdorazowo do dwu probówek). Zawartość probówek wymieszano i inkubowano je w wrzącej łaźni wodnej przez 5 minut. Po tym czasie próby schłodzono pod bieżącą wodą i dodano do każdej po 8 ml wody destylowanej. Następnie przygotowano jedną próbę kontrolną. Do 0,5 ml roztworu inwertazy dodano kolejno: 1 ml DNS i 0,5 ml 250 mM roztworu sacharozy i inkubowano przez 5 minut we wrzącej łaźni wodnej. Po schłodzeniu próby pod bieżącą wodą dodano do niej 8 ml wody destylowanej. Po przygotowaniu prób właściwych oraz próby kontrolnej zmierzono ich absorbancję (A540) wobec próby odczynnikowej. Do sporządzenia próby odczynnikowej użyto 0,5 ml wody destylowanej, do której dodano 0,5 ml DNS. Próbę wymieszano, inkubowano we wrzącej łaźni wodnej przez 5 minut, po czym schłodzono i dodano do niej 4 ml wody destylowanej.
3.1.2.Obliczenia.
Tabela 1.Wyniki pomiarów absorbancji badanych prób.
Czas [min] |
Próby właściwe A540 |
Próba kontrolna A540 |
ΔA540 |
ΔP [μmolCred/ml] |
|||
|
I |
II |
0,085 |
I |
II |
I |
II |
5 |
0,420 |
0,425 |
|
0,335 |
0,340 |
3,685 |
3,74 |
10 |
0,930 |
0,935 |
|
0,845 |
0,850 |
9,295 |
9,35 |
20 |
2,000 |
1,90 |
|
1,925 |
1,815 |
21,065 |
19,965 |
Przykład obliczeń ΔA540 dla czasu t = 5minut:
ΔA540 = A540 właściwe - A540 kontrolne
ΔA540 = 0,420 - 0,085 = 0,335
Na podstawie wzoru ΔP = ΔA540 · k · 2 obliczam przyrost stężenia cukrów redukujących uwolnionych w różnym czasie reakcji, gdzie: ΔP to przyrost stężenia cukrów redukujących [μmolCred/ml], ΔA540 to różnica absorbancji próby właściwej i kontrolnej, k to współczynnik nachylenia krzywej wzorcowej, wynoszący: 5,5 [μmolCred/ml].
Przykład obliczeń:
Dla czasu t = 5 minut:
ΔP5 = ΔA540 · k · 2 = 0,335 · 5,5 μmolCred/ml · 2 = 3,685 μmolCred/ml
Wykonuję wykres v = f(treakcji), z wykresu odczytuję czas, do którego krzywa progresji jest funkcja liniową, jest to czas, w którym przyrost cukrów redukujących (ΔP) jest wprost proporcjonalny do czasu trwania reakcji. Czas ten wynosi t = 10 minut.
Przy pomocy wykresu oraz wzoru obliczam wartość początkowej szybkości reakcji (V0)
Wykres 1.Przyrost stężenia cukrów redukujących P w czasie trwania reakcji.
Dla 5 minut inkubacji roztworu:
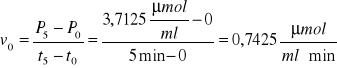
Wartośc P5 = 3,7125 μmolCred/ml jest średnią arytmetyczną ΔP dla czasu 5 minut.
Dla 10 minut inkubacji roztworu:
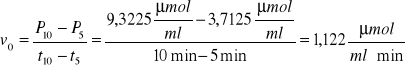
Wartośc P10 = 9,3225 μmolCred/ml jest średnią arytmetyczną ΔP dla czasu 10 minut.
Dla 20 minut inkubacji roztworu:
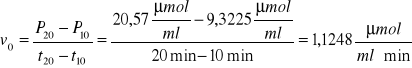
Wartośc P20 = 20,57 μmolCred/ml jest średnią arytmetyczną ΔP dla czasu 20 minut.
Obliczenie aktywności enzymu β-fruktofuranozydazy ze wzoru:
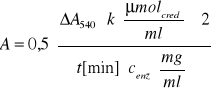
gdzie:
-współczynnik 0,5 wynika z tego, że hydroliza a cząsteczki sacharozy daje dwie cząsteczki cukrów redukujących.
-współczynnik 2 wynika z dwukrotnego rozcieńczenia enzymu w mieszaninie reakcyjnej
-k to współczynnik nachylenia krzywej wzorcowej, który wynosi 5,5 μmolCred/ml
-t to czas reakcji, który wynosi 10 minut
-cenz to stężenie enzymu równe 0,02 mg/ml
-ΔA540 różnica absorbancji próby właściwej i kontrolnej dla czasu t = 10 minut
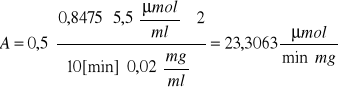
= 3,88·10-7![]()
Aktywność enzymu wyrażam, także w katalach:
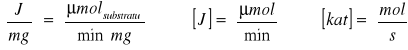
Ponieważ 1 mol = 106 μmola, a 1 minuta = 60 sekund, więc:
A=23,3063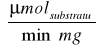
·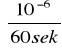
=3,88·10-7![]()
3.1.3.Wnioski.
Z wykresu P = f(treakcji) wynika, że do czasu około 10 minut reakcja jest rzędu zerowego. Po tym czasie reakcji przyrost cukrów redukujących przestaje być wprost proporcjonalny do czasu jej trwania i szybkość reakcji maleje. Wyliczona aktywność enzymu wynosi 23,3063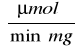
czyli 3,88·10-7![]()
. Aktywność enzymu określa się jako ilościowy przyrost produktów w odniesieniu do czasu reakcji katalizowanej przez enzym. Wartość V0 dla t = 5 minut wynosi 0,7425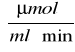
, dla t = 10 minut wynosi 1,122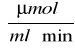
, a dla t = 20 minut wynosi 1,1248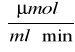
.
3.2.Wyznaczanie wpływu stężenia substratu na szybkość reakcji enzymatycznej.
3.2.1.Sposób wykonania doświadczenia.
W celu sporządzenia prób właściwych do ponumerowanych probówek odmierzono po 0,5 ml roztworów sacharozy o stężeniu 31,2; 62,5; 125 i 250 mM ( w dwu powtórzeniach). Następnie w równych odstępach czasu (co 15 sekund) dodano do każdej probówki po 0,5 ml roztworu inwertazy i natychmiastowo dokładnie wymieszano. Uzyskane próby inkubowano w temperaturze pokojowej przez 10 minut od momentu dodania roztworu enzymu do każdej z probówek. Po tym czasie do każdej próby dodano po 1 ml roztworu DNS, dokładnie wymieszano i inkubowano przez 5 minut we wrzącej łaźni wodnej. Po 5 minutach próby schłodzono i do każdej dodano 8 ml wody destylowanej i dokładnie wymieszano. Następnie przygotowano cztery próby kontrolne. Do ponumerowanych próbówek odmierzono po 0,5 ml roztworów sacharozy o stężeniu 31,2; 62,5; 125 i 250 mM. Po czym dodano do każdej próbówki po 1 ml DNS, wymieszano i dodano 0,5 ml roztworu inwertazy. Po wymieszaniu próby inkubowano we wrzącej łaźni wodnej przez 5 minut, schłodzono i dodano do każdej
8 ml wody destylowanej. Po przygotowaniu prób właściwych i prób kontrolnych zmierzono ich absorbancję wobec próby odczynnikowej, której sposób wykonania został podany w opisie wcześniejszego ćwiczenia (3.1.1.)
3.2.2.Obliczenia.
Tabela 3. Wyniki pomiarów absorbancji badanych prób.
Stężenie roztworu sacharozy [mM] |
Próby właściwe A540 |
Próby kontrolne A540 |
ΔA540 = A540 właściwe - A540 kontrolne |
||
|
I |
II |
|
I |
II |
31,2 |
0,255 |
0,260 |
0,04 |
0,215 |
0,22 |
62,5 |
0,345 |
0,295 |
0,01 |
0,335 |
0,285 |
125 |
0,73 |
0,56 |
0,21 |
0,52 |
0,35 |
250 |
0,54 |
0,59 |
0,13 |
0,41 |
0,56 |
Przykład obliczeń ΔA540 dla dla stężenia 31,2 mM:
ΔA540 = A540 właściwe - A540 kontrolne
ΔA540 = 0,255 - 0,0,4 = 0,215
Na podstawie wzoru ΔP = ΔA540 · k · 2 obliczam przyrost stężenia cukrów redukujących uwolnionych w różnym czasie reakcji, gdzie: ΔP to przyrost stężenia cukrów redukujących [μmolCred/ml], ΔA540 to różnica absorbancji próby właściwej i kontrolnej, k to współczynnik nachylenia krzywej wzorcowej, wynoszący: 5,5 [μmolCred/ml].
Przykładowe obliczenia przyrostu stężenia cukrów redukujących dla stężenia sacharozy
31,2 mM:
ΔP31,2 = ΔA540 · k · 2 = 0,215 · 5,5 μmolCred/ml · 2 = 2,365 μmolCred/ml
Obliczenie początkowej szybkości reakcji po czasie 10 minut według wzoru:
![]()
gdzie:
V0 to szybkośc początkowa reakcji katalizowanej przez enzym 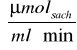
ΔA540 to różnica absorbancji próby badanej i próby kontrolnej
k to współczynnik nachylenia krzywej wzorcowej równy 5,5 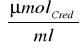
ΔP to przyrost stężenia cukrów redukujących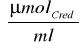
Przykładowe obliczenia:
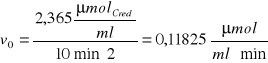
Tabela 4. Dane obliczeniowe potrzebne do wykonania wykresów ![]()
oraz ![]()
.
Ssacharozy [Mm] |
V0 [μmol/ml·min] |
ΔP [μmolCred/ml] |
1/Sacharozy [1/Mm] |
1/V0 [ml·min/ μmol] |
|||
|
I |
II |
I |
II |
|
I |
II |
31,2 |
0,11825 |
0,121 |
2,365 |
2,42 |
0,032 |
8,46 |
8,26 |
62,5 |
0,18425 |
0,15675 |
3,685 |
3,135 |
0,016 |
5,43 |
6,38 |
125 |
|
0,1925 |
|
3,85 |
0,008 |
|
5,19 |
250 |
0,2255 |
|
4,51 |
|
0,004 |
4,43 |
|
Wykres 2. Zależność początkowej szybkości reakcji katalizowanej przez enzym
(inwertazę) od stężenia sacharozy.
Z wykresu V0 = f(Ssach) odczytałem: maksymalną szybkość reakcji Vmax = 0,2255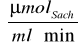
, połowę szybkości maksymalnej 1/2 Vmax = 0,121 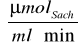
oraz stałą Michaelisa
KM = 29 [mM].
Wykres 3. Zależności odwrotności początkowych szybkości reakcji od odwrotności stężenia sacharozy.
Wyznaczenie stałej Michaelisa oraz szybkości maksymalnej z wykresu ![]()
:
Punkt przecięcia prostej z osią OX wynosi -0,02679![]()
i odpowiada wartości ![]()
, a więc
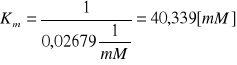
Punkt przecięcia z osią OY wynosi 3,7899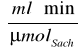
i odpowiada wartości ![]()
, a więc Vmax = 0,264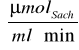
3.2.3.Wnioski.
Stała Michaelisa KM odczytana z wykresu V0 = f(Ssach) wynosi 29 [Mm], a maksymalna szybkośc reakcji Vmax wynosi 0,2255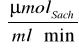
. Wartość KM odczytana z wykresu ![]()
wynosi 40,339 [Mm], a prędkość maksymalna Vmax wynosi 0,264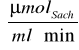
. Odczytane wartości KM i Vmax z obu wykresów różnią się od siebie. Bardziej wiarygodne są dane odczytane z zależności ![]()
, ponieważ jest to wykres liniowy. Stała Michaelisa jest to stężenie substratu, dla którego szybkość reakcji enzymatycznej osiąga połowę szybkości maksymalnej. KM okręsla stężenie substratu przy którym połowa cząsteczek enzymu obecnych w układzie jest związana w kompleksy z cząsteczkami substratu.
W miarę wzrostu stężenia substratu coraz więcej cząsteczek enzymu inwertazy może łączyć się z cząsteczkami sacharozy w wyniku, czego rośnie stężenie cukrów redukujących w roztworze. Wzrost stężenia substratu zwiększa stopniowo początkową szybkość reakcji, aż do momentu zrównania ilości cząsteczek enzymu i substratu w mieszaninie reakcyjnej, co powoduje osiągnięcie stałej maksymalnej prędkości reakcji.
3.3.Wyznaczenie wpływu stężenia enzymu na szybkość reakcji enzymatycznej.
3.3.1.Spsób wykonania doświadczenia.
Do ponumerowanych probówek dodano po 0,5 ml z pięciu przygotowanych roztworów enzymu o rozcieńczeniach: x0; x1,25; x1,67; x2,5 i 5,0 (w dwu powtórzeniach). Następnie w równych odstępach czasu (co 15 sekund) dodano do każdej próbówki 0,5 ml 250 mM roztworu sacharozy, wymieszano i pozostawiono w temperaturze otoczenia na 10 minut od momentu dodania enzymu do próbówek. Po upływie czasu dodano do probówek po 1 ml roztworu DNS. Zawartość wymieszano i inkubowano przez 5 minut we wrzącej łaźni wodnej, po tym czasie schłodzono i dodano do każdej probówki po 8 ml wody destylowanej
i zmierzono absorbancję prób wobec próby odczynnikowej, której sposób wykonania podano w opisie pierwszego doświadczenia (3.1.1.). Prób kontrolnych nie wykonano ze względu na brak czasu.
3.3.2.Obliczenia.
Tabela 5. Rozcieńczenie enzymu oraz wyniki pomiarów absorbancji badanych prób.
Enzym - inwertaza [ml] |
H2O [ml] |
Rozcieńczenie |
Absorbancja prób właściwych A540 |
Stężenie enzymu E [μg/ml] |
|
|
|
|
I |
II |
|
0,5 |
0 |
brak |
0,495 |
0,455 |
20 |
0,4 |
0,1 |
x 1,25 |
0,440 |
0,420 |
16 |
0,3 |
0,2 |
x 1,67 |
0,360 |
0,350 |
12 |
0,2 |
0,3 |
x 2,5 |
0,285 |
0,335 |
8 |
0,1 |
0,4 |
x 5,0 |
0,195 |
0,195 |
4 |
Aby uzyskać wartość stężenia enzymu należy podzielić stężenie enzymu przed rozcieńczeniem (20 μg/ml) przez wartość rozcieńczenia.
Przykład obliczenia stężenia enzymu na podstawie rozcieńczenia:
E = ![]()
= 16 μg/ml
Wykres 4. Zależność początkowych szybkości reakcji od stężenia enzymu (inwertazy).
3.3.3.Wnioski
Z wykresu ΔA540 = f(E) wynika, że wraz ze wzrostem stężenia enzymu - inwertazy, szybkośc reakcji również wzrasta. Wartość ΔA540 jest proporcjonalna do V0 dlatego została umieszczona na wykresie. Na wykresie widać, że szybkość reakcji enzymatycznej wzrasta liniowo do stężenia enzymu około 4 μg/ml.
Wyszukiwarka
Podobne podstrony:
06 Kinetyka reakcji enzymatycznych
kinetyka reakcji enzymatycznych I
Wyznaczanie parametrów kinetyki reakcji enzymatycznej za pomocą metod polarymetrycznych 5x
KINETYKA REAKCJI ENZYMATYCZNYCH
Kinetyka reakcji enzymatycznej m poteraj
Kinetyka reakcji enzymatycznych Nieznany
cwiczenie 4 inwertaza kinetyka reakcji enzymatycznych 05 05 2014
5 Kinetyka reakcji enzymatycznych
Kinetyka Reakcji Enzymatycznych
trusek hołownia, procesy membranowe, KINETYKA REAKCJI ENZYMATYCZNYCH
ENZYMY KINETYKA REAKCJI ENZYMATYCZNYCH
Kinetyka Reakcji Enzymatycznych
ĆWICZENIE 4 kinetyka reakcji enzymatycznej
Kinetyka reakcji enzymatycznych
I Wyznaczanie parametrow kinetyki reakcji enzymatycznej polarymetr
kinetyka reakcji enzymatycznych
Kinetyka reakcji enzymatycznych
rybiak,biologia i ekologia, Kinetyka reakcji enzymatycznych
więcej podobnych podstron




