
CHOROBY ZAKAŹNE
WETERYNARIA W PRAKTYCE
56
www.weterynaria.elamed.pl
KWIECIEŃ • 4/2010
rzęta zakażono dootrzewnowo szczepem
patogennym FPV, obserwując jedynie
pojawienie się spadku liczby leukocytów
we krwi. Także podanie inaktywowane-
go szczepu wirusa w tym samym wieku
i czasie, co powyżej, wzbudzało wysoki
poziom przeciwciał, który po 6 latach wy-
nosił 1:5312. Biorąc zatem pod uwagę wy-
sokość poziomu ochronnego przeciwciał
neutralizujących 1:8, można sądzić, że wy-
konanie w sposób wskazany przez pro-
ducenta szczepienia u kociąt doprowadzi
prawdopodobnie do uzyskania odporno-
ści na całe życie.
Wskazując termin szczepienia, nale-
ży uwzględnić warunki bytowania kociąt,
gdyż środowisko, w którym przebywają
zwierzęta, również wpływa na termin roz-
poczęcia szczepienia. Do ustalenia opty-
malnego terminu szczepienia istotna jest
wiedza o pojawianiu się odpowiedzi hu-
moralnej, która po zakażeniu pojawia się
między 7. a 8. dniem i osiąga maksymal-
ny poziom po 2 tygodniach. Zatem w sy-
tuacji, kiedy kocięta nie otrzymały sia-
ry i znajdują się w środowisku z wysoką
koncentracją wirusa, szczepienie należy
rozpocząć już w 6. tygodniu życia, z po-
wtórzeniem po 3-4 tygodniach. Natomiast
zdecydowanie częściej szczepieniu podda-
jemy kocięta pochodzące od matek szcze-
pionych lub takich, które miały kontakt
z wirusem i po podaniu siary. W tej sytu-
acji termin rozpoczęcia szczepienia mo-
żemy ustalić między 10. a 12. tygodniem
życia (1, 4, 26).
Herpeswiroza kotów
Herpeswirus koci (FHV-1) jest typowym
przedstawicielem rodziny Alphaherpesviri-
dae, przejmując wszystkie cechy wirusów
należących do tej rodziny. Zatem zakażenie
kota wiązać się będzie z zakażeniem latent-
nym, w przebiegu którego zaobserwujemy
pojawiające się epizody choroby połączone
z wydalaniem wirusa do środowiska. Do-
datkowo herpeswirus koci wzbudza słabą
odporność humoralną.
Uodpornianie czynne czy też profi lak-
tyka swoista, potocznie określana jako
szczepienie, zależy od dwóch głównych
składowych: stanu zdrowia zwierzęcia
(na który wpływ mają: wiek i obecności
przeciwciał matczynych) oraz właściwo-
ści szczepionki. Te dwa elementy skła-
dają się na skuteczność przeprowadzo-
nego szczepienia. Zagadnienie to zostało
szczegółowo omówione w opracowaniu
dr Katarzyny Płoneczki, które ukazało się
na łamach niniejszego czasopisma w 2005
roku (2/2005) (18).
P
ROFILKATYKA
SWOISTA
U
KOTÓW
Panleukopenia kotów
Najbardziej skuteczną metodą zabezpie-
czenia kotów przed zakażeniem jest uod-
pornianie czynne. Dostępne na rynku
szczepionki zawierają najczęściej żywy,
atenuowany wirus panleukopenii (modi-
fi ed live virus – MLV).
Skuteczność szczepionek atenuowanych
jest szczególnie wysoka u kociąt, u których
brak jest swoistych przeciwciał lub ich po-
ziom jest niski. Dodatkowo istnieje tylko
jeden serotyp tego wirusa, który wykazu-
je wysoką immunogenność. Dzięki temu
po przechorowaniu odporność utrzymu-
je się do końca życia. Ponadto ze względu
na wysoką homologię parwowirusa ko-
ciego i psiego organizm zwierzęcia szcze-
pionego wytwarza przeciwciała ochronne
przeciwko CPV-2a, CPV-2b i CPV-2c.
Ważnym elementem w prowadzeniu pra-
widłowej immunizacji zwierząt jest usta-
lenie czasu utrzymywania się przeciwciał
matczynych. Wykazano, iż przeciwciała
te wykrywalne są zwykle do 10. tygodnia
życia i mogą w tym czasie interferować
z wirusem szczepionkowym. Dlatego za-
leca się u kociąt stosowanie szczepionek
atenuowanych, które przełamują odpor-
ność bierną.
W celu potwierdzenia ochronnego
działania przeciwciał neutralizujących
po 36 miesiącach od szczepienia zwie-
dr hab. Krzysztof Rypuła, lek. wet. Aleksandra Kumala
Zakład Chorób Zakaźnych i Administracji Weterynaryjnej Wydziału Medycyny Weterynaryjnej Uniwersytetu Przyrodniczego we Wrocławiu
Abstract
Applied for a couple of hundred years,
vaccination, despite its many imperfec-
tions, is still the most common method
of controlling and fi ghting contagious
diseases in animals. The main goal
of the mass vaccination is to produce
the insusceptibility to viruses existing
in animals environment and also to li-
mit viral shedding and decrease preva-
lence of diseases.
Key words
vaccinations, prophylaxis, dog, cat
Streszczenie
Historia szczepień ochronnych ma już
ponadkilkusetletnią tradycję i stanowi
wciąż najczęściej stosowaną, mimo wie-
klu niedoskonałości, metodę kontroli
i zwalczania chorób zakaźnych zwierząt.
Cele, które chcemy osiągnąć, prowa-
dząc masowe uodparnienie zwierząt,
to wytworzenie stanu niewrażliwości
na zakażenie drobnoustrojami obecnymi
w środowisku bytowania zwierząt oraz
ograniczenie wystąpienia klinicznych
objawów choroby i siewstwa po wcze-
śniejszym zakażeniu.
Słowa kluczowe
szczepienia, profi laktyka, pies, kot
Profi laktyka swoista
w chorobach wirusowych
psów i kotów – aktualne poglądy
CURRENT VIEWS ON SPECIFIC PROPHYLAXIS OF CANINE
AND FELINE VIRAL DISEASES

CHOROBY ZAKAŹNE
WETERYNARIA W PRAKTYCE
57
www.weterynaria.elamed.pl
KWIECIEŃ • 4/2010
Zakażenia herpeswirusem kocim (FHV)
stanowią wciąż aktualne zagrożenie w ho-
dowlach kotów, zwłaszcza gdy wprowa-
dzane są do środowiska nowe zwierzęta,
a presja środowiska jest bardzo duża. Stąd
też zwierzęta takie należy poddać dwuty-
godniowej kwarantannie i jak najszybsze-
mu szczepieniu. W celu uzyskania szybkiej
niewrażliwości na zakażenie do immuniza-
cji wykorzystuje się szczepionki zawierają-
ce wirus żywy modyfi kowany.
Podobnie u nowo narodzonych, nie-
poddanych szczepieniu kociąt zakażenie
FHV-1 jest bardzo niebezpieczne, ponieważ
może być powodem śmierci lub trwałego
zakażenia i przewlekłego zapalenia błony
śluzowej jamy nosowej.
Dostępne w codziennej praktyce szcze-
pionki oparte są na antygenach zabitych
lub żywych modyfi kowanych, które mimo
wielu zalet niecałkowicie chronią przed za-
każeniem, a znacząco ograniczają siewstwo
wirusa oraz chronią przed wystąpieniem
objawów choroby.
The European Advisony Board on Cats
Diseases (ABCD) rekomenduje pierwsze
szczepienie u kociąt pochodzących zarów-
no od matek szczepionych, jak i nieszcze-
pionych, w wieku około 9. tygodnia, z po-
wtórzeniem po 2-4 tygodniach, najlepiej
w wieku około 12. tygodnia życia.
Drugą grupą często poddawaną szcze-
pieniu podczas wizyty u lekarza są koty,
których historia dotychczasowych szcze-
pień jest nam nieznana; tu również nale-
ży wykonać dwukrotne szczepienie w od-
stępie 2-4 tygodni – niezależnie od użytej
szczepionki. Ten schemat postępowania
wiąże się nie tyle z ochroną przed zacho-
rowaniem, ale ograniczeniem siewstwa
do środowiska wirusa.
Szczepienia przypominające zaleca się
wykonywać w odniesieniu do aktualne-
go zagrożenia kota przed zachorowaniem.
Należy ocenić ryzyko dla każdego zwierzę-
cia osobno. Producenci dostępnych na pol-
skim rynku szczepionek zalecają cyklicz-
ne doszczepianie kotów w odstępach 1-,
2-letnich. Jednakże mimo słabej i łatwej
do przełamania odporności poszczepiennej
utrzymuje się ona przez okres 3 lat u kotów
z niskim ryzykiem możliwości zakażenia,
tzn. kotów przebywających w skupiskach
bez możliwości kontaktu z innymi kotami.
Do doszczepiania można stosować prepa-
raty od różnych producentów. Jeśli okres
między kolejnymi szczepieniami jest dłuż-
szy niż 3 lata, zaleca się wykonanie dwóch
szczepień (9, 23).
Kaliciwiroza kotów
Pomimo wprowadzenia w latach 50.
XX w. szczepień przeciwko kaliciwiru-
sowi kociemu (FCV) nadal utrzymuje się
identyczna prewalencja zakażenia wśród
kotów. Powszechnie używany do produk-
cji szczepionek szczep F9 i 255 zostaje
powoli zastępowany szczepami G1 i 431.
Wynika to z faktu poszukiwania szczepów
FCV mogących stymulować odpowiedź
poszczepienną przeciwko wielu krążącym
w Europie wariantom tego wirusa (20). Za-
tem trudna staje się odpowiedź na pytanie,
jak należy prowadzić program szczepień,
by zwierzę było niewrażliwe na zakażenie.
Z jednej strony dostępne szczepionki nie
chronią w pełni przed zakażeniem wszyst-
kimi szczepami terenowymi FCV. Z dru-
giej strony dostępne doniesienia wskazują,
że szczepienie nie blokuje w pełni siewstwa
wirusa po zakażeniu (22). Podanie parente-
ralne szczepionki zawierającej żywy wirus
prowadzi do siewstwa wirusa na podob-
nym poziomie.
Pierwsze szczepienie wykonuje się za-
zwyczaj w wieku około 9. tygodnia życia.
Możliwe jest także zastosowanie u kociąt
na terenach endemicznych szczepionek li-
cencjonowach już w wieku kilku tygodni.
Szczepienie przypominające należy wy-
konać w wieku około 12. tygodnia życia,
jednakże nie przed 12. tygodniem. W sy-
tuacjach podwyższonego ryzyka u kociąt
należy zwierzęta doszczepić około 16. ty-
godnia życia.
Nieco inaczej trzeba postępować z kota-
mi o nieznanej historii szczepień. Tu nale-
ży szczepienie przeprowadzić dwukrotnie,
z zachowaniem odstępu 2-4 tygodni i uży-
ciem szczepionki żywej atenuowanej (7).
Doszczepianie kotów, według dostęp-
nych danych literaturowych i zaleceń
ABCD, wskazuje na konieczność analizy
środowiska, w którym żyje zwierzę, i okre-
ślenie bezpośrednich zagrożeń związanych
z występowaniem patogenów. I tak w sy-
tuacji niskiego zagrożenia można szczepić
zwierzęta w odstępach 3-letnich. Z kolei
w sytuacjach wzrostu ryzyka zakażenia za-
lecane jest coroczne szczepienie.
Koronawiroza kotów
Hodowle kotów są miejscem szczególnie
wysokiego ryzyka w odniesieniu do obec-
ności wirusa zakaźnego zapalenia otrzew-
nej (FIPV). Stąd też ze względu na duże
ograniczenia w możliwości wprowadze-
nia profi laktyki swoistej należy prowa-
dzić kontrolę rozprzestrzeniania się ko-
ronawirusa kociego (FCoV) poprzez
badanie zwierząt i wprowadzanie ich je-
dynie do środowisk o podobnym statusie
immunologicznym. Jednakże działania ta-
kie budzą wiele kontrowersji, gdyż typowy
FIP ujawnia się dopiero po odsadzeniu ko-
ciąt. Natomiast w środowisku, gdzie ende-
micznie występuje FCoV/FIP, nowo uro-
dzone kocięta są niewrażliwe na zakażenie
do 5.-6. tygodnia życia, a obecność koro-
nawirusa stwierdza się na około 2 tygo-
dnie przed porodem, a do 5.-6. tygodnia
po porodzie w tym środowisku nie stwier-
dza się obecności FCoV. Bliższe informa-
cje o różnicach w obrębie rodziny Corona-
viridae przedstawił dr Karczmarczyk (13).
Na rynku amerykańskim oraz w niektó-
rych krajach Europy dostępna jest szcze-
pionka przeciwko FIP oparta na wrażliwym
na temperaturę mutancie typu II korona-
wirusa kociego – szczep DF2. Skutecz-
ność tej szczepionki jest poddawana pod
dyskusję, gdyż uzyskane wyniki wynoszą
od 0% do 75% skuteczności ochrony przed
zakażeniem (23).
Zastosowanie szczepionki, ze względu
na brak jednoznacznie określonej skutecz-
ności, jest ograniczone i odnosi się szcze-
gólnie do hodowli, gdzie endemicznie wy-
stępuje FCoV, a nowo urodzone kocięta
nie są poddane ekspozycji wirusowej (np.
wczesne odsadzenie kociąt). Zatem szcze-
pienie należy u takich zwierząt rozpocząć
w 16. tygodniu życia, z powtórzeniem
po 3 tygodniach. U kociąt poniżej 16. ty-
godnia życia szczepienie nie chroni przed
możliwością zakażenia. Szczepień przypo-
minających nie wykonuje się (3, 14).
Białaczka kotów
Pierwsze szczepionki przeciwko wiruso-
wi białaczki kotów (FeLV) zostały wpro-
wadzone na rynek amerykański w połowie
lat 80. XX w. W tej chwili na rynku euro-
pejskim dostępnych jest wiele szczepionek,
z których część to szczepionki rekombi-
nowane, zawierające otoczkę glikoprote-
inową wirusa białaczki kotów z fragmen-
tem transbłonowego białka, które podlega
ekspresji w nośniku Escherichia coli, lub
wykorzystujące wirus ospy kanarków jako
wektor dla genów otoczki (gp 70) i białka
nukleokapsydu (p27). Mechanizm działa-
nia tych szczepionek jest związany z jed-
nokrotną replikacją wektora, która jest
wystarczająca do ekspresji wprowadzo-
nych genów FeLV. W efekcie podania takiej
szczepionki dochodzi do pobudzenia odpo-
wiedzi komórkowej, która z kolei prowa-
dzi do szybkiego wytworzenia przeciwciał
w sytuacji kontaktu szczepionego zwierzę-
cia z wirusem terenowym (2, 13).
Mimo że żadna szczepionka przeciwko
białaczce kotów nie zapewnia pełnej odpor-
ności i nie zapobiega zakażeniu, a wszystkie
koty z antygenemią p27 wykazywały obec-
ność prowirusa we krwi i wirusowego RNA
w osoczu, to ilości te były małe w porów-
naniu do poziomów u kotów trwale wire-
micznych. Czy stan ten jest niebezpieczny
dla zdrowia kotów? Odpowiedź na to py-
tanie daje wieloletnie doświadczenie pro-
wadzone u kotów poddanych szczepieniu
przeciwko zakażeniu FeLV, a następnie eks-
perymentalnie zakażonych tym wirusem.
Niski poziom wirusowego RNA oraz pro-
CHOROBY ZAKAŹNE
WETERYNARIA W PRAKTYCE
58
www.weterynaria.elamed.pl
KWIECIEŃ • 4/2010
wirusowego DNA we krwi po zakażeniu
nie był istotny, a takie koty można trak-
tować jako zabezpieczone przed zakaże-
niem (10).
Zatem szczepienie przeciwko FeLV po-
winno być składową programu szczepień
u kotów, a dostępne szczepionki zapewnia-
ją dobrą ochronę przeciwko wirusom te-
renowym i korzyści przewyższają ryzyko
ewentualnych efektów ubocznych. Należy
jednak pamiętać, by przed wykonaniem
szczepienia poddać kota, szczególne o nie-
znanym pochodzeniu, badaniu w kierunku
obecności swoistego antygenu FeLV, gdyż
szczepienie zwierząt już zakażonych jest
nieuzasadnione. Jeśli jednak nie ma żad-
nego ryzyka ekspozycji na zakażenie wi-
rusem, szczepienie nie jest zalecane. Geo-
grafi czna zmienność występowania FeLV
też powinna wpłynąć na decyzję o szcze-
pieniu, gdyż w niektórych państwach Eu-
ropy nie stwierdza się obecności FeLV,
podczas gdy w innych krajach zakażenie
to wciąż stanowi problem. Brak jest ba-
dań przeglądowych oceniających sytuację
w Polsce. Badania kotów z wysokim ryzy-
kiem zakażenia przeprowadzone na tere-
nie Wrocławia wykazały prewalencję na
poziomie 7,5% (23).
W sytuacji podjęcia szczepień koty z gru-
py ryzyka powinno się poddać szczepieniu
w wieku 8-9 tygodni i ponownie w 12. tygo-
dniu życia. Jeśli pochodzenie kota, którego
chcemy poddać szczepieniu, nie jest nam
znane, należy go bezwarunkowo przebadać
w kierunku FeLV, aby uniknąć „nieskutecz-
nego szczepienia”. Jest to częsta sytuacja,
gdy zaszczepiony kot jest zakażony i nie
wykazuje żadnych objawów choroby. Jeśli
natomiast znane jest pochodzenie, np. ko-
cię jest po ojcu i matce FeLV-negatywnych
i brak kontaktu z innymi kotami, prawdo-
podobieństwo zakażenia przed szczepie-
niem jest niewielkie.
Producenci szczepionek zalecają corocz-
ne doszczepianie kotów, jednak The Eu-
ropean Advisony Board on Cats Diseases
(ABCD) sugeruje, by koty w wieku powyżej
3 lat doszczepiać jedynie co 2-3 lata (3).
P
ROFILAKTYKA
SWOISTA
U
PSÓW
Wścieklizna
Zgodnie z artykułem 56 Ustawy o ochronie
zdrowia zwierząt oraz zwalczaniu chorób za-
kaźnych zwierząt z dnia 11 marca 2004 r. psy
przebywające na terenie Rzeczypospolitej
Polskiej podlegają obowiązkowym szcze-
pieniom przeciwko wściekliźnie w terminie
30 dni od dnia ukończenia przez psa 3. mie-
siąca życia, a następnie co 1-3 lata.
W odniesieniu do innych gatunków,
w tym kotów, nie ma obowiązku szcze-
pienia, a zalecenia co do terminu szcze-
pienia przeciwko wściekliźnie wskazuje
producent szczepionki i jest to wiek oko-
ło 3-4 miesięcy życia. Kolejne szczepie-
nie należy wykonać po 12 miesiącach,
a następne dawki powinno się podawać
co 1-3 lata zależnie od sytuacji epizootycz-
nej na na danym terenie oraz wskazań pro-
ducenta preparatu.
W sytuacji przemieszczania zwierząt
do krajów UE i krajów trzecich należy
mieć na uwadze fakt, że szczepienie staje
się ważne po 21 dniach po pierwszym po-
daniu i z dniem podania szczepionki, gdy
jest to szczepienie powtórne.
Natomiast oznaczenie poziomu przeciw-
ciał wymagane jest przy wwozie zwierząt
do niektórych krajów, jak Anglia, Irlandia
i oceniane jest dopiero po miesiącu od wy-
konania szczepienia. Jego poziom musi być
nie mniejszy niż 0,5 IU/l.
W ostatnich latach zwrócono uwa-
gę na ryzyko rozwoju u kotów włóknia-
komięsaków w miejscu podania szcze-
pionki. Te sytuacje odnoszą się jedynie
do szczepionek inaktywowanych i są zwią-
zane z drażniącym działaniem adjuwantów
w miejscu iniekcji. Częstotliwość wystą-
pienia „mięsaka poszczepiennego” wyno-
si od 1:1000 do 1:10 000 zaszczepionych
kotów (3, 6).
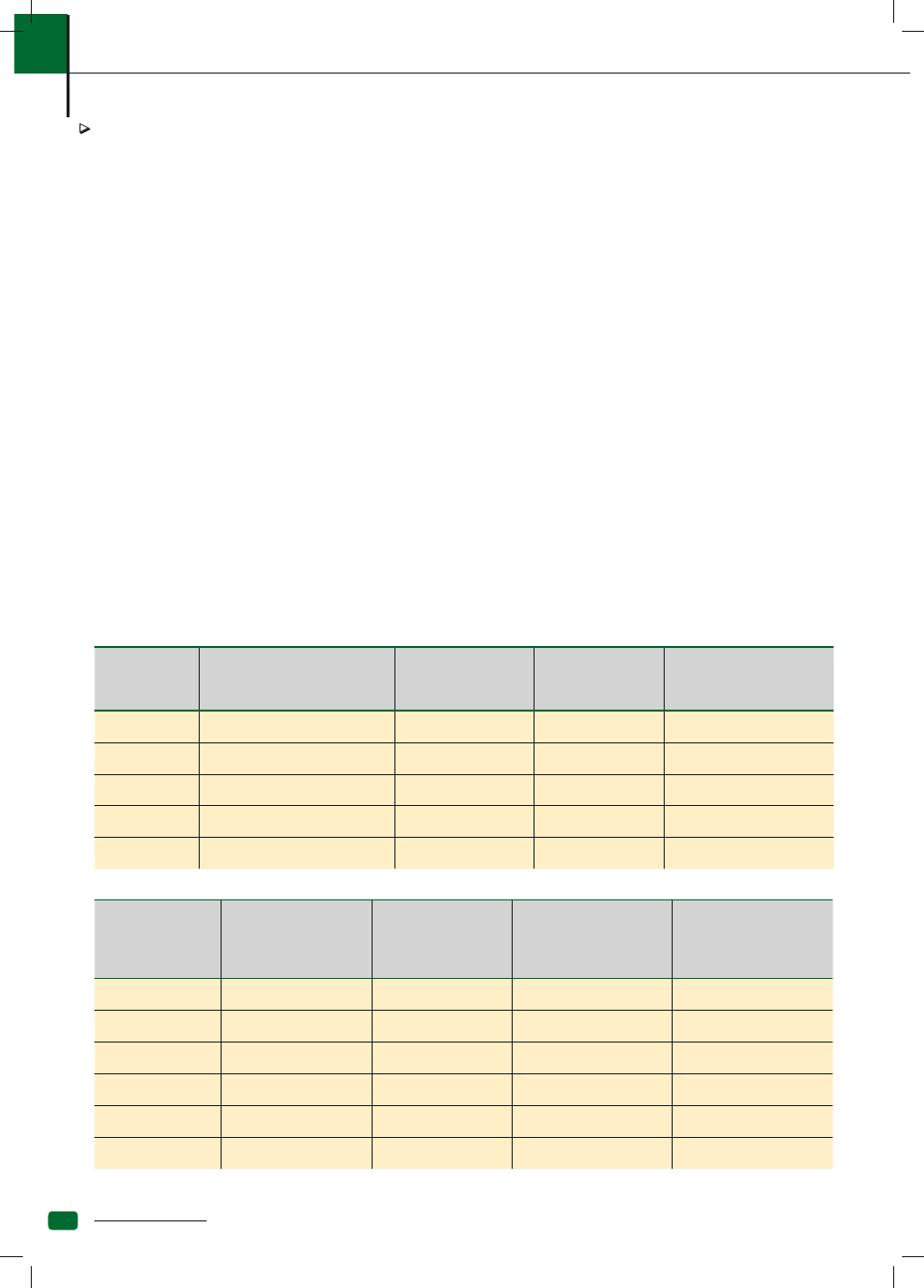
Pierwsze szczepienie szczeniąt
– tygodnie życia (ewentualnie,
w sytuacji wysokiego ryzyka)
Pierwsze szczepienie
psów dorosłych
Doszczepianie
Czas trwania
odporności (niepodatne
na doświadczalne
zakażenie)
Nosówka
(6-8), 9-11, 12-14
2 dawki, w odstępie
2-4 tyg.
pierwsze – po roku,
kolejne – co 3 lata
ok. 7 lat (Rockborn),
ok. 5 lat (Onderstepoort)
Ch. Rubatha
(6-8), 9-11, 12-14
1 dawka
pierwsze – po roku,
kolejne – co 3 lata
ok. 7 lat
Parwowiroza
(6-8), 9-11, 12-14, (15-18.)
1 dawka
pierwsze – po roku,
kolejne – co 3 lata
ok. 7 lat
Kaszel kenelowy
(6-8), 9-11,12-14,
donosowo – od 12. tyg.
2 dawki, donosowo
–1 dawka
zależnie od czynników
ryzyka
do roku
Koronawiroza
(6-8), 9-11, 12-14
1 dawka
jeśli są wskazania
– raz w roku
ochrona tylko częściowa, brak
badań
Pierwsze szczepienie
kociąt – tygodnie
życia (ewentualnie,
w sytuacji wysokiego
ryzyka)
Pierwsze szczepienie
kotów dorosłych
Doszczepianie
Czas trwania odporności
(niepodatne
na doświadczalne
zakażenie)
Panleukopenia
(6-8), 9-11, 12-14
1 dawka
pierwsze – po roku
kolejne – co 1-3 lata
ok. 7 lat
Herpeswiroza
(6-8), 9-11, 12-14
1 dawka
pierwsze – po roku
kolejne – co 1-3 lata
ok. 7 lat
Kalciwiroza
(6-8), 9-11, 12-14
1 dawka
pierwsze – po roku
kolejne – co 1-3 lata
ok. 7 lat
FIP
>16, druga dawka
po 3-4 tygodniach
2 dawki,
w odstępie 3-4 tyg.
jeśli są wskazania – raz w roku
rok
Białaczka
9-11, 12-14
2 dawki,
w odstępie 2-4 tyg.
jeśli są wskazania – raz w roku
rok
FAIDS
9-11, 12-14
3 dawki,
w odstępie 2-4 tyg.
jeśli są wskazania – raz w roku
brak danych
Tabela 1. Program szczepienia psów
Tabela 2. Program szczepienia kotów

CHOROBY ZAKAŹNE
WETERYNARIA W PRAKTYCE
59
www.weterynaria.elamed.pl
KWIECIEŃ • 4/2010
Parwowiroza psów
Szczepionki przeciwko zakażeniu parwowirusowemu (CPV) do-
stępne są w formie szczepionek żywych, zawierających wirus osła-
biony (modifi ed live virus – MLV), oraz szczepionek zabitych, gdzie
komponentem jest wirus inaktywowany.
Skuteczność szczepionek atenuowanych jest szczególnie wy-
soka u szczeniąt, u których brak jest swoistych przeciwciał, lub
u psów, u których wykazano ich niskie poziomy. Miano przeciw-
ciał 1:80 oznaczone w odczynie hamowania hemaglutynacji (HI)
przyjmowane jest powszechnie za wystarczające do zabezpieczenia
szczeniąt przed zakażeniem. Niższe miana mogą jedynie ograniczyć
natężenie przebiegu choroby. Utrzymywanie się przeciwciał przy
mianach powyżej 1:320 może trwać nawet przez kilka lat.
Ważny w ustalaniu programu szczepień jest okres utrzymywa-
nia się przeciwciał matczynych. Wykazano, iż przeciwciała u oko-
ło 20-25% szczeniąt wykrywalne są nawet do 12. tygodnia życia.
Mogą one zatem obniżać skuteczność szczepienia, dlatego też za-
leca się stosować u szczeniąt szczepionki atenuowane, które prze-
łamują odporność bierną oraz silniej indukują układ immunolo-
giczny zwierzęcia do produkcji przeciwciał. To stwarza sytuację,
że poziom wirusa w organizmie jest wyższy, a tym samym dłużej
się utrzymuje odporność bez konieczności ponownej immuniza-
cji. Psy poddane szczepieniu szczepionką zawierającą wirus inak-
tywowany już po 2 tygodniach od szczepienia stają się wrażliwe
na zakażenie, stąd konieczne jest ponowne podanie szczepion-
ki po 2-4 tygodniach. Szczepionka zawierająca wirus MLV może
powodować okresowe siewstwo wirusa z kałem, co nie stanowi
zagrożenia dla psów znajdujących się w tym samym środowisku,
a nawet wpływa korzystnie na podniesienie miejscowej odpor-
ności na ewentualny kontakt z CPV. Podaniu szczepionki towa-
rzyszy trwające od 2 do nawet 5 tygodni po szczepieniu obniże-
nie poziomu przeciwciał, będące wynikiem podania szczepionki.
W tym okresie szczenięta nadal pozostają wrażliwe na zakażenie
parwowirusem (9, 12, 25).
Ponieważ zakażenie parwowirusem jest najniebezpieczniejsze
dla zdrowia szczeniąt między 6. tygodniem a 6. miesiącem życia,
bardzo istotne jest podanie szczepionki w odpowiednim momen-
cie. Moment, w którym możemy skutecznie rozpocząć uodpor-
nianie szczenięcia, zależy od poziomu przeciwciał u matki. Jeśli
matka szczeniąt była uodporniana, prawdopodobnie przekazała
z siarą na tyle dużą ilość przeciwciał, że potomstwo będzie dłu-
żej chronione (nawet do 12. tygodnia życia). Jeśli jednak szczenię-
ta pochodzą od matki nieszczepionej regularnie lub o nieznanym
statusie immunologicznym, należy się liczyć z tym, że już między
4. a 6. tygodniem życia mogą one być wrażliwe na zakażenie CPV.
Zatem takie szczenięta możemy poddać szczepieniu już w 6. tygo-
dniu życia, a w sytuacji wysokiego ryzyka – nawet w 4. tygodniu
życia. Do tego celu wskazane jest zastosowanie preparatów zawie-
rających w swoim składzie wysoką koncentrację wirusa szczepion-
kowego – szczepionki typu puppy. By utrzymać wysoki poziom
przeciwciał, konieczna jest powtórna immunizacja w 9. i 12. tygo-
dniu życia. Takie postępowanie jest skuteczną metodą uniknięcia
luki immunologicznej, choć musimy wziąć pod uwagę zasobność
portfela właściciela naszego pacjenta (11, 19).
Szczególną uwagę należy zwrócić na dwie rasy: rottweiler i do-
berman; szczepiąc przeciwko parwowirozie psy tych ras, należy
pamiętać, by powtórzyć szczepienia w 15.-16. tygodniu życia (5).
Koronawiroza psów
Sensowność stosowania szczepionek przeciwko zakażeniu koro-
nawirusowym do dziś jest wątpliwa. Dostępne preparaty zawie-
rają inaktywowany koronawirus psi (CCV). Ze względu na wcze-
śniejszy proces inaktywacji są to preparaty bezpieczne, ale nie
dające pełnej ochrony przed zakażeniem, gdyż wzrost poziomu
s-IgA po parenteralnym podaniu szczepionki jest stosunkowo

CHOROBY ZAKAŹNE
WETERYNARIA W PRAKTYCE
60
www.weterynaria.elamed.pl
KWIECIEŃ • 4/2010
niski. Poza tym występowanie tego wirusa
u szczeniąt w wieku 2-10 tygodni jest po-
wszechne i często nie wiąże się z wystą-
pieniem objawów chorobowych (9, 21).
Potwierdzeniem tego stanu jest doświad-
czenie, w którym podano CCV wyizolowa-
ny od szczeniąt z objawami choroby. Wi-
rus ten podano drogą doustną wrażliwym
szczeniętom w wieku 2 tygodni i nie zaob-
serwowano żadnych objawów klinicznych
zakażenia (25).
Nosówka psów
Szczepienia przeciwko zakażeniu wirusem
nosówki (CDV) oparte są na żywym atenu-
owanym szczepie wirusa nosówki (modifi ed
live virus – MLV) i są one zwykle skojarzo-
ne z innymi antygenami, jak: parwowirus
psi (CPV-2), adenowirus psi (CAV) i psi
wirus parainfl uenzy-2 (CPiV-2). Przeciw-
ciała matczyne utrzymują się u szczeniąt
od 6 do 12 tygodni i ich poziom zależny
jest od poziomu przeciwciał matki. Stąd
też zaleca się podać pierwszą dawkę szcze-
pionki w 6.-9. tygodniu życia z powtórze-
niem po 2-4 tygodniach. Jeśli szczepieniu
poddajemy psa po raz pierwszy w wieku
powyżej 12. tygodni lub psa dorosłego,
zaleca się powtórną immunizację w celu
uzyskania trwałej odporności. Po pierw-
szej serii szczepień kolejne szczepienie po-
winno się wykonać 12 miesięcy później.
Kolejne szczepienia zaleca się wykonywać
co 3 lata, choć wiele badań wskazuje, że po-
ziom przeciwciał zabezpieczający zwierzę-
ta przed zakażeniem utrzymuje się nawet
przez okres 8-10 lat.
Dostępne na rynku szczepionki prze-
ciwko nosówce zawierają zwykle szczep
Rockborn lub szczep Onderstepoort wi-
rusa nosówki. Ten ostatni produkowa-
ny jest na embrionach kurzych i jest bez-
pieczniejszy w stosowaniu. Nie notuje się
po ich podaniu poszczepiennego zapalenia
mózgu, ale serokonwersja występuje tylko
w 80%. Szczep Rockborn CDV, pasażowa-
ny na hodowlach tkankowych – komór-
kach nerki psa – daje odporność w pełni
(100%) u wszystkich w wrażliwych psów
i indukuje wyższe poziomy przeciwciał
oraz trwalszą odporność. Może jednak-
że powodować poszczepienne zapalenie
mózgu. Powikłania te częściej obserwo-
wane są u fretek, stąd nie zaleca się stoso-
wać u tego gatunku szczepionek opartych
na hodowlach tkankowych (17, 27).
U psów powikłania w postaci zapale-
nia mózgu zwykle wiążą się z ogólną im-
munosupresją oraz obecnością zakażenia
neo- lub prenatalnego szczepionego osob-
nika. Objawy zwykle zaczynają się mię-
dzy 3. a 20. dniem po szczepieniu i są bar-
dzo zróżnicowane: od ruchów żuchwą
przypominających żucie gumy, po napa-
dy drgawek i ataksję. Należy pamiętać,
że po szczepieniu przeciwko nosówce wy-
stępuje przejściowa immunosupresja, bę-
dąca wynikiem namnażającego się wirusa
szczepionkowego w organizmie, dlatego
też pies powinien być przez okres dwóch
tygodni izolowany od psów oraz drobno-
ustrojów chorobotwórczych.
Herpeswiroza psów
Zakażenia herpeswirusowe u psów po-
wodowane są przez herpeswirus psi
(CHV-1), cechujący się dużą stabilno-
ścią antygenową – znany jest tylko jeden
serotyp wirusa. Podobnie jak u innych
gatunków zwierząt domowych i hodow-
lanych, z zakażeniem tym będzie się wią-
zać stan latencji i okresowe wydalanie
wirusa do środowiska. O powszechno-
ści występowania tego zakażenia świad-
czą badania, które wskazują, iż zakażenia
latentne rozpowszechnione są w hodow-
lach, gdzie stwierdza się do 100% zwie-
rząt wykazujących przeciwciała przeciw-
ko CHV-1. Zdecydowanie niższy odsetek
zwierząt mających przeciwciała stwierdza
się u zwierząt utrzymywanych pojedyn-
czo (około 6%). Zatem szczepienie uza-
sadnione jest w hodowlach, szczególnie
u suk hodowlanych.
Od niedawna na polskim rynku do-
stępna jest szczepionka podjednostko-
wa, zawierająca glikoproteinę otoczko-
wą CHV-1. Schemat szczepień odbiega
od powszechnie przyjętego, gdyż szcze-
pieniu poddajemy suki w okresie rui oraz
na 1-2 tygodnie przed spodziewanym ter-
minem porodu. Wytworzone przeciwcia-
ła po szczepieniu są przekazywane wraz
z siarą nowo narodzonym szczeniętom,
co z kolei zabezpiecza je przed zakaże-
niem. W hodowlach, gdzie herpeswiroza
stanowiła problem, podanie szczepionki
powodowało wzrost liczby ciąż oraz spa-
dek poporodowej śmiertelności szczeniąt.
Ponieważ jest to szczepionka podjednost-
kowa, zatem po jej podaniu nie ma ogra-
niczeń w wykorzystaniu techniki PCR lub
innych metod diagnostycznych identyfi -
kujących antygen wirusowy.
A
DENOWIROZA
PSÓW
Zakaźne zapalenie wątroby wywo-
ływane jest przez psi adenowirus typ
1 (CAV-1) pokrewny antygenowo z ade-
nowirusem typu 2 (CAV-2), który jest
jednym z głównych patogenów powodu-
jących kaszel kenelowy (kaszel psiarnia-
ny, zakaźne zapalenie tchawicy i oskrzeli)
u psów. Powszechnie dostępne prepara-
ty uodporniające przeciwko zakażeniom
adenowirusowym oparte są na typie
2 adenowirusa. Szczepionki zawierające
w swoim składzie żywy typ 1 adenowiru-
sa rozwijają odporność już po 5 dniach,
jednakże istnieje duże ryzyko powikłań,
takich jak: zmętnienie rogówki czy zapa-
lenie kłębuszków nerkowych oraz siew-
stwo wirusa z moczem. Już jedna dawka
żywego, atenuowanego CAV-1 uodparnia
zwierzę na bardzo długo, bo od 3 do 5 lat.
Szczepionki zawierające inaktywowa-
ny CAV-1, choć nie powodują żadnych
efektów ubocznych, muszą być podawa-
ne wielokrotnie w celu uzyskania, a na-
stępnie utrzymania ochronnego pozio-
mu przeciwciał. Konieczne staje się w tym
wypadku użycie adjuwantów, które z ko-
lei zwiększają możliwość wystąpienia
odczynów alergicznych. Optymalnym
rozwiązaniem jest zatem użycie żywego,
atenuowanego szczepu CAV-2, który nie
powoduje wyżej wymienionych efektów
ubocznych, a wytworzone przeciwcia-
ła w odpowiedzi na szczepienie chronią
w pełni zarówno przeciwko zakażeniu
CAV-1, jak i CAV-2 oraz utrzymują się
na wysokim poziomie 3 lata (9).
Omawiając zagadnienie zakażeń ade-
nowirusowych, należy także zaznaczyć,
że polietiologiczny charakter zachorowań
warunkuje konieczność szerokiego po-
dejścia do możliwości uodpornienia zwie-
rząt. I choć kaszel kenelowy – schorze-
nie o szerokim spektrum zakaźnym – nie
może być skutecznie zwalczany poprzez
użycie szczepionki, immunizacja może
ograniczyć powikłania oraz przyczynić
się do łagodnego przejścia choroby. Po-
nieważ wszystkie patogeny zakaźnego
zapalenia tchawicy i oskrzeli powodują
miejscowe zakażenia dróg oddechowych,
najważniejsze w ich zwalczaniu są prze-
ciwciała sekrecyjne (s-IgA). Wiadomo,
że odporność miejscowa błon śluzowych
jest stymulowana jedynie po bezpośred-
nim kontakcie z patogenem. W Polsce
od niedawna jest dostępna szczepionka
donosowa, zawierająca żywy, atenuowany
szczep wirusa parainfl uenzy-2 oraz Borde-
tella bronchiseptica. Szczepionkę donosową
wystarczy podać jednokrotnie, a odpor-
ność na zakażenie pojawia się już podczas
trzeciej doby po immunizacji. Szczepionki
donosowe stosuje się w Stanach Zjedno-
czonych w sytuacjach, kiedy zwierzę jest
narażone na czynniki zakaźne, np. przed
wystawą, przed pobytem w hotelu lub ho-
spitalizacją (planowany zabieg). Dostępne
szczepionki do podawania parenteralnego
(zwykle skojarzone z nosówką i parwowi-
rozą) muszą być zastosowane dwukrotnie
z 2-4-tygodniowym odstępem, najwcze-
śniej w 6. tygodniu życia, a odporność po-
jawia się dopiero w 2-3 tygodniu po po-
daniu drugiej dawki (8, 15, 16).
Inne choroby zakaźne, przeciwko któ-
rym możemy szczepić psy i koty, wskaza-
ne są w szczególnych przypadkach i po-
dyktowane trybem życia zwierzęcia (np.
udział w wystawach czy polowaniach).

CHOROBY ZAKAŹNE
WETERYNARIA W PRAKTYCE
61
www.weterynaria.elamed.pl
KWIECIEŃ • 4/2010
P
ODSUMOWANIE
Podsumowując przedstawione możliwości
i granice zastosowania profi laktyki swoistej
w ochronie przed zakażeniami wirusowy-
mi kotów i psów, należy podkreślić, iż jest
to nadal najskuteczniejsza broń w walce
z chorobami zakaźnymi, a proponowa-
ne schematy szczepień nie powinny być
rutynowe i należy je weryfi kować do in-
dywidualnych potrzeb zwierzęcia i ocze-
kiwań właściciela. Pojawiające się zagadnie-
nia zbyt częstego podawania szczepionek,
zwłaszcza zawierających wiele antygenów,
lub występowania zaburzeń autoimmuno-
logicznych nie powinny wpływać na ogra-
niczenie profi laktyki swoistej, szczególnie
u młodych zwierząt.
Piśmiennictwo
1. Addie D.D., Thompson H.: Feline pan
leukopenia/feline parvovirus infection. [W:]
Chandler i wsp.: Feline medicine and the-
rapeutics. Blacwell Scientifi c Publications,
Oxford, 2004, 571-575.
2. Annonim: Researches probe vaccine-associa-
ted feline sarcoma. „J. Am. Vet. Med Asocc.”,
News, 2004.
3. Annonim: Infectious diseases. „J. Fel Med.
Surg. Clin. Pract.”, 2009, 7, 565-575, 598-
-602.
4. Bush M., Povey R.C., Koonse H.: Im-
munogenicity and safety of an inactivated
vaccine for the prevention of rhinotracheitis,
caliciviral disease and panleukopenia in cats.
„J. Am. Vet. Med. Assoc.”, 1980, 177, 347-
-350.
5. Coyne M.J.: Effi cacy of two canine parvovirus
vaccines for inducing seroconversion in Rottwe-
iler and Doberman, Pinscher pups with various
levels of maternally derived antibodies. „Vet.
Therap.”, 2000, 1, 35-42.
6. Frymus T.: Wirusowe, bakteryjne, grzybicze
i prionowe choroby kotów. Psychoedukacja,
Warszawa 2005, 71-88.
7. Gaskell R.M., Radford A.D., Dawson S.:
Feline infectious respiratory disease. [W:]
Feline Medicine and Therapeutics, Backwell
Publisching 2004, 577-595.
8. Gore T., Headly M., Laris R., Bergman J.,
Sutton D., Horspol L., Jacobs A.: Interna-
sal kennel cough vaccine protecting dogs from
experimental B. bronchiseptica challenge within
72 hours. „Vet. Rec.”, 2005, 156, 482-483.
9. Green C.E.: Infectious diseases of dog and cat.
Elsevier 2006, 46-47, 69-70.
10. Hofmann-Lehmann R., Catorri V., Tan-
don R.: Vacconation against the feline leu-
kemia virus: outcome and response categories
and long-term follov-up. „Vaccine”, 2007, 25,
5531-5539.
11. Hoskins J.D., Gourley K.R., Taylor H.W.:
Challenge trial of Progard-7 vaccine using three
fi eld strains of CPV-2. Intervet’s Companion
Animal Technical Report 4, 1995, 1-4.
12. Kahn D.E., Emery J.B., Smith M.J.: Safety
and effi cacy of modifi ed-life canine parvovirus
vaccine. „VM/SAC”, 1983, 78, 1739-1746.
13. Karczmarczyk R. FIP. Aktualny problem
diagnostyczny. „Weterynaria w Praktyce”
2010, 3, 8-11
14. Kensil C.R., Barrett C., Kushner N.: De-
velopment of genetically engineered vaccine
against FeLV. „J. Am. Vet. Med. Asocc.”,
1991, 199, 1423-1427.
15. Lutz H., Gut M., Leutengger C.M.: Kinetics
of FcoV infection in kittens born in cattieres
of high risk for FIP under different rearing
conditions. Procc. II. Intern. FcoV/FIP Symp.,
Glasgow, Szkocja 2002.
16. Mansfi eld P.D.: Vaccination of dogs and cats
in veterinary teaching hospital in North America.
„J. Am. Vet. Med. Asocc.”, 1996, 208, 1242-
-1247.
17. Olson P., Hedhammar A., Klingeborn B.:
Canine parvovirus infection, canine distemper
and infectious canine hepatitis: inclination
to vaccinate and antibody response in the
Swedish dog population. „Acta. Vet. Scand.”,
1996, 37, 433-444.
18. Olson P., Klingeborn B., Bonnett B.:
Distemper titer study in Sweden 1995-1996.
„J. Vet. Intern. Med.”, 1997, 11, s. 148.
19. Płoneczka K.: Szczepienia profilaktyczne
zwierząt. „Weterynaria w Praktyce”, 2005,
2, 32-38.
20. Pollock R.V.H., Carmichael L.E.: Maternally
derived immunity to canine parvovirus infection:
transfer, decline and interference with vaccination.
„J. Am. Vet. Med. Assoc.”, 1982, 180, 37-42.
21. Pratelli A., Tinelli A., Decaro N.: Safety and
effi cacy of a modifi ed-live canine coronavirus
vaccine in dogs. „Vet. Microbiol.”, 2004, 99,
43-49.
22. Richards J., Rodan J.: Feline vaccination
guidelines. „Vet. Clin. Small Anim.”, 2001,
31, 455-472.
23. Rypuła K., Włodarczyk M., Chorbiński P.,
Płoneczka K.: Występowanie zakażeń wiru-
sowych u kotów na terenie miasta Wrocławia.
„Medycyna Wet.”, 2004, 60, 841-844.
24. Schultz R.D.: Current and future canine and
feline vaccination programs. „Vet. Med.”,
1998, 3, 233-252.
25. Schultz R.D., Larson L.J.: The new gene-
ration of parvovirus vaccines. A comparison
study. „Compend. Cont. Educ. Pract. Vet.”,
1996, 18, ss 640-641.
26. Scott F.W., Geissinger C.M.: Long-term im-
munity in cats vaccinated with an inactivated
trivalent vaccine. „Am. J. Vet. Res.”, 1999,
60, 652-658.
27. Van Heerden J., Bingham J., van Vuuren M.:
Clinical and serological response of wild dogs
(Lycaon pictus) to vaccination against canine
distemper, canine parvovirus infection and
rabies. „J. So. Afr. Vet. Assoc.”, 2002, 73,
8-12.
dr hab.n. wet.Krzysztof Rypuła
Zakład Chorób Zakaźnych i Administracji
Weterynaryjnej
Wydział Medycyny Weterynaryjnej
Uniwersytet Przyrodniczy we Wrocławiu
50-366 Wrocław, pl. Grunwaldzki 45
Document Outline
Wyszukiwarka
Podobne podstrony:
Profilaktyka swoista i nieswoista
Kopia Profilaktyka swoista szcepienia (1)
Profilaktyka swoista uodparnianie czynne i bierne
PROFILAKTYKA SWOISTA I NIESWOISTA, Pielęgniarstwo licencjat, licencjat, Studia III rok, ściągi obron
Profilaktyka swoista czynna
Profilaktyka swoista,nieswoista w chorobach psów i kotów
ćw 4 Profil podłużny cieku
Odpornosc swoista i nieswoista
Profilaktyka nowotworowa
Odporność swoista
profilaktyka przeciwurazowa
Niezawodowa profilaktyka poekspozycyjna
profilaktyka nadcisnienia(2)
więcej podobnych podstron