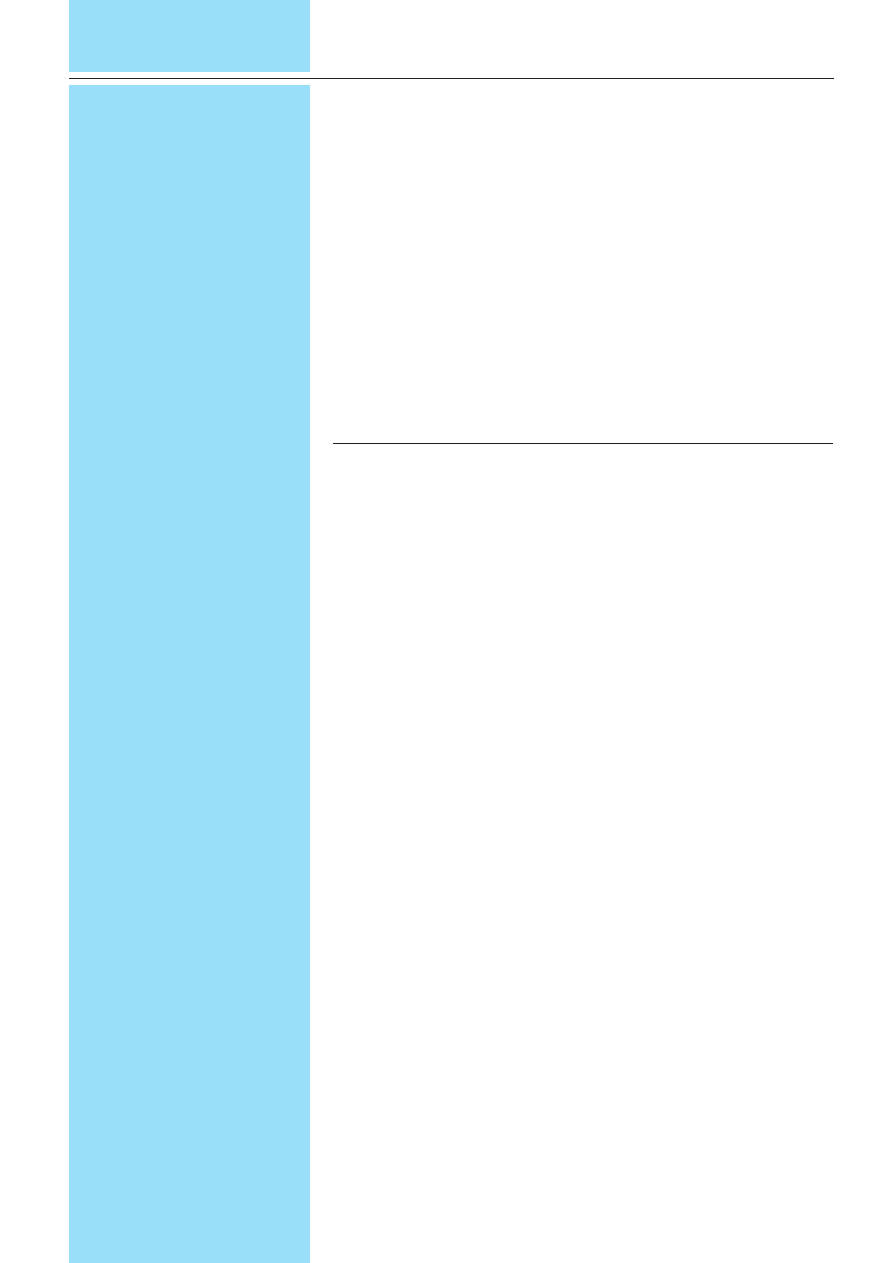
WSTÊP
W ci¹gu ostatnich lat obserwuje siê
wzrost skutecznoœci leczenia hormonalnego
stosowanego u chorych na raka sutka. Wy-
nika to z w³aœciwej selekcji chorych do le-
czenia, opracowania nowych taktyk leczenia
oraz syntezy nowych leków.
Obligatoryjne oznaczanie receptora hor-
monalnego u³atwia w³aœciwe planowanie le-
czenia, a ostatnio zakoñczone doœwiadcze-
nia kliniczne okreœlaj¹ miejsce i czas trwa-
nia hormonoterapii u chorych nie tylko na
zaawansowanego, ale i zlokalizowanego ra-
ka sutka. Okreœlono równie¿ celowoœæ sto-
sowania hormonoterapii u chorych z nad-
miern¹ ekspresj¹ receptora HER-2. Mo¿li-
woϾ
stosowania
agresywnych
form
chemioterapii, zarówno w leczeniu uzupe³-
niaj¹cym, jak i paliatywnym wymaga znale-
zienia miejsca hormonoterapii tak¿e u tych
chorych, jako leczenia pierwotnie lub wtór-
nie skojarzonego.
Pierwotna diagnostyka przedoperacyjna
wymaga obligatoryjnego oznaczania recep-
torów hormonalnych i o ile jest to mo¿liwe –
ewentualnych zaburzeñ genetycznych.
Zaniechanie wykonania tych badañ mo-
¿e powodowaæ nie tylko przeprowadzenie le-
czenia suboptymalnego, niew³aœciwie zapla-
nowanego i daj¹cego chorym mniejsz¹
szansê na wyleczenie, ale równie¿ zwiêksze-
nie kosztów leczenia poprzez stosowanie le-
czenia hormonalnego u chorych, u których
bêdzie ono nieskuteczne.
Leczenie chorych ze zlokalizowan¹ po-
staci¹ choroby polega na pierwotnym lub
wtórnym (chemioterapia indukcyjna) lecze-
niu operacyjnym, które w wiêkszoœci przy-
padków jest obecnie skojarzone z systemo-
wym leczeniem uzupe³niaj¹cym chemio- i/lub
hormonoterapi¹. U chorych w okresie przed-
menopauzalnym przewa¿a pogl¹d o stoso-
waniu kastracji hormonalnej, najlepiej farma-
kologicznej lub napromienianiem. Ta ostat-
nia jest tañsza i czasowo mniej obci¹¿a
chor¹, jednak ma charakter nieodwracalny
i obci¹¿aj¹cy chore stresem psychicznym.
Postêpowanie takie wymaga jednak bez-
wzglêdnego oznaczania receptorów hormo-
nalnych, nie tylko z uwagi na interes chore-
go, ale i obowi¹zkowe w wiêkszoœci krajów
przepisy prawne.
W grupie chorych leczonych paliatywnie,
zw³aszcza z dodatnim receptorem hormonal-
nym, leczenie hormonalne stosowane samo-
dzielnie lub z chemioterapi¹ jest stosowane
prawie obligatoryjnie. Kwesti¹ dyskusyjn¹
w niektórych oœrodkach pozostaje ocena, na
którym etapie choroby powinno byæ ono roz-
poczête. Czêœæ autorów uwa¿a, ¿e dopiero
w okresie objawowym, kiedy zmiana nowo-
tworowa zaczyna wp³ywaæ na jakoœæ ¿ycia.
Czêœæ oœrodków rozpoczyna leczenie nieza-
le¿nie od wielkoœci zmiany, stosuj¹c hormo-
noterapiê samodzielnie lub z chemioterapi¹.
Pozostaje wreszcie sprawa chorych
z ujemnym albo s³abo zaznaczonym recep-
torem. Wiele oœrodków uwa¿a, ¿e mimo ni-
skiej szansy na odpowiedŸ rzêdu 10–15
proc. w przypadku, kiedy zawodzi leczenie
cytostatykami nale¿y podj¹æ próbê leczenia
hormonalnego. Wed³ug naszych doœwiadczeñ
leczenie to, z wyj¹tkiem chorych w bardzo
zaawansowanym wieku jest ma³o celowe.
Dotychczas lekiem z wyboru w leczeniu
addycyjnym by³ tamoksyfen i z uwagi na
ni¿szy koszt leczenia wiêkszoœæ oœrodków
stosuje go nadal. Wprowadzenie do lecze-
nia w miejsce tamoksyfenu inhibitorów aro-
matazy spowodowa³o przeprowadzenie sze-
regu kontrolowanych badañ klinicznych po-
legaj¹cych na porównaniu skutecznoœci,
toksycznoœci i kosztów leczenia tamoksyfe-
nem z now¹ generacj¹ leków.
PODSTAWY HORMONOTERAPII
RAKA SUTKA
Wyniki badañ doœwiadczalnych, jak te¿
liczne dane kliniczne wskazuj¹, ¿e u czê-
œci chorych rak sutka jest chorob¹, której
Hormonoterapia jest podstawowym
leczeniem chorych na raka sutka
z pozytywnym receptorem estroge-
nowym lub progesteronowym, którzy
wymagaj¹ leczenia systemowego.
W zaawansowanej chorobie leczenie
hormonalne powoduje poprawê
prze¿yæ oraz obiektywn¹ remisjê
u 20–40 proc. leczonych chorych,
a u 40–80 proc. w przypadku pozy-
tywnego poziomu receptora estroge-
nowego. Ponadto u 20–40 proc. pa-
cjentów mo¿na uzyskaæ stabilizacjê
procesu nowotworowego. W lecze-
niu zaawansowanej choroby skutecz-
noœæ dostêpnych obecnie leków jest
porównywalna, a podstaw¹ ich do-
boru s¹ objawy niepo¿¹dane oraz
wp³yw na jakoœæ ¿ycia. W leczeniu
uzupe³niaj¹cym jedynie tamoksyfen
i wy³¹czenie czynnoœci hormonalnej
jajników u chorych przed menopau-
z¹ w badaniach prospektywnych
zmniejszy³y prawdopodobieñstwo
wystêpowania nawrotu i œmiertel-
noœæ. Dalszy rozwój hormonoterapii
powinny przynieϾ badania nad
czynnikami predykcyjnymi, odpowie-
dzi na leczenie nowymi lekami oraz
syntezê bardziej selektywnych pre-
paratów, zarówno o dzia³aniu chemo-
prewencyjnym, jak i lecz¹cym.
Przedstawiono nowe dane kliniczne
podkreœlaj¹ce rolê nowego blokera
aromatazy, letrozolu jako nowego
standardu w leczeniu hormonalnym
raka sutka.
S³owa kluczowe: rak sutka, leczenie
hormonalne, letrozol.
W
Ws
sp
pó
ó³³c
cz
ze
es
sn
na
a O
On
nk
ko
ollo
og
giia
a ((2
20
00
02
2)) v
vo
oll.. 6
6;; 2
2 ((9
91
1–
–9
97
7))
Miejsce hormonoterapii w leczeniu
raka piersi z uwzglêdnieniem roli
letrozolu (Femara
)
The place of hormonal therapy in breast cancer treatment
with taking into consideration the role of letrozole (Femara
)
Marek Pawlicki, Janusz Rolski
Klinika Chemioterapii, Centrum Onkologii - Instytutu im. M. Sk³odowskiej-Curie w Krakowie
rozwój zale¿y od pobudzenia hormonalne-
go. Wi¹¿e siê to z faktem, i¿ na gruczo³
sutkowy oddzia³uje wiele hormonów, z któ-
rych najwa¿niejsze to estrogeny, progesta-
geny, androgeny, glukokortykosterydy, pro-
laktyna oraz hormon wzrostu.
Obserwacje kliniczne, dotycz¹ce hormo-
nowra¿liwoœci raka sutka, datuj¹ siê od ro-
ku 1836. Pierwsz¹ udan¹ próbê hormono-
terapii (chirurgiczna owariektomia) przepro-
wadzi³ w
roku 1836 George Thomas
Beatson w Glasgow Cancer Hospital [1].
W pocz¹tkowym okresie hormonoterapii ra-
ka sutka stosowano metody ablatywne –
owariektomiê, adrenalektomiê, hipofizekto-
miê. Od prze³omu lat 50. i 60. datuje siê
burzliwy rozwój leków dzia³aj¹cych na
uk³ad hormonalny oraz wykrycie recepto-
rów hormonalnych – najbardziej istotnego
czynnika prognostycznego.
Najwy¿szy odsetek remisji (75–80 proc.)
uzyskaæ mo¿na u pacjentek z dodatnim re-
ceptorem estrogenowym oraz progestage-
nowym. Z drugiej jednak strony ok. 10
proc. chorych z ujemnym receptorem rów-
nie¿ reaguje na leczenie. Wiêksze prawdo-
podobieñstwo stwierdzenia pozytywnego
poziomu receptorów istnieje u kobiet po
menopauzie (83 proc.), jednak u 72 proc.
pacjentek przed menopauz¹ poziom recep-
tora estrogenowego lub progestagenowe-
go jest dodatni. Wynika z tego, ¿e wiêk-
szoϾ chorych na raka sutka jest kandy-
datkami do tej formy leczenia. Wysokie
prawdopodobieñstwo uzyskania remisji ist-
nieje u kobiet starszych z nowotworem
o wolnym przebiegu oraz lokalizacj¹ zmian
przerzutowych w tkankach miêkkich, ko-
œciach oraz p³ucach. Nisk¹ hormonowra¿-
liwoœci¹ cechuj¹ siê raki niskozró¿nicowa-
ne, których rozwój stymulowany jest przez
Hormonal therapy is appropriate tre-
atment for allstages of estrogen – or
progesterone-receptor-containing
breast cancer for which systemic the-
rapy is indicated. Against metastatic
disease, initial endocrine treatments
induce survival prolongation and
objective tumor shrinkage in 20–40%
of all patients (40–80% of estrogen
receptor –positive patients). Another
10–20% of patients will have clinical-
ly significant periods of tumor stabi-
lity. No single class of hormonal
agents has been shown to be consi-
stently superior as treatment of me-
tastatic disease, so the choice of tre-
atment is dictated by toxicity and ef-
fects on quality of life. As adjuvant
therapy of early disease, tamoxifen
and oophorectomy are the only hor-
monal treatments prospectively
shown to decrease recurrence and
mortality. Future prospects for hormo-
nal treatment include development of
additional predictors of response,
new classes of drugs and more se-
lective drugs to prevent as well as to
treat the disease. New clinical trial
data have strengthend support for
the aromatase inhibitor letrozole as
an new standard for hormone thera-
py in breast cancer.
Letrozole (Femara
) is third genera-
tion aromataze inhibitor for use in
postmenopausal women with hor-
monal-sensitive breast cancer. Le-
trozole was found to be at last as ef-
fective as megestrol acetate in the
second-line treatment of postmeno-
pausal women with advanced
breast cancer who had failed tamo-
xifen therapy, according to the re-
sults of three large multicenter, ran-
domized trials. Letrozole was also
superior to tamoxifen in the first-line
treatment of postmenopausal wo-
men with advanced breast cancer,
according to the results of a multi-
center, double-blind, randomized
study. Letrozol was superior to ta-
moxifen in time to progression, re-
ducing risk of progression by 30%.
Moreover, letrozole was superior to
tamoxifen in time to treatment failure.
Overall response rate was higher for
the aromatase inhibitor. A double-
-blind, randomized trial was recently
conducted, to evaluate the activity of
letrozole versus tamoxifen as preope-
rative endocrine therapy for postme-
nopausal women with estrogen-po-
sitive primary invasive breast cancer.
Overall objective response rate was
statistically significantly superior in
the letrozole group. Breast conserva-
tion was possible in 48% of patient
Ryc. 1. Hormony dzia³aj¹ce na gruczo³ sutkowy
W
Ws
sp
pó
ó³³c
cz
ze
es
sn
na
a O
On
nk
ko
ollo
og
giia
a ((2
20
00
02
2)) v
vo
oll.. 6
6;; 2
2 ((9
91
1–
–9
97
7))
H
Ho
orrm
mo
on
ny
y o
od
dd
dz
ziia
a³³u
ujj¹
¹c
ce
e n
na
a g
grru
uc
cz
zo
o³³ s
su
uttk
ko
ow
wy
y
g
go
on
na
ad
do
ottrro
op
piin
ny
y
((F
FS
SH
H+
+L
LH
H))
e
es
sttrro
og
ge
en
ny
y
p
prro
og
ge
es
stte
erro
on
n
p
prro
olla
ak
ktty
yn
na
a
h
ho
orrm
mo
on
n w
wz
zrro
os
sttu
u
przed menopauz¹
przed i po
menopauzie
jja
ajjn
niik
k
a
an
nd
drro
og
ge
en
ny
y
p
prro
og
ge
es
stte
erro
on
n
k
ko
on
nw
we
errs
sjja
a w
w ttk
ka
an
nk
ka
ac
ch
h o
ob
bw
wo
od
do
ow
wy
yc
ch
h
e
es
sttrro
og
ge
en
ny
y
p
prrz
zy
ys
sa
ad
dk
ka
a
n
na
ad
dn
ne
errc
cz
za
a
A
AC
CT
TH
H
L
LH
HR
RH
H
p
po
od
dw
wz
zg
gó
órrz
ze
e
kko
orrttyy
kko
osstt
e
erryy
d
dyy
Tab. 1. Historia hormonoterapii
H
Hiis
stto
orriia
a h
ho
orrm
mo
on
no
otte
erra
ap
piiii
1836
wp³yw cyklu miesi¹czkowego na przebieg raka sutka (Sir Astley Cooper)
1889
rak sutka u m³odych kobiet ma bardziej agresywny charakter
(Albert Schinzinges)
1895
owariektomia (Beatson)
1922
RT jajników (Courmelles)
1939
androgeny (Ulrich)
1944
estrogeny (Haddon)
1951
progestageny (Esher)
1952–53
andrenektomia i hipofizektomia (Huggins, Lufl)
1958–67
synteza antyestrogenów (Cole)
1960–66
odkrycie receptorów estrogenowych
1973
inhibitory aromatazy (Griffiths)
1982
antagoniœci LHRH (Klijn)
1987
antyprogestageny (Romieu)
1993
czyste antyestrogeny (Howell)

inne mitogeny ni¿ hormony. Cechuj¹ siê
one wysokim poziomem bia³ka c-erb B-2,
aneuploidi¹ oraz wysokim indeksem proli-
feracyjnym (Ki 67).
Ablatywne metody leczenia stosowane
s¹ obecnie rzadko, ze wzglêdu na porów-
nywaln¹ skutecznoœæ a mniejsze obci¹¿e-
nie chorych przy stosowaniu leków dzia³a-
j¹cych na uk³ad hormonalny. Leki te po-
dzieliæ mo¿na na estrogeny, androgeny,
antyestrogeny, blokery aromatazy, agoni-
stów LHRH oraz antyprogestageny.
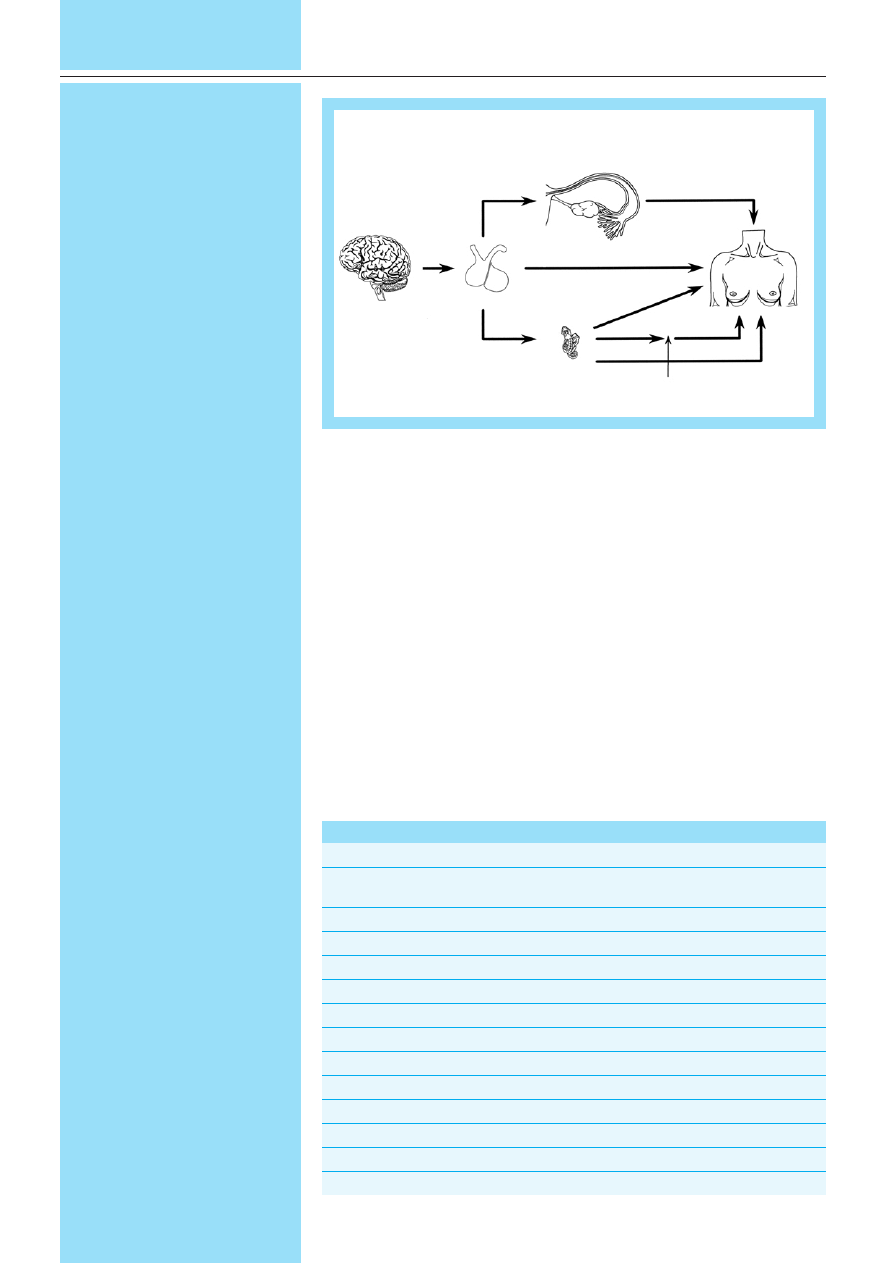
Antyestrogeny podzieliæ mo¿na z kolei
na antyestrogeny typu I, antyestrogeny czy-
ste oraz celowane. Do antyestrogenów ty-
pu I zaliczamy tamoksyfen i jego pochod-
ne: toremifen, droloksyfen oraz idoksyfen.
Estrogeny oddzia³uj¹ na komórki raka sut-
ka ³¹cz¹c siê z receptorem zlokalizowanym
w j¹drze komórki. Po aktywacji kompleks
ulega dimeryzacji, dzia³aj¹c jako kotwica
dla innych bia³ek i czynników transkrypcyj-
nych. W po³¹czeniu z polimeraz¹ RNA po-
woduje on transkrypcjê i translacjê genów
zale¿nych od estrogenów. Powstaj¹ tym sa-
mym bia³ka odpowiedzialne za wzrost
i ró¿nicowanie komórki. Antyestrogeny po-
woduj¹ powstanie kompleksu, który nie jest
w pe³ni aktywny, co hamuje aktywacjê ge-
nów estrogenozale¿nych [4].
Jak wspomniano wy¿ej, ok. 10 proc.
chorych z ujemnym poziomem receptorów
reaguje pozytywnie na hormonoterapiê.
Fakt ten zwi¹zany jest z innym mechani-
zmem dzia³ania antyestrogenów. Dzia³aj¹
one równie¿ na uk³ad odpornoœciowy, po-
woduj¹c wzrost syntezy przeciwcia³, wzrost
aktywnoœci limfocytów NK oraz hamuj¹c
aktywnoœæ supresorowych limfocytów T.
Dzia³aj¹ tak¿e na przekazywanie sygna³u
wewn¹trz komórki, hamuj¹c aktywnoœæ ki-
nazy C oraz zale¿nej od kalmoduliny cAMP
fosfodiesterazy. Hamuj¹ proces angiogene-
zy oraz syntezê mitogenów, takich jak IGF
I, TGF
α
, EGF oraz PDGF [5].
Najczêœciej stosowanym lekiem z tej gru-
py jest tamoksyfen. U pacjentek przed me-
nopauz¹ z dodatnim poziomem receptora
estrogenowego pozwala uzyskaæ 20–45
proc. obiektywnych remisji, u chorych po
menopauzie 15–53 proc. Œredni czas trwa-
nia remisji wynosi 9–12 mies. [6, 7]. Tole-
rancja leczenia jest dobra. U czêœci pacjen-
tów w pocz¹tkowej fazie leczenia wystêpu-
je tzw. tumor flare, polegaj¹cy na
zaostrzeniu dolegliwoœci bólowych przy roz-
siewie do koœci oraz wyst¹pieniu hiperkal-
cemii. Objaw ten ustêpuje samoistnie i jest
dobrym czynnikiem prognostycznym. Tamok-
syfen i jego pochodne maj¹ równie¿ dzia-
³anie estrogenne. Z jednej strony jest ono
pozytywne, powoduj¹c spadek poziomu
cholesterolu oraz wzrost gêstoœci koœci,
z drugiej jednak strony zwiêksza ryzyko za-
chorowania na raka trzonu macicy. Z tego
te¿ powodu pacjentki leczone przez d³u¿-
szy czas lekami z tej grupy wymagaj¹ okre-
sowej kontroli ginekologicznej. Innym efek-
tem, na który nale¿y zwróciæ uwagê jest
efekt agonistyczny. Zwi¹zany jest on z fak-
tem, i¿ w trakcie leczenia dochodzi do se-
lekcji klonów komórek, które odpowiadaj¹
na tamoksyfen jak na estrogeny. Równie¿
tamoksyfen mo¿e ulec biotransformacji do
metabolitów estrogenowych, które dzia³aj¹
na komórki nowotworowe jako mitogen.
Z tego te¿ powodu u 10–30 proc. pacjen-
tów oczekiwaæ mo¿na remisji z odstawienia.
Toremifen w porównaniu do tamoksyfe-
nu wykazuje 3 razy s³absze powinowactwo
do receptorów estrogenowych, dlatego sto-
sowany jest w dawce odpowiednio wy¿szej.
Pozwala uzyskaæ 21–68 proc. remisji,
z czego 26 proc. ca³kowitych. Wykazuje
s³abszy efekt estrogenowy ni¿ tamoksyfen
[8]. Droloksyfen wykazuje 10 razy wiêksze
powinowactwo do receptorów estrogeno-
wych ni¿ tamoksyfen przy s³abszym efek-
cie estrogenowym. W badaniach randomi-
zowanych jego skutecznoœæ okaza³a siê
jednak ni¿sza ni¿ tamoksyfenu. Kolejny lek
D
Dz
ziia
a³³a
an
niie
e a
an
ntty
ye
es
sttrro
og
ge
en
nó
ów
w
n
na
a k
ko
om
mó
órrk
kii rra
ak
ka
a s
su
uttk
ka
a
a
an
ntty
ye
es
sttrro
og
ge
en
ny
y
E
E
2
2
c
cz
zy
ys
stte
e a
an
ntty
ye
es
sttrro
og
ge
en
ny
y
E
ER
R
E
ER
R
m
mR
RN
Na
a
s
sy
yn
ntte
ez
za
a
E
ER
RE
E
z
za
ah
ha
am
mo
ow
wa
an
niie
e
w
wz
zrro
os
sttu
u g
gu
uz
za
a
Ryc. 2. Dzia³anie antyestrogenów na komórki raka sutka
treated with letrozole compared to
36% of those treated with tamoxifen.
Differences in response rates betwe-
en the aromatase inhibitor and tamo-
xifen were more marked for tumors
that were positive for erbB-1 and/or
erbB-2. These data confirmed the
high activity of letrozole in hormonal
therapy of breast cancer.
Key words: breast cancer, hormonal
treatment, letrozole.
W
Ws
sp
pó
ó³³c
cz
ze
es
sn
na
a O
On
nk
ko
ollo
og
giia
a ((2
20
00
02
2)) v
vo
oll.. 6
6;; 2
2 ((9
91
1–
–9
97
7))
94
Wspó³czesna Onkologia
z tej grupy, idoksyfen, w porównaniu do ta-
moksyfenu cechuje równie¿ wiêksze powi-
nowactwo do receptora estrogenowego
przy mniejszej toksycznoœci. Lek pozostaje
obecnie w fazie badañ klinicznych. Czyste
antyestrogeny (ICI 164 384 oraz ICI 182
780) wi¹¿¹ siê z receptorami estrogenowy-
mi, syntetyzowanymi w cytoplazmie, hamu-
j¹c ich transport do j¹dra komórkowego [9].
Hamuj¹ równie¿ proces dimeryzacji recep-
tora. Cechuje je równie¿ brak dzia³ania
agonistycznego. Dziêki innemu mechani-
zmowi dzia³ania powoduj¹ 37 proc. remisji
u chorych opornych na tamoksyfen. Obec-
nie stosowane s¹ równie¿ w badaniach ran-
domizowanych jako leczenie I rzutu. Celo-
wane antyestrogeny (raloksyfen) wywieraj¹
efekt estrogenowy na uk³ad kr¹¿enia i ko-
œci, natomiast efekt antyestrogenowy na su-
tek i macicê. Obecnie stosowane s¹ g³ów-
nie w leczeniu osteoporozy. W raku sutka
pozostaj¹ w fazie badañ klinicznych [10].
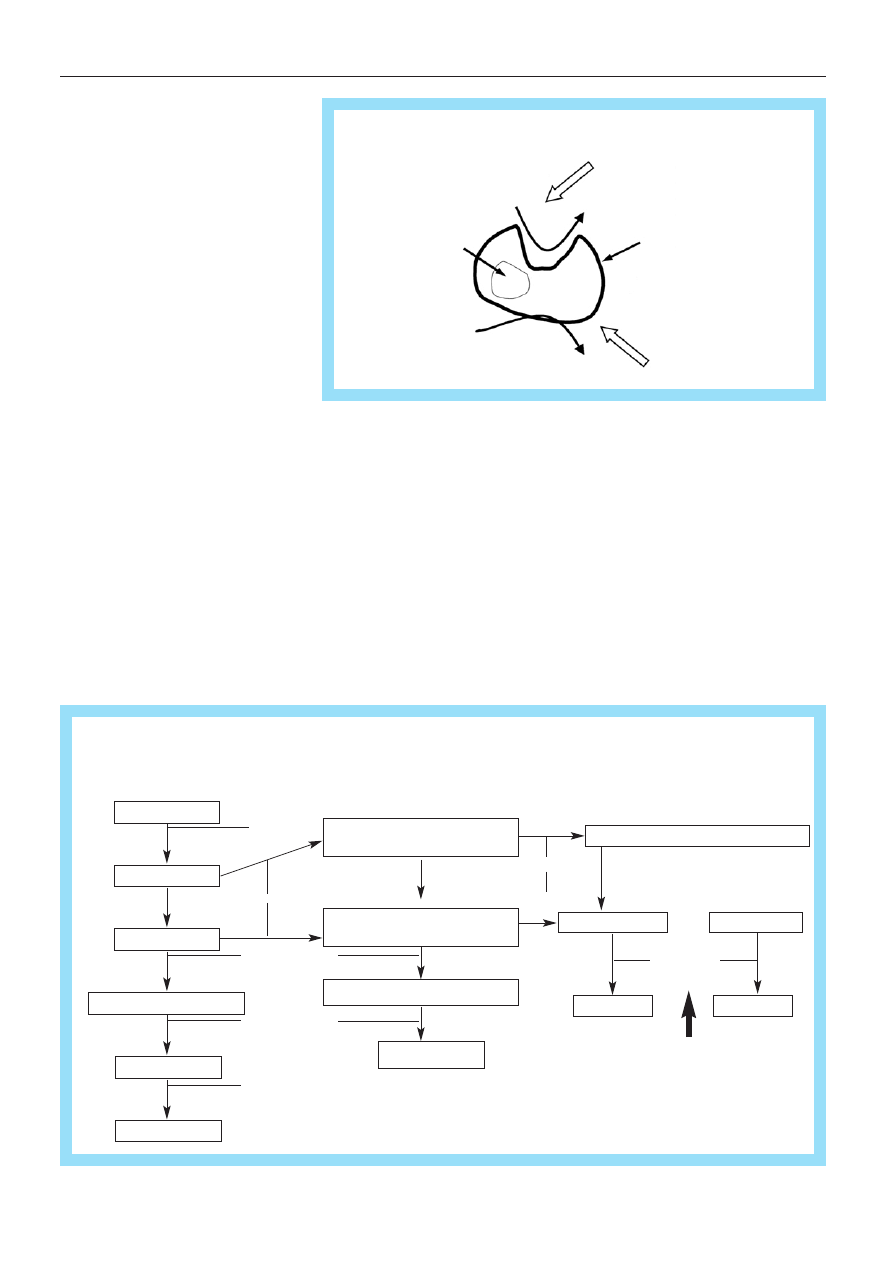
Kolejn¹ grup¹ leków stosowanych sze-
roko w hormonoterapii raka sutka s¹ blo-
kery aromatazy [11, 12]. U kobiet po me-
nopauzie estrogeny produkowane s¹ na
drodze konwersji z androgenów. Proces ten
odbywa siê w tkance t³uszczowej, miê-
œniach, w¹trobie oraz w tkance nowotwo-
rowej. Katalizowany jest przez kompleks
sk³adaj¹cy siê z 2 enzymów. Pierwszy
z nich, specyficzna aromataza wi¹¿e an-
drogen, który podlega procesowi aromaty-
zacji do fenolowego pierœcienia sterydu.
Drugi – reduktaza cytochromu P450 prze-
nosi elektrony z NADPH do aromatazy. Le-
ki z tej grupy mo¿na podzieliæ na blokery
sterydowe i niesterydowe. Pierwsze z nich
(foremestan, eksemestan) blokuj¹ miejsca
katalityczne enzymu.
Blokery niesterydowe nale¿¹ do 2 grup.
Nieselektywne (aminoglutetymid) – poza re-
duktaz¹ blokuj¹ równie¿ aktywnoœæ enzy-
mów z grupy hydroksylazy i desmolazy.
Powoduje to farmakologiczn¹ adrenalekto-
miê, co wi¹¿e siê z koniecznoœci¹ substy-
tucyjnego podawania glukokortykosterydów,
a w pewnych przypadkach równie¿ mine-
ralokortykosterydów. Inhibitory selektywne
(anastrozol, fadrozol, letrozol) blokuj¹ se-
lektywnie reduktazê cytochromu P450.
W zale¿noœci od stopnia blokowania
procesu aromatyzacji leki z tej grupy mo¿-
na równie¿ podzieliæ na blokery I, II i III
generacji. Najbardziej skuteczne blokery III
generacji hamuj¹ proces aromatyzacji w 99
proc. Skutecznoœæ leków z tej grupy wy-
daje siê porównywalna do blokerów recep-
torów estrogenowych.
Trzeci¹ grupê leków stanowi¹ agoniœci
LHRH. S¹ to polipeptydy o budowie zbli-
¿onej do LHRH. Z tego te¿ powodu zaraz
po podaniu powoduj¹ zwiêkszone wydzie-
lanie LH, natomiast po d³u¿szej ekspozycji
komórek przysadki na lek dochodzi do za-
hamowania wydzielania hormonu uwalnia-
Ryc. 3. Mechanizm dzia³ania blokerów aromatazy
Ryc. 4. Miejsce dzia³ania selektywnych i nieselektywnych blokerów aromatazy
M
Me
ec
ch
ha
an
niiz
zm
m d
dz
ziia
a³³a
an
niia
a iin
nh
hiib
biitto
orró
ów
w a
arro
om
ma
atta
az
zy
y
((tty
yp
p II v
vs
s tty
yp
p IIII))
a
an
nd
drro
og
ge
en
n
c
cy
ytto
oc
ch
hrro
om
m
P
P4
45
50
0
N
NA
AD
DP
P+
+
N
NA
AD
DP
PH
H
tty
yp
p IIII iin
nh
hiib
biitto
orró
ów
w
e
es
sttrro
og
ge
en
n
c
cz
z¹
¹s
stte
ec
cz
zk
ka
a a
arro
om
ma
atta
az
zy
y
tty
yp
p II iin
nh
hiib
biitto
orró
ów
w
S
Sy
yn
ntte
ez
za
a e
es
sttrro
og
ge
en
nó
ów
w –
– m
miie
ejjs
sc
ce
e d
dz
ziia
a³³a
an
niia
a s
se
elle
ek
ktty
yw
wn
ny
yc
ch
h
ii n
niie
es
se
elle
ek
ktty
yw
wn
ny
yc
ch
h** b
bllo
ok
ke
erró
ów
w a
arro
om
ma
atta
az
zy
y
c
ch
ho
olle
es
stte
erro
oll
1
17
7
αα
--
H
Hy
yd
drro
ok
ks
sy
yp
prre
eg
gn
ne
en
no
ollo
on
n
d
de
eh
hy
yd
drro
oe
ep
piia
an
nd
drro
os
stte
erro
on
n
a
an
nd
drro
os
stte
en
ne
ed
diio
on
n
tte
es
stto
os
stte
erro
on
n
e
es
sttrro
on
n
e
es
sttrra
ad
diio
oll
1
17
7
αα
--
H
Hy
yd
drro
ok
ks
sy
yp
prro
og
ge
es
stte
erro
on
n
1
11
1--D
De
eo
ok
ks
sy
yk
ko
orrtty
yz
zo
oll
k
ko
orrtty
yz
zo
oll
p
prre
eg
gn
ne
en
no
ollo
on
n
p
prro
og
ge
es
stte
erro
on
n
1
11
1--D
De
eo
ok
ks
sy
yk
ko
orrtty
yk
ko
os
stte
erro
on
n
k
ko
orrtty
yk
ko
os
stte
erro
on
n
a
alld
do
os
stte
erro
on
n
2
20
0,,2
22
2--L
Liia
az
za
a**
1
17
7,,2
20
0--L
Liia
az
za
a**
1
17
7
αα
--H
Hy
yd
drro
ok
ks
sy
ylla
az
za
a**
2
21
1
αα
--H
Hy
yd
drro
ok
ks
sy
ylla
az
za
a**
1
11
1
ββ
--H
Hy
yd
drro
ok
ks
sy
ylla
az
za
a**
a
arro
om
ma
atta
az
za
a
m
miie
ejjs
sc
ce
e d
dz
ziia
a³³a
an
niia
a lle
ek
ku
u
1
18
8 --H
Hy
yd
drro
ok
ks
sy
ylla
az
za
a**
95
Miejsce hormonoterapii w leczeniu raka piersi z uwzglêdnieniem roli letrozolu (Femara
)
j¹cego, co z kolei prowadzi do spadku po-
ziomu estradiolu. Leki z tej grupy to buse-
relina, goserelina, leuprolid i dekapeptyl.
S¹ one stosowane u kobiet przed meno-
pauz¹. Daj¹ 44 proc. obiektywnych remi-
sji, z czego 10 proc. ca³kowitych. Œredni
czas trwania remisji wynosi 8 mies. Naj-
czêœciej wystêpuj¹cym objawem ubocz-
nym, wystêpuj¹cym u 63 proc. leczonych
chorych s¹ uderzenia gor¹ca [13, 14].
Mechanizm dzia³ania leków z grupy pro-
gestagenów polega na hamowaniu osi pod-
wzgórze-przysadka-nadnercze, obni¿eniu po-
ziomu receptorów estrogenowych i progesta-
genowych oraz dzia³aniu na receptory
androgenowe i glukokortykosterydowe [15,
16]. W klinice stosuje siê g³ównie 2 leki.
Octan megestrolu w badaniach randomizo-
wanych wykaza³ skutecznoœæ porównywaln¹
do blokerów receptorów estrogenowych lecz
w optymalnej dawce 160 mg dziennie u 20
proc. chorych powoduje przyrost wagi cia-
³a. Lek stosowany w II rzucie powoduje 26
proc. remisji, z czego 5 proc. ca³kowitych.
Podobnymi w³aœciwoœciami cechuje siê
octan medroksyprogesteronu. Choæ lek jest
dostêpny w postaci doustnej, preferowan¹
drog¹ podania s¹ iniekcje domiêœniowe.
Ostatni¹ grup¹ leków hormonalnych s¹
antyprogestageny [17]. Blokuj¹ one recep-
tory dla progestagenów oraz glukokortyko-
sterydów. Leki z tej grupy to mifepriston
(RU 486), Org 31806 oraz ZKI 12996. Po-
woduj¹ 10–53 proc. remisji u chorych
uprzednio leczonych hormonalnie. Obec-
nie stosowane s¹ w badaniach klinicznych
razem z lekami antyestrogenowymi. Dzia-
³anie uboczne leków polega na hamowa-
niu syntezy glukokortykosterydów.
Hormonoterapia w raku sutka znajduje
zastosowanie w chemoprewencji, leczeniu
paliatywnym, leczeniu uzupe³niaj¹cym oraz
w pewnych przypadkach u osób starszych
w leczeniu neoadjuwantowym.
Chemoprewencja ma na celu zmniejsze-
nie zachorowalnoœci na raka sutka. Do chwi-
li obecnej zakoñczy³y siê 3 badania, ocenia-
j¹ce skutecznoœæ profilaktycznego stosowa-
nia tamoksyfenu. Podstaw¹ do stosowania
tego rodzaju leczenia by³y obserwacje,
wskazuj¹ce na spadek zachorowania na ra-
ka drugiej piersi o 50 proc. u kobiet leczo-
nych uzupe³niaj¹co tamoksyfenem. Najszer-
szym echem odbi³o siê badanie NSABP-P1,
prowadzone w USA i Kanadzie, a zamkniê-
te w kwietniu 1998 r. [18]. Kwalifikowano do
niego kobiety w wieku powy¿ej 60 lat oraz
w wieku 35–60 lat, je¿eli ryzyko zachorowa-
nia na raka sutka wynosi³o u nich co naj-
mniej 1,66 wg wieloczynnikowego modelu
prognostycznego Gaila. W badaniu tym,
w grupie leczonej tamoksyfenem stwierdzo-
no statystycznie znamiennie ni¿sz¹ zachoro-
walnoœæ zarówno na inwazyjnego, jak i nie-
inwazyjnego raka sutka, jednak ze wzglê-
dów etycznych badanie zosta³o wczeœniej
zamkniête. W grupie otrzymuj¹cej tamoksy-
fen stwierdzono zwiêkszon¹ zachorowalnoœæ
na raka trzonu macicy oraz wiêksz¹ ni¿
w grupie kontrolnej liczbê powik³añ zakrze-
powo-zatorowych. Jednak 2 inne zamkniê-
te do chwili obecnej badania (Italian Tamo-
xifen Prevention Study oraz Royal Marsden
Hospital Chemoprevention Study) nie po-
twierdzi³y tych wyników. Poniewa¿ ró¿ne by-
³y kryteria kwalifikuj¹ce, zw³aszcza w przy-
padku badania Royal Marsden Hospital, do
którego kwalifikowano chore obci¹¿one dzie-
dzicznie, przypuszcza siê w przypadku ra-
ków, gdzie promocja procesu nowotworowe-
go ma miejsce na pod³o¿u genetycznym
(mutacja genów z grupy BRCA), ¿e nie s¹
one hormonowra¿liwe. Wobec rozbie¿nych
wyników trudno jest obecnie wskazaæ kan-
dydatów do tego rodzaju leczenia.
W leczeniu paliatywnym u chorych na
zaawansowanego raka sutka, w przypad-
ku pozytywnego receptora hormonalnego,
hormonoterapia powinna byæ stosowana
jako leczenie pierwszego rzutu z tego
wzglêdu, ¿e pozwala uzyskaæ wyniki po-
równywalne do chemioterapii przy niewiel-
kiej toksycznoœci leczenia. Przed meno-
pauz¹ jako pierwszy rzut leczenia stosu-
je siê owariektomiê lub analogi LHRH,
jako drugi rzut mo¿na natomiast stosowaæ
leki z grupy blokerów receptorów estroge-
nowych. Po menopauzie stosuje siê blo-
kery receptorów estrogenowych, blokery
aromatazy, progestageny [19, 20, 21]. Ko-
lejnoœæ ta, mimo porównywalnej skutecz-
noœci podyktowana jest objawami ubocz-
nymi powodowanymi przez leki z po-
szczególnych grup.
Hormonoterapia jest równie¿ szeroko
stosowan¹ i uznan¹ metod¹ leczenia uzu-
pe³niaj¹cego u chorych leczonych opera-
cyjnie. Do leczenia tego kwalifikuje siê
wiêkszoœæ chorych, za wyj¹tkiem przypad-
ków guzów o œrednicy poni¿ej 1 cm, wy-
soko zró¿nicowanych histologicznie oraz
bez przerzutów do wêz³ów ch³onnych pa-
chy. Standardowym lekiem stosowanym
w leczeniu uzupe³niaj¹cym jest tamoksy-
fen. Przeprowadzona metaanaliza 133 ba-
dañ randomizowanych wykaza³a w grupie
leczonej poprawê 10-letnich prze¿yæ bez-
objawowych z 44,7 proc. do 51,2 proc.,
a prze¿yæ ca³kowitych z 52,6 do 58,8
proc. [22, 23]. U kobiet poni¿ej 50. roku
¿ycia równie¿ owariektomia w sposób zna-
mienny zmniejsza œmiertelnoœæ po lecze-
niu chirurgicznym.
Obecnie prowadzone s¹ badania oce-
niaj¹ce skutecznoœæ w leczeniu uzupe³nia-
j¹cym innych leków hormonalnych, takich
jak analogi LHRH oraz nowych blokerów
aromatazy. Podejmuje siê równie¿ próby
sekwencyjnego leczenia hormonalnego
(blokery receptorów estrogenowych oraz
blokery aromatazy). U chorych po meno-
pauzie z przerzutami do wêz³ów ch³onnych
i pozytywnym receptorem standardowo ko-
jarzy siê obecnie uzupe³niaj¹c¹ chemiote-
rapiê z leczeniem hormonalnym, chocia¿
wydaje siê, ¿e skojarzone leczenie popra-
wia wyniki u wszystkich pacjentek leczo-
nych uzupe³niaj¹co.
Tab. 2. Porównanie skutecznoœci letrozolu oraz octanu megestrolu jako leczenie II rzutu u chorych na zaawansowanego
raka sutka
letrozol 0,5 mg
letrozol 2,5 mg
octan megestrolu 160 mg
P
TTF*
3,9 m
5,1 m
3,2 m
NS
RR
12,8 proc.
23,6 proc.
16,4
,04
prze¿ycia
21,5 m
25,3 m
21,5 m
,03
* TTF – czas do wyst¹pienia niepowodzenia leczenia
1,0
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0,0
Start 13
26 39 52
65 78 91 100
pr
ogr
ession fr
ee
letrozole
tamoxifen
weeks
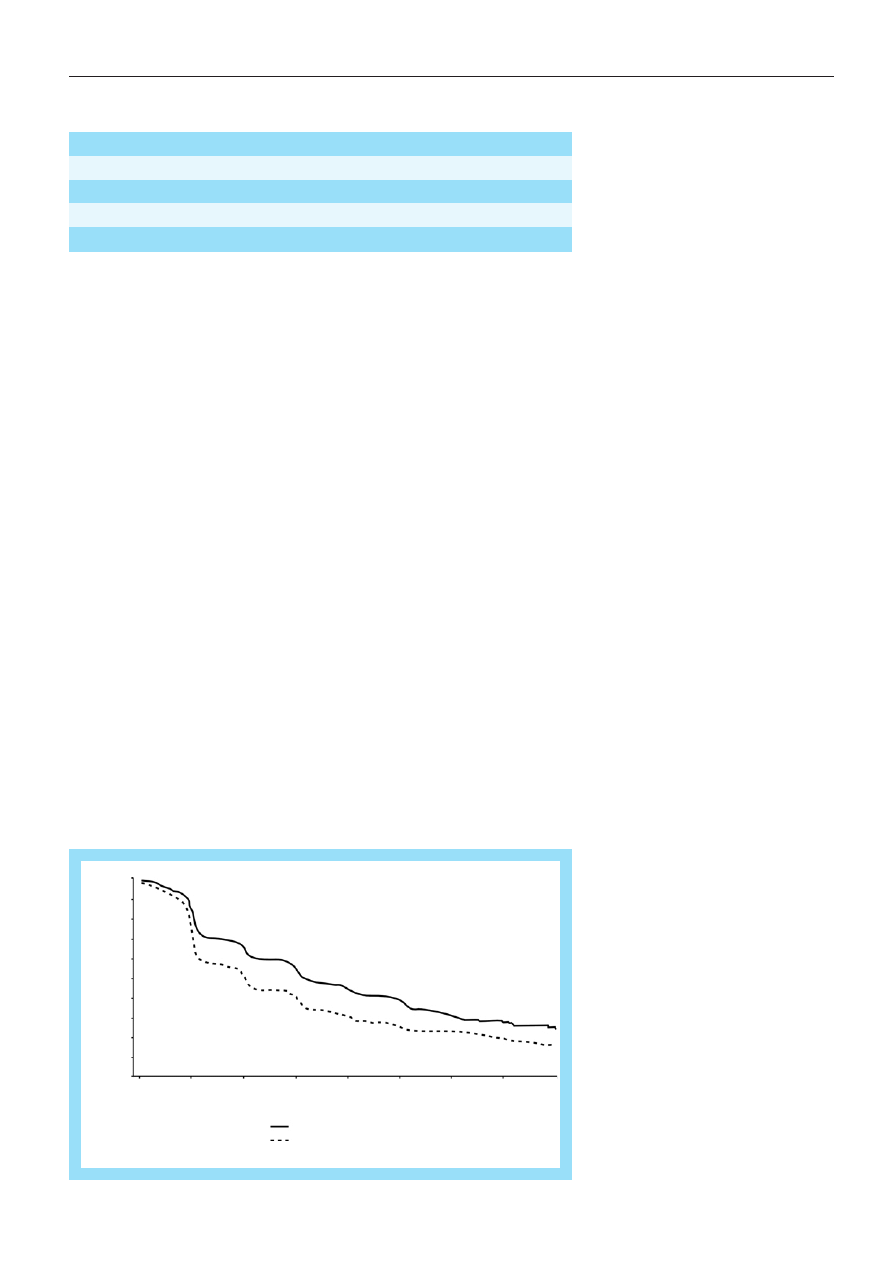
Ryc. 5. Porównanie czasu do progresji pacjentów leczonych letrozolem i tamoksyfenem (J Clin Oncol 2001; 19: 2596)

96
Wspó³czesna Onkologia
U kobiet starszych z miejscowo za-
awansowanym rakiem sutka, u których ist-
niej¹ przeciwwskazania do chemioterapii,
mo¿na zastosowaæ hormonoterapiê jako le-
czenie neoadjuwantowe.
Ostatnio podejmowane s¹ nowe kierun-
ki badañ, maj¹ce zwiêkszyæ skutecznoœæ
hormonoterapii. Poniewa¿ komórki z nad-
miern¹ ekspresj¹ c-erb B-2 s¹ oporne na
tamoksyfen, podjêto próby stosowania
przeciwcia³ przeciw temu bia³ku ³¹cznie
z antyestrogenem. Istnieje nadzieja, ¿e sku-
tecznoœæ tamoksyfenu zwiêkszaj¹ równie¿,
poprzez wp³yw na IGF I, pochodne soma-
tostatyny. Z kolei w leczeniu uzupe³niaj¹-
cym tamoksyfen kojarzony jest z pochod-
nymi witaminy A, które u zwierz¹t hamuj¹
proces karcinogenezy.
ZASTOSOWANIE LETROZOLU
(FEMARA
®
) W HORMONOTERAPII
RAKA SUTKA
Najczêœciej stosowanymi lekami z gupy
inhibitorów aromatazy s¹ letrozol (Femara
®
)
oraz anastrozol (Arimidex).
Letrozol (Femara
®
) jest selektywnym, nie-
sterydowym inhibitorem aromatazy III gene-
racji. Stosowany jest w hormonoterapii raka
sutka chorych po menopauzie z pozytywny-
mi receptorami hormonalnymi. Lek stosowa-
ny jest doustnie w dawce 2,5 mg dziennie.
Zmniejsza stê¿enie estronu o 80,8–82,0
proc., estradiolu o 68,1–84,1 proc., a aktyw-
noœæ aromatazy o 98,4–98,9 proc. Nie wp³y-
wa na produkcjê glikokortykosteroidów, mi-
neralokortykosteroidów i na czynnoœæ tar-
czycy.
Tolerancja
leku
jest
dobra.
Najczêœciej wystêpuj¹ce objawy uboczne to
bóle g³owy, nudnoœci, obrzêki [24].
U chorych pomenopauzalnych, leczo-
nych uprzednio hormonalnie, lek pozwala
uzyskaæ obiektywn¹ remisjê u 25 proc.
przypadków.
W badaniach randomizowanych, w któ-
rych w tej grupie pacjentów porównywano
letrozol w dawce 0,5 mg i 2,5 mg z octa-
nem megestrolu w dawce 160 mg wynika,
¿e letrozol w dawce 2,5 mg powoduje
wy¿szy odsetek remisji obiektywnych
o istotnie d³u¿szym czasie trwania [25].
Octan megestrolu okaza³ siê w tym ba-
daniu lekiem bardziej toksycznym, zw³asz-
cza je¿eli chodzi o powik³ania sercowo-na-
czyniowe, g³ównie epizody choroby zakrze-
powej (letrozol 2,5 mg 10 proc., octan
megestrolu 20 proc.).
W ostatnio przeprowadzonych bada-
niach randomizowanych letrozol okaza³ siê
równie¿ bardziej skuteczny ni¿ tamoksyfen
w hormonoterapii I rzutu u kobiet w wieku
pomenopauzalnym z zaawansowanym ra-
kiem sutka z pozytywnym lub nieznanym
poziomem receptorów hormonalnych [26].
Kobiety by³y randomizowane – otrzymuj¹-
ce letrozol 2,5 mg dziennie (n=453) lub ta-
moksyfen 20 mg dziennie (n=454). Podsta-
wowym ocenianym parametrem by³ czas do
wyst¹pienia progresji nowotworu. Ponadto
oceniono odsetek remisji obiektywnych oraz
czas ich trwania, odsetek tzw. korzyœci kli-
nicznej (CR + PR + NC>24 m) i czas jej
trwania, czas do wyst¹pienia niepowodze-
nia leczenia oraz objawy niepo¿¹dane.
Letrozol okaza³ siê bardziej skuteczny
ni¿ tamoksyfen, bior¹c pod uwagê czas do
wyst¹pienia progresji nowotworu (41 vs 26
tyg.), zmniejszaj¹c jednoczeœnie prawdopo-
dobieñstwo wyst¹pienia progresji o 30 proc.
Czas do wyst¹pienia progresji nowotwo-
ru by³ d³u¿szy u chorych otrzymuj¹cych le-
trozol, niezale¿nie od dominuj¹cej lokaliza-
cji nowotworu, poziomu receptorów hormo-
nalnych oraz wczeœniejszego leczenia
uzupe³niaj¹cego lekami blokuj¹cymi recep-
tory estrogenowe. Letrozol okaza³ siê rów-
nie¿ bardziej skuteczny ni¿ tamoksyfen, bio-
r¹c pod uwagê czas do wyst¹pienia niepo-
wodzenia leczenia (40 vs
25 tyg.,
p=0,0001). U chorych otrzymuj¹cych letro-
zol stwierdzono równie¿ wy¿szy odsetek re-
misji oraz wiêcej pacjentów uzyska³o korzy-
œci kliniczne z przeprowadzonego leczenia.
Nie stwierdzono istotnych ró¿nic miêdzy
letrozolem a tamoksyfenem w czasie trwa-
nia remisji i czasie trwania korzyœci klinicz-
nych.
Objawy niepo¿¹dane wystêpowa³y
w obu grupach chorych z podobn¹ czê-
stotliwoœci¹ (38 proc. w grupie leczonej le-
trozolem, a 37 proc. w grupie otrzymuj¹-
cej tamoksyfen). By³y to g³ównie uderzenia
gor¹ca i nudnoœci. Epizody choroby za-
krzepowej stwierdzono u 1 proc. chorych
leczonych letrozolem i 2 proc. w przypad-
ku podawania tamoksyfenu.
Letrozol okaza³ siê równie¿ bardziej sku-
teczny ni¿ tamoksyfen w leczeniu przed-
operacyjnym chorych po menopauzie,
z miejscowo zaawansowanym rakiem sut-
ka z pozytywnym receptorem estrogeno-
wym [27]. Po 4 mies. leczenia obiektywn¹
remisjê stwierdzono u 60 proc. chorych
w grupie leczonej letrozolem przy 41 proc.
u
chorych leczonych tamoksyfenem.
Oszczêdzaj¹ce leczenie chirurgiczne mo¿-
liwe by³o u 48 proc. chorych w przypadku
letrozolu, a 36 proc. w przypadku hormo-
noterapii tamoksyfenem.
Ró¿nice te okaza³y siê jeszcze wiêksze
w przypadku hormonoterapii przedopera-
cyjnej raka sutka z pozytywnym recepto-
rem estrogenowym i/lub progesteronowym
oraz nadmiern¹ ekspresjê ErbB-1 i ErbB-2
[28]. W tej grupie chorych pozytywn¹ od-
powiedŸ na leczenie stwierdzono u 88
proc. chorych leczonych letrozolem, a tyl-
ko u 21 proc. otrzymuj¹cych tamoksyfen.
Ró¿nicê tê t³umaczy siê faktem, i¿ ErbB-1
i ErbB-2 bior¹ udzia³ w procesie fosforyla-
cji receptora estrogenowego, co hamuje
antagonistyczne dzia³anie tamoksyfenu.
Obecnie prowadzone s¹ badania rando-
mizowane, oceniaj¹ce skutecznoœæ lecze-
nia uzupe³niaj¹cego letrozolem u chorych
na raka sutka po leczeniu operacyjnym. Je-
¿eli badania te wyka¿¹ zmniejszenie zacho-
rowalnoœci na raka drugiego sutka, stan¹
siê podstaw¹ do prób zastosowania tego
leku w chemoprewencji.
Podsumowuj¹c, letrozol stwarza now¹
mo¿liwoœæ leczenia chorych na zaawanso-
wanego raka sutka z pozytywnym recepto-
rem hormonalnym. Okaza³ siê on bardziej
skuteczny ni¿ tamoksyfen w hormonoterapii
I rzutu. Jest równie¿ bardziej skuteczny ni¿
progestageny jako leczenie II rzutu, w przy-
padku niepowodzenia tamoksyfenu. Ostatnio
przeprowadzone badania wskazuj¹ na du¿¹
skutecznoϾ leku w hormonoterapii przed-
operacyjnej. Du¿e nadzieje budzi wprowa-
Tab. 3. Porównanie skutecznoœci letrozolu i tamoksyfenu w hormonoterapii I rzutu u chorych na zaawansowanego raka sutka
lle
ettrro
oz
zo
oll
tta
am
mo
ok
ks
sy
yffe
en
n
ll.. c
ch
ho
orry
yc
ch
h
p
prro
oc
c..
ll.. c
ch
ho
orry
yc
ch
h p
prro
oc
c..
P
P
OR (CR + PR)
137
30
92
20
.0006
CR
34
8
13
3
PR
103
23
79
17
korzyϾ kliniczna
221
49
173
38
.001
(CR+PR+NC>24m)
200
44
250
55
PD
Tab. 4. Porównanie skutecznoœci letrozolu i tamoksyfenu jako leczenia przedoperacyjnego u chorych na raka sutka
lle
ettrro
oz
zo
oll ((u
u=
=1
15
54
4))
tta
am
mo
ok
ks
sy
yffe
en
n ((u
u=
=1
17
70
0))
P
P
CR+PR klinicznie
55 proc.
36 proc.
<0,001
CR+PR w USG
35 proc.
25 proc.
0,042
CR+PR w mammografii
34 proc.
16 proc.
<0,001
oszczêdzaj¹ce leczenie
45 proc.
35 proc.
0,022
operacyjne

97
Miejsce hormonoterapii w leczeniu raka piersi z uwzglêdnieniem roli letrozolu (Femara
)
dzenie preparatu do hormonoterapii uzupe³-
niaj¹cej oraz chemoprewencji, co jest celem
obecnie prowadzonych badañ klinicznych.
PIŒMIENNICTWO
1. Beatson GT. On the treatment of inoperable ca-
ses of carcinoma of the mammary: Suggestions
for a new method of treatment, with illustrative
cases. Lancet 1996; 104-7; 162-5.
2. Wittliff JL. Steroid-hormone receptors in breast
cancer. Cancer 1985; 3: 630-43.
3. McGuire WL, Chamness GC, Fuqua SAW. Mini-
-review – Estrogen receptor variants in clinical
breast cancer. Mol Endocrinol 1991; 5: 1571-7.
4. McDonnell DP, Clemm DL, Hermann T, et al.
Analysis of estrogen receptor function reveals
three distinct classes of antiestrogens. Mol En-
docrinol 1995; 9: 659-69.
5. Colletta AA, Benson JR, Baum M. Alternative
mechanisms of action of anti-oestrogenes. Bre-
ast Cancer Res Treat 1994; 31: 5-9.
6. Mouridsen H, Palshof T. Tamoxifen in advanced
breast cancer. Cancer Treat Rev 1978; 5: 131-41.
7. Jaiyesimi I, Buzdar AU, Decker DA, et al. Use
of tamoxifen for breast cancer: twenty eight
years later. J Clin Oncol 1995; 13: 513-29.
8. Hayes DF, Van Zyl JA, Hacking A, et al. Ran-
domized comparison of tamoxifen and two sepa-
rate doses of toremifene in postmenopausal pa-
tients with metastatic breast cancer. J Clin On-
col 1995; 13: 2556-66.
9. Nicholson RI, Gee JM, Bryant S, et al. Pure
antiestrogenes. The most important advance in
the endocrine therapy of breast cancer since
1896. Ann NY Acad Sci 1996; 784: 325-35.
10. Gradishar WJ, Jordan VC. Clinical potential of
new antiestrogenes. J Clin Oncol 1997; 15:
840-52.
11. Brodie AMH, Njar VCO. Aromatase inhibitors
and breast cancer. Semin Oncol 1996; 23
(Suppl. 9): 10-20.
12. Masamura S, Adlercreutz H, Harvery H, et al.
Aromatase inhibitor development for treatment of
breast cancer. Breast Cancer Res Treat 1994;
33: 19-26.
13. Taylor CW, Green S, Dalton WS, et al. Multi-
center randomized clinical trial of goserelin ver-
sus surgical ovariectomy in premenopausal pa-
tients with receptor-positive metastatic breast
cancer: an intergroup study. J Clin Oncol 1998;
994-9.
14. Saphner T, Troxel AB, Tormey DC, et al. Phase
II study of goserelin for patients with postmeno-
pausal metastatic breast cancer. J Clin Oncol
1993; 11: 1529-35.
15. Horowitz KB, Wei LL, Sedlacek SM, et al. Pro-
gestin action and progesterone receptor structu-
re in human breast cancer: a review. Rec Prog
Horm Res 1985; 41: 249-316.
16. Birrell SN, Roder DM, Horfall DJ, et al. Medro-
xyprogesterone acetate therapy in advanced
breast cancer: the predictive value of androgen
receptor expression. J Clin Oncol 1995; 13:
1572-7.
17. Romieu G, Mandelonde T, Ulman A, et al. The
antiprogestin RU486 in advanced breast cancer:
preliminar clinical trial. Bulletin du Cancer 74:
455-9.
18. Wickerham DL, Constantino JC, Fisher B, et
al. The initial results from NSABP P-1: a clinical
trial to determine the worth of tamoxifen for pre-
venting breast cancer in women at increased
risk. Proc Annu Meet Am Soc Oncol 1998; 17:
A3a.
19. Henderson IC. Endocrine therapy of metastatic
breast cancer. In: Breast Diseases. 2nd ed. (Har-
ris JR, Hellmann S, Henderson IC, Kinne DW,
eds.). Philadelphia Lippincott, 1995; 559-603.
20. Early Breast Cancer Trialists Collaborative Group.
Systemic treatment of early breast cancer by hor-
monal, cytotoxic, or immune therapy. Lancet
1992; 339: 1-15, 71-85.
21. Rose C. Endocrine therapy of advanced breast
cancer. In: Consensus Development in Cancer
Therapy: Therapeutic Management of Metastatic
Breast Cancer (Kaufmann M, Henderson IC,
Enghofer E, eds.). 1989; Berlin, de Gruyter.
22. Early Breast Cancer Trialists Collaborative Gro-
up. Systemic treatment of early cacer by hormo-
nal, or immune therapy: 133 randomized trials in-
volving 31.000 recurrences and 24.000 deaths
among 75.000 women. Lancet 1992; 339: 1-15,
71-85.
23. Early Breast Cancer Trialists Collaborative Gro-
up. Tamoxifen for early breast cancer: an ove-
rview of randomized trials. Lancet 1998; 351-
1467.
24. Tominaga T, Ohashi Y, Abe R. Phase II trial of
letrozole (a novel nonsteroidal aromatase
inhibitor) in postmenopauzal patients with
advanced or recurrent breast cancer. Eur J
Cancer 1995; 31A, A81.
25. Dombernowsky P, Smith I, Falkson G, et al.
Letrozole, a new oral aromataze inhibitor for ad-
vanced breast cancer: Double-blind randomized
trial showing a dose effect and improved efficacy
and tolerability compared with megestrol aceta-
te. J Clin Oncol 1998; 16: 453-61.
26. Mouridsen H, Gershamovic M, Sun Y, et al.
Superior eficacy of letrozole (Femara
) versus ta-
moxifen as first-line therapy for postmenopaual
women with advanced breast cancer: Result of
a phase III study of the International Letrozole
Breast Cancer Group. J Clin Oncol 2001; 19:
2596-606.
27. Eirmann W, Paeple S, Appfelstaed J, et al.
Preoperative treatment of postmenopauzal bre-
ast cancer with letrozole: A randomized double-
-blind multicenter study. Ann Oncol 2001; 12:
1527-32.
28. Ellis MJ, Coop A, Singh B, et al. Letrozole is
more effective neoadjuvant endocrine therapy
than tamoxifen for erb B-1 and/or erb-2 positive,
estrogen receptor-positive primary breast can-
cer: Evidence from a phase III randomized trial. J
Clin Oncol 2001; 19: 3808-16.
ADRES DO KORESPONDENCJI
prof. dr hab. med. M
Ma
arre
ek
k P
Pa
aw
wlliic
ck
kii
Klinika Chemioterapii
Centrum Onkologii
- Instytutu im. M. Sk³odowskiej-Curie
ul. Garncarska 11
31-115 Kraków
Wp³aty mo¿na dokonaæ na konto:
Termedia sp. z o.o. ul. Kleeberga 8,
61-615 Poznañ
WBK SA III Oddzia³ Poznañ,
10901359–604022–128–0100–01
lub
wype³niæ i wys³aæ formularz
zamieszczony na stronach
internetowych:
www.termedia.pl
Wydawca: TERMEDIA
Wydawnictwa Medyczne
W 2002 roku uka¿e siê
10 wydañ
Przewodnika Lekarza.
Cena jednego egz.: 10,00 z³
Cena jednego egz.
w prenumeracie: 8,00 z³
Cena prenumeraty
na 2002 r.: 80,00 z³
Ilustrowane czasopismo medyczne, skie-
rowane przede wszystkim do lekarzy opie-
ki podstawowej, lekarzy rodzinnych i rejo-
nowych, lekarzy prowadz¹cych prywatn¹
praktykê oraz samodzielnych placówek
opieki zdrowotnej.
Wyszukiwarka
Podobne podstrony:
GENETYKA 01 Dziedziczny rak sutka
GENETYKA 01. Dziedziczny rak sutka, GENETYKA ćwiczenie 1
pyt 18 rak sutka, Fizjoterapia
rak sutka
rak sutka (3)
Rak sutka leczenie oszczędzjące
rak sutka
GENETYKA 01. Dziedziczny rak sutka
Rak sutka ppt
Rak+sutka
Rak sutka, Chirurgia(1)
Rak sutka u kobiet w cišży, ustny
RAK SUTKA TARNOBRZEG
Rak sutka
GENETYKA 01 Dziedziczny rak sutka
Rak sutka Agata
rak sutka
rak sutka (3)
więcej podobnych podstron