
N
O W O C Z E S N Y
T
E C H N I K
D
E N T Y S T Y C Z N Y
20
I M P L A N T O P R O T E T Y K A
Wpływ obróbki
modyfikującej powierzchnie
implantów tytanowych
na stan zapalny okołowszczepowy – periimplantitis – cz. II
TITLE
Influence of titanium implants
surface modifying process on periimplantitis
– p. II
SŁOWA KLUCZOWE
analiza, implantacja,
periimplantitis, reakcje zapalne
STRESZCZENIE
Celem pracy jest
analiza stopnia adhezji mikroorganizmów
do powierzchni implantów protetycznych,
w zależności od zastosowania lub braku
obróbki modyfikującej powierzchnie
implantu.
KEY WORDS
analysis, implantation,
periimplantitis, inflammatory reactions
SUMMARY
Aim of this study is to analyze
the degree of microorganisms adhesion
to the surface of dental implants, depending
on the application or non-treatment
modifies the surface of the implant.
mgr inż. tech. dent. Tadeusz Zdziech
1
, prof. dr hab. n. tech. Maciej Hajduga
2
P
rzeprowadzone badania
mikrobiologiczne
szczepów bakteryjnych
wykazały zwiększoną
liczbę szczepów na niemo-
dyfikowanej powierzchni
tytanowego implantu
w porównaniu z powierzch-
nią modyfikowaną
jonami srebra, wpływając
na ograniczenie reakcji
zapalnych wokół wprowa-
dzonego wszczepu.
Wszystkie implanty SPI
®
mają kształt
śruby i samonacinający się gwint,
a ich śródkostna część (infrastruk-
tura) ma kształt cylindryczny lub
stożkowo-cylindryczny. Stożkowaty,
zaokrąglony wierzchołek sprzyja
optymalnemu umieszczeniu implan-
tu w łożu kostnym. Dodatkowo, po-
wierzchnia infrastruktury implantu
jest wypiaskowana tlenkiem glinu
(Al
2
O
3
)
o gradacji 25-50 μm i termicz-
nie wytrawiona roztworem kwasów
– 50% HCl (32-proc.), 25% H
2
SO
4
(95-97-proc.) – i 25% H
2
O w tempe-
raturze 108°C i czasie t = 5 minut,
co wpływa pozytywnie na proces
osteointegracji.
Implanty SPI
®
są dostępne w steryl-
nych plastikowych ampułkach, wraz
ze zintegrowaną śrubą zamykającą.
W systemie SPI
®
występują cztery
typy implantów: Element, Contact,
ONETIME, Direct. Badaniu został
poddany implant typu Element, który
jest stosowany w zabiegach dwufazo-
wych. Dzięki małej wysokości szyjki,
wynoszącej 1 mm, można za pomocą
tego typu implantu uzyskać bardzo
dobry efekt estetyczny, zwłaszcza
w odcinku przednim.
M
ODYFIKACJA
WARSTWY
WIERZCHNIEJ
IMPLANTU
Implant uzyskuje swoje podstawo-
we cechy i biokompatybilność dzięki
składowi chemicznemu materiału,
z którego został zbudowany. Naj-
większe znaczenie dla akceptacji
implantu przez tkankę, czyli proce-
su osteointegracji, ma jednak skład
jego warstwy wierzchniej (warstwa
wierzchnia wszczepu tytanowego
została zmodyfikowana poprzez im-
plantację jonów srebra w Instytucie
Fizyki Jądrowej Polskiej Akademii
Nauk w Krakowie przez dr. Bogusła-
wa Rajchela).
Dlatego też coraz szersze zasto-
sowanie znajdują obróbki mody-
fikujące powierzchnie implantów
tytanowych, do których należą:
implantacja jonów, utlenianie ano-
dowe, procesy natryskiwania ciepl-
nego bądź napylania próżniowego,
metoda zol-żel, procesy jarzeniowe
oraz coraz popularniejsze metody
hybrydowe. Najczęstszymi rodzaja-
mi modyfikacji powierzchni meta-
lowych wszczepów stomatologicz-
nych są:
1. Powierzchnia TI-unite lub SLA,
którą uzyskuje się poprzez obróbkę
strumieniowo-ścierną powierzch-
ni implantu przy użyciu grubych
ziaren piasku. Ziarna te powodują
uzyskanie porowatej makrostruk-
tury tytanu, która następnie zosta-
je wytrawiana kwasem, tworząc
mikrootwory i zwiększając po-
wierzchnię kontaktu.
6
/ 2 0 1 2
21
I M P L A N T O P R O T E T Y K A
2. Powleczenie implantu tytanowego
preparatem Tytan-Plazma-Flame
(TPF) rozgrzanym w łuku elek-
trycznym w osłonie argonowej.
Grubość tej warstwy wynosi około
0,3 mm i zwiększa powierzchnie łą-
czącą 6-krotnie w porównaniu z im-
plantami o gładkiej powierzchni.
3. Pokrycie powierzchni implantu
powłoką hydroksyapatytową (HA).
Badania implantów pokrytych po-
włoką hydroksyapatytową i zasto-
sowanych w jamie ustnej wykazały
odrywanie się powłoki od korpusu
tytanowego oraz wadliwą mecha-
nicznie i biologicznie stabilność
w kontakcie z kością i tkanką
miękką.
4. Powłoki z tlenku glinu, tlenku tan-
talu lub tlenku cyrkonu. Kontakt
pomiędzy tymi warstwami a ko-
ścią opiera się na nawarstwieniu
tkanki kostnej i określany jest jako
bioinercyjny – nieaktywny. Ostat-
nie badania dowiodły, że tworzą
z tkanką kostną związek fizykoche-
miczny, co w konsekwencji prowa-
dzi do zmian na powierzchni struk-
tury implantu.
5. Powierzchnia CELLplus. Jest ona
nowym osiągnięciem biotech-
nologii, które aktywnie wspiera
biologiczne procesy prowadzące
do nawarstwiania się kości wokół
implantu. Powierzchnia ta działa
jak gąbka i wchłania z otoczenia
zarówno krew, jak i krążące w niej
komórki kostne. Ta ułatwiająca
wchłanianie siła powierzchni pro-
wadzi do intensyfikacji wczesnych
stadiów gojenia się kości na im-
plancie nawet w słabej jakościowo
tkance.
Implantacja jonów jest procesem
domieszkowania materiałów opar-
tym na wykorzystaniu wysokiej
energii kinetycznej. Atomy domiesz-
ki są jonizowane w źródle jonów,
a następnie przyśpieszone w polu
elektrycznym do energii od kilku-
dziesięciu do kilkuset kiloelektro-
nowoltów (odpowiadającej pręd-
kości setek do tysięcy kilometrów
na sekundę). Uformowana wiązka
jonów kierowana jest na powierzch-
nię dowolnego materiału. Dzięki
odpowiednio dużej energii jonów
zostają one wprowadzone (wbite)
do bombardowanego materiału
na głębokość do jednego mikrome-
tra. W naszym przypadku warstwa
wierzchnia implantu tytanowego
została poddana procesowi implan-
tacji jonów srebra dawką jonów
10
16
/jon/cm
2
i energii implantacji
15 keV.
G
RUPY
BADAWCZE
Badaniu zostały poddane implanty
protetyczne opracowane w systemie
SPI
®
typu Element, powierzchnia jed-
nego z implantów została poddana
obróbce modyfikującej poprzez im-
plantację jonów srebra.
M
ETODYKA
BADAŃ
Badanie adhezji szczepów do implan-
tu przeprowadzono na pięciu szcze-
pach testowych:
• Actinobacillus actinomycetum,
• Fusobacterium nucleatum,
• Campylobacter rectus,
• Peptostreptococcus micros,
• Bacteroides.
Szczepy Actinobacillus actinomy-
cetum, Fusobacterium nucleatum,
Campylobacter rectus, Peptostrep-
tococcus micros, Bacteroides forsy-
thus wysiewano na agar wzbogaco-
ny z dodatkiem 5% krwi baraniej.
Ink ubowano pr zez 72 godziny
w 37°C w warunkach beztlenowych
z dodatkiem 5% CO
2
. Po tym czasie
szczepy zawieszano w roztworze fi-
zjologicznym soli (10
3
komórek/ml).
W każdej zawiesinie z mikroorgani-
zmami umieszczano oba implanty.
Próbę kontrolną stanowiły implan-
ty zawieszone w soli fizjologicznej.
Implanty w zawiesinie mikroorga-
nizmów i w soli fizjologicznej in-
kubowano przez 60 minut w 37
o
C,
wstrząsając zawiesiną co 15 minut.
Po inkubacji implanty przemywano
trzykrotnie w roztworze soli fizjo-
logicznej, następnie umieszczono
je w jałowej wilgotnej komorze.
W tym samym dniu, a następnie
w odstępach co 24 h z komory wyj-
mowano implanty. Po osuszeniu
implanty przykładano, a następ-
nie delikatnie toczono na agarze
wzbogaconym z krwią. Hodowle
inkubowano przez 72 godz. w 37°C,
w warunkach beztlenowych z do-
Implant uzyskuje swoje
podstawowe cechy
i biokompatybilność dzięki
składowi chemicznemu
materiału, z którego został
zbudowany. Największe
znaczenie dla akceptacji
implantu przez tkankę, czyli
procesu osteointegracji, ma
jednak
skład jego warstwy
wierzchniej
.
N
O W O C Z E S N Y
T
E C H N I K
D
E N T Y S T Y C Z N Y
22
I M P L A N T O P R O T E T Y K A
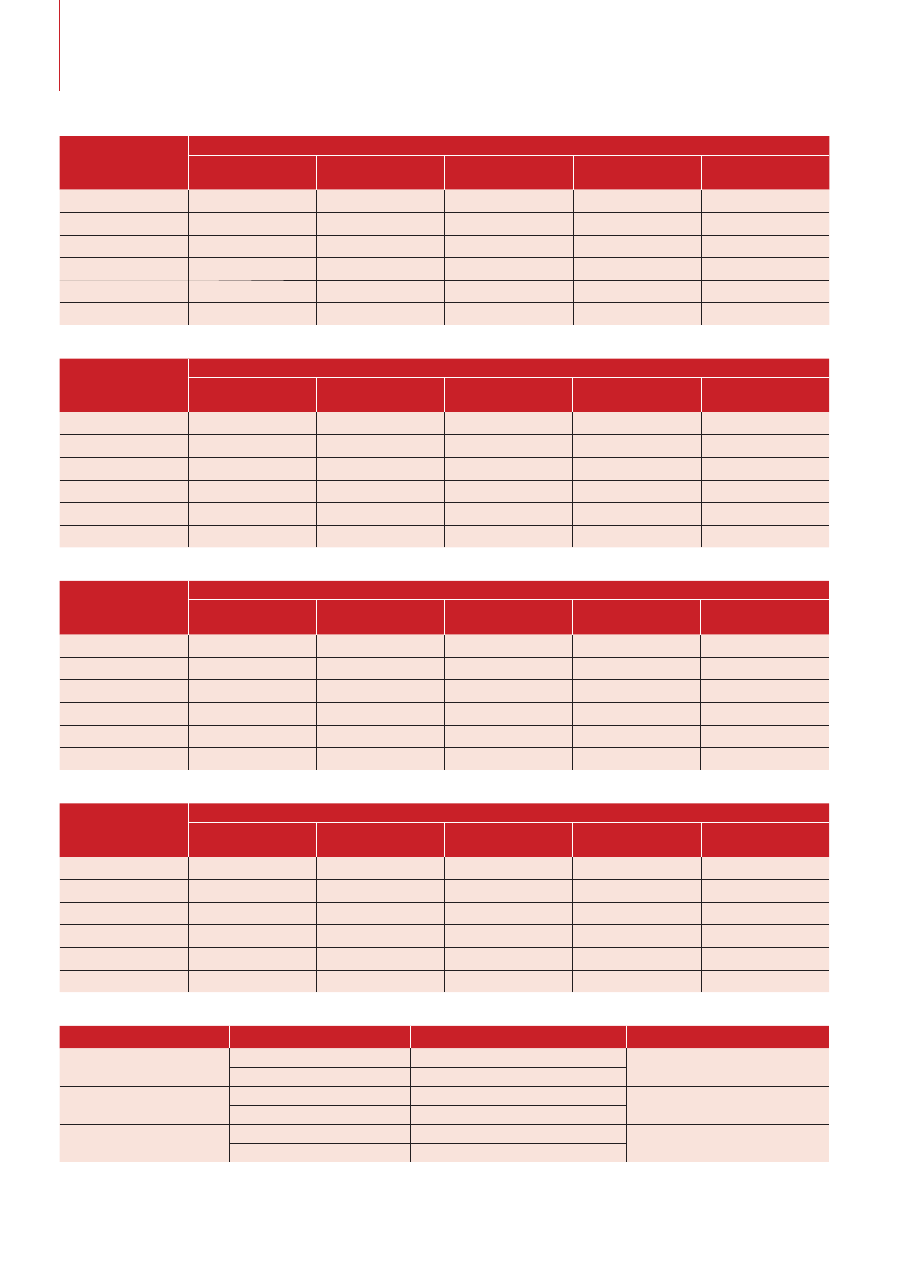
Dzień inkubacji
Liczba wyrosłych kolonii
Actinobacillus
actinomycetum
Fusobacterium
nucleatum
Campylobacter
rectus
Peptostreptococ-
cus micros
Bacteroides
forsythus
1
108
82
52
99
94
2
94
63
68
81
67
3
80
33
42
36
39
4
46
12
2
13
8
5
12
0
0
0
0
KONTROLA
0
0
0
0
0
Tab. 1. Przeżywalność bakterii na implantach z dodatkiem srebra. Wynik pierwszego badania
Dzień inkubacji
Liczba wyrosłych kolonii
Actinobacillus
actinomycetum
Fusobacterium
nucleatum
Campylobacter
rectus
Peptostreptococ-
cus micros
Bacteroides
forsythus
1
93
76
73
101
89
2
83
69
52
92
69
3
73
31
36
31
32
4
62
11
4
10
14
5
15
0
0
0
0
KONTROLA
0
0
0
0
0
Tab. 2. Przeżywalność bakterii na implantach z dodatkiem z srebra. Wynik drugiego badania
Dzień inkubacji
Liczba wyrosłych kolonii
Actinobacillus
actinomycetum
Fusobacterium
nucleatum
Campylobacter
rectus
Peptostreptococ-
cus micros
Bacteroides
forsythus
1
156
141
126
149
121
2
123
131
117
127
85
3
115
84
90
73
72
4
83
62
63
53
35
5
79
56
32
32
12
KONTROLA
0
0
0
0
0
Tab. 3. Przeżywalność bakterii na implantach bez udziału srebra. Wynik pierwszego badania
Dzień inkubacji
Liczba wyrosłych kolonii
Actinobacillus
actinomycetum
Fusobacterium
nucleatum
Campylobacter
rectus
Peptostreptococ-
cus micros
Bacteroides
forsythus
1
149
152
143
132
131
2
127
127
127
112
98
3
121
111
90; 66
81
81
4
92
73
44
69
39
5
85
62
35
42
21
KONTROLA
0
0
0
0
0
Tab. 4. Przeżywalność bakterii na implantach bez udziału srebra. Wynik drugiego badania
TEST
IMPLANT
ŚREDNIA ABSORBANCJA
RÓŻNICA W ADHEZJI
Alamar Blue
A
1,167
20%
B
0,929
MTT
A
0,239
13%
B
0,208
Safranin
A
0,280
14%
B
0,242
Tab. 5. Referencyjny szczep Streptococcus mutans, test (24 h)
6
/ 2 0 1 2
23
I M P L A N T O P R O T E T Y K A
datkiem CO
2
, po czym liczono wy-
rosłe kolonie.
Referencyjny szczep Streptococ-
cus mutans wysiewano na wzboga-
cony agar. Hodowlę w warunkach
tlenowych i w temperaturze 37°C
inkubowano przez 48 godzin. Uzy-
skaną hodowlę zmywano roztworem
soli fizjologicznej (PBS) i doprowa-
dzano do gęstości 2 McF. Uzyskaną
w ten sposób zawiesinę bakteryjną
podzielono na dwie części, jedną in-
kubowano przez godzinę, natomiast
drugą przez 3 godziny w tempera-
turze 25°C. Po inkubacji wykona-
no testy pozwalające na określenie
stopnia adhezji mikroorganizmów
do implantów. Wykonano następują-
ce testy: Alamar Blue, redukcji MTT
i barwienie safraniną. W przypadku
inkubacji przez 24 h bakterie inkubo-
wano w podłożu mikrobiologicznym
BHI (Brain Heart Infussion). Dodatko-
wym testem były posiewy powierzch-
niowe wykonane po 15-minutowej
inkubacji i wytrząsaniu implantów
w 2-proc. roztworze saponiny w PBS.
Posiewy wykonywane były na podło-
żu stałym BHI. Kolonie liczone były
po 48 h inkubacji w temperaturze
37°C. Po 24 h inkubacji nie można
było uzyskać wyników pozwalają-
cych na porównanie z kontrolą (za-
wiesina bakterii bez implantów),
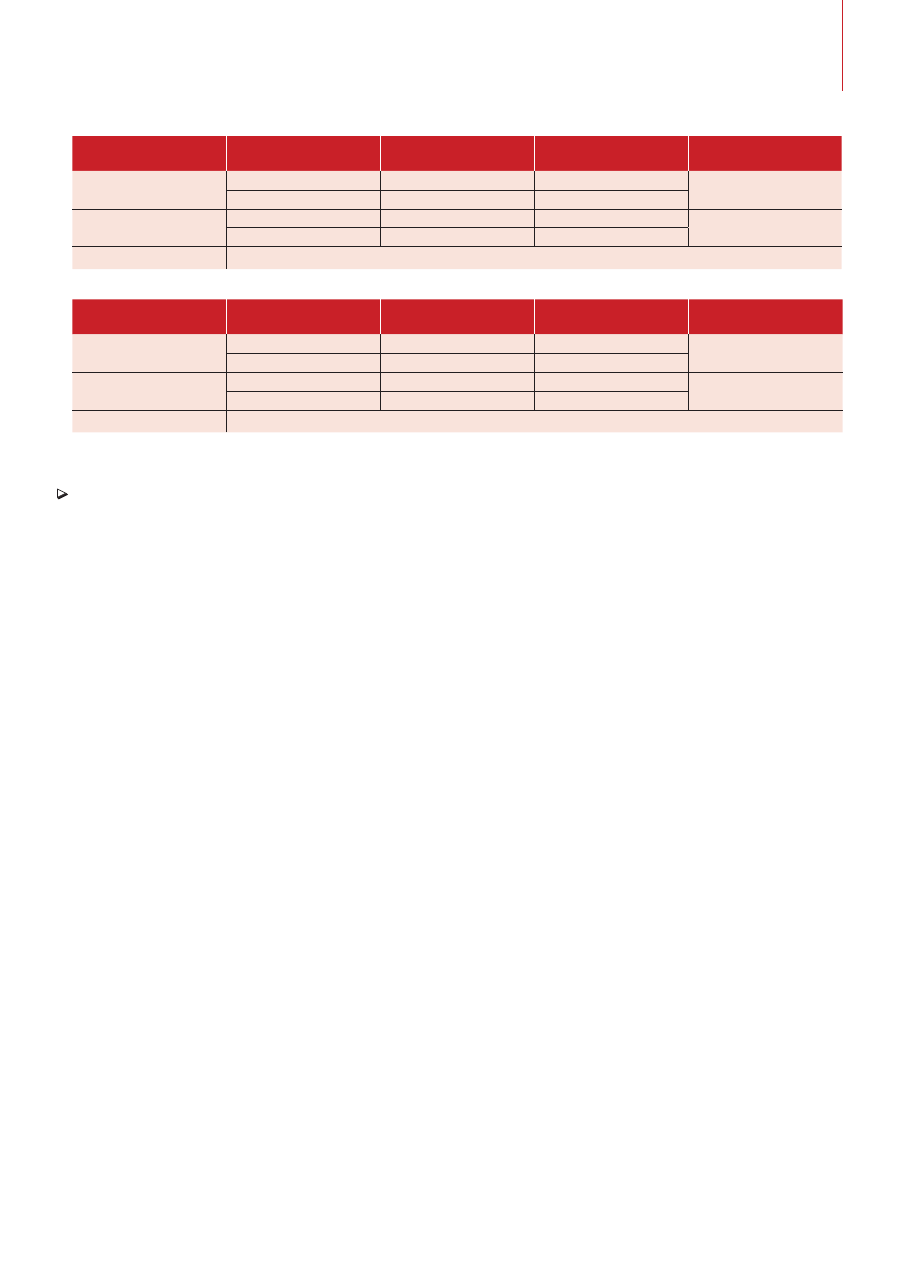
TEST
IMPLANT
ŚREDNIA
ABSORBANCJA
MINUS KONTROLA
RÓŻNICA W ADHEZJI
Alamar Blue
A
0,895
0,038
0,066%
B
0,834
0,099
MTT
A
0,266
0,019
0,063%
B
0,248
0,037
Safranin
Poniżej poziomu detekcji
Tab. 6. Referencyjny szczep Streptococcus mutans, test (6 h)
TEST
IMPLANT
ŚREDNIA
ABSORBANCJA
MINUS KONTROLA
RÓŻNICA W ADHEZJI
Alamar Blue
A
0,984
0,066
0,017%
B
0,966
0,084
MTT
A
0,511
0,027
0,025%
B
0,498
0,041
Safranin
Poniżej poziomu detekcji
Tab. 7. Referencyjny szczep Streptococcus mutans, test (1 h)
dlatego wyniki te pokazują tylko
różnicę w adhezji pomiędzy dwoma
implantami. Każdorazowo przed
wykonaniem testów implanty auto-
klawowano, a po inkubacji z bak-
teriami płukano 3-krotnie w PBS
w celu usunięcia niezwiązanych
bakterii (badanie adhezji szczepów
do implantu zostały przeprowadzone
w Zachodniopomorskim Uniwersy-
tecie Technologicznym w Szczecinie
przez prof. Danutę Czernomysy-Fu-
rowicz).
W
NIOSKI
Na podstawie przeprowadzonych
badań można przedstawić, co nastę-
puje:
1. Badania mikrobiologiczne wy-
branych szczepów bakteryjnych
wykazały zmniejszoną przeżywal-
ność bakterii na implantach z jona-
mi srebra w porównaniu z przeży-
walnością bakterii na implantach,
których powierzchnia nie została
wzbogacona jonami srebra.
2. Zastosowanie obróbki modyfi-
kującej powierzchnie implantów
tytanowych poprzez implanta-
cję jonów srebra w strukturę
zewnętrzną może być jednym
z czynników ograniczających re-
akcje zapalne wokół wprowadza-
nych wszczepów.
1, 2
Wyższa Szkoła Inżynierii Dentystycznej
w Ustroniu
2
Akademia Techniczno-Humanistyczna
w Bielsku-Białej
Piśmiennictwo
1. Wolf H.F., Rateitschak E.M.: Periodontologia.
Wydawnictwo Czelej, Lublin 2006.
2. Spiechowicz E.: Protetyka stomatologicz-
na. Podręcznik dla studentów stomatologii.
PZWL, Wydawnictwo Lekarskie 2006.
3. Ackermann K.L., Al-Nawas B., Behneke A.:
Implantologia. Wydawnictwo Medyczne
Urban & Partner, Wrocław 2004.
4. Majewski S., Majewski P.: Biologiczne me-
chanizmy przebudowy struktur kostnych
i gojenia tkanek miękkich jamy ustnej po za-
biegach implantacyjnych. „Implantoprotety-
ka”, 2009, Tom X nr 1.
5. Jańczuk Z.: Choroby przyzębia. Zapobiega-
nie, diagnostyka i leczenie. Wydawnictwo
Lekarskie PZWL, 2005.
6. Knychalska-Karwan Z.: Stomatologia wieku
podeszłego. Czelej 2005.
Implantacja jonów
jest
procesem domieszkowania
materiałów opartym na
wykorzystaniu wysokiej
energii kinetycznej. Atomy
domieszki są jonizowane
w źródle jonów, a następnie
przyśpieszone w polu
elektrycznym do energii
od kilkudziesięciu do kilkuset
kiloelektronowoltów.
Document Outline
Wyszukiwarka
Podobne podstrony:
technik artykul 2012 06 37650
technik artykul 2012 06 37659
technik artykul 2012 06 37660
technik artykul 2012 06 37645
technik artykul 2012 06 37654
technik artykul 2012 06 37647
technik artykul 2012 06 37651
technik artykul 2012 06 37643
technik artykul 2012 06 37656
technik artykul 2012 06 37652
technik artykul 2012 06 37646
technik artykul 2012 06 37653
technik artykul 2012 06 37658
technik artykul 2012 06 37644
technik artykul 2012 06 37657
technik artykul 2012 06 37648
technik artykul 2012 06 37655
technik artykul 2012 06 37640
technik artykul 2013 06 40592
więcej podobnych podstron