gr.10
Sprawozdanie nr 2
Temat: Argentometria.
Badanie zawartości masy NaCl w próbce roztworu nr 12.
Aby zbadać próbkę należy w pierwszej kolejności nastawić miano 0,05N roztworu AgNO3 na substancję podstawową NaCl. Oznaczony roztwór NaCl o stężeniu 1cm3 = 10mg rozcieńczono w kolbie stożkowej do około 100cm3 wodą destylowaną i dodano 1cm3 10% roztworu K2CrO4 jako wskaźnika. Następnie miareczkowano roztworem AgNO3, aż do pojawienia się trwałej zmiany zabarwienia z mlecznożółtej na żółtobrunatną.
I miareczkowanie: V(Ag NO3) = 14,4 cm3
II miareczkowanie: V(Ag NO3) = 13,6 cm3
Średnia wynosi: V(Ag NO3) = 14 cm3
W roztworze zachodziły następujące reakcje:
AgNO3 + Cl- → AgCl↓ + NO3
2AgNO3 + CrO42- → Ag2CrO4↓ + NO3-
Nastawienie miana:
Dane:
V(Ag NO3) = 14 cm3
R(NaCl) = 58,5 mg/mval
m(NaCl) = 50 mg
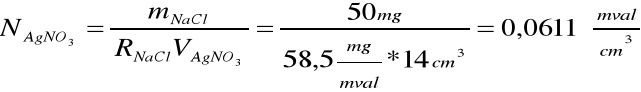
Po otrzymaniu miana AgNO3 przystąpiono do badania próbki nr 12. Badanie przeprowadzono podobnie jak nastawianie miana jednak niewiadomą jest masa NaCl w otrzymanej próbce. Po dopełnieniu wodą do kreski, pobrano pipetą 25 cm3 roztworu, wlano do kolby stożkowej i dopełniono do 100 cm3 wodą destylowaną. Następnie dodano 1 cm3 wskaźnika K2CrO4. Miareczkowano AgNO3, aż do pojawienia się zmiany zabarwienia z mlecznożółtej na żółtobrunatną.
I miareczkowanie : V(Ag NO3) = 11,1 cm3
II miareczkowanie: V(Ag NO3) = 10,9 cm3
Średnia wynosi: V(Ag NO3) = 11 cm3
Obliczanie masy NaCl:
Dane:
N(Ag NO3) = 0,0611 mval/cm3
V(Ag NO3) = 11 cm3
R(NaCl) = 58,5 mg/mval
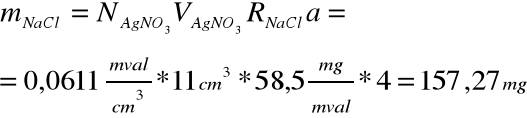
a = 4 (bo wlano 25 cm3 na 100 cm3)
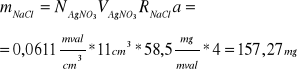
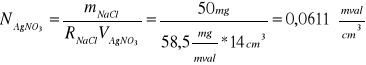
Wyszukiwarka
Podobne podstrony:
download Zarządzanie Produkcja Archiwum w 09 pomiar pracy [ www potrzebujegotowki pl ]
09 AIDSid 7746 ppt
09 Architektura systemow rozproszonychid 8084 ppt
TOiZ 09
Wyklad 2 TM 07 03 09
09 Podstawy chirurgii onkologicznejid 7979 ppt
Wyklad 4 HP 2008 09
09 TERMOIZOLACJA SPOSOBY DOCIEPLEŃ
09 Nadciśnienie tętnicze
wyk1 09 materiał
Niewydolność krążenia 09
09 Tydzień zwykły, 09 środa
09 Choroba niedokrwienna sercaid 7754 ppt
TD 09
moj 2008 09
IU 09
więcej podobnych podstron