Enzymy jako katalizatory biologiczne
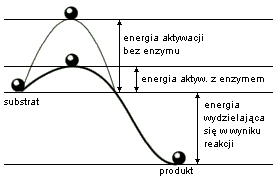
Większość reakcji chemicznych prowadzi do stanu równowagi substancji reagujących. To, czy dana reakcja w ogóle będzie zachodzić, a jeśli tak, to w którym kierunku, zależy przede wszystkim od stosunków energetycznych między związkami chemicznymi biorącymi w niej udział, ich stężenia i rozpuszczalności. Dla prawie każdej reakcji chemicznej istnieje pewna ilość energii konieczna do zapoczątkowania reakcji, zwana energią aktywacji. W chemii dla zainicjowania reakcji stosuje się często podniesienie temperatury układu w celu zwiększenia energii wewnętrznej cząstek. Innym sposobem pokonania bariery energii aktywacji jest dodanie katalizatora, który obniża energię aktywacji.
Rys: Energetyczny efekt działania enzymu
W organizmach żywych, u których nie jest możliwe podniesienie energii wewnętrznej cząsteczek reagujących poprzez dostarczenie ciepła, ponieważ procesy biochemiczne muszą zachodzić w temperaturze fizjologicznej, wykorzystywane są enzymy spełniające funkcje katalizatorów. Z racji tego, że enzymy działają w żywych komórkach, noszą one nazwę biokatalizatorów. Wszystkie enzymy są białkami produkowanymi przez żywe komórki. Enzymy mogą być białkami prostymi, jednak większa część enzymów stanowi białka złożone, w których obok proteiny występuje ściśle z nią związana grupa prostetyczna. Inne wiążą się w sposób odwracalny z grupą niebiałkową i wówczas część białkowa nazywa się apoenzymem, grupa niebiałkowa - koenzymem, a całość - holoenzymem. Holoenzym = apoenzym + koenzym
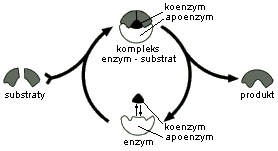
Rys: Schemat katalicznego działania enzymu
W skład koenzymów wchodzą pewne witaminy, jak: B1, B2, B6, B12, H, PP, kwas foliowy, kwas pantotenowy. Jeden składnik holoenzymu bez drugiego nie przejawia katalitycznego działania, czyli enzym jest aktywny tylko wówczas, gdy oba komponenty są połączone ze sobą. Apoenzym wykazuje powinowactwo do substratu, a więc decyduje o specyficzności substratowej, a grupa niebiałkowa określa kierunek przemiany substratu. Istotną funkcję w katalizie enzymatycznej spełnia tzw. centrum aktywne, będące specyficznie pofałdowanym fragmentem łańcucha polipeptydowego. Istnienie centrum aktywnego pozwala na powstanie nietrwałego kompleksu enzym-substrat, którego utworzenie powoduje obniżenie energii aktywacji warunkujące zajście procesu enzymatycznego. Jednak powstanie kompleksu E-S jest uzależnione od przestrzennego dopasowania centrum aktywnego enzymu do substratu. Utworzenie właściwej konformacji centrum aktywnego następuje w wyniku okresowego łączenia się z nim substancji, które dopasowują jego układ przestrzenny do substratu. Funkcję tę spełniają aktywatory, np. jony, albo koenzymy, zwane z tego powodu kosubstratami (substratami pomocniczymi). Kataliza enzymatyczna przebiega etapami:
przestrzenne dopasowanie centrum aktywnego do substratu;
utworzenie nietrwałego kompleksu E-S, co obniża energię aktywacji, umożliwia i przyspiesza zajście procesu;
oddzielenie się enzymu od produktu.
Wyróżniamy dwa typy mechanizmów łączenia się enzymu z substratem:
-model klucza i zamka - gdzie enzym, tzn. jego miejsce aktywne, musi być dopasowany swoim kształtem do substratu by móc przekształcić go w produkt. Teoria ta jednak ma już tylko znaczenie historyczne
- model indukowanego dopasowania (ręka do rękawiczki)-mechanizm opierający się na dopasowaniu kształtu enzymu do substratu lub odpowiedniej grupy substratów i przekształceniu ich w produkty. Poza tym enzym może zniekształcić substrat wymuszając w nim konformację podobną do stanu przejściowego.
Enzymy biorące udział w reakcji mogą być wielokrotnie wykorzystywane do katalizowania takich samych reakcji, jednak w komórce istnieje stała potrzeba produkowania nowych cząsteczek białka enzymatycznego. Cząsteczki, które różnią się od określonego substratu, nie mogą zbliżyć się do centrum aktywnego na odległość wiązania i nie ulegają reakcji. Tak więc jeden enzym katalizuje jedną reakcję.
Możliwość kontynuacji przebiegu reakcji istnieje dlatego, że powstałe produkty są zużywane w następnej reakcji, bądź odprowadzane dalej. W przypadku łańcucha lub cyklu reakcji (a te dominują w komórkach) powstające produkty są często substratami następnego ogniwa, przy czym każde ogniwo ciągu reakcji jest katalizowane przez określony enzym. Enzym przyspiesza reakcję biochemiczną, a więc szybkość reakcji zależy od aktywności enzymu.
Rys: Łańcuch oraz cykl metaboliczny
Na aktywność enzymów wpływają różne czynniki:
Temperatura. Wzrost temperatury o każde 10°C zwiększa szybkość reakcji enzymatycznych mniej więcej dwukrotnie. Jednak odbywa się to wyłącznie do poziomu temperatury powodującego denaturację białka, czyli zazwyczaj do 40 - 45°C. Denaturacja białka enzymatycznego powoduje trwałą utratę zdolności katalitycznej. Obniżanie temperatury zmniejsza szybkość reakcji biochemicznych, ale nawet zamrożenie enzymu nie powoduje trwałego utracenia jego aktywności; ponowne ogrzanie przywraca zdolność katalityczną enzymu. W przyrodzie jak zwykle istnieją wyjątki, które przystosowały się do warunków środowiskowych np. zwierzęta pustynne wymagają do inkubacji jaj temp. powyżej 50 st., bakterie z gorących źródeł wytrzymują temp. 110 st.
pH Większość enzymów komórkowych najszybciej działa w środowisku zbliżonym do obojętnego, czyli w pH około 7. Natomiast enzymy działające pozakomórkowo, w świetle przewodu pokarmowego, charakteryzują się znacznym zróżnicowaniem optymalnych warunków kwasowości środowiska. Wpływ pH na aktywność enzymów tłumaczy się tym, że są one białkami, a liczba dodatnich i ujemnych ładunków cząsteczki białka i ukształtowanie powierzchni cząsteczki są zależne od kwasowości środowiska. stężenia jonów wodorowych (optymalne pH reakcji jest różne dla różnych enzymów, np. dla pepsyny wynosi 1, dla arginazy — 10)
Stężenie enzymu i substratu. W stałej temperaturze, w stałym pH i przy nadmiarze substratu szybkość reakcji chemicznej jest wprost proporcjonalna do stężenia enzymu. W przypadku gdy temperatura, pH i stężenie enzymu są utrzymane na stałym poziomie, szybkość reakcji chemicznej początkowo wzrasta, w miarę zwiększania się stężenia substratu, do pewnej wartości, a następnie ustala się na jednakowym poziomie. Dochodzi do tego w momencie, gdy wszystkie cząsteczki enzymu są połączone z substratem, tworząc kompleksy E-S. Wykres zależności szybkości reakcji od stężenia substratu nosi nazwę krzywej Michaelisa.
Stała Michaelisa Km to wielkość liczbowa, określająca stężenie substratu (w molach na litr roztworu), przy którym szybkość reakcji enzymatycznej jest równa połowie szybkości maksymalnej, osiąganej przy wysyceniu enzymu substratem i niezależnej już od dalszego wzrostu jego stężenia.
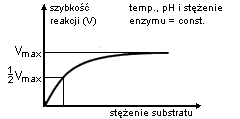
Rys: Zależność szybkości reakcji od stężenia substratu
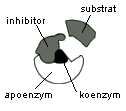
Inhibitory. W środowisku komórkowym występują różne substancje niskocząsteczkowe, które przyłączając się do enzymu powodują zmianę struktury przestrzennej enzymu, uniemożliwiając tworzenie kompleksów E-S (substancje te mogą również działać jako aktywatory). Istnieją też przypadki, gdy związek chemiczny, mając podobną budowę do substratu, konkuruje z nim o związanie się z centrum aktywnym enzymu. Jeżeli inhibitor występuje w dostatecznie dużym stężeniu, to może całkowicie zablokować reakcję (przyłączenie substratu). Z kolei zwiększenie stężenia substratu może spowodować wyparcie inhibitora. Odwracalna inhibicja enzymów odgrywa ważną rolę w regulacji metabolizmu.
Rys: Schemat inhibicji działania enzymu
Pewne inhibitory enzymów są normalnymi metabolitami komórkowymi, które hamują dany enzym w ramach naturalnej metabolicznej kontroli odpowiedniego szlaku. Inne inhibitory mogą być substancjami obcymi dla organizmu, takimi jak toksyny i leki, i w tym przypadku hamowanie enzymu może mieć działanie terapeutyczne , ale również letalne (śmiertelne).
Rozróżnia się dwa główne typu inhibicji :
- nieodwracalną
odwracalną
Inhibicję odwracalną można podzielić na:
1) kompetycyjną
2) niekompetycyjną
Inhibicja nieodwrcalna polega na wiązaniu się inhibitora i enzymu w sposób trwały , nieodwracalny, często tworząc wiązania kowalencyjne z resztami aminokwasów, znajdującymi się w miejscu aktywnym lub jego pobliżu i w ten sposób inaktywują enzym na stałe.
W wiązaniu tym biorą udział reszty Ser i Cys mające , odpowiednio, reaktywne grupy -OH i -SH .
(Przykładem może być związek diizopropylofluorofosforan ( DIPF) , składnik gazów bojowych (soman) działający na układ nerwowy, reaguje z resztą Ser w miejscu aktywnym enzymu esterazy acetylocholinowej, nieodwracalnie hamując enzym i uniemożliwiając przekazywanie impulsów nerwowych.)
Inhibitor kompetycyjny jest zazwyczaj strukturalnie podobny do normalnego substratu danego enzymu. Dzięki temu współzawodniczy z cząsteczkami o wiązanie się z miejscem aktywnym. Enzym może się wiązać albo z cząsteczkę substratu, albo cząsteczkę inhibitora, ale nie z obiema jednocześnie. Inhibitor kompetycyjny wiąże się z centrum aktywnym odwracalnie. (zatrucie alkoholem metylowym leczy się podając alkohol etylowy, czyli czym większe stężenie substratu, tym większe prawdopodobieństwo, że to on połączy się z centrum aktywnym, a nie inhibitor)
Przy dużych stężeniach substratu działanie inhibitora kompetycyjnego zostaje przezwyciężone, ponieważ duże stężenie substratu będzie z powodzeniem współzawodniczyć z cząsteczką inhibitora o wiązanie się w miejscu aktywnym.
Inhibitor niekompetycyjny wiąże się odwracalnie w innym miejscu enzymu niż jego miejsce aktywne i powoduje zmianę przestrzennego kształtu enzymu, co prowadzi do zmniejszenia aktywności katalitycznej. Ponieważ inhibitor wiąże się w innym miejscu niż substrat, enzym może wiązać albo inhibitor, albo substrat równocześnie.
Efektu inhibitora niekompetycyjnego nie można przezwyciężyć przez zwiększanie stężenia substratu i dlatego zmniejsza się wartość Vmax . W inhibicji niekompetycyjnej powinowactwo enzymu do substratu pozostaje nie zmienione, a więc wartość Km nie zmienia się .
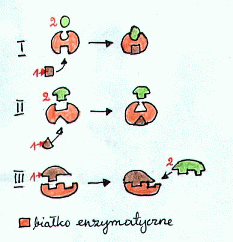
Oprócz enzymów z jednym centrum aktywnym mamy także enzymy allosteryczne.
Są to związki mające więcej niż jedno miejsce aktywne, które to miejsca kooperatywnie wiążą cząsteczki substratu, dzięki czemu związanie substratu w jednym miejscu aktywnym indukuje w enzymie zmianę konformacyjną, zmieniającą powinowactwo do substratu w innych miejscach aktywnych. Ten typ enzymów może występować w formie białka złożonego z wielu podjednostek, z których każda ma miejsce aktywne. Poza tym enzymy allosteryczne mogą być kontrolowane przez cząsteczki efektorowe (aktywatory i inhibitory), które wiążą się do innych miejsc niż miejsca aktywne i zmieniają szybkość aktywności enzymatycznej.
Aktywatory. Pod wpływem różnych substancji, np. jonów, może nastąpić taka zmiana kształtu cząsteczki enzymu, która jest korzystna dla przebiegu katalizy enzymatycznej. Odbywa się to na skutek przyłączenia aktywatora do centrum aktywnego i polepszenia w ten sposób wiązania substratu.
Hormony regulują przebiegi procesów enzymatycznych.
Podstawą klasyfikacji enzymów, wprowadzonej 1961 przez Komitet Enzymowy Międzynarodowej Unii Biochemicznej, jest rodzaj katalizowanej reakcji.
Dawniej poznane enzymy noszą nazwy zwyczajowe używane do dzisiaj, np. pepsyna, trypsyna. Później tworzone nazwy enzymów mają końcówkę -aza, często dodawaną do nazwy substratu, na który dany enzym oddziałuje, np. sacharaza, która katalizuje rozszczepienie sacharozy do glukozy i fruktozy. Ogromną liczbę różnych enzymów pogrupowano w sześć głównych klas:
hydrolazy - enzymy katalizujące rozkład związków organicznych bardziej złożonych do prostszych z wykorzystaniem wody jako substratu (hydro - woda, liza - rozkład); do nich zaliczane są enzymy trawienne;
oksydoreduktazy - enzymy katalizujące procesy utleniania i redukcji. Występują w postaci utlenionej i zredukowanej, np. wiele enzymów biorących udział w fotosyntezie i oddychaniu;
transferazy - enzymy katalizujące przenoszenie grup chemicznych z jednego związku na drugi, np. aminotransferazy przenoszą grupę aminową;
liazy - enzymy katalizujące reakcje odłączenia lub przyłączenia różnych grup chemicznych, powodujące niehydrolityczny rozpad cząstek substratu;
ligazy - enzymy katalizujące tworzenie wiązań (łączenie cząstek);
izomerazy - enzymy katalizujące przekształcenia wewnątrz cząsteczki, np. przekształcające aldozy w ketozy;
Najgroźniejsze skutki dla komórki mogą spowodować enzymy rozkładające białka. Ich niekontrolowane działanie mogłoby doprowadzić do strawienia białek cytoplazmy i jądra komórkowego, a w konsekwencji do śmierci komórki. Dlatego enzymy rozkładające białka w obszarze komórki są izolowane błonami lizosomalnymi, a poza obszar komórek, np. do światła przewodu pokarmowego - wydzielane w formie nieaktywnych proenzymów.
Enzymy są wykorzystywane w przemyśle do prowadzenia różnego rodzaju fermentacji, w lecznictwie służą jako leki (pepsyna, streptokinaza) Oznaczanie różnych enzymów w tkankach i płynach fizjologicznych odgrywa rolę w diagnostyce lekarskiej. Brak lub niedobór pewnych enzymów lub zmiana ich aktywności w wyniku zmiany ich budowy jest powodem wielu schorzeń (np. albinizm, fenyloketonuria, galaktozemia, methemo-globi-nemia).
Enzymy posiadają następujące cechy:
obniżają energię katalizowanych reakcji, tzw. energię aktywacji, oznacza to, że ilość energii potrzebnej dla przebiegu dowolnej reakcji jest mniejsza od ilości energii wykorzystywanej w danej reakcji bez użycia enzymów,
nie zmieniają się w wyniku reakcji, a przez to mogą wielokrotnie działać na kolejne substraty,
ponadto działają na ściśle określone substraty - jest to tzw. działanie enzymów swoiste
nie mają one wpływu na równowagę reakcji,
wykazują dużą aktywność kataboliczną (przyśpieszają wielokrotnie reakcje chemiczne)
warunkują większą skuteczność przebiegu reakcji, nadają kierunek reakcjom.
4
Wyszukiwarka
Podobne podstrony:
pytania zerówka enzymy, Biologia, Enzymologia
ENZYMY pojecia, olimp biologia
rybiak,biologia i ekologia, enzymy
ENZYMY, olimp biologia
Enzymy, Enzymy- czynniki pełniące role katalizatorów biologicznych, mające charakter białkowy
enzymy restrykcyjne-stud, Biologia molekularna
Enzymy i koenzymy, olimp biologia
enzymy (2 str), INNE KIERUNKI, biologia
Enzymy, Studia, II semestr II rok, Biologia komórki
Enzymy i ich aktywność biologiczna, Kosmetologia, Notatki i wyłady, Biochemia
1Ochr srod Wyklad 1 BIOLOGIA dla studid 19101 ppt
Biologiczne uwarunkowania ADHD
enzymy
ANALIZA KOSZTU BIOLOGICZNEGO WYKONYWANEJ PRACY
Przykłady roli biologicznej białek
03 RYTMY BIOLOGICZNE CZŁOWIEKAid 4197 ppt
Szkol Biologiczne w środowisku pracy
KOROZJA BIOLOGICZNA II
Budowa, wystepowanie i znaczenie biologiczne disacharydow
więcej podobnych podstron