Polimery w medycynie
Sprawozdanie
ćw. 2
Wytwarzanie otoczek polimerowych
Enkapsulacja substancji bioaktywnych
data wykonania ćwiczenia: 17 IV2012
Wstęp teoretyczny
Immobilizacja (łac. immobilis - nieruchomy) jest to zespół metod prowadzących do całkowitego lub częściowego ograniczenia swobody poruszania się określonych atomów, cząsteczek, substancji lub materiału biologicznego poprzez unieruchomienie na podłożu stałym lub wewnątrz specyficznych struktur. Zamknięcie określonych substancji lub całych komórek wewnątrz otoczki polimerowej nazywamy enkapsulacją.
Metody enkapsulacji stosuje się do wytwarzania leków o przedłużonym uwalnianiu (immobilizacja substancji chemicznych), w terapii niektórych chorób do wytwarzania tzw. sztucznych narządów (immobilizacja komórek lub fragmentów tkanek) lub w przemyśle do unieruchamiania biokatalizatorów, co umożliwia ich łatwy odzysk do ponownego użycia (immobilizacja enzymów lub komórek drobnoustrojów).
Jednym z nośników najczęściej stosowanych do enkapsulacji jest alginian sodu czyli sól sodowa kwasu alginowego. Kwas alginowy jest naturalnym kopolimerem kwasu mannurowego i guluronowego. Wchodzi w skład ścian komórkowych alg i trawy morskiej.
Kwas alginowy tworzy liniowe cząsteczki złożone z bloków kwasu D-mannurowego i L-guluronowego połączonych wiązaniami 1,4-glikozydowymi. Kolejność i długość bloków może być różna.
Sole kwasu alginowego mogą być rozpuszczalne (alginian sodu) lub nierozpuszczalne (alginian wapnia). Sam kwas nie rozpuszcza się w wodzie, ale pęcznieje. Potrafi zaabsorbować nawet do trzech razy więcej wody w stosunku do własnej masy, dlatego jest stosowany jako środek zagęszczający czy osuszający. Używany jest także jako środek żelujący w przemyśle spożywczym (dżemy, galaretki, soki) i kosmetycznym (żele pod prysznic, szampony, pasty do zębów, mydła).
Sieciowanie alginianów przebiega w obecności jonów wapnia. Segmenty kwasu poliguluronowego (GG) łączą się w agregaty, a jony wapnia zajmują przestrzenie międzyłańcuchowe, natomiast segmenty MM oraz MG nie biorą udziału w sieciowaniu.
Powstała w ten sposób struktura hydrożelowa świetnie sprawdza się jako ochrona przed urazami mechanicznymi, na jakie mogą być narażone enkapsulowane komórki czy fragmenty tkanek podczas implantacji i przebywania w organizmie. Ponadto hydrożelowa otoczka nie wywiera tak dużych naprężeń na błony immobilizowanych komórek jak polimery nieusieciowane, dzięki czemu unika się uszkodzenia materiały biologicznego podczas otrzymywania kapsułek.
Produkcja hydrożelowych kapsułek jest prosta, a powstałe struktury są przezroczyste, dzięki czemu można obserwować zamknięte w nich komórki. Otoczka hydrożelowa jest półprzepuszczalna, co umożliwia przenikanie substancji odżywczych, metabolitów czy tlenu.
Klasyczna metoda kapsułkowania za pomocą alginianu polega na wymieszaniu zawiesiny enkapsulowanych komórek lub roztworu enkapsulowanego związku z roztworem alginianu sodu, wprowadzeniu tej mieszaniny do urządzenia wkraplającego i formowaniu kapsułek poprzez wkraplanie mieszaniny do niskoprocentowego roztworu dwuwartościowych kationów (najczęściej Ca2+ lub Ba2+). Tam następuje wytrącanie alginianu wapnia i jednoczesne jego sieciowanie, w wyniku czego powstaje trójwymiarowa struktura hydrożelowa, w której zostają zamknięte enskapuslowane substancje lub komórki. Zmieniając średnicę igły, odległość jej końca od powierzchni roztworu sieciującego, stężenie roztworu alginianu, a także szybkość wkraplania, można regulować kształt i wielkość kapsułek.
Wytworzone kapsułki można otoczyć dodatkową warstwą polimeru, która stanowi dodatkową ochronę przed urazami mechanicznymi, a także zapobiega wypływowi komórek na zewnątrz, zapewniając jednocześnie odpowiednią porowatość. W tym celu kapsułki zanurza się kilkakrotnie w roztworach polimerów np. poli-L-lizyna, chitozan, heparyna. Dzięki obecności ujemnie naładowanych grup karoksylanowych w cząsteczkach alginianu możliwe jest elektrostatyczne związanie dodatnio naładowanych łańcuchów innych polimerów.
Cel ćwiczenia
Celem ćwiczenia było poznanie metody wytwarzania makrokapsułek przeznaczonych do enkapsulacji modelowych komórek i związków chemicznych poprzez wytworzenie kapsułek alginianowych z modelowym związkiem - albuminą, a następnie zmierzenie ich rozmiarów, zbadanie nasiąkliwości oraz szybkości uwalniania substancji enkapsulowanej.
Wykonanie
Przygotowanie kapsułek alginianowych
Przygotowano 2 zlewki o pojemności 250 ml. W jednej z nich umieszczono 150 ml 0,9% (w/v) roztworu NaCl, zaś w drugiej - 150 ml roztworu CaCl2 o stężeniu 0,15 mol/dm3. W innej zlewce sporządzono 20 ml 1,5% roztworu alginianu z albuminą poprzez wymieszanie w stosunku 1:1 3% roztworu alginianu sodu z roztworem albuminy o stężeniu 0,5 g/dm3.
Tak przygotowany roztwór alginianu wprowadzono do strzykawki o pojemności 20 ml, na której następnie umieszczono igłę o średnicy 1,1 mm. Strzykawkę zamocowano w statywie nad zlewką z CaCl2 na takiej wysokości, aby koniec igły znajdował się 10 cm nad powierzchnią roztworu.
Za pomocą strzykawki wkraplano roztwór alginianu z albuminą do roztworu CaCl2. Po wytworzeniu ok. 50 kapsułek za pomocą sitka przeniesiono je do roztworu NaCl, po czym ponownie odsączono na sitku i przemyto wodą dejonizowaną.
Połowę kapsułek pokryto dodatkowo otoczką alginianową. W tym celu na szalkę Petriego wylano ok. 20 ml 3% roztworu alginianu sodu i umieszczono w nim kapsułki, starając się, aby nie przylegały do siebie. Po 3 min kapsułki przeniesiono do zlewki z roztworem NaCl umieszczonej na mieszadle magnetycznym i mieszano intensywnie przez 3 min, po czym kapsułki odsączono na sitku.
Badanie kapsułek alginianowych
Na wadze analitycznej zważono 10 kapsułek z otoczką oraz 10 kapsułek bez otoczki, a także zmierzono ich średnice za pomocą suwmiarki. Następnie kapsułki te umieszczono w suszarce w temperaturze 36,8ºC na 30 min, po czym powtórnie zważono.
W celu zbadania uwalniania albuminy z wytworzonych kapsułek do 2 zlewek nalano po 50 ml wody destylowanej. W jednej z nich umieszczono 15 kapsułek bez otoczki, zaś w drugiej 15 kapsułek z otoczką. Co 10 min mierzono absorbancję roztworów przy λ = 200 nm wobec wody destylowanej. Wcześniej przygotowano krzywą wzorcową, sporządzając serię rozcieńczeń roztworu albuminy i mierząc ich absorbancję.
Opracowanie wyników
Tabela 1. Masa kapsułek z otoczką i bez otoczki przed i po suszeniu
kapsułki |
m [g] |
nasiąkliwość [%] |
|
|
mokre |
suche |
|
bez otoczki |
0,11148 |
0,06268 |
77,86 |
z otoczką |
0,18136 |
0,08967 |
102,25 |
Przykładowe obliczenia
![]()
, gdzie:
Nw - nasiąkliwość [%]
mn - masa kapsułek przed suszeniem [g]
ms - masa kapsułek po suszeniu [g]
![]()
Tabela 2. Średnice kapsułek z otoczką i bez otoczki przed i po suszeniu
l.p. |
d [mm] |
|
|
bez otoczki |
z otoczką |
1 |
2,69 |
3,13 |
2 |
2,72 |
3,21 |
3 |
2,37 |
2,99 |
4 |
2,20 |
3,21 |
5 |
2,36 |
3,04 |
6 |
2,54 |
2,68 |
7 |
2,63 |
2,83 |
8 |
2,57 |
2,88 |
9 |
2,45 |
3,24 |
10 |
2,55 |
2,95 |
średnia arytmetyczna |
2,51 |
3,02 |
odchylenie standardowe |
0,16 |
0,19 |
Na podstawie uzyskanych wyników obliczono średnią grubość otoczki alginianowej:
![]()
, gdzie:
g - grubość otoczki [mm]
dot - średnica kapsułki z otoczką [mm]
dbez - średnica kapsułki bez otoczki [mm]
![]()
Tabela 3. Absorbancja wzorcowych roztworów albuminy
cw/v [g/ dm3] |
c [mol/dm3] |
A200 |
0,5 |
7,53 · 10-6 |
0,917 |
0,25 |
3,76 · 10-6 |
0,512 |
0,125 |
1,88 · 10-6 |
0,259 |
0,0625 |
9,41 · 10-7 |
0,127 |
0,03125 |
4,70 · 10-7 |
0,068 |
0,015625 |
2,35 · 10-7 |
0,031 |
Malbuminy = 66,43 kDa = 66 430 g/mol
Przykładowe obliczenia
![]()
, gdzie:
c - stężenie molowe [mol/dm3]
cw/v - stężenie masowe [g/dm3]
Malb - masa molowa albuminy [g/mol]
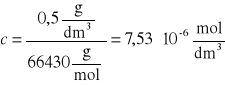
Na podstawie uzyskanych wyników sporządzono krzywą wzorcową i przedstawiono na wykresie 1.
Na podstawie nachylenia prostej obliczono molowy współczynnik ekstynkcji albuminy, korzystając z zależności:
A = ε l c = a·c, gdzie:
A - absorbancja roztworu albuminy
ε - molowy współczynnik ekstynkcji albuminy [dm3·mol-1·cm-1]
l - długość drogi optycznej w aparacie pomiarowym [cm]
c - stężenie roztworu albuminy [mol/dm3]
a - współczynnik kierunkowy prostej [dm3/mol]
l = 0,5 mm = 0,05cm
Zatem:
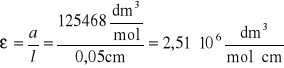
Tabela 4. Absorbancja roztworów albuminy uwolnionej z kapsułek po różnym czasie
t [min] |
A200 |
|
|
bez otoczki |
z otoczką |
10 |
0,009 |
0,01 |
20 |
0,002 |
0 |
30 |
0 |
0,006 |
40 |
0 |
0 |
50 |
0 |
0 |
120 |
0,069 |
0,086 |
Korzystając z wyznaczonego uprzednio współczynnika ekstynkcji, obliczono stężenie albuminy uwolnionej z kapsułek po 120 min, korzystając z zależności ![]()
dla kapsułek nieotoczkowanych: dla kapsułek otoczkowanych:
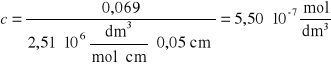
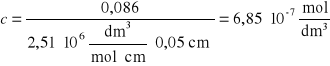
Wnioski
Sporządzone w niniejszym ćwiczeniu kapsułki były zbudowane z alginianu, który w zastosowanych warunkach tworzy hydrożele. Świeżo wytworzone kapsułki zawierały więc znaczną ilość wody. Potwierdza to pomiar masy kapsułek przed i po suszeniu - w trakcie suszenia część zawartej w kapsułkach wody wyparowała, co skutkowało zmniejszeniem masy kapsułek. Nasiąkliwość wagowa kapsułek bez otoczki wyniosła 77,86%, a z otoczką - 102,25%. Zatem kapsułki z otoczką mogą wchłonąć więcej wody niż te bez otoczki właśnie ze względu na obecność dodatkowej warstwy alginianu. Kapsułki z otoczką mogą wchłonąć nawet więcej wody niż same ważą (a ściślej - więcej niż wynosi ich sucha masa).
Wytworzone kapsułki odznaczały się dość wyrównanymi rozmiarami (odchylenie standardowe na poziomie ok. 6%). Rozrzut rozmiarów wynikać mógł z nierównomiernego przyłożenia siły podczas wkraplania alginianu sodu to chlorku wapnia, jak również możliwa była deformacja kapsułek podczas mierzenia ich suwmiarką. Jak można się było spodziewać, kapsułki z otoczką miały większą średnicę (3,02 mm) niż bez otoczki (2,51 mm). Średnia grubość otoczki alginianowej wynosiła więc 0,255 mm.
Molowy współczynnik ekstynkcji albuminy wyznaczony na podstawie krzywej wzorcowej wynosił 2,51 · 106 dm3·mol-1·cm-1.
Uwalnianie substancji wzorcowej - albuminy - z kapsułek alginianowych zachodzi początkowo powoli. Dopiero pomiar po upływie 2 h wykazał mierzalny wzrost stężenia albuminy w roztworze. Dla kapsułek bez otoczki było to 0,55 μmol/dm3, zaś dla kapsułek z otoczką - 0,69 μmol/dm3.
4
2
Wyszukiwarka
Podobne podstrony:
spr rurki, studia, nano, 3rok, 6sem, polimery w medycynie
spr rurki, studia, nano, 3rok, 6sem, polimery w medycynie
spr szampon, studia, nano, 3rok, 6sem, materiały i nanomateriały kosmetyczne, lab
spr chemisorpcja, studia, nano, 3rok, 6sem, metody badań nanomateriałów funkcjonalnych, chemisorpcja
spr pomadka, studia, nano, 3rok, 6sem, materiały i nanomateriały kosmetyczne, lab
czesc I, studia, nano, 3rok, 6sem, projektowanie wyrobów z materiałów polimerowych
projekt - elastomery o optymalnym usieciowaniu, studia, nano, 3rok, 6sem, projektowanie wyrobów z ma
spr krem z mocznikiem, studia, nano, 3rok, 6sem, materiały i nanomateriały kosmetyczne, lab
spr UV-Vis, studia, nano, 3rok, 6sem, metody badań nanomateriałów funkcjonalnych, Vis
spis cwiczen, studia, nano, 3rok, 6sem, metody badań nanomateriałów funkcjonalnych
z czym to się je, studia, nano, 3rok, 6sem, metody badań nanomateriałów funkcjonalnych, tranzystory
Zasady zaliczenia, studia, nano, 3rok, 6sem, metody badań nanomateriałów funkcjonalnych
SEM-EDS IS, studia, nano, 3rok, 6sem, metody badań nanomateriałów funkcjonalnych, SEM
sprawozdanie2, studia, nano, 3rok, 6sem, metody badań nanomateriałów funkcjonalnych, chemisorpcja
radiacja spr3-polimeryzacja radiacyjna, studia, nano, 3rok, 5sem, chemia i technologia radiacyjna po
roztw spr3-potencjał zeta, studia, nano, 3rok, 5sem, fizykochemia roztworów polimerowych, lab
Dozymetr alaninowy, studia, nano, 3rok, 5sem, chemia i technologia radiacyjna polimerów, lab
Chemia i technologia radiacyjna polimerow Cw2 - Dozymetria CalorymetriaAlanina, studia, nano, 3rok,
reometr, studia, nano, 3rok, 5sem, fizykochemia roztworów polimerowych, lab, Makrocząsteczka Laborat
więcej podobnych podstron