Konwersatorium z fizyki chemicznej II rok chemii biologicznej
Lista 8
Zagadnienia: Spektroskopia elektronowa
Jakie przejścia elektronowe mogą zachodzić w podanych niżej związkach? Podaj które z nich zachodzą w standardowym zakresie spektroskopii UV-Vis:
Benzen (C6H6), pirydyna (C6H5N), aceton, Co(H2O)6+2, Pr(H2O)9+3, MnO4-
W widmie UV związku organicznego C7H14O obserwuje się maksimum absorpcji przy 296nm (ε = 3.7 m2/mol). Jest to prawdopodobnie keton czy alken? Odpowiedź uzasadnij.
3. Poniżej przedstawiono widma absorpcyjne chlorofilu i ksantofilu zarejestrowane w zakresie promieniowania UV-Vis . Wiedząc, że chlorofil ma barwę zieloną a ksantofil żółtą oraz biorąc pod uwagę „barwy komplementarne” powiedz, które widmo odpowiada któremu barwnikowi.
a) b)
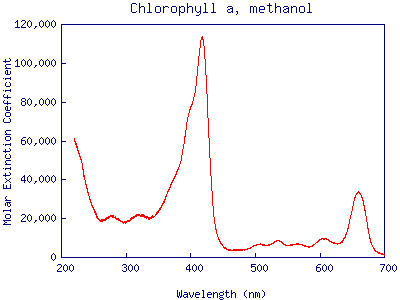
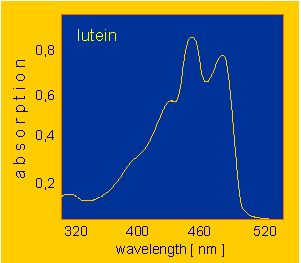
4. Na rysunku przedstawionym poniżej obserwujemy dwa widma, w których widoczne są pasma przejść π→π*. Określ które z widm należy do cząsteczki CH2=CH-CH=CH2 a które do CH2=CH-CH=CH-CH=CH2?
5. Poniższy rysunek przedstawia widmo absorpcyjne cząsteczek: naftalen, antracenu i tetracenu. Przypisz poszczególne widma odpowiednim cząsteczkom.
0,01/
6. Które z podanych niżej przejść są dozwolone jako przejścia dipolowe elektryczne?
1s → 2s, 1s → 2p, 2p → 3d, 3s → 5p
7. Na podstawie diagramu poziomów energetycznych orbitali molekularnych określ liczby niesparowanych elektronów w następujących cząsteczkach dwuatomowych:
O2+, O2, O2- i O22-.
Uporządkuj według wzrastającej energii termy, które mogą wynikać z następujących konfiguracji dwu elektronów: 1s2p, 2p3p, 3p3d
Wyznacz dozwolone termy konfiguracji 2p2.
Literatura:
Z.Kęcki, Podstawy spektroskopii molekularnej
A. Bartecki, Spektroskopia elektronowa związków nieorganicznych i kompleksowych
A
B
C
B
A
Wyszukiwarka
Podobne podstrony:
lista9, Spektroskopia molekularna
cwiczenie rotacja, Ćwiczenia ze Spektroskopii Molekularnej
Z Kęcki Podstawy spektroskopii molekularnej
S1 Spektroskopia molekularna (wyznaczanie energii dysocjacji molekuy jodu) spis zagadnień
Spektroskopia NMR
w4 orbitale molekularne hybrydyzacja
SPEKTROSKOPIA ROTACYJNA
Biologia molekularna
W03b Komórkowe i molekularne podłoże zapaleń
Spektrometria mas NMAZ
Biologia molekularna koniugacja
instr 2011 pdf, Roztw Spektrofoto
genetyka molekularna
elementy genetyki molekularnej biologia 2
analityka podstawy spektroskopii 2012 2013
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
Met. izol. oczysz.DNA dla studentów, Biologia molekularna
więcej podobnych podstron