Do wykładu № 6
Druga i trzecia zasada termodynamiki. Procesy odwracalne i nieodwracalne. Procesy kołowe (cykle). Cykl Carnota. Druga zasada termodynamiki i entropia. Potencjały termodynamiczne. Trzecia zasada termodynamiki.
Gumiński K. Termodynamika. - Warszawa: PWN, 1971.
Resnik R., Holliday D. Fizyka. - Warszawa: WN PWN, 1998. W 2 t.
Feynman R.P., Leighton R.B., Sands M. Feynmana wykłady z fizyki. - Warszawa: PWN, 1971. - W 5 t.
Bobrowski C. Fizyka - krótki kurs. - Warszawa: WNT, 2007.
Wykłady realizowany są w ramach projektu pt. „Mechatronika kierunkiem przyszłości - dostosowanie oferty edukacyjnej Uniwersytetu Kazimierza Wielkiego do potrzeb rynku pracy”, Działanie 4.1.1, Programu Operacyjnego Kapitał Ludzki, współfinansowanego ze środków Europejskiego Funduszu Społecznego”.
Pierwsza zasada termodynamiki nie wystarcza do pełnego opisu procesów zachodzących w przyrodzie. Dla przykładu, całkowicie zgodna z pierwszą zasadą termodynamiki byłaby zamiana na pracę nieprzebranej ilości energii w postaci ciepła tkwiącej w wodach mórz i oceanów, w powietrzu, czy skorupie ziemskiej. Wiemy, że energia ta nie może być w całości zamieniona na pracę.
Wymieńmy jeszcze inne przykłady procesów, które nie mogą zachodzić, chociaż nie są sprzeczne z zasadą zachowania energii.
Wiemy, że wskutek tarcia wytwarzają się znaczne ilości ciepła. Pierwotni ludzie tak właśnie rozniecali ogień. Tarcie jest przyczyną rozgrzewania się hamulców w samochodach. Nie zdarza się jednak, by ciepło powstałe wskutek ruchu trących się przedmiotów wprawiło te przedmioty z powrotem w ruch.
Gdy w naczyniu znajduje się powietrze pod ciśnieniem większym od ciśnienia atmosferycznego, to opuści ono naczynie, kiedy tylko pojawi się w nim otwór. Proces ten następuje samorzutnie aż do momentu wyrównania się ciśnień wewnątrz i na zewnątrz naczynia. Jest to jednak proces nieodwracalny, bowiem proces odwrotny jest nieprawdopodobny.
Gdy stykają się dwa ciała o różnych temperaturach następuje przepływ energii w postaci ciepła od ciała o temperaturze wyższej do ciała o niższej temperaturze. Proces trwa aż do momentu wyrównania się temperatur. Nie obserwujemy nigdy samorzutnego przepływu ciepła od ciał chłodniejszych do cieplejszych.
Istnieje szereg warunków zachodzenia procesów w przyrodzie - innych niż te, wynikające z zasady zachowania energii. Warunki te ujęte są w postaci drugiej zasady termodynamiki, która może być sformułowana na kilka sposobów.
Sformułowanie podane przez Clausiusa w 1850r. Niemożliwe jest przekazywanie energii w postaci ciepła przez ciało o temperaturze niższej ciału o temperaturze wyższej bez wprowadzenia innych zmian w obu ciałach i w otoczeniu.
Sformułowanie podane przez Kelvina w 1851r. Niemożliwe jest pobieranie energii w postaci ciepła z jednego termostatu i zamiana go w całości na pracę bez wprowadzania innych zmian w układzie i w otoczeniu.
Właśnie sformułowanie Kelvina wskazuje na brak możliwości wykorzystania energii zmagazynowanej w wodzie oceanów. Hipotetyczny silnik, który pobierałby energii w postaci ciepła z otoczenia i zamieniał je w całości na pracę nazwano "perpetuum mobile drugiego rodzaju". Drugą zasadę termodynamiki sformułować można wiec także w następujący sposób: skonstruowanie perpetuum mobile drugiego rodzaju jest niemożliwe
W silnikach (maszynach) cieplnych energia w postaci ciepła zamieniane jest na pracę. Elementami silnika są: źródło energii (grzejnik) o temperaturze ![]()
, chłodnica o temperaturze ![]()
i substancja robocza, którą jest gaz. Pracę silnika charakteryzuje sprawność (wydajność). Sprawność silnika określa, jaka część energii pobranej na sposób ciepła może być przekazana innemu układowi na sposób pracy, w jednym cyklu.
Dla wykonania pracy konieczne jest oddawanie części energii pobranej w postaci ciepła otoczeniu, a warunkiem tego jest chłodnica o niższej temperaturze niż temperatura źródła ciepła. Gdy zaś temperatury źródła i odbiornika ciepła stają się bliskie, to wydajność silnika zmniejsza się do zera.
W silnikach cieplnych realizowany jest cykl przemian termodynamicznych. Oznacza to, że układ, który przemianom tym podlega, powraca cyklicznie do stanu początkowego. Nie oznacza to jednak, że cykl taki musi być odwracalny. Pamiętamy, że proces odwracalny to taki, który może przebiegać od stanu początkowego do końcowego i odwrotnie przechodząc przez ten sam ciąg procesów kwazistacjonarnych bez wprowadzania zmian w otoczeniu. Warunek ten nie jest nigdy spełniony w rzeczywistych silnikach cieplnych.
Zanim jednak będziemy rozpatrywać pracę konkretnych typów silników zajmiemy się cyklem, który będzie wygodnym punktem odniesienia do dalszych naszych rozważań. Cykl ten rozpatrywany był przez francuskiego inżyniera i fizyka Leonarda Sadi Carnota na początku XIX-go wieku i zwany jest cyklem Carnota. Jest to cykl odwracalny składający się z dwóch przemian izotermicznych oraz dwóch adiabatycznych.
Silnik cieplny pracujący w sposób odwracalny pomiędzy dwoma zbiornikami o różnych temperaturach ![]()
i ![]()
. Energia wymieniana jest na sposób ciepła i przekazywana jest na sposób pracy. Kolejność przemian gazu doskonałego, w cyklu, zgodna z kierunkiem ruchu wskazówek zegara (![]()
).
Na cykl składają się cztery przemiany: dwie adiabatyczne i dwie izotermiczne. Zakładamy, że cykl rozpoczyna się stanem (1) opisanym przez ![]()
, ![]()
, ![]()
i odpowiednio poprzez kolejne stany (2), (3), (4) kończy powrotem do stanu (1).
W przemianie 1 do 2 izotermicznego rozprężania gaz pobiera energię w postaci ciepła ![]()
ze zbiornika o temperaturze ![]()
. Przemiana zachodzi przy stałej temperaturze, więc energia wewnętrzna gazu nie ulega zmianie oraz
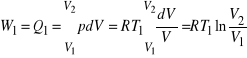
.
W przemianie drugiej, zachodzącej pomiędzy punktami 2 i 3, gaz ulega rozprężeniu adiabatycznemu. Oznacza to, że odcięty został zarówno dopływ energii w postaci ciepła, jak i możliwość przekazania energii otoczeniu, ale rozprężanie odbywało się nadal do objętości ![]()
. Trzeci etap jest znów przemianą izotermiczną, w której gaz zostaje sprężony od objętości ![]()
do ![]()
. Gaz oddaje energię w postaci ciepła do chłodnicy o wielkiej pojemności cieplnej, wiec temperatura ![]()
pozostaje niezmieniona, ale wskutek rozprężania adiabatycznego od objętości ![]()
do ![]()
, które zaszło wcześniej, jest niższa od temperatury ![]()
. Praca wykonana przez gaz w tym procesie wynosi
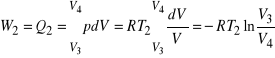
.
Zauważmy, że w tym przypadku obie wielkości: wykonana praca i ciepło "pobrane" z chłodnicy są ujemne. Ciepło oddane, któremu przypisujemy wartość dodatnią, oznacza się zwykle symbolem ![]()
. Mamy, więc
![]()
.
Czwarty proces jest znów adiabatyczny i przeprowadza układ od punktu 4 do początkowego punktu 1. W ten sposób cykl zostaje zamknięty, a energia wewnętrzna po wykonaniu całego cyklu ma swą pierwotną wartość. Przyrost energii wewnętrznej układu równy jest zeru, a sumaryczna wykonana praca równa jest pobranemu przez układ energii w postaci ciepła
![]()
.
Stosunek pracy wykonanej przez układ w jednym cyklu do pobranego w tym cyklu ciepła nazywamy sprawnością lub wydajnością silnika cieplnego (maszyny cieplnej). W naszym przypadku mamy
![]()
.
Widzimy, że sprawność byłaby równa jedności gdyby cała energia pobrana w postaci ciepła zostałaby zamieniona na pracę. Układ musiałby wyłącznie pobierać ciepło. Część ciepła musi być jednak oddawana otoczeniu i w rezultacie sprawność jest zawsze mniejsza od jedności. Wykorzystując własności przemiany adiabatycznej, mamy w naszym przypadku związki
![]()
oraz ![]()
.
Dzieląc stronami pierwsze z powyższych równań przez drugie otrzymujemy
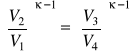
czyli ![]()
.
Wykorzystując ten związek i to, że
![]()
, ![]()
,
mamy
![]()
lub ![]()
.
Wynika z tego, że sprawność silnika Carnota może być przedstawiona w postaci
![]()
.
Otrzymaliśmy ważny związek, który mówi, że sprawność silnika Carnota określona jest wyłącznie stosunkiem temperatur; mniejszej do większej, i że rośnie wraz ze zmniejszaniem się tego stosunku. Widzimy też, że sprawność ta jest mniejsza od jedności, co oznacza, że nie całe pobrane ciepło zamienia się na pracę. Część ciepła oddawana jest chłodnicy, ale jest to konieczne dla przeprowadzenia cyklu kołowego. Jeśli cykl jest nieodwracalny, co może być wynikiem niedoskonałej izolacji cieplnej lub tego, że przemiany nie są kwazistatyczne, to sprawność silnika jest mniejsza niż w przypadku cyklu odwracalnego
![]()
.
Wniosek, że sprawność silnika Carnota zależy wyłącznie od stosunku temperatur znany jest pod nazwą pierwszego twierdzenia Carnota.
Twierdzenia Carnota: 1. Wszystkie silniki pracujące w odwracalnym cyklu Carnota pomiędzy tymi samymi temperaturami mają tę samą sprawność.
Twierdzenie to oznacza również, że sprawność dowolnego cyklu odwracalnego, ale składającego się z innych przemian niż cykl Carnota nie może być większa od sprawności odwracalnego cyklu Carnota.
2. Sprawność cyklu nieodwracalnego jest zawsze mniejsza od sprawności cyklu odwracalnego.
Zwróćmy uwagę, że możliwe jest także przeprowadzenie cyklu w kierunku odwrotnym. Oznacza to, że nad układem wykonywana jest praca, zaś ciepło odbierane jest z chłodnicy i przekazywane nagrzewnicy. Układ taki działa jak maszyna chłodząca, czyli może stanowić lodówkę. Ciepło odbierane jest wtedy od ciała o temperaturze niższej i przekazywane ciału o temperaturze wyższej poprzez wykonanie pracy. Odpowiednikiem sprawności jest tutaj skuteczność chłodzenia określona jako
![]()
.
Cykl Otta. Pracę czterosuwowego silnika benzynowego, z dobrym przybliżeniem, opisuje cykl Otta, na który składa się sześć następujących procesów
Od 0 do 1 izobaryczne wessanie powietrza zawierającego pary benzyny do cylindra, o pojemności minimalnej
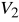
oraz maksymalnej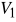
.Od 1 do 2 adiabatyczne sprężenie zassanej mieszanki aż do
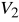
.Od 2 do 3 zapłon, izochoryczne spalanie mieszanki w minimalnej objętości cylindra.
Od 3 do 4 adiabatyczna ekspansja gazów spalinowych do
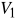
.Od 4 do 5 izochoryczny spadek ciśnienia w wyniku otwarcia wentyla spustowego.
Od 5 do 0 izobaryczne usunięcie reszty gazów spalinowych z układu spalania i powrót układu do stanu początkowego.
Zakładamy, że cykl rozpoczyna się stanem 1 opisanym przez ![]()
i odpowiednio poprzez kolejne stany 2, 3, 4 kończy powrotem do stanu 1.
Przy obliczaniu wydajności cykli odwracalnych posługujemy się najwygodniejszymi charakterystykami rozważanego cyklu.
W procesie od 2 do 3 izochorycznego ogrzewania gaz pobiera ciepło
![]()
.
W procesie od 4 do 1 izochorycznego ochładzania gaz oddaje ciepło
![]()
.
Ale ![]()
, więc ciepło oddane przez gaz wyniesie
![]()
.
Sprawność cyklu Otta obliczamy ze wzoru:
![]()
.
Po podstawieniu, otrzymujemy
![]()
.
Aby wyrazić tę sprawność za pomocą stopnia sprężenia wykorzystamy równania adiabat w postaci ![]()
, gdzie wykładnik w równaniu adiabaty (Poissona) ![]()
. Dla procesu od 1 do 2 mamy: ![]()
, dla procesu od 3 do 4 mamy: ![]()
. Z powyższych równań obliczamy temperatury i podstawiamy do wzoru na sprawność. Otrzymujemy, że 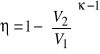
. Wzór ten pokazuje łatwy, na pozór, sposób na zwiększenie wydajności silnika spalinowego poprzez zwiększenie stopnia sprężenia mieszanki.
Cykl Diesla opisuje pracę czterosuwowego silnika wysokoprężnego. Stan gazów w cylindrze opisany jest za pomocą sześciu następujących po sobie przemian odwracalnych.
Od 0 ->1 izobaryczne wessanie powietrza do całkowitego wypełnienia objętości cylindra.
Od 1 do 2 adiabatyczne sprężenie zassanego powietrza.
Od 2 do 3 wtrysk paliwa, izobaryczne spalanie mieszanki
Od 3 do 4 adiabatyczna ekspansja gazów spalinowych
Od 4 do 1 izochoryczny spadek ciśnienia w wyniku otwarcia wentyla spustowego.
Od 1 do 0 izobaryczne usunięcie reszty gazów spalinowych z układu spalania i powrót układu do stanu początkowego.
Zakładamy, że cykl rozpoczyna się stanem 1 opisanym przez ![]()
i odpowiednio poprzez kolejne stany 2, 3, 4 kończy powrotem do stanu 1.
Przy obliczaniu wydajności cykli odwracalnych posługujemy się najwygodniejszymi charakterystykami rozważanego cyklu.
W procesie od 2 do 3 izobarycznego ogrzewania gaz pobiera ciepło
![]()
.
W procesie od 4 do 1 izochorycznego ochładzania gaz oddaje ciepło
![]()
.
Ale ![]()
, więc ciepło oddane przez gaz wyniesie
![]()
.
Sprawność cyklu Diesla obliczamy ze wzoru:
![]()
.
Po podstawieniu, otrzymujemy:
![]()
.
Korzystając z równania adiabaty i równania stanu gazu doskonałego możemy tę sprawność wyrazić za pomocą stopnia sprężenia. Wykładnik w równaniu adiabaty (Poissona). Dla procesu od 1 do 2 mamy: ![]()
, dla procesu od 3 do 4 mamy: ![]()
. Dla osób zainteresowanych, zachęta do samodzielnego dokończenia obliczeń zależności wydajności od objętości gazu w tym cyklu, bo
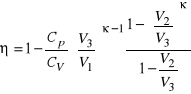
.
Jak widać, wydajność silnika Diesla zależy również od przebiegu procesu spalania, który ma charakter izobarycznego ogrzewania przy zmianie objętości od ![]()
do ![]()
. Warto zauważyć, że w obu przypadkach właściwą substancją pracującą jest powietrze, a proces spalania mieszanki paliwowej rozpatrujemy jako izochoryczne (cykl Otta), bądź izobaryczne (cykl Diesla) jego ogrzewanie.
Wyszukiwarka
Podobne podstrony:
Fizyka W 6 B, Fizyka wykłady i zagadnienia Czapla
Pyt Ekz Fiz, Fizyka wykłady i zagadnienia Czapla
Zagad Fiz, Fizyka wykłady i zagadnienia Czapla
Fizyka W 1, Fizyka wykłady i zagadnienia Czapla
Fizyka W 2, Fizyka wykłady i zagadnienia Czapla
Fizyka W 9, Fizyka, FIZYKA, Fizyka wykłady i zagadnienia Czapla, Elektrodynamika
Fizyka W 10b, Fizyka, FIZYKA, Fizyka wykłady i zagadnienia Czapla, Elektrodynamika
Fizyka W 3, Fizyka wykłady i zagadnienia Czapla
Fizyka W 10c, Fizyka, FIZYKA, Fizyka wykłady i zagadnienia Czapla, Elektrodynamika
temp krytyczna, TRANSPORT PWR, STUDIA, SEMESTR II, FIZYKA, fizyka-wyklad, zagadnienia opracowane, za
sprawozdanie 33a, fizyka 2 wykład i zagadnienia, 33
Zjawisko dopplera, TRANSPORT PWR, STUDIA, SEMESTR II, FIZYKA, fizyka-wyklad, zagadnienia opracowane,
Sprawko 89, fizyka 2 wykład i zagadnienia, 89
sprawdzanie prawa hooke a wyznaczanie modu u younga 1, fizyka 2 wykład i zagadnienia, sprawozda
Pomiar zależności rezystancji metali i półprzewodników od temperatury, fizyka 2 wykład i zagadnienia
siła i energia, TRANSPORT PWR, STUDIA, SEMESTR II, FIZYKA, fizyka-wyklad, zagadnienia opracowane, za
więcej podobnych podstron