0000061 (6)

gdzie:
8tl2/c
przy czym J = O, 1,2, ... oznacza odpowiednią liczbę kwantową, I — moment bezwładności cząsteczki, c — prędkość światła. Dla przykładu, przejściu ze stanu 7=3 do stanu 7=4 odpowiada różnica energii &£rol =8 B c h. Dla cząsteczki HC1 ta różnica energii wynosi około 0,01 eV, do wzbudzenia tego poziomu należałoby więc użyć kwantu o energii = 0,01 eV, co odpowiadałoby długości fali około 124 jam, a więc w dalekim zakresie podczerwieni.
Widma rotacyjne leżą w dalekiej podczerwieni oraz w zakresie mikrofal (100-1000 (im), ich badanie dostarcza cennych informacji o budowie cząsteczki. Można znaleźć jej moment bezwładności, a co za tym idzie, odległości międzyatomowe w cząsteczce, np. dla HC1 otrzymuje się odległość między atomami 0,128 nm.
Energia oscylacyjna jest związana z drganiami atomów cząsteczki względem siebie. W najprostszym przypadku cząsteczki dwuatomowej można sobie ją wyobrazić jako dwie kulki związane sprężyną. Atomy wykonują wtedy ruch harmoniczny. Energia takiego ruchu jest według mechaniki kwantowej skwantowana i wyraża się wzorem
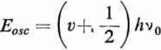
gdzie t? = 0,1, 2, ... są oscylacyjnymi liczbami kwantowymi, v0 — częstotliwość drgań oscylatora. Energia wzbudzenia, potrzebna do przejścia z poziomu energetycznego v = 0 na poziom v = 1, wynosi AjEosc = /;v0. Energia wzbudzenia poziomów oscylacyjnych jest rzędu 10_1 eV, odpowiada jej długość fali rzędu 10 (im, a więc bliższej podczerwieni. Wzór 2.3 należy uważać za przybliżenie, gdyż drgania atomów w cząsteczce nie są harmoniczne. Cząsteczki niepolarne, jak H2, O, itp. nie dają widm oscylacyjnych (odnosi się to także do rotacyjnych), gdyż drgania atomów w tego rodzaju cząsteczkach nie dają zmian momentu dipolowego, co jest koniecznym warunkiem emisji promieniowania elektromagnetycznego. W związku z tym powietrze nie absorbuje promieni podczerwonych Słońca, natomiast pochłania je w pewnych zakresach widma para wodna. Na energie oscylacyjne nakładają się zawsze rotacyjne, mamy więc w zasadzie do czynienia z widmami oscylacyjno-rotacyjnymi, w dziedzinie podczerwieni. Poziomy oscylacyjno--rotacyjne przedstawia ryc. 2.8. Widma oscylacyjno-rotacyjne dostarczają ważnych informacji o strukturze cząsteczek. Niektóre częstości są charakterystyczne dla określonych grup atomów, np. grupie C-H odpowiada liczba falowa około 2900 cm-1, nawet gdy wchodzi w skład innej cząsteczki można ją z widma rozpoznać.
Energia elektronowa cząsteczki związana jest z elektronowymi poziomami molekuły. Przejście elektronów na wyższe poziomy energetyczne jest możliwe przy energiach kwantów w zakresie światła widzialnego czy nawet nadfioletu. W cząsteczce stan elektronu jest także opisany czterema liczbami kwantowymi n, l, X, ms, znaczenie tych liczb jest takie samo jak w atomie, z tym że odpowiednikiem orbitalnej liczby magnetycznej m, jest w cząsteczce liczba X. Na wzbudzone stany elektronowe nakładają się wzbudzone stany oscylacyjne i rotacyjne zgodnie z wzorem 2.1. W ten sposób powstaje bardzo złożone widmo pasmowe elektronowo-oscylacyjno-rotacyjne; odpowiednie poziomy
5* 67
Wyszukiwarka
Podobne podstrony:
skanuj0063 (46) Wszystkie węzły sieci są końcami wektorów ua--vb przy czym u i v oznaczają dowolne l
6.1. UKŁADY PODSTAWOWE. WŁAŚCIWOŚCI I WIELKOŚCI ZALEŻNE 297 przy czym C oznacza iloczyn wielkości
78424 skanuj0063 (46) Wszystkie węzły sieci są końcami wektorów ua--vb przy czym u i v oznaczają dow
zobowigzały się do wspólnej ochrony wojskowej kanaki przy czym główna odpowiedzialność do 1999 r, sp
306 t. FUNKCJE ZMIENNEJ ZESPOLONEJfiż)dz Slira^ ACdM przy czym d. oznacza średnicę podziału przedzia
306 IK. FUNKCJE ZMIENNEJ ZESPOLONEJ przy czym <5. oznacza średnicę podziału przedziału <a, fi)
257 (16) 514 20. Elementy analizy macierzowej obwodów przy czym wiersze odpowiadają oczkom niezależn
MG!80 przy czym e oznacza tutaj odkształcenie liniowe przekątnych kostki pierwszej. Mierząc to odks
Mechanika ogolna0011 22 Oznaczmy odpowiednio: B = -m • aM - tzw. siła bezwładności (siła fikcyjna) &
ewolucję LO oraz NLO DGLAP. Wzrost funkcji struktury przy małych x kształtuje odpowiednio ich obcięt
DSCF6565 86 gdzie:<p + «V = o(8) , 4tc2 D ® ~ 1*~ 1 T =2n Ponieważ nie znamy ani momentu bezwładn
stat Page9 resize 39 Statystyka matematyczna gdzie również ©i C ©, przy czym ©o n Oi = 0. Oznacz to
więcej podobnych podstron