skrypt wzory i prawa z objasnieniami63


■ W przemianie izoleriuic/ncj gazu doskonałego warunek T - consi jCS, równoważny warunkowi pV= const lub p\V[ -Pi^2 (prawo Boyle'a . Manune‘a}. W przemianie izoicmicznej /miana energii wewnętrznej jest równa zeru, gdyż temperatura gazu nie zmienia się dU-n CyAT = 0. Gdy gaz pobiera ciepło, lo jest ono całe zużyte na wykonanie przez gaz pracy O - W.
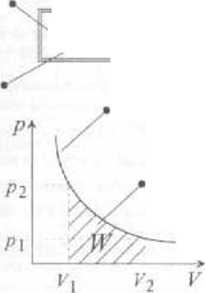
Pracę wykonywaną przez gaz w przemianie izoternneznej obliczamy ze wzoru
Vi
W= [ póV v\
Podstawiając ciśnienie p - nRTiV otrzymujemy
W=nRT J ^ = n-|^
J V VI
* I
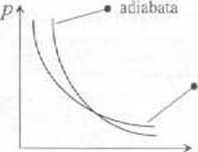
■ Przemiana adiabatyczna jest to proces, podczas którego nie zachodzi wymiana ciepła z otoczeń cm Można to uzyskać poprzez oddzielenie układu od otoczenia dobrymi izolatorami cieplnymi lub jeżeli proces przeprowadzimy dostatecznie szybko.
/ pierwszej zasady termodynamiki AQ-dGid^T wynika, że ponieważ d£ - O ,n» dt'+ćH'=0. Czyli w przemianie adiabatycznej praca wykonywana przez jklać równa est ubytkowi energii wewnętrznej układu, a wiec dłP = - d(/
■ Przyrost energii wewnętrznej układu powoduje wzrost jego temperatury Ten wzrost temperatury powoduje dodatkowy wzrost ciśnienia gazu A więc podczas adiabatycznego sprężania (rozprężania) gazu zmiany ciśnienia są większe niż podczas izolermiczncgo sprężania (rozprężania) gazu (wykres po prawej stronie).
■ 7. rów nania adiabaty (równania Pois«ma) dla zmiennychp i V (pYr -cnnftf' nożna przejść do zmiennych T 1 V Skorzystamy w tym celu z równania Clapcyrona p- *,RT>Y Otrzymujemy pV- nRTV^!V = nRTV ’~] = const. Stąd !T * = const (stałe występujące w dwóch ostatnich równaniach są oczywiście różne). lak więc równanie adiabaty rriożc być wyrażone poprzez dowolne iwie wielkości spośród p. V. '/'
■ Przemianą połltropową nazwywainy przemianę, podczas której ciepło molowe C (ciepło właściwe c) jest stałe. Równanie poiitropy gazu doskonałego ma postać
pV n = const, gdzie k - ; nazywamy W7kładnikicm poiitropy
Wszystkie dotychczas omówione przemiany są szczególnymi przypadkami przemiany poi tropowej. W przemianie izobarycznej C-Cp a więc n = 0. izochoryczncj C = C, czyli n - *, izotcrmicznej n = / Przemiana adiabatyczna również jest przemianą po.itropową dla n = y

63.3 Przemiana izotermiczna
pV = const
izoterma {T= const)
ciśnienie gazu doskonałego
objętość gazu doskonałego
63.4. Przemiana adiabatyczna
objętość gazu doskonałego
• współczynnik Poissona
równanie Poissona
c^r.ienic gazu doskonałego
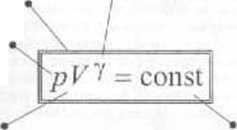
i stała wartość dla danej masy gazu doskonałego
praca w przemianie lzoiermicznej
W= J pdv= nRTin^r
ciepło molowe przy stał\m ciśnieniu
\
~r •
ciepło molowe przy stałej objętości
stała wartość dla danej masy gazu doskonałego
izoterma {T = consri
V
Wyszukiwarka
Podobne podstrony:
skrypt wzory i prawa z objasnieniami62 122 Przemiany stanu gazu doskonałego ■ W tr
skrypt wzory i prawa z objasnieniami63 124 Przemiany stanu gazu doskonałego ■ W pr
skrypt wzory i prawa z objasnieniami62 122 Przemiany stanu gazu doskonałego ■ W tr
skrypt wzory i prawa z objasnieniami71 140 Średnia droga swobodna. Dyfuzja ■ Pomię
skrypt wzory i prawa z objasnieniami61 120Gaz doskonały. Równanie van der Waałsa ■
skrypt wzory i prawa z objasnieniami69 136Rozkład Boltzmanna T ■ Ko/Mud Boit/iminu
skrypt wzory i prawa z objasnieniami61 120Gaz doskonały. Równanie van der Waałsa ■
skrypt wzory i prawa z objasnieniami71 Średnia droga swobodna. Dyfuzja ■ Pomiędzy kornym; zderzeniam
skrypt wzory i prawa z objasnieniami03 4 Układy współrzędnych ■ Układem odniesienia nazywamy ciało,
skrypt wzory i prawa z objasnieniami05 8 Prędkość ■ Tor jest to krzywa opisywana w przestrzeni przez
skrypt wzory i prawa z objasnieniami24 46 Pole grawitacyjne ■ Pole grawitacyjne przy powierzchni Zie
skrypt wzory i prawa z objasnieniami25 Pole sił zachowawczych (potencjalnych) ■ Jeśli w każdym punkc
skrypt wzory i prawa z objasnieniami37 72Moment bezwładności ■ Moment bezwładności
skrypt wzory i prawa z objasnieniami38 74 Ruch obrotowy ciała ■ Jak wynika z własności iloczynu wekt
więcej podobnych podstron