skrypt wzory i prawa z objasnieniami62

122 Przemiany stanu gazu doskonałego
■ W trakcie pr/crai;in> i/obaryc/ucj spełniony est warunek /> = const,a więc z równania stanu gazu doskonałego wynika zależność VfT = consi lub !•’|/7*j = YtfTi (prawo Gay - Lussaca)
W czasie przemiany izoharycznęj go/ pobiera ciepło i wykonuje pracę Ilość ciepła potrzebna do ogrzan a n moli gazu od temperatury Tdo temperatury T ' AT w przemianie izobarycznej wyraża się wzorem
Q — nCp&T,
gdzie zakładamy, żc Cp - ciepło molowe pod stałymi ciśnieniem jest stale.
Praca ft'wykonana przez gaz w przemianie izobarycznej wyraża się wzorem
v? , H
H' = pdV~p j ćY = p{Y2 - Y\)-pAV .
f\' '
Pierwsza zasada termodynamiki dla tej przemiany ma więc postać nCpAT = A U-rpUY.
■ Przemiana i/.ocboryczna gazu doskonałego zachodzi przy* w-arunku J consi. który jest równoważny warunkowi p!T- canst lub P\>T\ -P2W2 (prawo Chariesa)
W czasie przemiany izochorycznej gaz mc wykonuje pracy dW- pdV= 0.
Ilość ciepła potrzebna do ogrzania r, moli gazu od temperatury T do temperatury r + AT wynosi Q - nCy&T, gdzie Cy jest ciepłem molowym przy stałe; objętości P erwsza zasada termodynamiki dla tej przemiany ma w ięc postać
hCy&T = A U.
■ Powyższy' wzór w postaci różniczkowej dt/= nCyóT wyraża zmianę energii wewnętrznej n moli gazu przy zmianie temperatury o dT w dowolnym procesie termodynamicznym.
■ Równanie Mayera. Zastosujmy pierwszą zasadę termodynamiki do przemiany zobaiycżnej n moli gazu doskonałego
nCr.AT= AU-pAY.
Ponieważ dla gazu doskonałego mamy A U = nCy&T, więc otrzymujemy nCpAT = /iC j'A’jf + pAY 7. równania Clapcyrona mamy pAY = nRAT Zatem nCpAT-*RAT- r.CyAT,
skąd dzieląc obie strony równanie przez r,AT otrzymujemy
Cp ~ Cy — R.
Dla każdego gazu ciepło molowe pod stałym ciśnieniem jest zawsze większe od ciepła molowego w stałej objętość; o wielkość równą stałej gazowej Równanie Mayera można także zapisać dla cicpeł właściwych
gdzie Af jest masą cząsteczkową gazu
Termodynamika 123
objętość gazu < doskonałego
temperatura bezwzględna gazu doskonałego
ciepło molowe
ciepło pobrane przez gaz przy stałym ciśnieniu
w czasie przemiany izobarycznej
V\
praca w przemianie izobarycznej
liczba moli gazu •"
masa gazu •
63.2. Przemiana izochoryczna
>• ciepło właściwe przy stałym ciśnieniu
ciśniecie gazu doskonałego
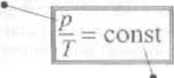
siała w artość dla danej masy gara doskonałego
ciepło pobrane przez gaz w czasie przemiany izochoryczncj
ciepło molowe przy stałej objętości •
Równanie Mayera
■ ciepło molowe przy stałym ciśnieniu 1
izoebora M - consti
t zmiana
temperatur;, gazu
-s. ciepło właściwe
przy stałej objętości
wielkość zależna od ilości atomów w cząsteczce gaza
|
W- |
stała gazowa | |
|
\Cp-Cy = R |
^ /? = 8,31 —TTT raoi-K |
Cy r |
• ciepło molowe przy stałej objętości
Wyszukiwarka
Podobne podstrony:
skrypt wzory i prawa z objasnieniami62 122 Przemiany stanu gazu doskonałego ■ W tr
skrypt wzory i prawa z objasnieniami63 124 Przemiany stanu gazu doskonałego ■ W pr
skrypt wzory i prawa z objasnieniami63 124Przemiany stanu gazu doskonałego ■ W prz
skrypt wzory i prawa z objasnieniami71 140 Średnia droga swobodna. Dyfuzja ■ Pomię
skrypt wzory i prawa z objasnieniami69 136Rozkład Boltzmanna T ■ Ko/Mud Boit/iminu
skrypt wzory i prawa z objasnieniami71 Średnia droga swobodna. Dyfuzja ■ Pomiędzy kornym; zderzeniam
skrypt wzory i prawa z objasnieniami03 4 Układy współrzędnych ■ Układem odniesienia nazywamy ciało,
skrypt wzory i prawa z objasnieniami05 8 Prędkość ■ Tor jest to krzywa opisywana w przestrzeni przez
skrypt wzory i prawa z objasnieniami24 46 Pole grawitacyjne ■ Pole grawitacyjne przy powierzchni Zie
skrypt wzory i prawa z objasnieniami25 Pole sił zachowawczych (potencjalnych) ■ Jeśli w każdym punkc
skrypt wzory i prawa z objasnieniami37 72Moment bezwładności ■ Moment bezwładności
skrypt wzory i prawa z objasnieniami38 74 Ruch obrotowy ciała ■ Jak wynika z własności iloczynu wekt
skrypt wzory i prawa z objasnieniami49 96 Składanie drgań ■ Przy składaniu drgań o
więcej podobnych podstron