skrypt wzory i prawa z objasnieniami61

120
Gaz doskonały. Równanie van der Waałsa
■ Ca/ doskonal} definiuje się następująco:
* cząsteczk’ gaza poruszają się chaotycznie we wszystkich kierunkach, z których żaden nie jest uprzywilejowany,
- cząsteczki zderzają się sprężyście ze sobą wzajemnie i ze ściankami naczynia, w którym znajduje się gaz,
- między cząsteczkami nic działają żadne siły, poza krótką chwilą, w której następuje zderzenie,
- cząsteczki poruszają się od zderzenia do zderzenia ruchem jednostajnym
prostoliniowym,
- suma objętości cząsteczek gazu jest dużo mniejsza od objętości naczynia, w
który r.i znajduje się gaz.
Każdy gaz rzeczywisty pod odpowiednio małym ciśnieniem (dostatecznie . zfzedzcny; ma własności zbliżone do gazu doskonałego.
■ Star. danej masy gazu jest określony przez wartości trzech parametrów C1ŚII.C1U3 p, objętości 1 i temperatury T. Związek między tymi parametrami nu>zx
yc dany w postaci równania Ftp, V,T)~ 0. które nazywamy równaniem stanu. Da gazu doskonałego równanie stanu (równanie C Iapeyrona) ma postać pi' = >;RT , gdzie n esl liczbą moli gazu. a /? stałą gazową. Dla stałej masy gazu równanie *.o mniemy zapisać w postaci pi'!T =const Wprowadzając wielkość ( - ił \'A, która jest nazywana stałą Uoltzmanna. a V* = 6,022 • I023 mol 1 jest lic/ ą cząsteczek w jednym molu gazu (liczba Avogadro), możemy przekształcić równanie Clupcyrons do postaci
^1= . nSĄkT= V kT,
gdzie .V est całkowitą liczbą cząsteczek gazu.
■ W warunkach normalnych (7’:: 273AT 0°C, pg - 1.10 lD5 l’a) olęętuśi I
mola każdego gazu jest State i wynosi
l'o * ifV,ra Ł ?2.4 1/moi - 22,4 10"3 m:Vmnl
■ Wraz ze wzrostem ciśnienia i ze spadkiem temperatury obserwuje się dla gazu rzeczywistego odstępstwa od równania stanu gazu doskonałego. Wzrost gęstości gazu powozu je. źe dużą rolę zaczyna odgrywać objętość cząsteczek oraz oddzlaływanin międzycząstcczkowc.
Zachowanie s:ę gazów rzeczywistych w szerokim zakresie gęstości opisuje równanie Van der Waałsa. Otrzymuje się je przez wprowadzenie dwóch poprawek do rów nania stanu gazu doskonałego (pV - nRT)
Poprawka /rai* charakteryzuje dodatek do ciśnienia zewnętrznego, który wyn ka ze wzajemnego przyciągania się cząsteczek gazu. Gaz wywiera n:i ścianki naczynia ciśnienie/», które jest równe ciśnieniu wywieranemu na gaz z zewnątrz Z :u>\yodu przyciągania się cząsteczek gaz jest jakby ściskany ciśnieniem większym od p.
Ponieważ cząsteczki mają skończoną objętość, w ięc przestrzeń dostępna d'a mchu cząsteczek jest w rzeczywistości mm cisza od objętości naczynia V. Poprawka nb charakteryzuje tę część objętości, która me jest dostępna dla ruchu cząsteczek
61. Równanie stanu gazu doskonałego (Równanie Clapeyrona)
* masa gazu /
-4-
liczba moli
T
, liczba wszystkich cząsteczek gazu
cisnicnic gazu doskonałego
•liczba Avogadro masa molowa gazu
raiura gazu doskonałego
objętość gazu« doskonałego
• stała gazowa R - 8,31
moMĆ
*• •liczi
stała wartość dla danej masy gazu doskonałego
\
parametry stanu gazu doskonałego na początku procesu termodynamicznego
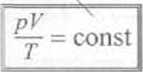
62. Równanie Van der Waałsa
parametry stanu gazu doskonałego na końcu procesu termodynamicznego
stałe Van der Waałsa Jt (wyznaczone doświadczalnie)
ciśnienie wywierane przez gaz na ścianki naczynia

mol-K
Wyszukiwarka
Podobne podstrony:
skrypt wzory i prawa z objasnieniami61 120Gaz doskonały. Równanie van der Waałsa ■
skrypt wzory i prawa z objasnieniami03 4 Układy współrzędnych ■ Układem odniesienia nazywamy ciało,
skrypt wzory i prawa z objasnieniami05 8 Prędkość ■ Tor jest to krzywa opisywana w przestrzeni przez
skrypt wzory i prawa z objasnieniami05 8Prędkość ■ Tor jest to krzywa opisywana w przestrzeni przez
skrypt wzory i prawa z objasnieniami03 4 Układy współrzędnych ■ Układem odniesienia nazywamy ciało,
skrypt wzory i prawa z objasnieniami19 □ Siła Coriolisa ■ Siła Coriolisa (siła bezwładności Conohsa)
skrypt wzory i prawa z objasnieniami62 122 Przemiany stanu gazu doskonałego ■ W tr
skrypt wzory i prawa z objasnieniami63 124 Przemiany stanu gazu doskonałego ■ W pr
skrypt wzory i prawa z objasnieniami17 32 Ruch ciał ze zmienną masą ■ Równanie ( różniczkowe) mchu r
skrypt wzory i prawa z objasnieniami42 82 Równanie drgań harmonicznych ■ W równani
skrypt wzory i prawa z objasnieniami45 88 Wahadło fizyczne ■ Równanie różniczkowe ruchu wahadła fizy
skrypt wzory i prawa z objasnieniami51 100 Drgania tłumione ■ Równanie różniczkowe drgań tłumionych
skrypt wzory i prawa z objasnieniami52 102 Drgania wymuszone ■ Równanie różniczkowe drgań wymuszonyc
skrypt wzory i prawa z objasnieniami40 78Ruch obrotowy ciała ■ Jeśli wyróżnimy nieruchomą oś obrotu,
skrypt wzory i prawa z objasnieniami62 122 Przemiany stanu gazu doskonałego ■ W tr
skrypt wzory i prawa z objasnieniami63 124Przemiany stanu gazu doskonałego ■ W prz
skrypt wzory i prawa z objasnieniami24 46 Pole grawitacyjne ■ Pole grawitacyjne przy powierzchni Zie
więcej podobnych podstron