073

A HibUl. IM1U.1 .Vvu .•»•»»«. :i>, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >WJ
73
3 6 WIDMO EMJŚYJNE I ABSORPCYJNE WODORU
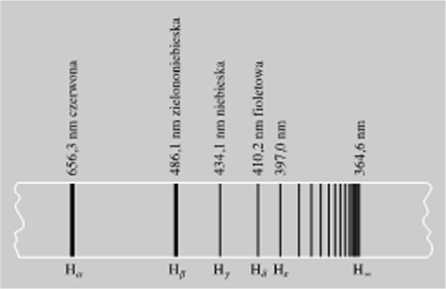
Rys. 3.19. Linie widmowe wkIwu. Seria Balniem. Liczby oznaczają dlugujci fali (wicllncj ixlpo» iada-i>fi< poszczególnym liniom widmowym Pizy lunach położonych w zakicuc SwimU wnl/ialncgo podano również b.irwę 1xlp.nv1a1Uy4.cgo im promieniowania
oraz cztery serie w podczerwieni iseric: Faschcna. Brackctta. Ffunda 1 Humphreysa 1 Prążki odpowiadające serii Balrnera przedstawiono na rys. 3.19. Rozróżnienie poszczególnych serii w widmie wodoru jest łatwe i nie budzi wątpliwości. W przypadku innych pierwiastków scnc najczęściej nakładają się na siebie, co znacznie utrudnia ustalenie, do której z nich należy dana linia widmowa.
W roku 1885 JJ. Balmer poda! wzór empiryczny wyrażający długości fali odpowiadające poszczególnym liniom widzialnej sent w widmie wodoru Wzór ten został później uogólniony, tak że można go .stosować również do innych serii widma wodoru. Najczęściej zamiast długości fali A. podaje się jej odwrotność l/A = v. zwaną liczbą falową. W/ót Balmera przyjmuje wówczas postać
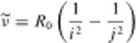
R0 oznacza .stałą Rydherga równą 1.0973731534 • 10' m j oraz i są liczbami naturalnymi. przy czym j > i.
Liczby falowe odpowiadające limom należącym do tej samej seni znajduje się. podstawiając tę samą wartość za i oraz różne wartości za j. Na przykład w celu otrzymania liczb falowych charakteryzujących serię Lymana podstawiamy i = 1 oraz
l = 2.3.4...., serię Rainiera 1 = 2 oraz j = 3,4,5.....serię Faschcna / = 3 oraz
j = 4.5.6...
Układ prążków widmowych w widmach emisyjnych, otrzymanych przez wzbudzenie gazów lub par w luku elektrycznym lub w płomieniu gazowym, jest charakterystyczny dla pierwiastków zawartych w badanych substancjach, a nie zależy od rodzaju użytego związku. Jest on charakterystyczny dla wolnych atomów, które powstały ptzez rozpad
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 .Vvu r.., r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 34
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 2
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2 a SZY
A HibUl. IM1U.1 ,Vvu r.», r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2
A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 37
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 40 2
A HibUl. IM1U.1 .Vvu -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2 1
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 3 1 DWO
A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 2 ZAS
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-Ż © l>. »N TOS »*} 3.2 ZASADA
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 54 3
A HibUl. IM1U.1 .Vvu -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 E
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3.5 Oft
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 67 3 5
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 78
A HibUl. IM1U.1 .Vvu :i>, r I, buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*}
A HibUl. IM1U.1 .Vvu :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 3.1
więcej podobnych podstron