094

A HibUl. IM1U.1 .Vvu :i>, r I, buui :uO
ISBN D4H1II ł-7. © l>. »N TOS >*}
3 ELEKTRONOWA STRUKTURA ATOMU
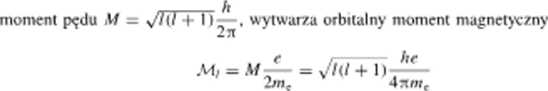
(3.34)
przy czym wc oznacza masę elektronu, <• — jego ładunek, h — stałą Plancka, l — poboczną liczbę kwantową. Stały współczynnik pojawiający się w tym równaniu nosi nazwę magnetonu Bohra i jest oznaczany symbolem /<&. A więc
(3.35)
Mi = M + ' )/z H
Wartość liczbowa magnelonu Bohra wynosi 9.2740154 10 21 A m2 W paragrafie 3.4 stwierdziliśmy, żc jeżeli zachowanie się elektronu w atomie wodoru opisuje orbita! * (/ = 0). moment pędu elektronu M = 0; w tym stanic atom wodoru nic wykazuje także i orbitalnego momentu magnetycznego. Orbitalny moment magnetyczny pojawia się natomiast wtedy, gdy zachowanie elektronu opisuje orbital />. d. f itd. W szczególności możemy napisać:
dla orbualu s
M = 0
dla orbitalu p
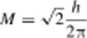
M, = 0 M/ — v'2/ib
dla orbualu d
dla orbualu /
Ms = v'6jib
Jak juz wiadomo z p 3.7. elektron obok orbitalnego momentu pędu M. wykazuje także spinowy moment pędu <r. Ze spinowym momentem związany jest spinowy moment magnetyczny, który oznaczamy symbolem M,:
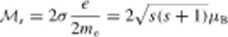
(3.36)
Ponieważ liczba s przyjmuje tylko jedną wartość s = 1/2. można napisać
(3.37)
M, = v'3jin
Rozważania przytoczone w tym paragrafie prowadzą zatem do wniosku, ze każdy elektron w atomie wykazuje spinowy moment magnetyczny oraz z wyjątkiem ciek tronów x — orbitalny moment magnetyczny. Momenty magnetyczne poszczególnych elektronów, zarówno orbitalne jak i spinowe, oddziałują na siebie w analogiczny sposób, jak momenty magnetyczne magnesów sztabkowych. Jest to równoznaczne z oddziaływaniem na siebie także i związanych z nimi momentów pędu. Tego rodzaju oddziaływania, zwane sprzężeniami, prowadzą do sumowania się momentów pędu i powstawania wypadkowych momentów pędu wszystkich elektronów w atomie. Zostaną one omówione nieco szerzej w następnych paragrafach.
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 .Vvu r.., r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 34
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 2
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2 a SZY
A HibUl. IM1U.1 ,Vvu r.», r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2
A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 37
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 40 2
A HibUl. IM1U.1 .Vvu -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2 1
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 3 1 DWO
A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 2 ZAS
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-Ż © l>. »N TOS »*} 3.2 ZASADA
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 54 3
A HibUl. IM1U.1 .Vvu -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 E
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3.5 Oft
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 67 3 5
A HibUl. IM1U.1 .Vvu .•»•»»«. :i>, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >WJ 73 3 6 W
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 78
A HibUl. IM1U.1 .Vvu :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 3.1
więcej podobnych podstron