216
A HibUl. IM1U.1 ,Vv»« r„, r ), buui :uO
ISBN D4H1II ł-7. © l>. WN TOS >«}
216 7 CIAŁO STAŁE
odległości od jądra. Prawdopodobieństw to zresztą w pewnej odległości od jądra gwałtownie maleje do wątłości bliskich zera.
Niezależnie od tych zastrzeżeń można obliczyć przybliżone promienie atomowe i jonowe dla danego rodzaju wiązań oraz danego stopnia utlenienia i liczby koordynacyjnej Otizymanc wartości powtarzają się z zadowalającą dokładnością w różnych krystalicznych połączeniach danego pierwiastka. Znajomość promieni atomowych i jonowych jest bardzo pomocna w rozwiązywaniu wielu problemów z zakresu kiystalochemii. Płomienie te dobiera się w ten sposób, by suma promieni dwóch sąsiadujących atomów czy jonów równała się odległości ich jąder, odległości, którą możemy wyznaczyć na drodze doświadczalnej.
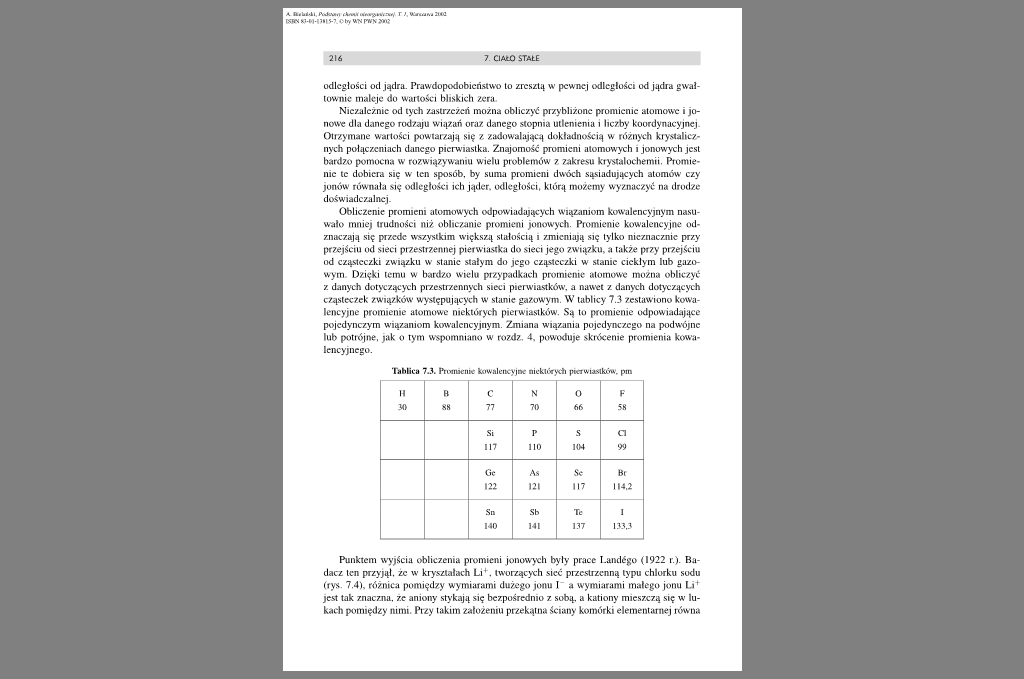
Obliczenie promieni atomowych odpowiadających wiązaniom kowalencyjnym nasuwało mniej trudności niż obliczanie promieni jonowych. Promienie kowalencyjne odznaczają się przede wszystkim większą stałością i zmieniają się tylko nieznacznie przy przejściu od sieci przestrzennej pierwiastka do sieci jego związku, a także przy przejściu od cząsteczki związku w stanic stałym do jego cząsteczki w stanic ciekłym lub gazowym Dzięki temu w bard/.o wielu przypadkach promienie atomowe można obliczyć z danych dotyczących przestrzennych sieci pierwiastków, a nawet z. danych dotyczących cząsteczek związków występujących w stanie gazowym. W tablicy 7.3 zestawiono kowalencyjne promienie atomowe niektórych pierwiastków. Są to promienie odpowiadające pojedynczym wiązaniom kowalencyjnym Zmiana wiązania pojedynczego na podwójne lub potrójne, jak o tym wspomniano w rozdz. 4, powoduje skrócenie promienia kowalencyjnego.
Tablica 7.3. Promienie kowalencyjne niektórych pierwiastków, pm
|
Ił |
B |
C |
N |
0 |
F |
|
30 |
88 |
77 |
70 |
66 |
58 |
|
Si |
P |
S |
a | ||
|
117 |
110 |
104 |
99 | ||
|
Ge |
As |
Sc |
Bi | ||
|
122 |
121 |
117 |
114.2 | ||
|
Sn |
Sb |
Te |
1 | ||
|
140 |
14! |
137 |
133.3 |
Punktem wyjścia obliczenia promieni jonowych były prace Landćgo <1922 r.). Badacz ten przyjął, ze w kryształach Li * . tworzących sieć przestrzenną typu chlorku sodu (rys. 7.4). różnica pomiędzy wymiarami dużego jonu I a wymiarami małego jonu Li* jest tak znaczna, ze aniony stykają się bezpośrednio z sobą. a kationy mieszczą się w lukach pomiędzy nimi. Przy takim założeniu przekątna ścian)' komórki elementarnej równa
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 ,Vv»« raa, r ), buui :uO ISBN D4H1II ł-7. © t>< WN TOS >«
A HibUl. IM1U.1 ,Vv»« rw, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 18
A HibUl. IM1U.1 .Vvu .«n>v>».--u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 2 2 EN
000VI A HibUl. IM1U.1 ,Vv»« .«»•»».--u, r ), buui :uO ISBN D4H1II S-7. © l>. WN TOS >*} VI
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II S-7. © l>. WN TOS >WJ 1 2 WC
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II t-7. © l>. WN TOS >«} 2
A HibUl. IM1U.1 ,Vv»« .«»•»». :i>, r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >«} 52
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >*} 1
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >«} 5 2 PU
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II *?. © l>. WN TOS >*} 7 CIAŁO
A HibUl. IM1U.1 ,Vv»« -u, r ), buui :uO ISBN D4H1II S-7. © l>. WN TOS »*} 214 7
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >«} 7 15 W
A HibUl. IM1U.1 ,Vv»« :i>, r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >«
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >«} 108 RÓ
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >*} 346
A HibUl. IM1U.1 ,Vv»« :u, r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >«} U
A HibUl. IM1U.1 .Vv,« r ), buui :uO ISBN D4H1II t-7. © l>. WN TOS >«} 456
S10 A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II S-7. © l>. WN TOS
więcej podobnych podstron