309

A HibUl. IM1U.1 ,Vv.i r ), buui :uO
ISBN D4H1II ł-7. © l>. »N TOS »*}
10 4 PRAWO DZIAŁANIA .MAS
Stosując tę ostatnią postać prawa działania mas. musimy jednak pamiętać, że stała równowagi K. jest wielkością bezwymiarową
10.4. PRAWO DZIAŁANIA MAS W ZASTOSOWANIU DO RÓWNOWAG CHEMICZNYCH W UKŁADACH HETEROGENICZNYCH
W poprzednim paragrafie omówiono równowagi chemiczne ustalające się w układach jednofazowych, w których wszystkie reagenty znajdowały się w tej samej fazie gazowej lub ciekłej. Zdarza się jednak często, że reakcje odwracalne zachodzą pomiędzy reagentami występującymi w różnych fazach. Przykładem takiej reakcji może być reakcja pomiędzy CO; a stałym węglem, zachodząca w wysokich temperaturach:
C<,i + COji,. t— 2COio
Dla stanu równowagi prawu działania mas napiszemy w postaci
•*CQ _ [■
Xc ■ XcOi
Tlenki węgła tworzą wspólną fazę gazową, a skład jej podają ułamki molowe r<,, i Ano.. Ułamek molowy ac odnosi się do fazy stałej utworzonej przez węgiel Rozpatrujemy tutaj reakcję z udziałem czystego węgla, co oznacza, żc
*c = I
Prawo działania mas inozemy teraz napisać w uproszczone j postaci
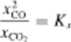
(10 16)
w której pojawiają się ułamki molowe tylko tych reagentów, które obecne są w fazie gazowej, tj. reagentów, których stężenie może się zmieniać. Nic występują w tym wyrażeniu natomiast ułamki molowe węgla. tj. reagenta, który stanowi oddzielną fazę zawierającą tylko jeden składnik, a więc reagenta, którego stężenie w tej fazie nie może ulegać żadnej zmianie.
Prawo działania mas dla rozpatrywanej tutaj równowagi chemicznej można również wyrazić za pomocą cząstkowych ciśnień reagentów występujących w fazie gazowej. Wystarczy bowiem w równaniu (10.16) podstawić zamiast .vęo i *<o, następujące wyrażenia:
P«>:
P
Pro
•*co =-
P
w których ciśnienie całkowite p = pa> + Pco:- Znajdujemy wówczas
(10.17)
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 ,Vv»« :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3
A HibUl. IM1U.1 ,Vv»« :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 10
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 10 S
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 1
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 1
A HibUl. IM1U.1 ,Vv»« .«»•»»«.--u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} I) 10 REAKC
A HibUl. IM1U.1 .Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} I) 10
A HibUl. IM1U.1 ,Vv»« :i>, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«
A HibUl. IM1U.1 .Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 6
A HibUl. IM1U.1 ,Vv»« :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 1
A HibUl. IM1U.1 ,Vv». r ), buui :uO ISBN D4H1II t-7. © l>. »N TOS >*} 22 2 J
A HibUl. IM1U.1 ,Vv». -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 26
A HibUl. IM1U.1 ,Vv»« .«»•»». :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 33 2 7 PROST
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 2 JĄ
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II f- © l>. »N TOS >«} 50 3
A HibUl. IM1U.1 ,Vv». -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} S5
A HibUl. IM1U.1 .Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 59 3 4
więcej podobnych podstron