325

A HibUl. IM1U.1 ,Vvu r ), buui :uO
ISBN D4H1II ł-7. © l>. »N TOS >«}
325
10 9 REGUŁA FA2
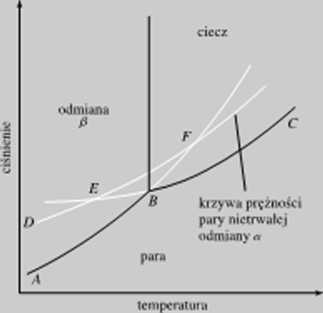
Rys. 10.5. Diagram fazowy dla układu, w którym występują pnlimorficzne odmiany nłonolropowv
IX) najhardziej znanych przykładów przemian monotropowych należy przemiana nietrwałego fosforu białego w trwały fosfor czerwony.
10.9. REGUŁA FAZ
W poprzednim paragrafie omawiano równowagi fazowe w układzie jednoskładnikowym. Zależały one tylko od temperatury i ciśnienia. W układach wieloskładnikowych zachodzi potrzeba uwzględnienia także zmian stężenia składników w poszczególnych fazach. Pojawia się w nich często także kilka faz stałych. zdaizają się przypadki, ze obok siebie współistnieją dwie lub więcej faz ciekłych. Wszystkie te okoliczności powodują. że w miarę jak zwiększa się liczba składników, obraz równowag fazowych staje sic coraz bardziej skomplikowany. W tych przypadkach szczególnie duże usługi oddaje tzw. reguła faz. formułująca ogólne warunki równowag fazowych w układach jedno-i wieloskładnikowych. Została ona wyprowadzona w 1876 r przez. Josi aha W. Gibbsa. Wypowiedzenie reguły faz wymaga wprowadzenia trzech pojęć: fazy, liczby niezależnych składników oraz liczby stopni swobody.
Pojęcie fazy zostało wprowadzone w p 10.1 Liczbę faz obecnych w układzie oznaczać będziemy literą /.
Liczba niezależnych składników, n. jest to najmniejsza liczba składników (substancji), z. których można zbudować cały układ. Układ zawierający węgiel, tlenek węgla i ditlcnck węgla, pozostające z sobą w równowadze, jest układem trójskładnikowym, lecz tylko dwa spośród nieb można uważać za składniki niezależne. Pozostały tizcci składnik, zależny, tworzy się z dwóch składników niezależnych w reakcji
C + CO, - 2CO
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 155 i
A HibUl. IM1U.1 .Vvu :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 27S
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 15 10 W
A HibUl. IM1U.1 .Vvu r.., r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 34
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 2
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2 a SZY
A HibUl. IM1U.1 ,Vvu r.», r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2
A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 37
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 40 2
A HibUl. IM1U.1 .Vvu -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2 1
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 3 1 DWO
A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 2 ZAS
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-Ż © l>. »N TOS »*} 3.2 ZASADA
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 54 3
A HibUl. IM1U.1 .Vvu -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 E
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3.5 Oft
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 67 3 5
więcej podobnych podstron