skan0094 (2)
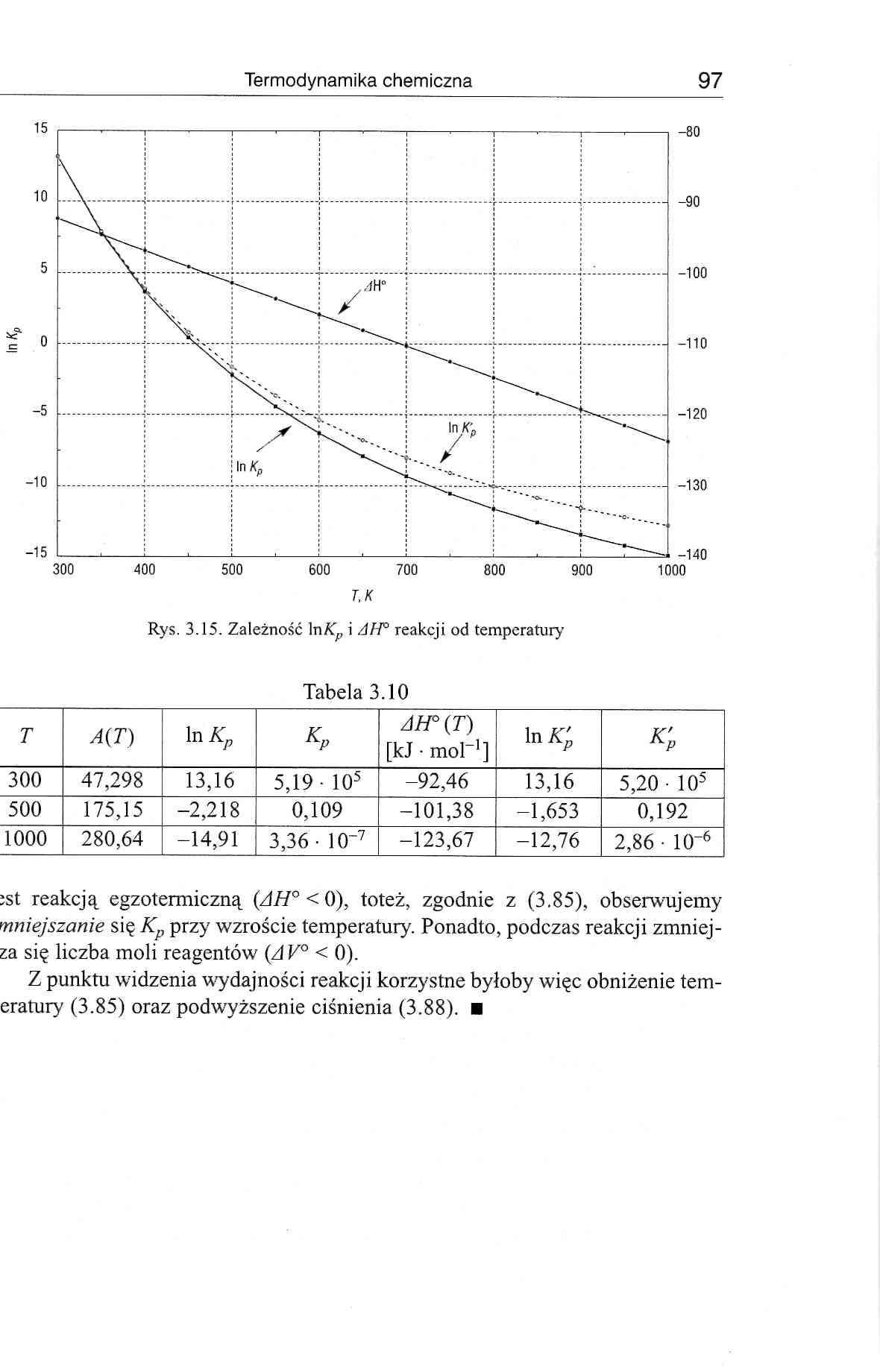
Termodynamika chemiczna 97
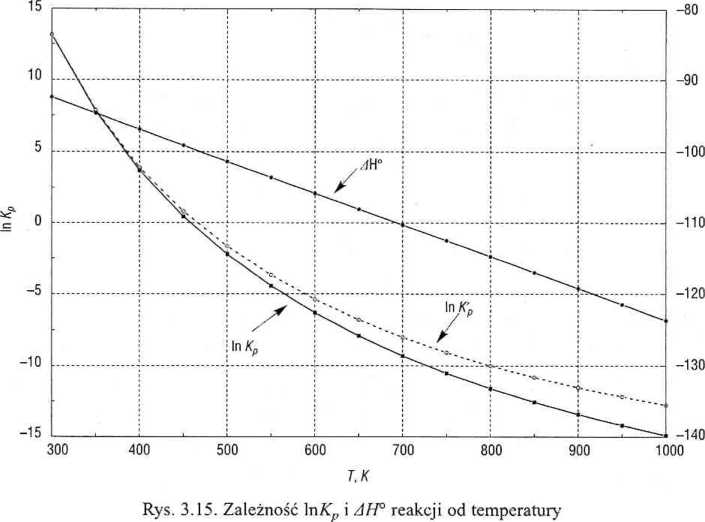
Tabela 3.10
|
T |
A(T) |
In Kp |
KP |
AH°(T) [kJ-mok1] |
In K'p |
K'P |
|
300 |
47,298 |
13,16 |
5,19- 105 |
-92,46 |
13,16 |
5,20- 105 |
|
500 |
175,15 |
-2,218 |
0,109 |
-101,38 |
-1,653 |
0,192 |
|
1000 |
280,64 |
-14,91 |
3,36- 10-7 |
-123,67 |
-12,76 |
2,86 • 10~6 |
ist reakcją egzotermiczną (AH° < 0), toteż, zgodnie z (3.85), obserwujemy mniejszanie się Kp przy wzroście temperatury. Ponadto, podczas reakcji zmniej-za się liczba moli reagentów (A V° < 0).
Z punktu widzenia wydajności reakcji korzystne byłoby więc obniżenie tem-eratury (3.85) oraz podwyższenie ciśnienia (3.88). ■
Wyszukiwarka
Podobne podstrony:
61950 skan0076 Termodynamika chemiczna 79 Tabela 3.4 T ln T CP [J • K- mor1] PU) [J • K"1 •
66861 skan0052 Termodynamika chemiczna 55 W = -nRTl ln P Pl = -3-8,314-298,15- In 100 120 = 1355,83
skan0046 (2) 3. Termodynamika chemiczna I zasada termodynamiki stwierdza, że energia wewnętrzna U uk
skan0048 (2) Termodynamika chemiczna 51 Rys. 3.1. Praca izotermiczncgo rozprężania gazu Wstawiając w
skan0084 Termodynamika chemiczna 87 Ostatecznie otrzymujemy AG°(T) = -280,14 • 103 + 2,730r+ 13,72 T
22460 skan0054 Termodynamika chemiczna 57We = n CydT. (3.24) Pracę gazu idealnego
64780 skan0066 (2) Termodynamika chemiczna 69 puje powrót do stanu początkowego poprzez rozprężanie
skan0050 (3) Termodynamika chemiczna 53 raz definicjami (2.15) i (2.16) 1 I dV V dT n a = :amy C„ -
skan0060 Termodynamika chemiczna 63 Gdy to założenie nie jest spełnione, to do powyższej sumy należy
skan0062 Termodynamika chemiczna 65 ;_-_ eśla zależność między temperaturą T a ciśnieniemp w punkcie
skan0068 Termodynamika chemiczna 71 ze sprawność urządzenia jest zawsze wielkością dodatnią, a zatem
skan0074 Termodynamika chemiczna 77 Wartość entropii molowej CC14 w T2 = 298,15 K obliczymy z równan
41584 skan0070 Termodynamika chemiczna 73 Analogicznie dla entalpii dH(T, p) dH(p, T) = (4^ dp + (-
więcej podobnych podstron