skan0151

154 Roztwory i równowagi fazowe
zJ/fjn, jest graniczną wartością całkowitego ciepła rozpuszczania:
AH?m = lim
n2 : n i —> 0
Ze schematu 4.2 wynika oczywisty związek między tymi efektami:
0r = A HZ - AHml.
Przykład 4.12. W tabeli poniżej zestawiono wyniki^ pomiarów całkowitego ciepła rozpuszczania 1 mola HN03 w nx molach wody w 25°C [kJ ■ mol-1]
|
"1 |
1 |
2 |
3 |
4 |
5 |
6 |
8 |
10 |
15 |
|
477jnt |
-13,11 |
-20,08 |
-24,3 |
-26,98 |
-28,73 |
-29,84 |
-31,12 |
-31,84 |
-32,46 |
|
«1 |
20 |
30 |
40 |
50 |
75 |
100 |
200 |
500 |
1000 |
|
4//int |
-32,67 |
-32,76 |
-32,75 |
-32,74 |
-32,74 |
-32,75 |
-32,8 |
-32,9 |
-32,98 |
Podczas rozpuszczania jednego mola kwasu w nieskończenie dużej ilości wody w tej temperaturze zostaje wydzielone 33,34 kJ • mol-1.
a) wykreślić zależność AHm{^m) i &T(y!m) oraz molowej entalpii mieszania H™(x2), a także znaleźć ich równania. Wyznaczyć na tej podstawie cząstkowe molowe entalpie mieszania w roztworze zawierającym 4 mole wody na 1 mol kwasu.
b) Obliczyć zmianę entalpii po dodaniu, w 25°C, 1000 g wody do roztworu A, zawierającego 1748,9 g HN03 rozpuszczonych w 1000 g H20 (n{ : n2 = 2 : 1).
c) Pojemność cieplna w 25°C wodnego roztworu HN03 o ułamku molowym x2 = 0,25 wynosi 2,78 J ■ K-1 • g-1. O ile wzrośnie temperatura naczynia zawierającego 400 g wrody (o temperaturze początkowej 25°C), gdy szybko wprowadzi się do niej taką ilość HN03, by ułamek molowy kwasu wyniósł 0,25?
Rozwiązanie, a) Przekształcając nieznacznie w'zór (4.4) dla M] = 18,015 [g • mol-1], obliczamy molalność [mol • kg-1] poszczególnych roztworów, wstawiając za n2 1 mol:
1000 nlMl '
Ułamek molowy kwasu dla n2 = 1 mol obliczamy zc wzoru (4.2):
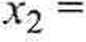
_1_
?7( + 1
K.P. Miszczenko, A.A. Rawdiel, Zbiór wielkości fizykochemicznych, PWN, Warszawa 1974, s. 56.
Wyszukiwarka
Podobne podstrony:
skan0137 140 Roztwory i równowagi fazowe Równanie (4.24) jest nazywane prawem Van’t Hoffa. Dla roztw
11532 skan0147 150 Roztwory i równowagi fazowe Termodynamiczna funkcja mieszania yM, gdzie Y jest do
65435 skan0153 (2) 156 Roztwory i równowagi fazowe gdzie wyrażenie w pierwszym nawiasie jest entalpi
skan0155 158 Roztwory i równowagi fazowe Po podstawieniu odpowiednich wartości z tab. 4.9 dostaniemy
skan0167 170 Roztwory i równowagi fazowe Rys. 4.20. Równowaga w układzie dwuskładnikowym, ciało stał
skan0171 (2) 174 Roztwory i równowagi fazowe Przykład 4.16. W tab. 4.12 zestawiono dla ciśnienia 760
skan0195 198 Roztwory i równowagi fazowe Temperatury wrzenia benzenu i toluenu pod ciśnieniem 400 mm
12851 skan0127 130 Roztwory i równowagi fazowe wego w wodzie c i ksylenie c" wynosiły odpowiedn
skan0125 128 Roztwory i równowagi fazowe Zatem 0,343 0,343 + 5,11 0,0629; x} = 1 -x2 = 0,937. c) Stę
skan0133 136 Roztwory i równowagi fazowe Temperatura krzepnięcia roztworu Tk, zawierającego nielotną
skan0135 138 Roztwory i równowagi fazowe Rozwiązanie. Do obliczeń y2 wykorzystamy wzór (4.20) 0- 1 m
skan0139 142 Roztwory i równowagi fazoweym = Y n + n2 - X] Yy + x2Y2. (4.28) Różniczkując (4.27) otr
więcej podobnych podstron