280 [1024x768]

WŁAŚCIWOŚCI ROZTWORÓW 289
Obliczmy bracę maksymalną dla procesu przeniesienia I mola rozpuszczalnika do roztworu przy zachowaniu stałego ciśnienia osmotycznego, tj. przy stałym stężeniu rbztworu. Gdybyśmy chcieli wyznaczyć wielkość takiej pracy praktycznie, to kónieczne byłoby oczywiście przeniesienie nieskończenie małej ilości rozpuszczalnika i przeliczenie go na 1 mol bądź też, co byłoby niezwykle trudne, posługiwanie się bardzo dużą ilością roztworu tak, aby wprowadzenie ł mola rozpuszczalnika nie doprowadziło do zauważalnej zmiany stężenia. O uwadze tej trzeba pamiętać przy konstruowaniu osmometru. Podczas ustalania się bowiem równowagi pomiędzy działającym z zewnątrz ciśnieniem i ciśnieniem osmotycznym nie może dojść do zmiany stężenia roztworu. W osmometrze pokazanym na rys. 4.6 objętość kapilary musi być niewspółmiernie mała w stosunku do objętości całego naczynia z roztworem.
Pracę przeniesienia I mola rozpuszczalnika do roztworu możemy obliczyć dla dwóch równoważnych procesów. Jeden będzie polegać na odparowaniu rozpuszczalnika i kondensacji nad roztworem, drugi na bezpośrednim przeniesieniu przez błonę, przy czym praca w drugim przypadku będzie mieć charakter zwykłej pracy objętościowej.
Dla procesu pierwszego
= RT\n-r'0
ponieważ />, jest prężnością pary nad roztworem, a więc ciśnieniem końcowym. natomiast p°x — prężnością pary nad rozpuszczalnikiem, a więc ciśnieniem początkowym. Prace związane z odparowaniem (— RT) i kondensacją (+ RT) znoszą się. gdyż mają znaki przeciwne.
Praca natomiast w drugim procesie
-UV
(4.32)
gdzie: // jest ciśnieniem osmotycznym* a K,- objętością I mola czystego rozpuszczalnika. Przyrównując obie prace, otrzymujemy
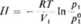
(4.33)
Jest to ogólne wyrażenie na ciśnienie osmotycznc, przy założeniu, że para nad roztworem i czystym rozpuszczalnikiem zachowuje się jak gaz doskonały. Jeżeli roztwór jest doskonały, to zgodnie z prawem Raoulta plfp° = xt. Natomiast dla roztworów rzeczywistych ułamek molowy musi być zastąpiony przez aktywność. Najbardziej więc ogólne równanie na ciśnienie osmotyczne ma postać:
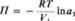
(4.34)
>rzyrc
Wyszukiwarka
Podobne podstrony:
274 [1024x768] WŁAŚCIWOSO ROZTWORÓW 283 mm Hg. Obliczyć masę cząsteczkową benzaldehydu. Zakładamy, ż
276 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 285 przy czym m2 — masa substancji rozpuszczonej, m, — masa
282 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 291 rtijRT ^ m2RT Mty ’ * " /IV 3
312 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 321 Zatem współczynnik izotermiczny van’t Hoffa wy
318 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW E1ZJLTR0UTÓW 327 Elektroliza wodnego roztworu NaCi jest przykła
320 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 329 przestrzeni środkowej, a stąd do przestrzeni k
322 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW W równaniu tym liczby przenoszenia /J i /£ są wart
324 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 333 zakrcskowaną płaszczyznę na rys. 5.4. W ciągu
270 [1024x768] Właściwości roztworówTermodynamiczna charakterystyka roztworów Zgodnie z definicją (p
525 [1024x768] 536 KOLOIDY fali obliczona z równania de Broglie’a (1.12) wynosi 0,12 A. Potrzebną do
zadania II2 1.013 • 10S Pa. Obliczyć dla procesu parowania 1 mola wody w podanych warunkach zmianę e
zad4 2 65 1,013-10® Pa. Obliczyć dla procesu parowania 1 mola wody w podanych warunkach zmianę energ
DSC00433 (11) Osmoza. Zjawisko polegające na jednokierunkowym przenikaniu cząsteczek rozpuszczalnika
P1120626 [1024x768] 124 Opracowanie wyników m m 1. Obliczyć pH roztworów, przyjmuj
272 [1024x768] 281 WŁAŚCIWOŚCI ROZTWORÓW W roztworze określa potencjał chemiczny d
278 [1024x768] 287 WŁAŚCIWOŚCI ROZTWORÓW Tabela 4.2 Slałe kriometryczne kjekfórych
289 [1024x768] 298 ROZTWORY I RÓWNOWAGI FAZOWF nika w fazie a i 0, a a* i af są aktywnościami tego s
305 [1024x768] Właściwościroztworów elektrolitów Charakterystyka roztworów elektrolitów Roztwory ele
więcej podobnych podstron